HARS2基因突变致以耳聋为表现的Perrault综合征机制的研究
2023-01-06梁云红陈曦费静余莉亚廖娜庄璐杨婷钰李雷激
梁云红,陈曦,费静,余莉亚,廖娜,庄璐,杨婷钰,李雷激
(西南医科大学附属医院 耳鼻咽喉头颈外科,四川 泸州 646000)
耳聋是临床常见疾病,它严重影响人们的生活及工作。临床上将耳聋分为非综合征型耳聋(仅有听力下降表现)和综合征型耳聋(伴有除听力下降以外症状或体征),约30%为综合征型耳聋[1],目前发现的综合征型耳聋有400余种[2]。60%的耳聋是由于遗传所致,其余常见病因有细菌病毒感染、耳毒性药物及环境因素等。
Perrault综合征临床表现为双侧感音神经性听力损失,女性患者伴有卵巢功能不全、障碍,部分患者可合并神经系统功能障碍[3]。研究表明Perrault综合征与HARS2[4]、HSD17B4[5]、ERAL1[6]、LARS2[7]、CLPP[8]、TWINKLE[9]6个基因突变有关。目前Perrault综合征的报道较少,但实际可能并不少见,临床中,部分男性患者仅表现为听力下降,可能被诊断为非综合征型耳聋。本实验通过检测1个耳聋家系基因,发现HARS2基因2个新突变位点,并进一步行体外实验,探讨该突变位点对HARS2蛋白的影响及其在Perrault综合征发生过程中的致病机制。
1 资料与方法
1.1 一般资料
包含三代10人,其中2例耳聋患者(图1)。先证者(Ⅲ-1),男,出生时听力筛查未通过,2岁诊断为双侧感音神经性听力下降,佩戴助听器效果差;10岁听力检查提示双侧感音神经性听觉丧失(图2)。

图1 Perrault综合征家系图谱

图2 先证者听觉脑干诱发电位结果及影像资料 A:客观听力检查提示极重度感音神经性听力损失; B、C:影像学检查示内耳无畸形
先证者哥哥(Ⅲ-2),3岁时家属发现患儿听力障碍,检查为双侧极重度感音神经性听力下降,佩戴助听器效果差。2例患者均于我院行右侧人工耳蜗(cochlear implant,CI)植入术。此2例患者查体、智力无异常,无外伤史、耳毒性药物使用史,相关检查(影像学、彩超)均无异常。其余家系成员听力正常,且无遗传病史,先证者父母否认近亲结婚。本研究前期[10]检测先证者外周血DNA,结果显示HARS2基因有2个新突变位点:c.349G>A(p.Asp117Asn)和c.908T>C(p.Leu303Pro),分析可能为致病突变,在签署知情同意书后,抽取该家系10人静脉血进行相关验证分析。本研究经西南医科大学附属医院伦理委员会审批后实施。
1.2 方法
1.2.1 主要实验材料 HEK293T细胞(本实验室),野生型HARS2慢病毒重组质粒、突变型HARS2(Asp117Asn和Leu303Pro)慢病毒重组质粒、慢病毒空载质粒、慢病毒包装转染试剂(上海和元生物),DH5α感受态细胞、血液DNA提取试剂盒(DP304)(北京天根),HARS2兔克隆抗体(11301-1-AP)(Proteintech公司),山羊抗小鼠IgG抗体(A0216)、抗兔IgG抗体(A0208)(上海碧云天),Flag鼠克隆抗体(F1804)(Sigma公司),GAPDH兔克隆抗体 (AP0063)(Bioworld公司)。
1.2.2 实验分组 ①突变型:Asp117Asn细胞组(转染Asp117Asn突变的HEK293T细胞)、Leu303Pro细胞组(转染Leu303Pro突变的HEK293T细胞);②野生型:WT细胞组(转染野生型的HEK293T细胞);③NC细胞组(转染空病毒载体的HEK293T细胞)。
1.2.3 外周血DNA提取、测序 根据DNA提取试剂盒的操作流程,提取先证者及家系成员外周血标本DNA,进行基因测序(北京迈基诺公司)。
1.2.4 蛋白质功能域和稳定性分析 SWISS-MODE对蛋白质建模,Swiss-PdbViewer 4.1选定突变位点位置,分别用I-Mutant、DUET、CUPSAT、mCSM预测突变蛋白质稳定性变化。
1.2.5 构建稳定转染细胞 选用真核细胞表达载体(GL120,上海和元生物构建),携带增强型绿色荧光蛋白(EGFP)及Flag标签。DH5α菌接种在LB培养基中,制备感受态细胞,将质粒加入感受态细胞中,质粒感受转化态细胞。抽取质粒并进行测序验证,对测序鉴定成功的菌液培养,再次抽取质粒,并保存于-20 ℃冰箱。复苏HEK293T细胞,进行培养及传代,将该细胞接种到6孔板,后加入慢病毒包装质粒(HARS2突变型、HARS2野生型、空载体),混匀后培养。3d后加入DEME培养基(含嘌呤霉素)培养,筛选EGFP阳性表达的细胞株。
1.2.6 检测方法 Western blot检测:提取Asp117Asn细胞组、Leu303Pro细胞组、WT细胞组和NC细胞组蛋白。配置蛋白标准液及各孔中标准液加样,加入30 μg待测蛋白至各孔,进行电泳、转膜、封闭。加入稀释的一抗4 ℃过夜,TBST洗膜,加入二抗孵育2 h。孵育结束后用TBST洗膜。ECLA液A、B试剂混匀显影后采图并保存。
免疫荧光检测:接种细胞,培养过夜,Mito-Tracker Red染色液孵育0.5 h。加入4%多聚甲醛固定10 min,PBS清洗,封闭。加入稀释好的一抗,4 ℃孵育过夜。然后加入封闭液稀释后的二抗,室温避光孵育1 h。加入DAPI染色液复染细胞核,封片。拍照并保存。
Northern blot杂交:制胶(10%PAG凝胶)、电泳完成后将RNA转移至尼龙膜用SSC漂洗1 min。将膜置于滤纸上,放入紫外交联仪中交联。将膜放入杂交管,55 ℃预杂交2 h。取30 pmol探针置入杂交管,过夜,收集杂交液,洗涤2次。High stringency wash,洗涤2次。将尼龙膜转移至DIG washing buffer溶液中,室温漂洗,转移至Blocking solution中,室温封闭30 min。置于Antibody solution,孵育30 min。转移至DIG,洗涤2次。转移至Detection buffer中处理5 min。最后将尼龙膜置于杂交袋,加入CDP-star,放置5 min,拍照。
1.3 统计学分析

2 结果
2.1 HARS2基因检测结果
该家系HARS2基因测序结果见表1和图3。

表1 家系HARS2测序结果
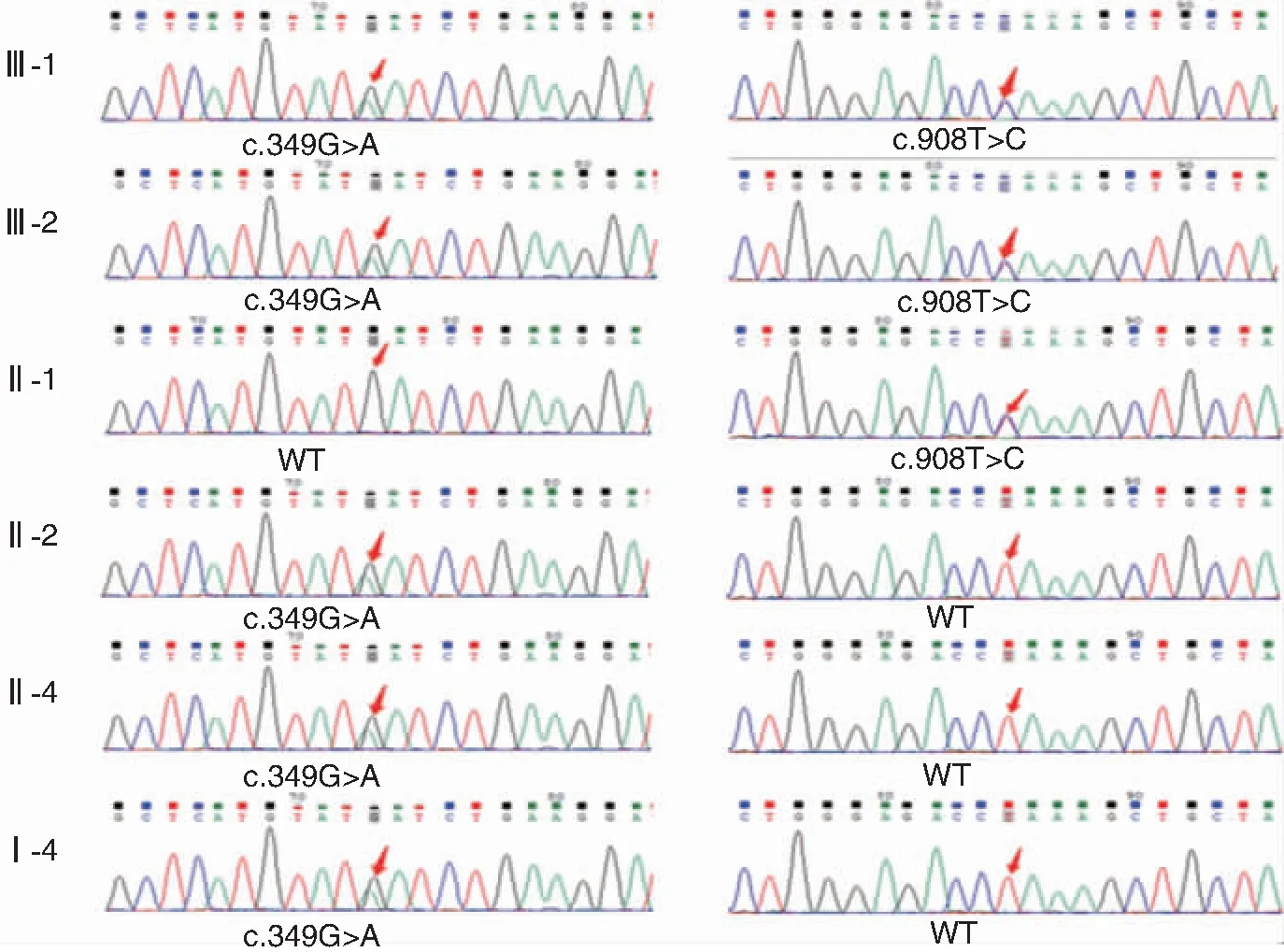
图3 部分家系成员HARS2 349G>A和908T>C位点测序图
2.2 蛋白质功能域和稳定性分析
HARS2蛋白117位氨基酸和303位氨基酸均位于催化核心区域,突变可能影响组氨酰tRAN合成酶的催化活性,p.Asp117Asn还位于蛋白质二聚化界面,该突变还可能影响HARS2蛋白的二聚化作用。正确的蛋白质一级结构是蛋白质正确折叠保持构象稳定性的前提。通过Swiss-Model建立HARS2三维结构模型并标注两个突变在模型上的位点,发现117Asn位于β折叠结构上,Leu303位于α螺旋结构上,HARS2蛋白Asp117Asn和Leu303Pro变异可能导致蛋白质结构改变,进而影响蛋白质稳定性。由于氨基酸排列顺序决定蛋白质空间构象,且蛋白质三维结构为最低自由能状态。而蛋白质解折叠自由能是评估蛋白质热动力学稳定性的一个重要指标,因此可通过计算野生型和突变型蛋白质解折叠自由能差值(ΔΔG)可以预测突变对蛋白质热稳定性的影响。在I-Mutant、I-Mutant、CUPSAT及mCSM中预测突变型蛋白解折叠自由能较野生型蛋白解折叠自由能高,HARS2蛋白p.Asp117Asn与 p.Leu303Pro变异均可能导致蛋白质热稳定性下降。见图4、5。

图4 HARS2蛋白功能域示意图 注:N端WHEP结构域(amino acid,aa3-43); anticodon binding:C端反密码子结合域(aa406-501); Ⅱ类aaRS核心结构域(aa80-393); Dimer interface:二聚化界面(aa65-177); HisA:组氨酸识别位点(aa327-332);HisB:组氨酸结合位点(aa361-365)。

图5 HARS2蛋白模型构建(PDB ID:4phc),图中箭头所对应标红的地方为突变位点
2.3 转染HEK293T细胞结果
野生型和突变型(c.349G>A和c.908T>C)HARS2的重组质粒(上海和元生物构建)测序结果见图6。转染3 d后,结果显示:除HEK293T空细胞外,余各细胞组均出现绿色荧光。见图7。
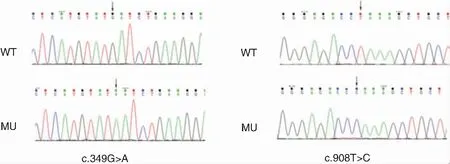
图6 质粒部分测序图 注:WT表示野生型质粒;MU表示点突变质粒(箭头指示突变位点)。

图7 HEK293T细胞转染3 d后表达情况 (免疫荧光 ×100)
2.4 HARS2蛋白表达
本研究将Flag标签加入HARS2基因N端,并通过检测3×Flag+HARS2来检测HARS2蛋白表达情况。结果显示:Asp117Asn细胞组与WT细胞组比较,3×Flag+HARS2蛋白表达无明显差异(P=0.356);Leu303Pro细胞组与WT细胞组比较,3×Flag+HARS2蛋白表达较低(P=0.000)。见图8。

图8 各细胞组3×Flag+HARS2蛋白的Western blot检测结果 A:各组中3×Flag+HARS2蛋白的Western blot条带,GAPDH为内参; B:各组中3×Flag+HARS2蛋白的相对表达
2.5 免疫荧光检测细胞内HARS2蛋白分布
将EGFP基因(绿色荧光蛋白)融合至HARS2基因中,同时应用红色荧光试剂(Mito-Tracker Red CMXRos)对细胞线粒体进行染色。NC细胞组中的绿色荧光均匀的在细胞内分布。各组细胞绿色荧光与红色荧光重合,表明HARS2蛋白均分布于线粒体。见图9。
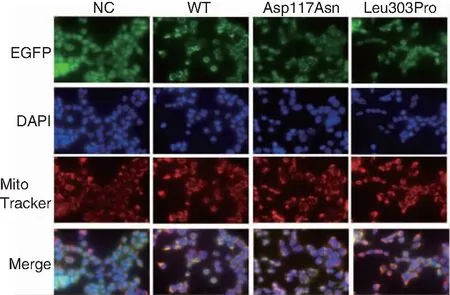
图9 各细胞组免疫荧光检测结果 ( ×600)
2.6 Northern bolt分析线粒体tRNAHis氨酰化水平
线粒体tRNAHis氨酰化水平 NC细胞组低于WT细胞组(P=0.010);WT细胞组高于Asp117Asn细胞组和Leu303Pro细胞组(P=0.000,P=0.000);Leu303Pro细胞组低于Asp117Asn细胞组(P=0.016)。见图10。
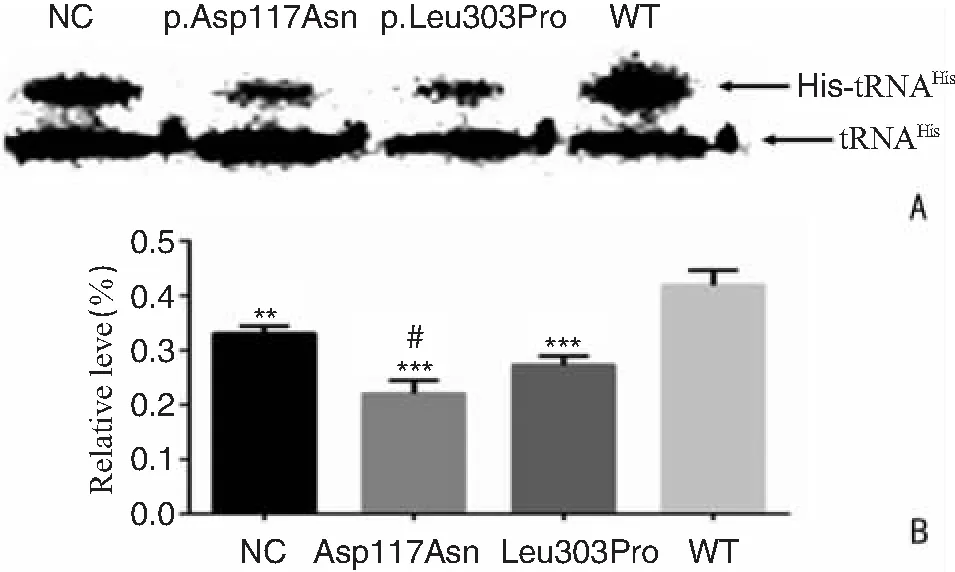
图10 各细胞组线粒体tRNAHis氨酰化结果 A:各组线粒体tRNAHis氨酰化水平Northern blot条带; B:各组线粒体tRNAHis氨酰化水平百分比 注:与Leu303Pro细胞组相比,#P<0.05;与WT细胞组相比,**P<0.01,***P<0.001。
3 讨论
在本研究前期[10-11],对该家系2例患者行GJB2、SLC26A4、mtDNA12SrRNA基因筛查,检测结果为阴性,进一步检测先证者及其哥哥HARS2、ABHD12等139个耳聋基因和m.C1494T、m.A1555G等6个药物性聋位点,结果显示:先证者及其哥哥为HARS2 c.349G﹥A和c.908T﹥C复杂杂合突变。完善该家系sanger 测序验证,发现母亲(Ⅱ-2)、舅舅(Ⅱ-4)、外婆(Ⅰ-4)为HARS2 c.349G﹥A杂合突变,其父亲(Ⅱ-1)为HARS2 c.908T﹥C杂合突变,考虑该家系患者突变基因来自其母亲和父亲。以上两个突变位点在PROVEAN和MutationT aster软件致病性预测中显示为有害[12],因此我们推断该家系患者耳聋病因为HARS2 c.349G>A和c.908T>C。在仅有男性患者的家系中,可能表现为单纯性耳聋,可能诊断为为非综合征性耳聋,若仅依靠表型,无法判断患者是相关基因突变引起PRLTS而导致耳聋,还是非综合征性耳聋。HARS2基因突变在PRLTS的发病中有重要作用,相关报道表明大多数由HARS2突变导致的PRLTS,其突变为复合杂合突变。在本文中,2例患者为男性,且年幼,目前仅有听力下降表现,可能神经系统功能障碍尚未表现出来,结合其基因检测结果,考虑这2例患者很可能是由于上述基因突变引起PRLTS,从而表现出非综合征性耳聋,我们将持续追踪该2例患者病情变化情况。
HARS2位于5q31,编码产物为线粒体组氨酰-tRNA合成酶,在细胞质翻译后进入线粒体发挥作用:连接组氨酸与tRNA,参与线粒体翻译过程。Yu等[13]使用软件预测HARS2 p.Asp117Asn和p.Leu303Pro致病性表明为有害突变,且同源建模表明以上突变可以改变(形成或缺失)蛋白质中氢键,在本研究HARS2蛋白结构模型分析中,HARS2 p.Asp117Asn和p.Leu303Pro均位于线粒体组氨酰-tRNA合成酶的催化核心区域,突变可能导致其热稳定性下降,因此HARS2 p.Asp117Asn和p.Leu303Pro突变可能影响HARS2蛋白三维结构,进而影响蛋白质功能。
本研究表明,与WT组相比,HARS2 p.Leu303Pro突变会使HARS2蛋白的表达下降,而Yu等[13]研究显示HARS2 p.Leu303Pro突变后,HARS2蛋白的表达无明显下降,可能是由于本文与其Yu等检测时机不同,本文为转染后72 h,而Yu等为转染后48h。这可能表明HARS2 p.Leu303Pro突变后,早期不影响蛋白表达,随着时间的延长,畸形HARS2蛋白产物增加,其负反馈抑制转录和/或翻译过程,进而影响蛋白表达,这需要我们进一步研究探讨。HARS2 p.Asp117Asn突变后,HARS2蛋白表达与WT组相比无明显差异。有学者[14]研究大肠杆菌中HIS1蛋白表达发现:线粒体功能障碍与HIS1蛋白表达降低有关。线粒体氨酰tRNA合成酶发挥功能的前提是进入线粒体,这与其N端线粒体靶向信号有关[15-16]。免疫荧光结果显示HARS2蛋白均定位于线粒体。Pierce等[5]分析HARS2野生型和突变型细胞HARS2蛋白的表达亦表明突变不影响HARS2蛋白的定位。
本研究表明,Asp117Asn细胞组线粒体tRNAHis氨酰化水平和Leu303Pro细胞组线粒体tRNAHis氨酰化水平明显低于WT细胞组。有文献报道,部分线粒体氨酰tRNA合成酶基因突变所致疾病,与其氨基酰化水平下降有关[17]。Li等[18]研究指出过表达LARS2不影响野生型细胞氨酰化水平,却提高突变细胞氨酰化水平。在本研究,NC细胞组tRNAHis氨酰化水平低于WT细胞组,这可能是因为NC细胞组线粒体tRNAHis氨酰化水平没有达到最大阈值。Gong等[19]研究发现线粒体中tRNAHis50%的氨酰化水平可能是维持细胞正常功能的最大阈值水平。Asp117Asn细胞组tRNAHis氨酰化水平明显低于WT组,但其HARS2蛋白表达较WT组无明显变化,这表明该突变对蛋白表达无影响,但能使其活性降低,进而使氨酰化水平降低[5]。Asp117Asn细胞组tRNAHis氨酰化水平高于Leu303Pro细胞组,其中一个原因可能是蛋白表达差异,研究发现突变位点不同,氨酰化水平变化也不相同[20-21],线粒体亮氨酸tRNA合成酶p.Thr522Asn突变的催化效率降低了9倍,而p.Ala430Val突变的催化效率降低了18倍[22]。Yu等[13]研究表明HARS2 p.Asp117Asn和p.Leu303Pro突变后,细胞内活性氧产生增加,这可能是由于突变后,线粒体中tRNA氨酰化水平异常,进而导致线粒体呼吸功能障碍,出现线粒体自噬加快、ATP产生减少、活性氧增加[23]。耳蜗对能量变化极其敏感,线粒体呼吸功能障碍早期就可导致耳蜗退行性改变[24-26]。Blocquel 等[27]研究表明,腓骨肌萎缩症的严重程度与患者细胞中突变引起的组氨酰-tRNA合成酶的开放构象程度关系密切,为研究HARS突变相关疾病有了新方向。多个实验发现线粒体tRNA氨酰化降低会抑制线粒体呼吸功能,蛋白质翻译减少。本研究表明,以上2个HARS2基因突变位点会降低线粒体tRNAHis氨酰化水平,但其对线粒体相关功能有无作用则需我们进一步研究。
本研究筛查、验证了一个家系的HARS2基因2个新突变位点,并进一步探讨以上两种突变对HARS2蛋白结构稳定性、表达含量及部位、线粒体氨酰化水平的影响,有助于对HARS2突变所致PRLTS机制进一步的研究。
