铁氧还原蛋白1与胃癌免疫浸润及临床预后研究
2023-01-06张铁英
张铁英,高 晶,方 堃,黄 颜
胃癌(GC)是最常见的消化道肿瘤之一,在我国癌症发病率中位居第二位,死亡率排第三位,严重危害了人群健康[1]。胃癌起病隐匿,进展迅速,早期诊断困难,确诊时多处于中晚期,使多数病例失去了最佳手术时机[2]。除了经典的手术和全身化疗外,免疫疗法也被证明具有根除癌症的潜力[3],因此,确定新的免疫相关治疗靶点,阐明胃癌-免疫相互作用的免疫表型,是目前胃癌免疫治疗的重要研究方向。铁氧还原蛋白是最早被鉴定的Fe-S蛋白之一,铁氧还原蛋白1(FDX1)被认为是一种多功能的电子传递蛋白,参与多种生理过程,如向细胞色素P450酶提供类固醇激素的生物合成和维生素D代谢[4]。FDX1基因的敲除会导致蛋白脂酰化作用的完全丧失和细胞呼吸作用的显著减少[5]。本研究基于TCGA数据库获得的数据进行一系列生物信息学分析,以挖掘FDX1在胃癌的临床预测价值以及与免疫浸润的相关性,并利用胃癌患者标本进行了表达验证,以期为胃癌的临床诊治提供新的靶点。
1 资料与方法
1.1 一般资料:FDX1表达谱和TCGA基因型组织表达 (GTEx) 临床泛癌数据从加州大学圣克鲁斯分校 (UCSC) Xena 数据库下载。为了评估FDX1的表达,肿瘤组织从TCGA获得,正常组织从TCGA和GTEx数据库获得。
1.2 FDX1表达水平与患者临床病理特征及预后相关性分析:根据下载整理的患者临床病理信息,匹配FDX1表达水平,研究FDX1与年龄、性别、组织学分级、TNM 分期等的相关性。FDX1表达水平中位数为截断值,将患者分为高表达组和低表达组,比较2组间的生存差异,并用“survival”包绘制生存曲线。采用单因素和多因素Cox回归分析判断 FDX1在胃癌中的预后价值。
1.3 相关性和富集分析:使用TCGA STAD数据在胃癌中进行FDX1-mRNA和其他mRNA的Pearson相关性分析。选择与FDX1-mRNA最正相关的300个基因进行富集分析以确定FDX1的功能。使用clusterProfiler中的gseKEGG和gsePathway函数进行基因集富集分析,参数如下:nPerm=1 000,minGSSize= 10,maxGSSize= 1 000,pvalue-Cutoff=0.05。
1.4 FDX1和浸润性免疫细胞的关系:使用cibersort工具计算免疫细胞的相对分数,将数据上传到cibersort Web网络工具,设置默认特征矩阵为1 000个排列,以计算每个样品中22种浸润性免疫细胞(包括B细胞、T细胞、自然杀伤细胞、巨噬细胞、树突细胞、嗜酸性粒细胞和中性粒细胞)的比例,并分析FDX1的表达及与其的关系。
1.5 蛋白印记法检测胃癌中FDX1的蛋白表达:将获得样本匀浆后,使用强效RIPA裂解液(北京索莱宝公司)、提取总蛋白BCA试剂盒(上海碧云天公司)检测蛋白质浓度后进行SDS-PAGE凝胶电泳,然后将蛋白转至PVDF膜(Millipore)上。使用含5%脱脂奶粉的TBST封闭液在室温下封闭1 h。将内参和目的条带分离后,分别置于ELK3(SantaCruz)和GAPDH(Proteintech)一抗中4 ℃孵育过夜,吸净一抗并清洗后加入HRP标记的山羊抗兔lgG和山羊抗鼠lgG二抗(北京康为世纪公司)稀释比例为1∶10 000,室温孵育1 h,吸净二抗并清洗。用超敏ECL发光试剂盒(苏州宇恒公司)和化学发光成像系统(BioRad)进行曝光分析。
1.6 统计学方法:采用SPSS 23.0统计软件,计算Spearman相关系数以检查连续变量之间的关联,分类变量之间的关系采用卡方检验。对Cox比例风险回归模型进行 Kaplan-Meier 单变量和多变量预后分析,以评估每个变量对生存的影响,以P<0.05为差异有统计学意义。
2 结果
2.1 FDX1在胃癌中的表达:评估TCGA和GTEx泛癌数据库中FDX1的表达发现,与相应的正常组织相比,FDX1在结肠癌、胰腺癌、直肠腺癌、卵巢浆液性囊腺癌、胃癌等组织中呈显著高表达,见图1D(封二)。特别是TCGA 数据库中,FDX1在胃癌组织中表达水平明显高于正常组织(P<0.05),见图1A(封二)。TCGA队列在胃癌中观察到FDX1高表达,Western blot 方法分别检测了胃癌与正常组织中FDX1表达差异,差异有统计学意义(P<0.05),见图1B至图1C(封二),表明FDX1可能参与了胃癌的发病。
2.2 FDX1在胃癌中的预后价值:Kaplan-Meier分析证明,FDX1表达下降与胃癌患者预后较好相关。单因素和多因素Cox回归分析发现,FDX1低表达、年龄>65岁、M分期(远处转移)是胃癌患者独立预后因素,见表1。
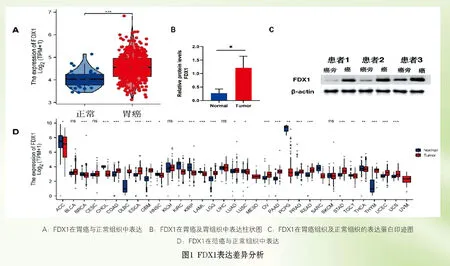
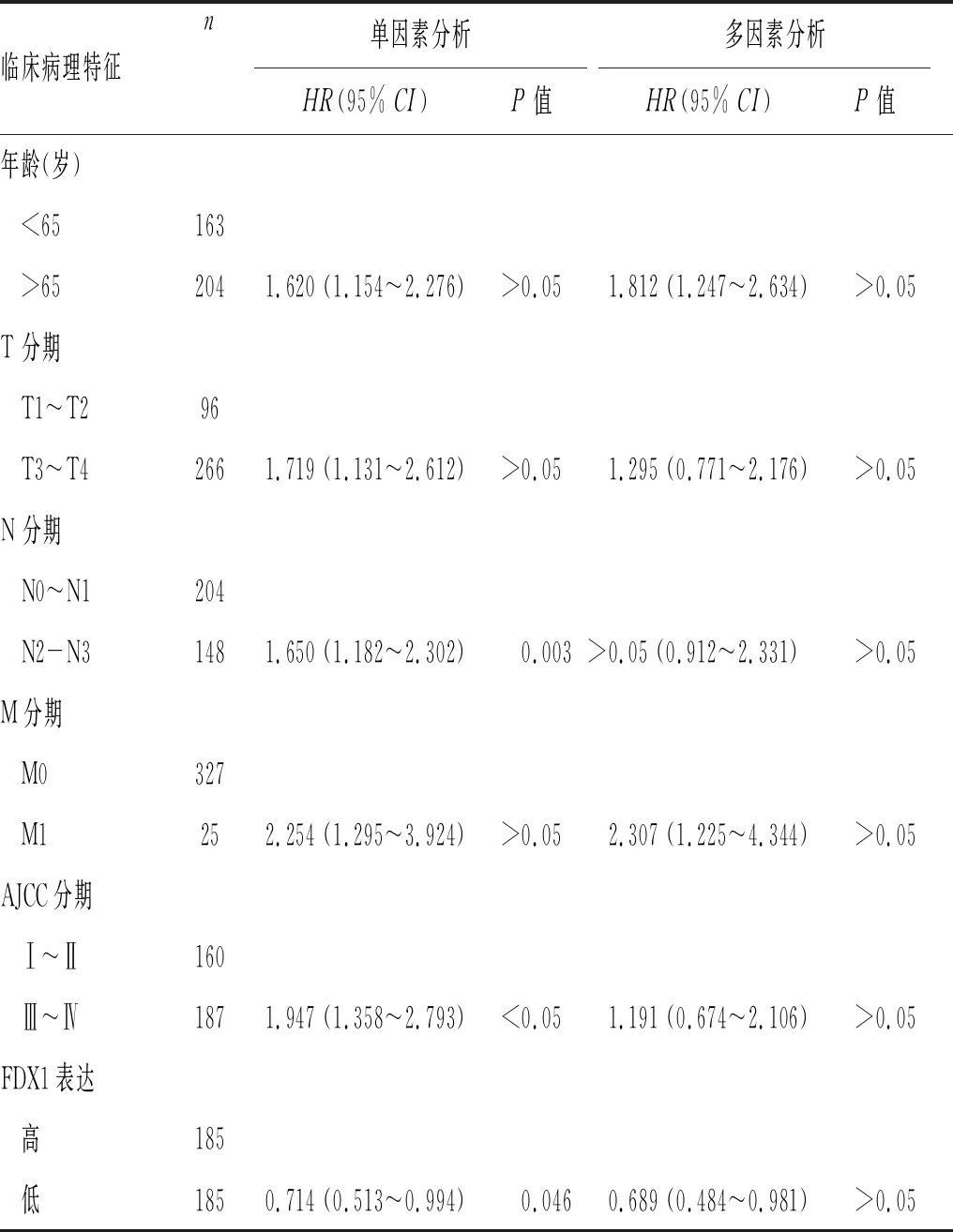
表1 FDX1表达与胃癌临床病理学特征相关性
2.3 FDX1相关性基因潜在功能及途径:为了进一步探索受FDX1影响的功能和途径,使用TCGA数据进行FDX1与胃癌中所有其他mRNA之间的相关性分析,选择与FDX1最正相关的基因进行富集分析,使用R软件clusterProfiler包进一步探索基于前300个基因的潜在功能途径。基因富集分析京都基因和基因组百科全书(KEGG)和Reactome通路数据库,KEGG分析结果显示细胞因子受体相互作用显著富集。Reactome 分析揭示了细胞外基质途径、G蛋白耦联家族显著富集,表明FDX1的低表达与胃癌中多种致癌途径的过度激活有关。
2.4 FDX1表达与22种胃癌免疫细胞浸润的相关性:分析375例胃癌样本中的浸润性免疫细胞分布,并分析FDX1表达与22种免疫细胞的关系,结果显示FDX1表达与Th2 、Th17、辅助性Th细胞呈正相关,而与浆细胞样树突状细胞、NK细胞及CD8+T细胞、巨噬细胞等呈负相关。
3 讨论
胃癌具有严重不良预后及高死亡率等特点,预计在2035年仍将在全球范围内具有较高的发病率[6],因此探索新的生物学分子标记物有利于胃癌的早期筛查、诊断及治疗。FDX1是人类线粒体中的一种铁氧还原蛋白,FDX1是一种多功能电子介体参与了多种生理过程,例如向细胞色素P450酶提供电子作为类固醇激素生物合成和维生素D代谢的一部分[4]。有研究发现FDX1对Fe-S簇的生物发生很重要,参与了类固醇激素的产生[7-8]。最近,FDX1已成为铜死亡关键调节基因。ZHANG等人发现,FDX1的下调对LUAD细胞的生长、凋亡和细胞周期分布没有明显影响,但可能会影响细胞的代谢。敲除FDX1主要促进糖酵解和脂肪酸氧化,并改变氨基酸代谢[5]。目前对FDX1的研究层出不穷,但对FDX1在癌症中的研究特别是胃癌中的研究仍然缺乏。因此,我们通过在胃癌中探索FDX1差异表达、预后以及免疫浸润,以期发现其在胃癌中的潜在价值。
本研究利用生物信息学发现FDX1 在多种肿瘤组织中普遍失调,在胃癌肿瘤组织中上调,而通过胃癌与正常组织中FDX1蛋白表达验证也证实了胃癌组织中FDX1显著表达高于正常组织,表明FDX1可能与胃癌的发生有密切关系。通过 Kaplan-Meier plotter 数据库分析发现,FDX1高表达患者的预后要优于低表达者,进一步进行Cox回归分析发现,FDX1低表达与高龄(年龄>65岁)、更深的组织学浸润(T分期)、区域淋巴结转移程度(N分期)、发生远处转移(M分期)程度相关,均为胃癌预后影响因素。而FDX1低表达与高龄(年龄>65岁)、M分期是胃癌患者的独立预后风险因素,且FDX1这种预后差异独立于其他临床病理因素。表明FDX1有望成为胃癌潜在的生物标志物及治疗靶点。
GSEA富集分析发现,FDX1的低表达与胃癌细胞外基质途径(ECM)显著相关,而细胞外基质(ECM)是胃肿瘤微环境的关键组成部分[9]。事实上,ECM为癌细胞提供持续的增殖信号,例如生长因子和趋化因子,并保护它们免受生长抑制物的影响,充当拮抗常规化疗药物的扩散屏障[10]。此外,ECM受体的上调会影响细胞死亡、血管生成、癌症化学抗性的下游信号通路细胞侵袭和转移[8]。因此我们推测,FDX1下调可能通过与细胞外基质串扰,从而影响胃癌细胞对细胞死亡、血管生成、癌症化学抗性的下游信号通路的激活而促进侵袭和转移,这也是为什么通过生存分析发现FDX1低表达预后更差的原因,但其潜在机制仍需要深入研究。
肿瘤微环境中的基质细胞,尤其是免疫细胞,是调节肿瘤细胞恶性行为的重要因素,越来越多的证据阐明了它们在预测癌症患者的结果和治疗效果方面的临床病理学意义。据报道,CD8+T细胞和肿瘤相关巨噬细胞的浸润促进了上皮性胃癌的进展[11]。本研究中FDX1低表达的胃癌组CD8+T细胞和巨噬细胞的浸润水平显著升高。此外,FDX1的表达与CD8+T细胞和巨噬细胞的浸润水平呈正相关,表明FDX1在调节肿瘤免疫学中具有关键作用,提示FDX1可能参与肿瘤免疫微环境调节,FDX1低表达可能促进胃癌中的免疫调节,从而促进胃癌进展及免疫逃逸。
总之,FDX1与胃癌免疫浸润水平相关,其可能通过影响巨噬细胞、NK细胞,进而导致胃癌免疫抑制状态及肿瘤进展。FDX1可以视为免疫治疗的相关靶点,并可以作为预测患者预后的标志物。本研究的不足之处是仅在表达水平方面利用胃癌细胞进行了验证。后续将进一步开展功能验证来探索FDX1对胃癌细胞的影响。本研究首次将铜死亡关键基因FDX1作为胃癌潜在标志物,也提示铜死亡与胃癌免疫及预后的潜在关系,为进一步开展靶向治疗开辟了新的方向。
