猕猴桃内生真菌Fusarium tricinctum化学成分研究
2023-01-05何隽马锦涛马蕊吴风杨诚鑫冯涛
何隽,马锦涛,马蕊,吴风,杨诚鑫,冯涛
(中南民族大学 药学院,武汉 430074)
自然生态系统中的植物与菌根真菌或真菌内生菌共生.这些共生真菌可对植物生态、适应性以及塑造植物群落产生深远影响,并对相关生物的群落结构和多样性表现出强烈影响[1].自然界中的真菌是许多结构新颖和生物活性显著的有机化合物的丰富来源[2].猕猴桃是闻名世界的水果之王,但猕猴桃溃疡病对猕猴桃植株的健康生长有极大的破坏性,其致病菌为丁香假单胞菌猕猴桃致病变种(Pseudomonas syringaepv.actinidiae,Psa).目前,仍缺乏有效的手段防治该细菌性病害.为了寻找安全有效的Psa抑制剂,本研究从猕猴桃内生菌及其次生代谢产物出发,挖掘具有拮抗Pseudomonas syringaepv.actinidiae(Psa)活性的内生菌天然产物.
镰刀菌属真菌(Fusarium)在自然界中广泛分布,所产生的霉菌毒素对人类和动物均具有显著影响.前期研究从猕猴桃健康植株中分离出一种镰刀菌属真菌Fusarium tricinctum(F.tricinctum),文献调查发现该菌的代谢产物中蕴含大量的fusagerins、chlamydosporol、enniatins、trichothecene以及其他萜类成分[3-7].镰刀菌次生代谢产物结构多样、复杂,并具有广泛的生物活性,如抗胆碱酯酶、抗细菌、抗真菌和抗癌活性[8-9].为了从F.tricinctum中找到能抑制Psa的活性分子,本文对该菌的大米发酵提取物进行了化学成分研究,共分离得到15个化合物(图1).通过核磁共振、高分辨质谱以及多种波谱学方法确定了化合物的结构,分别为:1H-indole-3-carboxaldehyde(1),indole-3-acetic acid(2),indole-3-acetic acid methyl ester(3),nicotinic acid(4),Nacetylanthranilic acid(5),4-hydroxybenzaldehyde(6),methyl 4-hydroxybenzeneacetate(7),methylphydroxyphenyl acetate(8),methyl 4-hydroxy-3-methoxyphenylacetate(9),α- hydroxy-βphenylpropionic acid(10),methyl 4-hydroxy-3,5-dimethoxybenzeneacet ate(11),3, 4, 5-trimethoxyphenylacetic acid methyl ester(12),3,7,9-trihydroxy-1-methyl-6H-dibenzo[b,d]pyran-6-one(13),enniatin B1(14)和enniatin A1(15).对化合物13~15进行了抗Psa活性筛选.
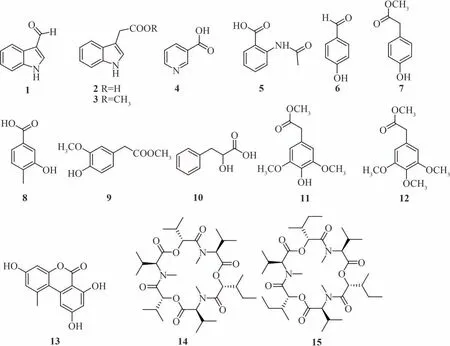
图1 化合物1~15的结构Fig.1 Chemical structuresof compounds1-15
1 实验部分
1.1 实验仪器和材料
瑞士Biotage Isolera one中压制备系统;Agilent 1200/1260高效液相色谱仪(美国);Bruker 500/600 MHz核磁共振波谱仪(德国);Bruker HCT/Esquire质谱仪(德国);TECAN spark10M酶标仪(瑞士).
薄层层析硅胶板GF254和柱层析硅胶(80~100目以及200~300目)均购自中国青岛海洋化工厂;Sephadex LH-20凝胶(瑞士Amersham biosciences);Agilent ZORBAXSB-C18柱(分析型:4.6 mm×150 mm;制备型:9.4 mm×150 mm),径粒为5μm;显色剂为香草醛10%硫酸溶液.
1.2 猕猴桃内生真菌F.tricinctum以及Psa的培养
采用固体发酵方法:大米80 g,加水100 mL,置于500 mL三角烧瓶中,于121℃灭菌锅灭菌20 min,共培养150瓶;培养条件:恒温24℃;静置,暗培养30 d.Psa由西北农林科技大学闫合博士赠送,在35℃使用LB培养基进行常规培养.
1.3 提取分离
将发酵好的F.tricinctum次级代谢产物置于2倍体积的丙酮中反复浸泡6次,每次24 h,减压浓缩除去有机溶剂,加入乙酸乙酯2 L和等体积的去离子水置于5 L分液漏斗中反复萃取5次,减压浓缩最后称取浸膏180 g.将所得浸膏于中压柱用水/甲醇(80∶20,60∶40,40∶60,30∶70,20∶80,10∶90,0∶100)梯度洗脱得5个组分(A~E),将D组分经正相硅胶柱层析用氯仿/甲醇(1∶0,50∶1,20∶1,10∶1,5∶1,0∶1)系统梯度洗脱得5个亚组分(D1~D5).
组分D5经正相硅胶柱层析(石油醚-丙酮1∶0,50∶1,20∶1,10∶1,5∶1,0∶1)分离得到5个组分,D5-1~D5-5,D5-4粗样品10 mg,经过半制备型HPLC甲醇-水体系(10%~25%,20 min)纯化得到化合物1(5 mg)和化合物2(2 mg).组分D5-3 100 mg经Sephadex-LH 20(氯仿-甲醇1∶1)层析,得到6个组分(D5-3-1~D5-3-5),其中第一个组分(D5-3-1)经正相硅胶(200~300目)乙酸乙酯:甲醇(50∶1~0∶1)洗脱,得到结晶,通过多次不同溶剂体系洗涤得到化合物3(10 mg),D5-3-4 500 mg经正相硅胶柱层析用氯仿-甲醇(30∶1~0∶1)层析,得到8个组分,D5-3-4-1~D5-3-4-8,D5-3-4-8经过制备型HPLC甲醇-水(甲酸)体系(5%~25%,20 min)得到化合物4(3 mg)、化合物5(15 mg)和化合物6(10 mg).D5-3-4-6经过HPLC甲醇-水(甲酸)体系(10%~25%,20 min),纯化得到化合物7(10 mg),化合物8(15 mg),化合物9(15 mg)和化合物10(3 mg).D5-2组分经正相硅胶柱层析(石油醚-丙酮:5∶1~0∶1),得到组分D5-2-1~D5-2-3,D5-2-2半制备型HPLC甲醇-水体系(15%~25%,25 min)得到化合物11(2 mg),化合物12(3.5 mg)和化合物13(2 mg).D5-1-1经正相柱层析得到化合物14(8 mg)和15(6 mg).
1.4 抗菌活性实验
将培养达到对数生长期的菌液稀释至1×106CFU/mL进行抗菌活性测定.采用96孔板二倍稀释法[10]检测化合物13~15对Psa的拮抗活性.将100μL稀释至1×106CFU/mL菌液分配到96孔板中.将药物二倍稀释成不同的浓度梯度(200、100、50、25、12.5、6.25、3.125、1.5625μg/mL),每3个孔作平行试验,5%DMSO作为空白对照,35℃下静置培养12 h,利用酶标仪测OD600.
2 实验结果
2.1 结构鉴定
化合物1:分子式C9H7NO,淡黄色固体.1H NMR(600 MHz,methanol-d4)δH9.88(s,J=0.9 Hz,1H),8.15(d,J=7.6 Hz,1H),8.10(s,J=1.1 Hz,1H),7.49-7.43(d,J=7.6 Hz,1H),7.31-7.21(m,2H).13CNMR(150 MHz,methanol-d4)δC186.0(d),138.3(d),137.5(s),124.3(s),123.6(d),122.2(d),121.0(d),118.7(s),111.7(d).HRESIMS m/z:146.0600[M+H]+.以上数据与文献[11]数据基本一致.故化合物1被确定为1H-indole-3-carboxaldehyde.
化合物2:分子式C10H9NO2,淡黄色固体.1H NMR(600 MHz,methanol-d4)δH7.56(d,J=7.6 Hz,1H),7.31(d,J=12.0 Hz,1H),7.14(s,1H),7.06(ddd,J=8.1,6.9,1.1 Hz,1H),6.98(td,J=7.4,6.9,1.0 Hz,1H),3.66(s,2H).13CNMR(150MHz,methanol-d4)δC178.1(s),136.6(s),127.5(s),122.9(d),120.8(d),118.2(d),118.1(s),110.6(d),109.1(s),32.4(t).HRESIMS m/z:176.0706[M+H]+.以上数据与文献[12]数据基本一致.故化合物2被确定为indole-3-acetic acid.
化合物3:分子式C11H11NO2,淡黄色粉末.1H NMR(600 MHz,methanol-d4)δH7.50(d,J=7.9 Hz,1H),7.33(d,J=8.1 Hz,1H),7.15(s,1H),7.09(t,J=7.5 Hz,1H),7.00(t,J=7.5 Hz,1H),3.76(s,2H),3.67(d,J=1.9 Hz,3H).13C NMR(150 MHz,methanol-d4)δC173.4(s),136.6(s),127.1(s),123.2(d),121.0(d),118.4(d),117.9(s),110.8(d),107.1(s),50.9(q),30.4(t).HRESIMSm/z:190.0862[M+H]+.以上数据与文献[13]数据基本一致.故化合物3被确定为indole-3-acetic acid methyl ester.
化合物4:分子式C6H5NO2,白色固体.1H NMR(600 MHz,methanol-d4)δH9.12(dd,J=2.2,0.9 Hz,1H),8.73(dd,J=5.0,1.7 Hz,1H),8.41(dt,J=7.9,1.9 Hz,1H),7.57(ddd,J=8.0,4.9,0.9 Hz,1H).13C NMR(150 MHz,methanol-d4)δC166.3(s),152.2(d),149.8(d),137.8(d),127.3(d),123.8(d).HRESIMSm/z:124.0393[M+H]+.以上数据与文献[14]数据基本一致.故化合物4被确定为nicotinic acid.
化合物5:分子式C9H9NO3,白色固体.1H NMR(500 MHz,methanol-d4)δH8.49(d,J=8.3 Hz,1H),8.06(d,J=7.8 Hz,1H),7.43(ddd,J=8.6,7.3,1.5 Hz,1H),7.11-7.05(m,1H),2.18(s,2H).13C NMR(150 MHz,methanol-d4)δC175.2(s),171.3(s),141.7(s),133.5(s),132.5(d),123.7(d),121.7(d),120.8(d),25.1(q).HRESIMSm/z:180.0655[M+H]+.以上数据与文献[15]数据基本一致.故化合物5被确定为N-acetylanthranilic acid.
化合物6:分子式C7H6O2,白色固体.1H NMR(600 MHz,methanol-d4)δH9.74(s,1H),7.76(d,J=8.7 Hz,1H),6.89(d,J=1.2,Hz,1H).13C NMR(150 MHz,methanol-d4)δC192.7(d),166.1(s),133.5(d),133.5(d),129.8(s),117.1(d).HRESIMSm/z:123.0440[M+H]+.以上数据与文献[16]数据基本一致.故化合物6被确定为4-hydroxybenzaldehyde.
化合物7:分子式C9H10O3,白色粉末.1H NMR(600 MHz,methanol-d4)δH7.04(d,J=8.5 Hz,2H),6.70(d,J=8.6 Hz,2H),3.63(d,J=0.8 Hz,3H),3.50(s,2H).13CNMR(150 MHz,methanol-d4)δC174.6(s),157.6(s),131.3(d),131.3(d),126.3(s),116.2(d),116.2(d),52.3(q),40.8(t).HRESIMSm/z:167.0702[M+H]+.以上数据与文献[17]数据基本一致.故化合物7被确定为methylp-hydroxyphenyl acetate.
化合物8:分子式C8H8O3,白色固体.1H NMR(600 MHz,methanol-d4)δH7.53(d,J=7.7 Hz,1H),7.11(t,J=7.9Hz,1H),7.04(dd,J=8.1,1.4Hz,1H),2.23(s,3H).13C NMR(150 MHz,methanol-d4)δC171.6(s),149.9(s),126.5(d),126.1(d),125.5(d),122.2(d),121.6(s),22.2(q).HRESIMSm/z:153.0546[M+H]+.以上数据与文献[18]数据基本一致.故化合物8被确定为methyl 4-hydroxybenzeneacetate.
化合物9:分子式C10H12O4,白色粉末.1H NMR(500 MHz,methanol-d4)δH6.84(d,J=1.9 Hz,1H),6.72(d,J=8.0 Hz,1H),6.68(dd,J=8.1,1.9 Hz,1H),3.83(d,J=1.1 Hz,3H),3.66(d,J=0.9 Hz,3H),3.54(s,2H).13CNMR(125 MHz,methanol-d4)δC174.5(s),148.9(s),146.7(s),126.9(s),122.9(d),116.1(d),113.9(d),56.3(q),52.4(q),41.2(t).HRESIMSm/z:197.0808[M+H]+.以上数据与文献[19]数据基本一致.故化合物9被确定为methyl 4-hydroxy-3-methoxyphenylacetate.
化合物10:分子式C9H10O3,白色粉末.1H NMR(500 MHz,methanol-d4)δH7.19(d,J=4.3 Hz,4H),7.12(d,J=4.2 Hz,1H),4.25(dd,J=8.2,4.2 Hz,1H),3.03(dd,J=13.9,4.2 Hz,1H),2.82(dd,J=13.9,8.1 Hz,1H).13CNMR(150 MHz,methanol-d4)δC177.3(s),138.9(d),130.5(d),129.2(d),127.4(d),72.9(d),41.6(t).HRESIMS m/z:167.0702[M+H]+.以上数据与文献[20]数据基本一致.故化合物10被确定为α-hydroxy-βphenylpropionic acid.
化合物11:分子式C11H14O5,白色粉末.1H NMR(500 MHz,methanol-d4)δH6.54(s,2H),3.82(s,6H),3.67(s,3H),3.55(s,2H).13CNMR(150 MHz,methanol-d4)δC173.0(s),147.8(s),147.8(s),134.2(d),124.7(d),106.2(s),106.2(s),55.3(q),55.3(q),51.1(q),40.2(t).HRESIMS m/z:227.2354[M+H]+.以上数据与文献[21]数据基本一致.故化合物11被确定为methyl 4-hydroxy-3,5-dimethoxybenzeneacetate.
化合物12:分子式C12H16O5,白色固体.1H NMR(500 MHz,methanol-d4)δH6.58(s,2H),3.82(s,3H),3.74(s,3H),3.68(s,3H),3.59(s,2H).13C NMR(150 MHz,methanol-d4)δC174.0(s),154.4(s),154.4(s),131.6(d),122.2(d),107.7(s),107.7(s),61.0(q),56.5(q),56.5(q),52.5(q),41.8(t).HRESIMSm/z:241.1070[M+H]+.以上数据与文献[22]数据基本一致.故化合物12被确定为3,4,5-trimethoxyphenylacetic acid methyl ester.
化合物13:分子式C14H10O5,黄色粉末.1H NMR(500 MHz,methanol-d4)δH7.26(d,J=2.1 Hz,1H),6.69(d,J=2.7 Hz,1H),6.61(d,J=2.6 Hz,1H),6.36(d,J=2.0 Hz,1H),2.76(s,3H).13C NMR(150 MHz,methanol-d4)δC167.0(s),166.9(s),166.2(s),159.8(s),154.4(s),140.0(s),139.8(s),118.5(s),110.9(d),105.5(s),102.7(d),101.9(d),99.1(s),25.8(q).HRESIMSm/z:259.0601[M+H]+.以上数据与文献[23]数据基本一致.故化合物13被确定为3,7,9-trihydroxy-1-methyl-6H-dibenzo[b,d]pyran-6-one.
化合物14:分子式C33H57N3O9,白色晶体.1H NMR(600 MHz,CDCl3)δH5.16(d,J=8.5 Hz,1H),5.12(dd,J=14.3,8.6 Hz,2H),4.71(d,J=9.7 Hz,1H),4.50(d,J=9.7 Hz,1H),4.45(d,J=9.7 Hz,1H),2.22-2.36(m,5H),2.09-2.06(m,1H),1.89(s,2H),1.26(m,1H),1.07(d,J=6.6 Hz,6H),1.03-0.92(m,20H),0.91-0.86(m,9H).13CNMR(125 MHz,CDCl3)δC113CNMR(125 MHz,CDCl3)δC170.3(s),169.3(s),77.2(d),75.8(d),75.4(d),63.5(d),63.4(d),61.5(d),33.8(d),33.4(d),32.7(q),29.9(d),29.9(q),28.0(q),27.9(d),25.3(t),20.5(q),19.4(q),18.7(q),18.6(q),18.6(q),18.4(q),16.1(q),10.8(q).HRESIMS m/z:676.4143[M+Na]+.以上数据与文献[24]数据基本一致.故化合物14被确定为enniatin B1.
化合物15:分子式C36H63N3O9,白色固体.1H NMR(600 MHz,CDCl3)δH5.11(d,J=8.3 Hz,1H),4.64(d,J=9.6 Hz,1H),3.11(s,3H),2.25(q,J=7.1 Hz,1H),2.06(d,J=7.1 Hz,1H),1.42(ddd,J=13.8,7.5,3.3 Hz,1H),1.14-1.07(m,1H),1.00(d,J=6.7 Hz,3H),0.97(d,J=6.6 Hz,1H),0.94(d,J=6.8 Hz,3H),0.86(t,J=7.4 Hz,4H).13CNMR(150 MHz,CDCl3)δC170.60(s),169.58(s),75.73(d),61.92(d),34.11(d),33.12(d),30.07(d),25.59(t),18.74(q),18.63(q),16.39(q),11.07(q).HRESIMSm/z:704.4456[M+Na]+.以上数据与文献[25]数据基本一致.故化合物15被确定为enniatin A1.
2.2 抗菌活性结果
化合物1~12均为常见的小分子化合物,因此本文只对非常见化合物13~15做了抗菌活性,结果表明化合物13~15均表现出一定的抗菌活性(表1).

表1 化合物13~15的抗菌活性(MIC,μg/mL)Tab.1 Anti-Psa activities of compounds 13-15
3 结语
通过对猕猴桃内生真菌(Fusarium tricinctum)次级代谢产物的研究,分离纯化得到化合物15个,其中含氮芳香类化合物5个,酚类化合物8个以及环肽类2个,所有化合物均是首次从该菌种中分离得到.活性研究发现化合物14对猕猴桃溃疡病致病菌Psa有一定的抑制活性.该研究丰富了猕猴桃内生真菌化学成分的结构类型,也为从猕猴桃内生菌中挖掘抗菌活性物质提供了参考方法.
