载脂蛋白E基因型对急性大动脉粥样硬化性脑卒中血清炎症水平影响
2023-01-05田冰洁殷令妮张寅飞
田冰洁,殷令妮,张寅飞
卒中是世界范围内重要的公共卫生问题。虽然在一些发达国家和地区,卒中的发病率有所下降[1]。但在中国,卒中仍然是致死的首位原因,并导致严重神经功能缺损及残疾[2]。除高血压、糖尿病、肥胖、吸烟等危险因素,目前很多研究发现载脂蛋白E(apolipoprotein E,ApoE)基因型也与卒中风险相关。
由于存在两个单核苷段多态性位点,rs429358和rs7412,ApoE基因存在三种等位基因(ε2、ε3、ε 4),组成6种基因型(ε2∕ε2、ε2∕ε3、ε3∕ε3、ε2∕ε4、ε3∕ε 4、ε4∕ε4)[3]。三种等位基因在世界范围内分布不同,其中ε3最为常见,亚洲在85%左右,ε4在欧洲和亚洲的分布存在南北梯度,在我国南部地区<10%,北部地区可以高达25%,ε2比例最低,约7.3%左右[4]。Wei等[5]纳入81项病例对照研究(29 506例病例和32 628例对照)的Meta分析结果表明ApoEε 4增加缺血性卒中风险(OR=1.58),而ApoEε3对缺血性卒中具有保护作用(OR=0.77)。Zhao等[6]对我国西北汉族缺血性卒中人群进行了TOAST(Trial of Org10172 in Acute Stroke Treatment)分型后的亚组分析,结果发现ε4等位基因(P=0.047,OR=1.61)及ε 4∕ε4基因型(P=0.017,OR=16.53)与大动脉粥样硬化性脑卒中(LAA)相关,ε2则对此型卒中具有保护性意义(P=0.044,OR=0.50,);ε4∕ε4基因也可增加小动脉闭塞性卒中的风险[P=0.028,OR=11.30,95%CI:(1.31,97.72)],但在心源性卒中和其他原因所致卒中组中未发现ApoE基因多态性与其相关性。虽然很多研究发现ApoE基因型与缺血性卒中风险相关,但其具体的机制并未明确。一方面作为载脂蛋白参与脂质运输[7],可影响动脉粥样硬化进程[8]。另一方面ApoE与神经炎症相关[9],而神经炎症也是卒中重要的病理机制之一[10],因而推测ApoE可能通过调节炎症反应参与卒中的病理进程。
本课题选择与ApoE基因型相关度较高的LAA人群,分析与卒中密切相关的白细胞介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子-α(TNF-α)、IL-10[10]等炎性因子在不同ApoE基因型之间的差异,探讨ApoE基因多态性影响卒中的病理机制。
1 资料与方法
1.1 一般资料2018年10月至2020年5月上海健康医学院附属嘉定区中心医院收住首次缺血性卒中病人80例。入选标准:①符合1995年全国第四届脑血管病学术会议制订的脑梗死诊断标准[11],且头颅磁共振证实有新发病灶;②首次卒中,发病时间≤7 d;③符合TOAST(trial of org10172 in acute stroke treatment)分型[12]中LAA诊断标准。排除标准:①其他类型的卒中:如小动脉闭塞性卒中(SAA)、心源性脑栓塞(CE)、其他原因所致的卒中(SOE)及病因未明的卒中(SUE);②急性感染,肝炎、结核等慢性炎症性疾病,肿瘤及自身免疫性疾病;③近期应用抗生素及免疫抑制药物。对照组为无卒中史的健康体检者74例,且无上述疾病史及特殊用药史。入组病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
入组卒中人群根据美国国立卫生研究院卒中量表(NIHSS)评分,按照神经功能缺损程度分为(≤3分)、中(4~11分)、重(≥12分)三组[13],轻度组33例,中度组38例,重度组9例。在头颅MRI的DWI序列上,根据Pullicino提出的公式[14]计算梗死灶体积,将入组卒中人群分为小梗死组(<5 cm3)、中梗死组(5~15 cm3)、大梗死组(>15 cm3)[15-16],其中小梗死组34例,中梗死组31例,大梗死组15例。
1.2 实验室检测入组人群均于发病第7天清晨抽取空腹血,采用TIANamp Blood DNA Kit(DP348-02∕50 preps,TIANGEN公司)进行DNA提取,-20℃冻存。50 μL PCR扩增体系:1 μL DNA,1 μL引物(正向序列5'-GCCTACAAATCGGAACTGG-3'、反向序 列5'-CCTGCTCCTTCACCTCGTC-3',上 海Sangon),1 μL脱氧核糖核苷三磷酸(dNTP),5 μL Taq缓冲液,5 μL 25 mmol氯化镁(MgCl2),0.5 μL Taq脱氧核糖核酸(DNA)聚合酶(5 U∕μL)和35.5 μL水。94℃预变性3 min,94℃变性30 s,58℃退火30 s,72℃延伸40 s,72℃修复延伸5 min,循环35次,扩增ApoE基 因。ABI 3730xl DNA Analyzer(Sangon Biotech)进行基因测序。-80℃冻存血清,Procarta-Plex Human High Sensitivity Panel(9 plex,96 tests,eBioscience)试剂盒同时检测血清中检测血清IL-1β、IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17a、干扰素-γ(IFN-γ)、TNF-α水平。luminex 200读板记录数据。
1.3 统计学方法χ2检验或Fisher确切概率法对离散型变量两组间比较。连续性变量两样本资料采用t检验分析,多样本资料进行单因素方差分析;连续性变量用±s表示;logistic逐步回归分析各危险因素与卒中相关性。双侧P<0.05认为差异有统计学意义(stata 10软件)。
2 结果
入院人群基本信息见表1,两组间年龄、性别匹配,LAA组高血压的(P=0.041)比例显著高于对照组。
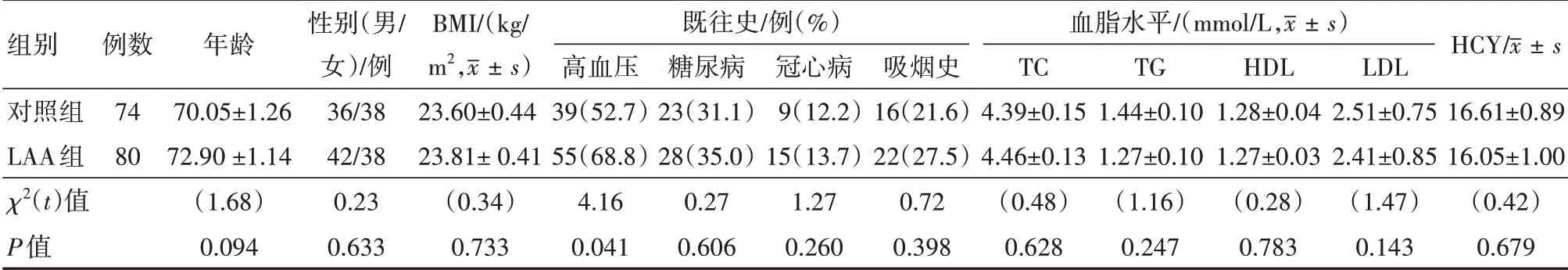
表1 入组人群基本信息
入组人群ApoE基因型分布见表2。与对照组相比,LAA组中ApoEε3∕ε4基因型(P=0.035)和等位基因ApoEε4比例(P=0.031)显著较高。对照组ApoE等位基因频率符合哈迪-温伯格平衡定律(P>0.05)。logistic逐步回归矫正诸多混杂因素影响后,ApoEε4与LAA仍 显 著 相 关[P=0.020,OR=2.94,95%CI:(1.18,7.32)],此外高血压也与LAA显著相关[P=0.005,OR=2.80,95%CI:(1.38,6.12)]见表3。
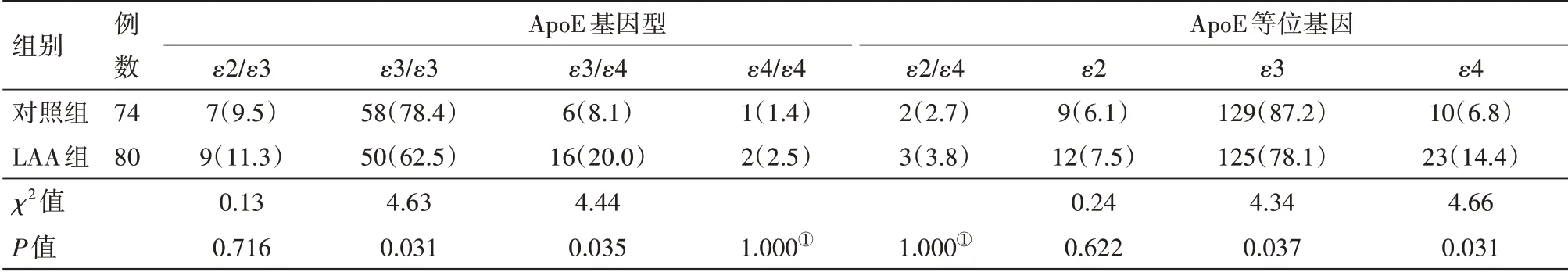
表2 大动脉粥样硬化性脑卒中(LAA)组及对照组ApoE基因型分布∕例(%)
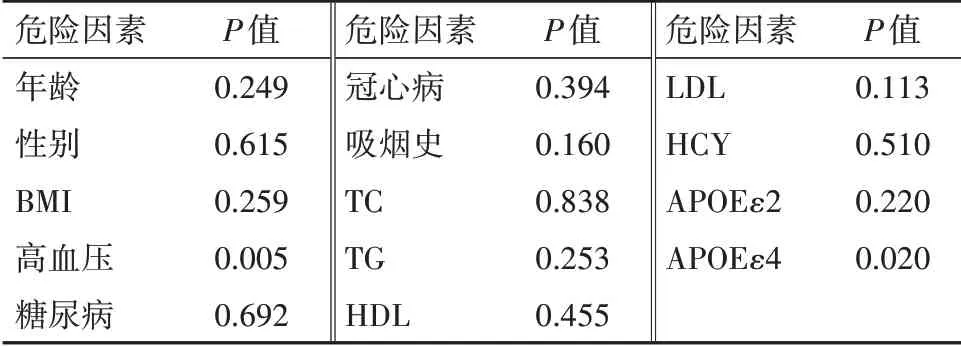
表3 logistic逐步回归分析LAA危险因素
Luminex检测血清IL-1β、IL-2、IL-4、IL-6、IL-10、IL-12p70、IL-17a、IFN-γ、TNF-α水平。如表4所示,LAA组血清IL-1β(t=2.02,P=0.046)、IL-6(t=2.43,P=0.017,)、TNF-α(t=3.18,P<0.001)水平显著高于对照组,IL-10显著低于对照组(t=2.10,P=0.038)。
表4 LAA组与对照组炎性因子水平∕(ng∕L
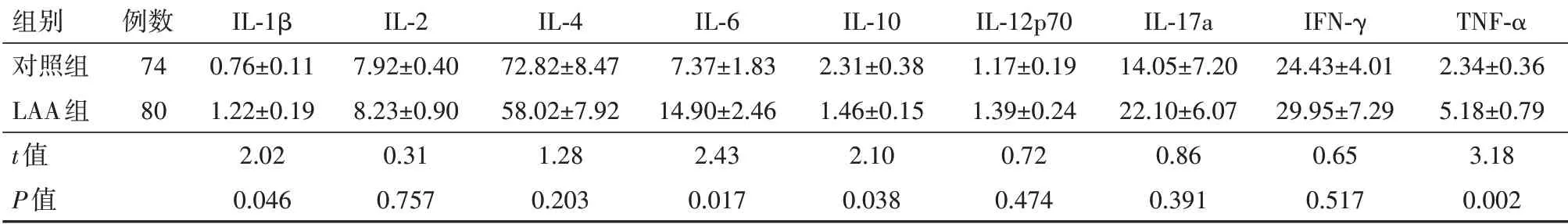
表4 LAA组与对照组炎性因子水平∕(ng∕L
注:IL为白细胞介素,IFN-γ为干扰素,TNF-α为肿瘤坏死因子-α。
组别对照组LAA组t值P值例数74 80 IL-1β 0.76±0.11 1.22±0.19 2.02 0.046 IL-2 7.92±0.40 8.23±0.90 0.31 0.757 IL-4 72.82±8.47 58.02±7.92 1.28 0.203 IL-6 7.37±1.83 14.90±2.46 2.43 0.017 IL-10 2.31±0.38 1.46±0.15 2.10 0.038 IL-12p70 1.17±0.19 1.39±0.24 0.72 0.474 IL-17a 14.05±7.20 22.10±6.07 0.86 0.391 IFN-γ 24.43±4.01 29.95±7.29 0.65 0.517 TNF-α 2.34±0.36 5.18±0.79 3.18 0.002
比较不同程度神经功能缺损LAA人群的血清炎症水平差异,见表5所示,重度神经功能缺损组IL-1β水平显著高于轻度组(P=0.004)和对照组(P<0.001),中度组IL-1β水平显著高于对照组(P=0.039)。重度组IL-6水平显著高于轻度组(P=0.003)及对照组(P<0.001),中度组IL-6水平显著高于对照组(P=0.030)。重度组TNF-α水平显著高于轻度组(P<0.001)和对照组(P<0.001),中度组TNFα水平亦显著高于对照组(P=0.001)。神经功能缺损较为严重的人群,呈现较高的炎症水平。
表5 LAA后不同程度神经功能缺损血清炎性因子水平∕(ng∕L
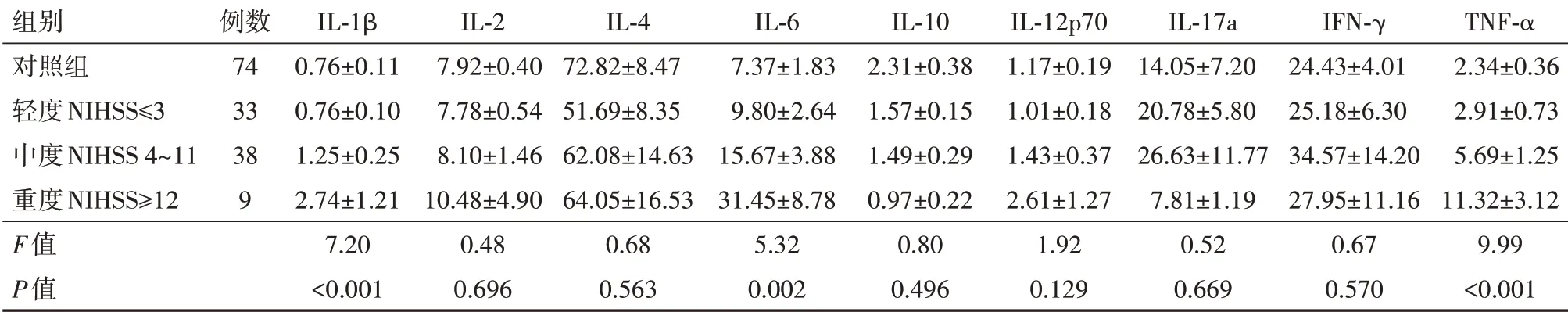
表5 LAA后不同程度神经功能缺损血清炎性因子水平∕(ng∕L
注:IL为白细胞介素,IFN-γ为干扰素,TNF-α为肿瘤坏死因子-α。
组别对照组轻度NIHSS≤3中度NIHSS 4~11重度NIHSS≥12 F值P值例数74 33 38 9 IL-1β 0.76±0.11 0.76±0.10 1.25±0.25 2.74±1.21 7.20<0.001 IL-2 7.92±0.40 7.78±0.54 8.10±1.46 10.48±4.90 0.48 0.696 IL-4 72.82±8.47 51.69±8.35 62.08±14.63 64.05±16.53 0.68 0.563 IL-6 7.37±1.83 9.80±2.64 15.67±3.88 31.45±8.78 5.32 0.002 IL-10 2.31±0.38 1.57±0.15 1.49±0.29 0.97±0.22 0.80 0.496 IL-12p70 1.17±0.19 1.01±0.18 1.43±0.37 2.61±1.27 1.92 0.129 IL-17a 14.05±7.20 20.78±5.80 26.63±11.77 7.81±1.19 0.52 0.669 IFN-γ 24.43±4.01 25.18±6.30 34.57±14.20 27.95±11.16 0.67 0.570 TNF-α 2.34±0.36 2.91±0.73 5.69±1.25 11.32±3.12 9.99<0.001
表6比较了LAA人群不同梗死灶体积之间血清炎症水平,结果发现大梗死组IL-1β水平显著高于小梗死组(P=0.001)和对照组(P<0.001)。中梗死组IL-6水平显著高于小梗死组(P=0.044)、及对照组(P=0.003)。大梗死组IL-12p70水平显著高于小梗死组(P=0.032)及对照组(P=0.019)。大梗死组TNF-α水平显著高于小梗死组(P<0.001)和对照组(P<0.001),中梗死组TNF-α水平亦显著高于小梗死组(P=0.044)及对照组(P=0.003)。梗死灶较大的人群呈现较高的炎症水平。
表6 LAA后不同病灶大小血清炎性因子水平∕(ng∕L
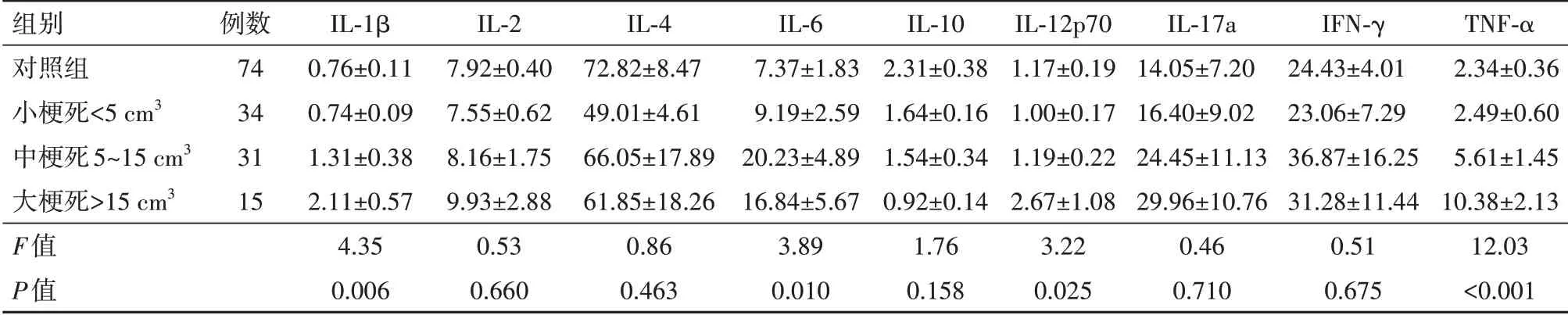
表6 LAA后不同病灶大小血清炎性因子水平∕(ng∕L
注:IL为白细胞介素,IFN-γ为干扰素,TNF-α为肿瘤坏死因子-α。
组别对照组小梗死<5 cm3中梗死5~15 cm3大梗死>15 cm3 F值P值例数74 34 31 15 IL-1β 0.76±0.11 0.74±0.09 1.31±0.38 2.11±0.57 4.35 0.006 IL-2 7.92±0.40 7.55±0.62 8.16±1.75 9.93±2.88 0.53 0.660 IL-4 72.82±8.47 49.01±4.61 66.05±17.89 61.85±18.26 0.86 0.463 IL-6 7.37±1.83 9.19±2.59 20.23±4.89 16.84±5.67 3.89 0.010 IL-10 2.31±0.38 1.64±0.16 1.54±0.34 0.92±0.14 1.76 0.158 IL-12p70 1.17±0.19 1.00±0.17 1.19±0.22 2.67±1.08 3.22 0.025 IL-17a 14.05±7.20 16.40±9.02 24.45±11.13 29.96±10.76 0.46 0.710 IFN-γ 24.43±4.01 23.06±7.29 36.87±16.25 31.28±11.44 0.51 0.675 TNF-α 2.34±0.36 2.49±0.60 5.61±1.45 10.38±2.13 12.03<0.001
进一步分析在LAA人群中中ApoE基因型对血清水平的影响(表7)。结果表明,ApoEε4+组血清IL-6(t=2.30,P=0.024)、IL-12p70(t=2.01,P=0.049)水平高于ApoEε3∕ε3组,TNF-α(t=2.66,P=0.012)水平显著高于ApoEε2+组;而ApoEε4+(t=3.56,P=0.001)和ApoEε3∕ε3组(t=2.13,P=0.038)IL-10水平则显著低于ApoEε2+组。
表7 LAA人群ApoE基因型之间血清炎症水平差异∕(ng∕L
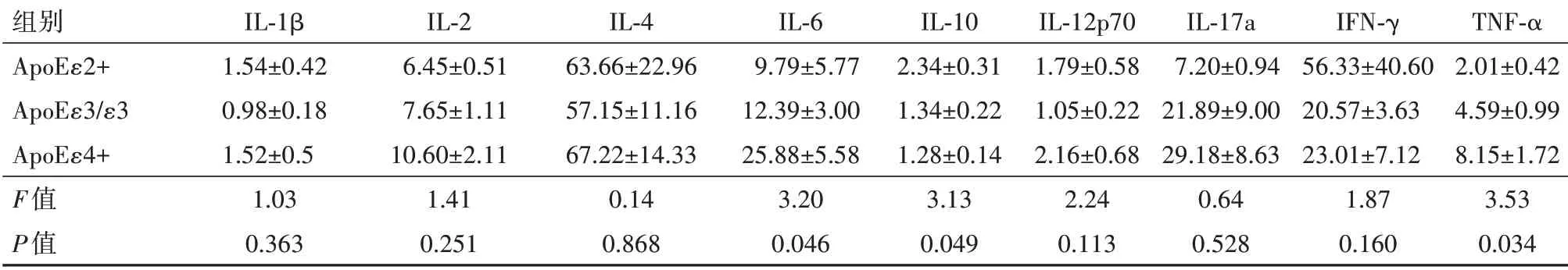
表7 LAA人群ApoE基因型之间血清炎症水平差异∕(ng∕L
注:IL为白细胞介素,IFN-γ为干扰素,TNF-α为肿瘤坏死因子-α。
组别ApoEε2+ApoEε3∕ε3 ApoEε4+F值P值IL-1β 1.54±0.42 0.98±0.18 1.52±0.5 1.03 0.363 IL-2 6.45±0.51 7.65±1.11 10.60±2.11 1.41 0.251 IL-4 63.66±22.96 57.15±11.16 67.22±14.33 0.14 0.868 IL-6 9.79±5.77 12.39±3.00 25.88±5.58 3.20 0.046 IL-10 2.34±0.31 1.34±0.22 1.28±0.14 3.13 0.049 IL-12p70 1.79±0.58 1.05±0.22 2.16±0.68 2.24 0.113 IL-17a 7.20±0.94 21.89±9.00 29.18±8.63 0.64 0.528 IFN-γ 56.33±40.60 20.57±3.63 23.01±7.12 1.87 0.160 TNF-α 2.01±0.42 4.59±0.99 8.15±1.72 3.53 0.034
由于既往有研究表明高血压与炎症也相关,为了排除高血压作为混杂因素的影响,比较LAA组不同ApoE基因型高血压人群的分布,ε2+有8例(66.7%),ε3∕ε3有35例(70.0%),ε4有13例(61.9%),三组之间差异无统计学意义(χ2=0.45,P=0.800)。
3 讨论
本研究发现LAA组中ApoEε3∕ε4基因型和等位基因ApoEε4分布比例显著高于对照组。logistic逐步回归矫正诸多混杂因素影响后,ApoEε4与LAA显著相关。Sudlow等[17]对31项研究进行Meta分析,结果表明相较于白人或其他人群,亚洲人群中ε4与缺血性卒中呈现较高的相关性,且ε4与大血管性卒中的相关度较高[OR95%CI:1.33(0.99,1.78)],而在小动脉性卒中、心源性卒中及原因不明的卒中等亚型中未发现相关性。Kumar等[18]入组了250例来自北印度卒中病例,研究结果也表明ApoEε4与大血 管 性 卒 中 风 险 相 关[OR=2.57,95%CI:(1.72,3.85),P=0.001]。上述研究与我们的研究结果类似。但也有一些研究得出不一致的结论,比如希腊Chatzistefanidis等[19]的研究入组了329例首次缺血性卒中的病人,仅在女性人群中发现ε3∕ε3对于卒中具有一定的保护意义中[OR95%CI:0.67(0.48,0.95)]。来自印度南方人群中的一项研究分析不同卒中亚型的ApoE基因型分布,结果发现与对照组相比,在颅内LAA组中ε4的分布显著较低,ε3显著较高[P=0.01,OR=1.6,95%CI:(1.1,2.4)],与我们的研究结果相反[20]。其原因可能是入组人群的种族、数量及研究方法等方面差异。此外在本研究中还发现高血压也与LAA显著相关,但其他危险因素如糖尿病、吸烟史、BMI、血脂等未发现与LAA相关性,可能由于样本量较小的原因。
炎症应答在缺血性卒中的病理进程中发挥着重要的作用。急性血管闭塞后,缺血的脑组织及免疫细胞释放活性氧,激活内皮血管内皮细胞,造成氧化应激及炎症瀑布样反应[21]。血脑屏障(BBB)破坏,中性粒细胞、T细胞等血源性细胞浸润及小胶质细胞激活[22],激活的小胶质细胞一方面吞噬坏死组织、细胞碎片,另一方面释放TNF-α、IL-6等促炎因子以及活性氧(ROS)、一氧化氮(NO)等,进一步加重氧化应激[23],此外,缺氧和氧化应激可诱导NFκB、缺氧诱导因子1(HIF1)等转录因子合成,增加一系列促炎和抗炎因子的表达[24]。这些炎性因子还可以促进内皮细胞表达黏附分子,募集更多的外周白细胞,正反馈促进更多炎性因子合成,最终通过与相应的炎性因子受体相作用,激活凋亡信号通路,促进神经元死亡,造成梗死灶面积扩大,加重神经功能缺损。Basic等[25]研究发现急性缺血性卒中12 h内,卒中组促炎因子IL-6水平为8(4,21)ng∕L,显著高于对照组8(4,21)ng∕L,而抗炎因子IL-10水平为13.5(6.9,20.9)ng∕L,显著低于对照组21.5(12.4,27.5)ng∕L,两组间TNF-α水平无明显差别。Ormstad等[26]的研究表明急性缺血性卒中人群血清IL-1ra、IL-6、IL-8、IL-9、IL-10、IL-12、IL-18及CXCL1水平显著升高,IL-1β、IL-2、IL-4、TNF-α无明显变化。与上述结果类似,本研究也发现LAA组血清IL-1β、IL-6、TNF-α显著高于对照组,IL-10显著低于对照组。也有研究发现卒中人群TNF-α水平升高,并且与梗死灶体积[27],NIHSS评分呈正相关[28]。本研究也发现重度神经功能缺损组或者梗死灶较大的LAA人群呈现较高的IL-1β、TNF-α等炎性因子水平,表明炎症反应强度与病情严重程度及梗死体积相关,再次证明炎症应答促进卒中的病理进程及病情进展。
虽然ApoE与缺血性卒中相关,但其具体机制并未明确。ApoE是299个氨基酸的糖蛋白,存在E2、E3和E4三种亚型,其区别在于112和158位氨基酸残基不同[29]。这些区别会影响ApoE对脂蛋白选择性及其与相应受体结合的敏感性,造成血脂水平不同,从而影响动脉粥样硬化的风险[7]。此外,目前许多研究发现ApoE与神经炎症相关,从整体上看,ApoE是抑制炎症应答的[30]。将小鼠的单核-巨噬细胞系与人类重组ApoE共培养,再分别用脂多糖(LPS)和聚肌苷-聚胞苷酸(Poly I∶C)刺激,结果显示相较于未用ApoE处理的对照组,实验组细胞IL-6、IL-1β和TNF-α的分泌水平显著降低,而且呈现ApoE剂量依赖性[31]。Li等[32]的研究发现ApoE可以通过增强单核和巨嗜细胞miR-146a水平抑制NFκB介导的炎症反应。但ApoE不同基因型对炎症应答的影响不同。Gale等[33]抽取基因型ApoEε3∕ε4及ApoEε3∕ε3健康志愿者的外周血,然后分别和热灭活的单核细胞细胞增多性李斯特菌、LPS等共同孵育,ApoEε3∕ε4组TNF-α、IL-1β、IL-6、IL-17、IFN-γ、MIP-1α等细胞因子水平显著较高。Maezawa等[34]将人类ApoE靶向替换(ApoE-TR)小鼠的小胶质细胞暴露 于LPS 12 h后,IL-6、TNF-α等 的 分 泌水 平ApoE4-TR>ApoE3-TR>ApoE4-TR。分别直接向人类ApoE-TR和ApoE基因敲除(KO)小鼠脑室内注射LPS,与ApoE2-TR、ApoE3-TR相 比,ApoE-KO和ApoE4-TR小鼠海马的小胶质细胞、星形胶质细胞呈现较高的活化水平,且海马组织中促炎因子TNF-α、IL-1β、IL-6分泌水平也高于其余两组,表明在CNS中ApoE4抗炎作用减弱,因而呈现较高的炎症水平[35]。
综上所述,ApoE参与炎症应答,且神经炎症是缺血性卒中重要的病理机制,推测ApoE可能也通过调节神经炎症参与缺血性卒中的病理进程。本研究 发 现LAA组中ApoEε4+人 群 血 清IL-6、IL-12p70水平高于ApoEε3∕ε3人群,TNF-α水平显著高于ApoEε2+人群;而ApoEε4+和ApoEε3∕ε3人群IL-10水平则显著低于ApoEε2+人群,表明ApoEε4呈现较高炎症水平,而ApoEε2基因型炎症水平相对较低,与上述基础研究结类似。其余的炎性因子在不同基因型之间差异无统计学意义,其原因一方面可能是缺血性卒中急性期,血清中不同炎性因子水平发生改变的时间不同,另一方面可能与炎性因子、免疫细胞等相互作用相关。
另外由于既往有研究表明炎症反应也是高血压的病理机制之一,TNF-α、IL-1β、IL-6、CRP等炎症标志物在高血压人群中也有显著升高[36-37],为了排除高血压作为混杂因素的影响,我们还比较了LAA组不同ApoE基因型高血压人群的分布,确定三组之间高血压分布差异无统计学意义。
目前在卒中人群中分析ApoE基因型对血清炎症标志物影响的研究较少,也是本课题的创新之处。仅有韩国的一项研究发现缺血性卒中ApoEε2携带人群MMP-9水平(181.8±215.8)μg∕L显著高于非ApoEε2携带人群(103.0±106.2)μg∕L[38]。在其他疾病模型中,如在冠心病发现ApoEε4与较低的IL-10水平相关[39],ApoEε4+阿尔茨海默病病人外周血单个核细胞分泌的IL-1β显著较高[40]。从上述研究可以看出,目前关于ApoE基因型对血清炎症水平影响的研究结论并不一致,且以缺血性卒中为模型的研究较少,进一步探究有助于深入了解ApoE与卒中相关的病理机制,探索干预的靶点。
本研究依然有不足之处,一方面是样本量较小;另一方面,虽已经排除急性感染、免疫系统疾病等影响炎症水平的疾病,但潜伏期感染、个人合并症及免疫基础不同,造成炎性因子水平的变异较大,也会引起结果的偏差。此外,目前为横断面研究,可进一步动态随访卒中恢复期血清炎性因子的变化,探讨ApoE基因型与卒中预后及血清炎症水平三者之间相关性。
本研究中ApoEε4是LAA重要的危险因素,ApoEε4+人群呈现较高炎症水平,表明ApoE可能通过参与炎症应答在缺血性卒中病理进程中发挥重要的作用。
