三碘甲状腺原氨酸在脑外伤预后模型中的研究价值
2023-01-05张晟胡方琪王成张良嘉周辉
张晟,胡方琪,王成,张良嘉,周辉
创伤性脑损伤(traumatic brain injury,TBI)被定义为由外力引起的大脑功能的改变,在世界各地每年发生超过5 000万次[1],因高致死率和致残率的特点,成为严重的公共健康问题。预测模型是创伤性脑损伤治疗和长期管理的基础[2],利用预后模型早期预测病人预后意义重大。据综述报道,TBI急性期容易出现三碘甲状腺原氨酸(T3)水平降低,且与预后不良有一定相关性,但还未有研究将其纳入TBI预后模型[3]。因此,本研究验证了T3水平与预后的关系,并将其纳入预后模型中,观测预后模型的性能。
1 资料与方法
1.1 一般资料回顾性分析2018年6月至2021年5月徐州医科大学附属连云港医院收治的中、重度TBI病人临床资料。纳入标准:(1)明确脑外伤病史;(2)年龄≥18岁;(3)GCS评分≤12分。排除标准:(1)有甲状腺疾病史或近期有激素服用史;(2)入院时离发病时间≤6 h;(3)开放性脑损伤、严重多发伤;(4)既往脑外伤手术史或入院前已在外院行手术治疗;(5)入院24 h内死亡;(6)合并严重感染者;(7)临床资料不全及失访病人。病人或其近亲属知情同意。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 研究因素及预后判断收集病人的以下资料:一般情况,包括年龄,入院时格拉斯哥昏迷量表(GCS)评分,瞳孔对光反射情况,致伤原因,既往情况(包括高血压,糖尿病,以及近1周内抗凝、抗血小板药物服用史);影像学表现,包括出血类型(硬膜下出血,硬膜外出血,脑内出血),出血量,脑室出血,鞍上池受压情况,蛛网膜下腔出血,计算赫尔辛基CT(HCT)评分,具体算法为硬膜下出血记2分,脑内出血计2分,硬膜外出血计-3分,出血体积大于25 cm3记2分,脑室出血计3分,鞍上池正常计0分,鞍上池受压计1分,鞍上池消失计5分,总分-3~14分。。实验室指标,包括D2-聚体,纤维蛋白原(FIB),血小板,血红蛋白,白细胞,血糖,T3,游离总甲状腺素(FT4)。影像学检查以入院时头颅CT为准,实验室检查以第2日清晨8点采血检验结果为准。
预后判断:以出院后6个月格拉斯哥预后评分(GOS)为判断预后的标准,GOS评分1~3分被认为预后不良,GOS评分4~5分被认为预后良好。6个月GOS评分由门诊随访,电话随访获得。
1.3 统计学方法应用SPSS 25.0和R语言4.1.1进行统计分析,按4∶1比例随机将研究对象分为模型组与验证组。连续性变量正态分布以±s表示,非正态分布以M(P25,P75)表示,两组间比较采用独立样本t检验。分类变量采用百分率表示,两组间采用±s检验。单因素分析比较各个预测因素在两组间的差异。将差异有统计学意义的指标进行共线性筛选及逐步回归确定最终纳入预后模型的因素,建立logistic回归模型,生列线图。采用自举法和重复采样法进行模型的内部验证。模型的性能以敏感性、特异性、准确性、受试者工作特征曲线(ROC曲线)曲线下面积等指标评价。P<0.05差异有统计学意义。
2 结果
2.1 单因素分析结果共计319名病人纳入模型组,以GOS评分为预后标准,187名病人预后良好,132名病人预后不良。单因素分析结果示年龄,GCS评分,HCT评分,D2-聚体,FIB,血红蛋白,白细胞,血糖,T3,瞳孔对光反射,抗凝药服用史,创伤性蛛血在预后良好组与预后不良组差异有统计学意义。而血小板,FT4,受伤方式,性别,高血压,糖尿病在两组间差异无统计学意义。模型组预后不良单因素分析结果见表1。
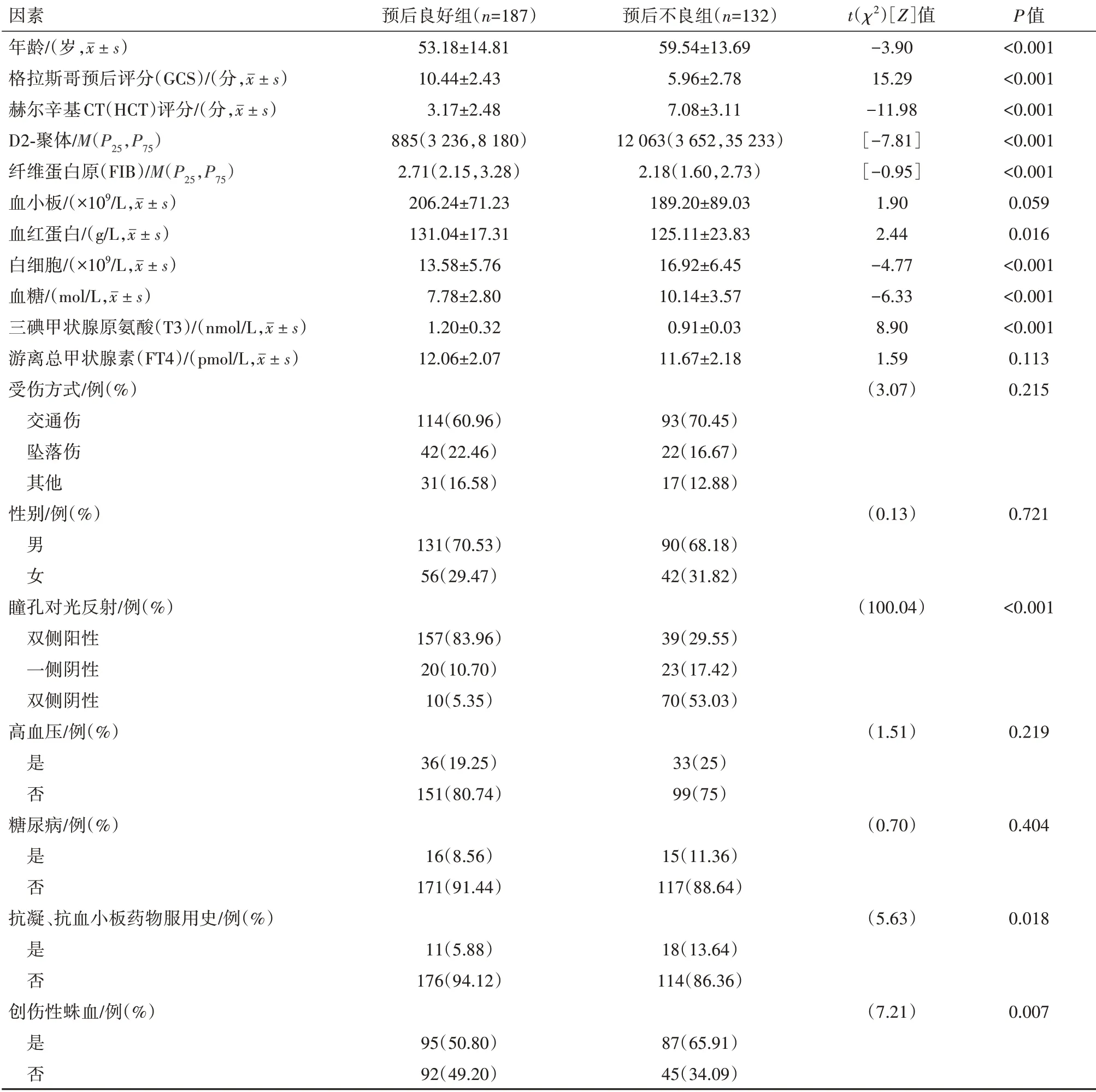
表1 模型组创伤性脑损伤预后不良单因素分析结果
2.2 模型建立与多因素分析结果将单因素分析有意义的指标进行共线性筛选及逐步回归后,年龄,GCS评分,瞳孔对光反射双侧阴性,HCT评分,抗凝、抗血小板药服用史,白细胞,T3纳入模型分析。模型建立:(1)模型A,由年龄+GCS评分+瞳孔对光反射组成;(2)模型B,在模型A的基础上增加HCT评分及抗凝,抗血小板药物服用史;(3)模型C,在模型B的基础上增加白细胞,T3指标。多因素分析结果及模型建立见表2。
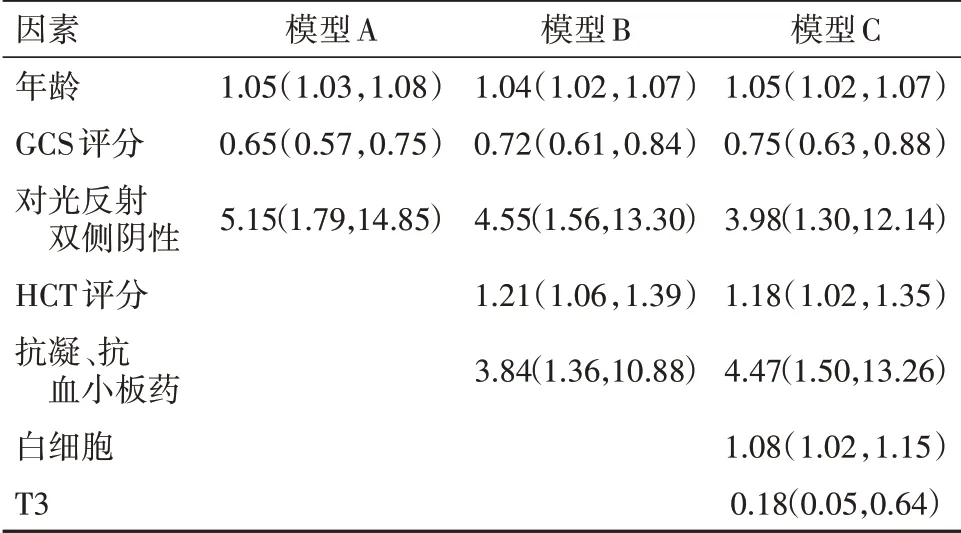
表2 创伤性脑损伤预后模型多因素分析OR 95%CI结果
2.3 模型的性能评估以对瞳孔对光反射(双侧阳性=0分,一侧阴性=1分,双侧阴性=2分)抗凝、抗血小板药物(否=0分,是=1分)进行赋值,分别计算模型A,模型B,模型C的ROC曲线下面积,特异度,灵敏度,准确度,见表3。随着纳入因素的增多,从模型A到模型C,ROC曲线下面积逐渐增大,提示模型的性能逐渐增强。模型C是最佳预测模型,根据赋值,颅脑创伤病人6个月预后不良的计算公式:-1.1+0.044×年龄-0.294×GCS评分+1.381×瞳孔对光反 射 双 侧 阴 性+0.163×HCT评 分+1.496×抗 凝+0.079×白细胞-1.694×T3。模型的相关数据见表4。根据模型C的相关数据,建立列线图,见图1。
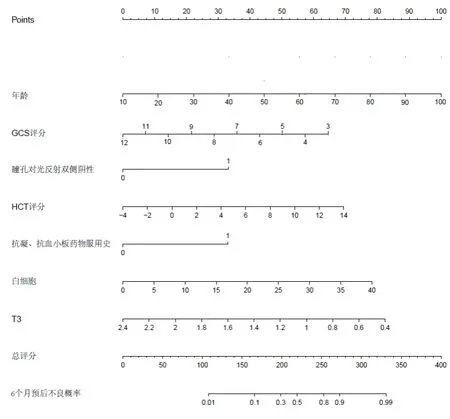
图1 基于创伤性脑损伤预后模型C的远期预后列线图
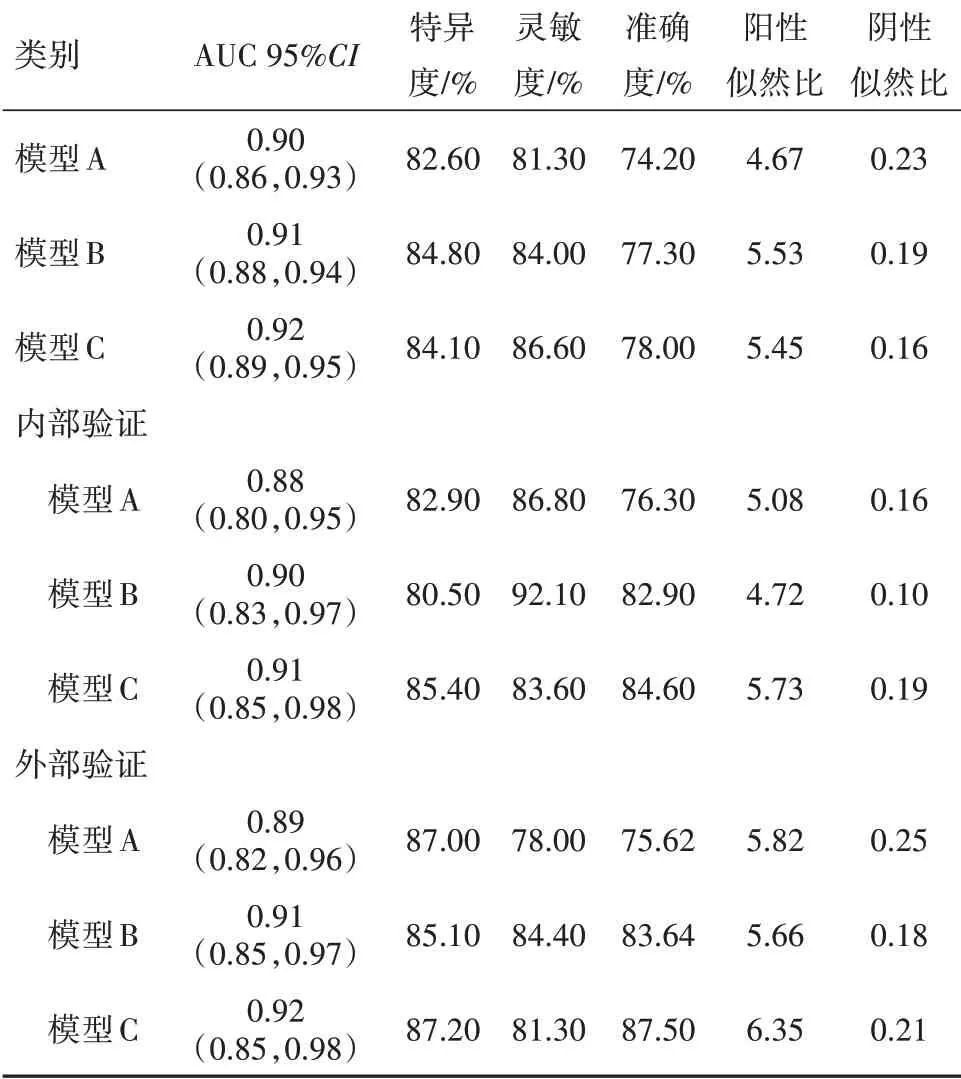
表3 创伤性脑损伤病人6个月预后不良预测模型的性能评估
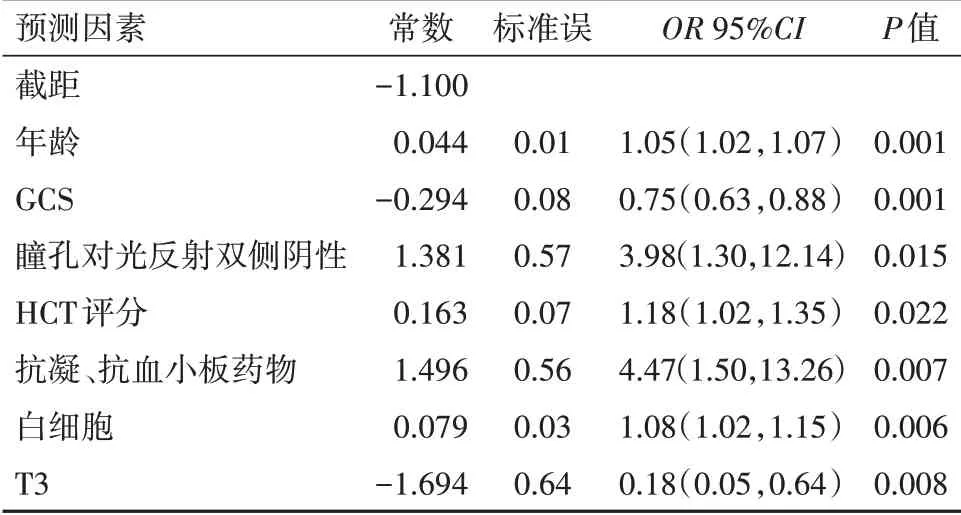
表4 创伤性脑损伤预后预测模型相关数据
3 讨论
我们的结论得出,T3水平与中、重度颅脑损伤病人预后不良相关,T3水平可以作为一个预后的参考指标。我们首次将T3水平纳入预后模型,发现可以提高模型的性能。列线图已被公认为一种用于疾病预防性干预的科学实用工具,可精准预测疾病发生风险的个体化概率[4],本研究也绘制了基于模型C数据的列线图。
迄今为止,很多研究者致力于颅脑损伤病人预后的早期预测,评估中重型颅脑损伤病人的预后[5]。目前国际上有两个较有影响力的颅脑损伤预后预测模型,分别是国际颅脑损伤预后临床测试研究协作组(IMPACT)和颅脑损伤后糖皮质激素随机研究协作组(CRASH)。经过多中心验证,IMPACT模型更适用于中、高等收入国家,因此更适用于我国。IMPACT模型分为基本模型,CT模型及实验室模型,我们根据此思路创建模型。我们的模型从A到C,随着纳入因素的增多模型的判别能随之增强(ROC由0.90升至0.92),内部验证不存在过度乐观,外部验证提示外部适用性强。
我们的模型A和IMPCT基本模型一致,包含年龄,CGS评分和瞳孔对光反射。一项来自361个中心的大样本量针对年龄与脑外伤研究提示,高龄病人有更高的死亡率,即使他们入院时意识较清楚[6]。与年轻病人相比,老年病人创伤后相关并发症发生概率也显著增加,呼吸机相关性肺炎,创伤性脑积水,压性溃疡的形成与高龄相关[7-9]。GCS评分量表评估病人反应的3个方面(眼睛、语言和运动反应),被广泛用作“整体”脑损伤的指标,是区分不同严重程度的头部损伤、监测病人进展和估计预后的最重要特征[10]。一篇前瞻性队列的系统评价指出GCS评分,特别是GCS评分中的运动评分,是预测TBI病人6个月预后的强有力证据[11]。随着入院时的GCS评分从14降至4,早期死亡率平稳上升;幸存者伤后6个月时无残疾恢复的可能性与较高的早期GCS评分相关[12]。此外,早期GCS评分还与TBI幸存者的《创伤后成长评分量表》相关,提示GCS评分可以作为判断TBI幸存者创伤后成长状况的指标[13]。瞳孔检查对评估颅内病变危重病人的神经功能至关重要[14],尤其是在急性脑损伤病人的情况下,瞳孔异常与预后不良有关[15]。因为瞳孔异常常提示脑干受压[16],脑干的功能主要是维持个体生命,包括心跳、呼吸、消化在内的一系列重要生理功能。然而,瞳孔反应有时局限于主观判断,神经瞳孔指数,自动瞳孔测量法等客观指标目前仍在开发应用于神经疾病病人[17-18]。
经逐步回归筛选,模型B在模型A的基础上增强了HCT评分和抗凝、抗血小板药物服用史。不同于IMPACT模型中的马歇尔CT评分,我们纳入HCT评分评估影像学特征。Raj等[19]根据2014年869名病人的数据重新设计并提出HCT评分系统。在此系统中首次强调脑室内出血(占3分)并将鞍上池细分为正常(0分),受压(1分),消失(5分)。Yao等[20]对HCT评分进行外部验证,发现其可以作为一个预测TBI预后的独立预测因子。Thelin等[21]进行的多中心研究表明,HCT预后评估的准确性优于马歇尔CT分级和鹿特丹CT评分。美国国际创伤数据库(National Trauma Data Bank)进行的一项大型研究发现,伤前使用华法林是老年人死亡风险的一个强有力的标志,即使在调整了混杂的合并症之后,它也与死亡的显著增加有关[22]。一项加州的大样本研究也提示使用抗凝剂或抗血小板药物的病人在头部外伤后有较高的概率出现TBI,但未提示与死亡率及预后的关联[23]。同样地,另一项文献综述中提及,创伤病人院前抗血小板治疗与创伤前未接受治疗的病人相比,增加了发病率和可能增加的死亡风险,伤前抗血小板治疗将轻微的脑外伤转变为进展性脑出血是可能的[24]。Wong等[25]认为与对照组的病人相比,使用氯吡格雷的TBI病人可能增加了长期残疾和致命后果。我们认为,抗凝、抗血小板药物服用史的病人,血流动力学及凝血功能改变,一旦发生TBI,血液凝固及血肿压迫出血点效应减弱,轻微的出血量也可能发展成重度脑损伤。因此,抗凝,抗血小板药物服用史可能是TBI预后不良的一个相关因素。
我们的模型C参考但不同于IMPACT模型中的实验室模型,有白细胞计数和T3水平两个指标。白细胞是一种重要的免疫调节细胞,参与TBI的炎症反应过程[26]。白细胞计数与脑外伤病人预后不良相关的可能解释为:外周血白细胞通过破坏的血脑屏障浸润脑组织,介导炎症反应,导致脑水肿加剧,神经细胞凋亡或坏死,最终造成神经功能障碍[27-28]。本研究重点在于T3水平与脑外伤病人预后不良的关系及纳入预后模型的可行性。我们多因素分析得出,T3水平与预后不良呈负相关,T3水平越低,预后不良的可能性越大。在一系列疾病中,会出现甲状腺激素浓度的实质性变化,其特征是血浆T3明显降低,促甲状腺激素(TSH)处于正常或降低,被称为低T3综合征[29]。Plikat等[30]研究指出,在重症疾病状态下,约有44%的病人伴有甲状腺激素水平异常,其中以低T3综合征最为常见,且其与病人的预后及远期生存率密切相关。在脑外伤中,较低的血清T3浓度与更严重的疾病严重程度和更复杂的临床过程相关[3]。甲状腺激素的降低与活性物质的减少和低代谢状态有关,是保护组织免受氧化损伤的一种方式[31]。关于低T3水平与预后不良相关,除了与病情严重程度相关,我们推测可能还与脑外伤并发症相关并做出以下解释:(1)文献报道T3水平与免疫功能相关:甲状腺激素紊乱会影响免疫功能,扰乱血液凝血-抗凝平衡,导致心脏功能障碍和呼吸功能紊乱[32],发生或加重肺部感染及心功能不全。另外,一项韩国的新型冠状病毒肺炎回顾性研究发现低T3水平可能是预后不良的危险因素[33],这支持我们的推测。(2)T3可能参与脑外伤后癫痫的发生[34]:T3下降会导致线粒体功能障碍和氧化应激;L-氨基丁酸(Gaba)神经元的发育和功能依赖于正常的T3功能;脑源性神经营养因子是受T3影响的最重要的营养因子之一。这些因素都是癫痫可能的发生机制,T3水平低可能更容易发生癫痫。(3)有研究报道脑积水与垂体激素内分泌异常相关[35],我们推测长期低T3状态整体代谢降低,脑脊液回流速度减慢,结合其他脑积水的危险因素(如脑室出血,蛛网膜下腔出血,高龄等)更容易形成脑积水。
预后模型可以根据病人的早期临床资料对预后进行预测,在临床工作中有重要意义。我们认为,脑外伤病人预后的最主要因素为年龄,GCS评分,瞳孔对光反射情况。T3水平与预后不良呈负相关,将其与白细胞计数作为实验室指标共同纳入脑外伤预后模型可以提高模型的性能。利用预后模型及列线图可以早期判断病人预后。但我们的预后模型仍需经过多中心的验证。未来我们将探索脑外伤并发症与T3水平的关系,验证我们的解释。
