黑果枸杞茎叶响应NaCl胁迫合成花色苷的转录组学分析
2023-01-05郭嫒姜牧炎哈力马提巴合太力刘煜媛王静
郭嫒 姜牧炎 哈力马提·巴合太力 刘煜媛 王静,2
(1.北方民族大学生物科学与工程学院 国家民委黄河流域农牧交错区生态保护重点实验室,银川 750021;2.北方民族大学 经济林遗传改良创新团队,银川 750021)
花色苷是植物次生代谢产生的黄酮类色素,与植物而言,具有多种生物学功能。花色苷是植物主要的呈色物质,可吸引昆虫传粉受精[1]。植物能够响应环境因子,如强光[2]、盐碱[3]、温度[4]、营养匮乏[5]等合成花色苷,以适应环境。长期强光照射可诱导植物合成花色苷,花色苷吸收了高能的光量子,保护饱和的光合电子传递链[6]。不利的环境往往导致植物直接或者间接遭受水分胁迫,花色苷还能够作为渗透调节物质发挥作用[7]。花色苷具有极强的抗氧化能力,能有效清除多种胁迫产生的游离氧、氮自由基,有助于植物适应逆境胁迫[8-10]。拟南芥[3]、烟草[11]、假俭草[12]等,可响应盐胁迫迅速合成花色苷,花色苷的合成量与植株耐受盐碱的能力正相关。
黑果枸杞(Lycium ruthenicum Murr.)为茄科(Solanaceae)枸杞属(Lycium)多年生灌木,是世界上三大盐碱性土壤的指示植物和先锋植物之一,广泛分布于我国西北荒漠地区,防风固沙能力强,耐盐碱、干旱[13]。在漫长的进化过程中,黑果枸杞与环境相互作用,逐渐形成了许多内在生理和外在形态的适应对策[14]。目前,有关黑果枸杞响应盐胁迫的研究主要集中于生理、生化指标的变化[15];野生条件下黑果枸杞植株的功能性状[16]、根际微生物与盐碱环境的关系[17];盐胁迫后植株离子稳态的维持等方面[18]。黑果枸杞富含花色苷,相关研究更多集中于其药理作用。从响应环境变化的调节因子角度,开展黑果枸杞植株中花色苷的合成、调控与盐碱环境关系的研究尚不多见。
本研究以黑果枸杞植株为实验材料,利用转录组测序(RNA-Seq)技术,研究NaCl胁迫下,黑果枸杞茎叶中基因的表达特性,分析并挖掘参与合成花色苷的基因,以期为深入理解黑果枸杞与盐碱环境的适应机制提供理论依据,为黑果枸杞的引种驯化及品种选育提供参考。
1 材料与方法
1.1 材料
本实验所用材料为北方民族大学植物培养室中培养的黑果枸杞扦插幼苗。
1.2 方法
1.2.1 NaCl胁迫处理黑果枸杞幼苗 选取扦插2周,长势一致的黑果枸杞幼苗,分别移至对照及含有300 mmol/L NaCl的MS培养基表面[19],培养5 d,观察黑果枸杞幼苗的花色苷的积累变化,分别于第0、1、3、5 天测定花色苷含量。培养条件为28℃恒温,光周期为光照12 h / 黑暗12 h,光照强度为4 000 lx。
1.2.2 花色苷测定方法 收集CK及NaCl处理后的黑果枸杞幼苗茎叶,称重,按照0.05 g/200 μL比例,加入含1% HCl的甲醇溶液,置于4℃冰箱中,黑暗条件下抽提过夜。抽提结束后,加入150 μL ddH2O,150 μL氯仿,颠倒混匀,4℃ 12 000 r/min离心5 min;取200 μL上清液置于酶标板中,分别测定上清液在530 nm、657 nm的吸光度值,通过公式A530-0.25A657计算花色苷的相对含量。
收集CK及NaCl处理后的黑果枸杞茎叶,冷冻干燥。分别称取干粉0.05 g,用0.5 mL甲醇/水/盐酸(500∶500∶1,V/V/V)溶液,涡旋 5 min,置于 4℃抽提5 min,12 000×g离心5 min后,取上清液,经0.22 μmol/L滤膜过滤后用于LC-MS/MS分析。选用C18色谱柱分离(1.7 μm,2.1 mm×100 mm),流动相A相为含0.1%甲酸的水溶液,B相为含0.1%甲酸的甲醇溶液。梯度洗脱,0 min B相比例为5%,6 min增至50%,12 min增至95%,保持2 min,14 min降至5%,平衡2 min。采用电喷雾离子源ESI(+),雾化器压力35 psi,离子喷雾电压5 500 V,扫描范围(m/z)为50-1 500。
1.2.3 转录组数据测定及数据分析 选取扦插2周,长势一致的黑果枸杞幼苗,分别移至对照及含300mmol/L NaCl的MS培养基表面,竖直培养3 d,剪取茎叶部分,液氮速冻,置于-80℃保存,用干冰将样本运送至诺禾致源,测定各样本转录组。对照及NaCl处理组各3个重复,分别记为CK1、CK2、CK3、Na1、Na2 和 Na3。
采用全式金的TRIzol Up提取各样本中RNA,经DNase I消化后,通过琼脂糖凝胶电泳及超微量紫外分光光度计检测RNA的纯度和质量;取1.5 μg的RNA经NEB Next Ultra RNA文库制备试剂盒合成测序文库,经Illumia TruSeq PE Cluster Kit v3-cBot-HS 生成Cluster后,在Illumina Hiseq platform 边合成边测序。
下机数据经错误率分布检查,A/T/G/C含量分布检查,测序数据过滤等获得Clean reads,对Clean reads进行Trinity拼接,再经过Corset层次聚类,获得Unigenes。
在此基础上,筛选差异表达基因,以Unigenes的 fpkm(fragments per kilobase of transcript sequence per millions base pairs sequenced,fpkm) 值 > 0.3,Log2Nafpkm/CKfpkm≥0.5,Padj<0.05,且3次生物学重复中均发生变化的基因为差异表达基因(DEGs),对筛选所得的差异表达基因进行GO注释和KEGG通路分析。
1.2.4 实时荧光定量PCR 随机选择12个差异表达基因,其中7个上调表达基因,5个下调表达基因,使用Primer Premier 5.0设计用于qPCR分析的特异性扩增引物,引物序列如表1所示,LrH2B1为内参基因。qPCR反应步骤:95℃预变性30 s,95℃变性20 s,58℃退火30 s,72℃延伸30 s,变性至延伸循环40次,结果采用2-ΔΔCt计算基因相对表达量。分析基因表达变化趋势是否与转录组测序结果相符,检测转录组测序的准确性。

表1 qPCR特异性引物列表Table 1 List of specific primers for qPCR
1.2.5 数据处理 试验重复3次,采用Graph pad 5.0软件对数据进行统计学分析并绘图。
2 结果
2.1 300 mmol/L NaCl胁迫对黑果枸杞幼苗花色苷含量的影响
300 mmol/L NaCl可诱导黑果枸杞幼苗合成花色苷,随着NaCl胁迫时间的增长,花色苷含量逐渐增多,结果如图1-A、B所示,NaCl处理的第0、1天时,黑果枸杞幼苗嫩绿,无明显的花色苷积累,NaCl处理的第3 天时,黑果枸杞幼苗的花色苷积累量显著增加,相对含量为0.674,且花色苷主要集中在顶部叶片及茎部,NaCl处理的第5天,花色苷含量继续增加,为0.893。可见,NaCl胁迫能够促进黑果枸杞幼苗合成花色苷,并随着NaCl胁迫时间的延长,黑果枸杞幼苗中花色苷的积累量逐渐增加,在NaCl胁迫处理的第5天时,花色苷含量最高。

图1 不同时间NaCl胁迫下黑果枸杞幼苗中花色苷的含量Fig.1 Contents of anthocyanin in L.ruthenicum seedlings under NaCl stress at different times
黑果枸杞茎叶中,矮牵牛素3-O-芸香糖苷是含量最高的花色苷。NaCl胁迫后,黑果枸杞茎叶中有3种花色苷和1种黄酮显著升高,即飞燕草素-3-O-葡萄糖苷、飞燕草素3-O-芸香糖苷、矮牵牛素-3-O-芸香糖苷和柚皮素-7-O-葡萄糖苷。其中,飞燕草素-3-O-芸香糖苷含量升高的倍数最高,达11.9倍,矮牵牛素-3-O-芸香糖苷是含量最高的花色苷(5.313± 0.286)μg/g。结果如表2所示。

表2 NaCl胁迫后黑果枸杞茎叶中显著变化的花色苷种类及含量Table 2 Types and contents of significantly-changed anthocyanins in L.ruthenicum shoots under NaCl stress
2.2 转录组数据质量分析
经转录组测序后,对照组CK1、CK2、CK3及NaCl处理组Na1、Na2及Na3共产生48.49 G数据,包含Clean reads 323 291 058条,Clean reads总数量在总测序数量的96%以上。单个碱基数错误率为0.02%、0.03%,均低于1%。评估测序碱基错误率的数值Q20大于96%,Q30大于91%,GC含量在42%-43%之间,统计数据如表3所示,表明转录组测序的质量符合要求,可用于后续分析。
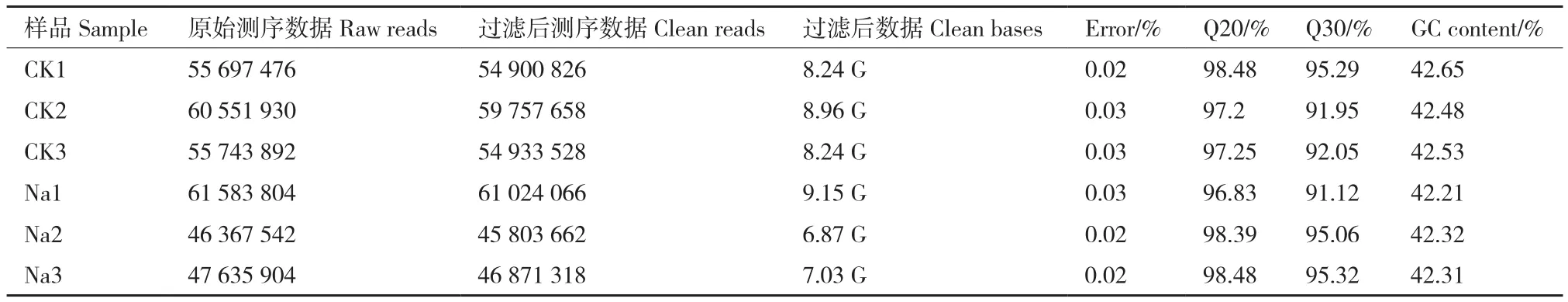
表3 对照及NaCl胁迫后黑果枸杞茎叶转录组测序数据信息Table 3 Transcriptome sequencing data of L.ruthenicum shoots under control and NaCl stress
2.3 差异表达基因的筛选
分析转录组测序数据,NaCl胁迫后黑果枸杞茎叶中共筛选到1 416个DEGs,其中上调的DEGs 867个,下调的DEGs 549个,上调DEGs的数目显著多于下调DEGs的数目。
2.4 GO、KEGG功能注释及富集分析
经GO注释后,1 416个DEGs可聚类分为生物学过程、细胞组分和分子功能3大类。在生物学过程分类中催化活性、氧化还原反应活性及吡咯化合物的结合等具有较高富集频次;在细胞组分中,光合的膜、类囊体部分、类囊体与光合作用相关的过程具有较高富集频次;在分子功能中,单一有机体代谢过程、氧化还原反应过程、碳水化合物代谢过程等具有较高富集,说明这些过程在黑果枸杞茎叶响应NaCl胁迫中起着重要的作用,结果如图2所示。
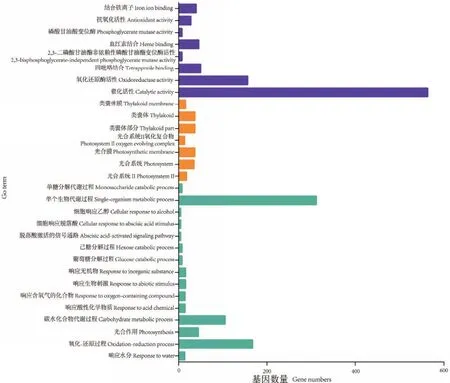
图2 NaCl胁迫后黑果枸杞茎叶转录组差异表达基因GO富集分析Fig.2 Enriched GO terms of DEGs in L.ruthenicum shoots and leaves under NaCl stress
1 416 个差异表达基因经KEGG通路分析后,显著富集(Q-value<0.05)的通路有14个,结果如表4所示。其中光合作用-天线蛋白、光合作用、光合有机体的碳固定、铁卟啉环及叶绿素的代谢与植物光合作用紧密相关;乙醛酸和二乙酸代谢、淀粉和蔗糖代谢2个通路与碳水化合物的稳态调节有关;苯丙素生物合成、黄酮生物合成、蜡质、角质生物合成、二苯乙烯类、二芳基庚烷类和姜辣素生物合成4个通路参与了植物次生代谢产物的调节;植物激素信号转导通路也有差异表达基因显著富集。由此推测,NaCl胁迫可能直接或通过植物激素调节黑果枸杞茎叶的光合作用、碳水化合物的稳态变化及多种次生代谢产物的合成与分解。

表4 KEGG显著富集通路Table 4 KEGG enrichment pathways
2.5 花色苷生物合成通路基因分析
花色苷属黄酮类物质,合成过程起始于苯丙素的生物合成途径,因此,选择苯丙素生物合成通路、黄酮生物合成通路及植物激素信号转导通路3条通路深入研究。
苯丙素及黄酮的生物合成通路中,共涉及21个DEGs,其中有7个DEGs属花色苷合成的结构基因,Cluster-45.113297(LrPAL)、Cluster-45.125726(Lr-C4H)、Cluster-45.245219(LrCHS)3个基因参与花色苷合成的早期过程,Cluster-45.100570(LrDFR)、Cluster-45.96209(LrF3H)、Cluster-45.242733(Lr-F3′H)、Cluster-45.156739(LrANS)4 个基因参与花色苷合成的晚期过程。NaCl胁迫后,7个基因的表达量均上调,结果如图3所示。这些基因的上调表达与黑果枸杞茎叶中花色苷含量升高的表型紧密相关。

图3 NaCl胁迫下黑果枸杞茎叶中参与花色苷生物合成的差异表达基因热图Fig.3 Heat map of DEGs related to anthocyanin biosynthesis in L.ruthenicum shoots under NaCl stress
NaCl胁迫后,激活了黑果枸杞茎叶中多个植物激素的信号转导通路,共有27个差异表达基因参与了脱落酸(ABA)、生长素、乙烯、赤霉素(GA)、细胞分裂素、水杨酸的信号转导,结果如表5所示。其中,有15个差异表达基因参与了ABA的信号转导,其中的14个差异基因表达量显著上调。可见,在黑果枸杞茎叶响应NaCl胁迫过程中,ABA信号通路的调控发挥了重要的作用。

表5 NaCl胁迫下黑果枸杞茎叶中参与植物激素信号通路的差异表达基因Table 5 DEGs related to hormone signaling transduction pathway in L.ruthenicum shoots under NaCl stress
2.6 转录因子的表达模式分析
NaCl胁迫后,黑果枸杞茎叶转录组中共有25类,87个转录因子表达量发生明显变化,结果如图4所示,位列前3位的转录因子家族是HB(调节蛋白)家族、MYB家族和AP2家族,分别含有的DEGs数量为13、11和10个。

图4 NaCl胁迫后黑果枸杞茎叶转录组中转录因子聚类分析Fig.4 Cluster analysis of transcription factors in L.ruthenicum shoots under NaCl stress
在花色苷合成的过程中,转录因子MYB、bHLH及WD40形成转录复合体MBW,调控花色苷合成通路中的结构基因,实现对花色苷合成的调节。转录组数据中,分别有11个MYB转录因子和5个bHLH转录因子发生显著变化,这些转录因子的表达量如表6所示。NaCl胁迫后,MYB转录因子的表达量均明显上调,其中表达量上调倍数最高的为Cluster-45.35768,表达量为对照的4.73倍,上调倍数最低的为Cluster-45.112186,表达量为对照的1.6倍。编码bHLH转录因子的差异基因中,有4个基因表达量下调,1个基因表达量上调。
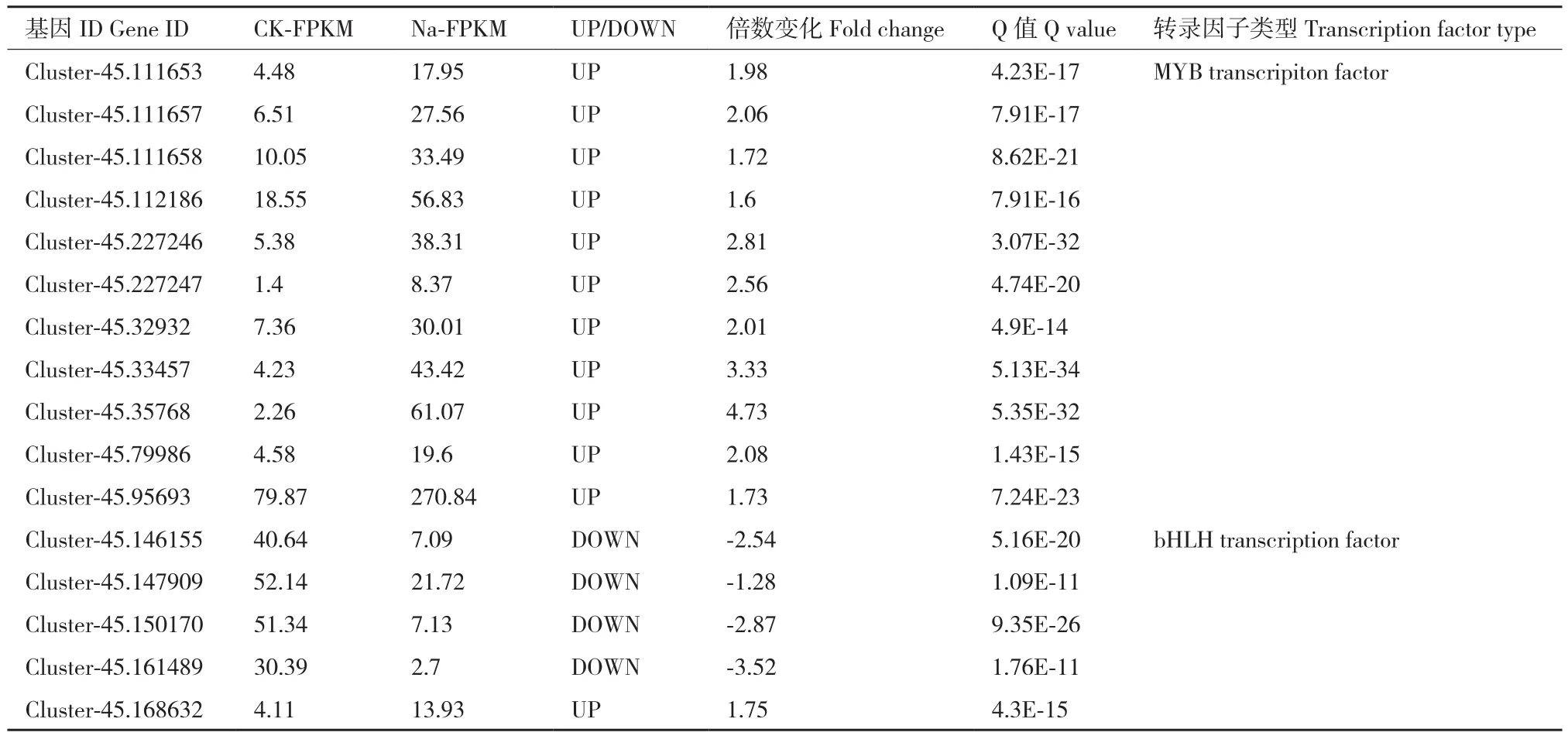
表6 表达量发生显著变化的MYB和bHLH转录因子Table 6 MYB and bHLH transcription factors with significantly changed expression levels
2.7 转录组数据验证
从分析获得的差异表达基因中,随机选取12个进行RT-qPCR的验证,经验证,与RNA-seq中基因的表达变化趋势一致,结果如图5所示。可见,RNA-seq的测序结果具有较高的准确性。
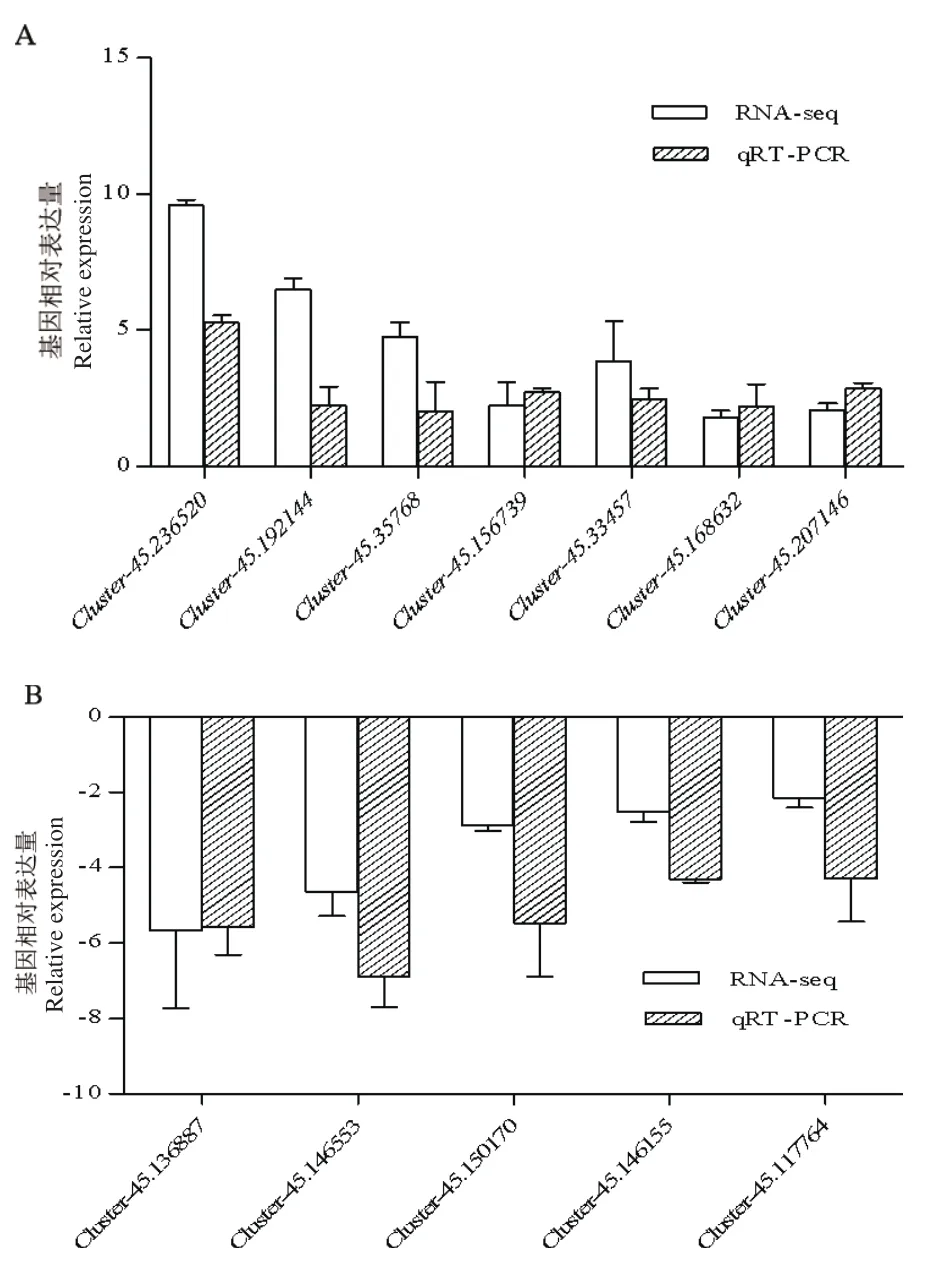
图5 RT-qPCR验证RNA-seq中差异表达基因Fig.5 Validation of DEGs in RNA-seq using RT-qPCR
3 讨论
花色苷是调节植物生命活动重要的次生代谢产物,具有较强的抗氧化能力,在植物响应胁迫环境中发挥积极作用。NaCl胁迫后黑果枸杞茎叶合成了大量花色苷,其中矮牵牛素-3-O-芸香糖苷含量最高(5.313 ± 0.286)μg/g,NaCl胁迫后升高2.28倍。另外两种花色苷,飞燕草素-3-O-葡萄糖苷和飞燕草素3-O-芸香糖苷在胁迫后,分别升高7.5和11.9倍。在拟南芥pap1-D中,过量合成的花色苷能够显著提高植株对盐胁迫的耐受能力[20],转了Del基因的烟草中,花色苷的含量升高与活性氧的清除能力呈正相关,并且增加了幼苗对盐、干旱胁迫的耐受性[21]。由此推测,NaCl胁迫后黑果枸杞茎叶中花色苷含量的显著增加,可能提高了茎叶抗氧化、抗盐胁迫的能力。
分析对照及NaCl胁迫后黑果枸杞茎叶转录组的变化,差异表达基因中有7个编码花色苷合成的结构基因,均有不同程度上调,在葡萄[22]和紫雨桦[23]响应盐胁迫过程的研究中,也得到了类似的结果,即花色苷合成通路基因的表达量与花色苷的合成具有正相关性。由此可见,黑果枸杞茎叶中花色苷合成通路基因的上调表达与花色苷含量升高的表型紧密相关。黑果枸杞茎叶中含量最高的花色苷种类为矮牵牛素,LrF3′5′H是调节矮牵牛素合成的重要基因[24]。分析转录组数据后发现,LrF3′5′H 的表达量并没有显著变化。查找LrF3′5′H在NaCl处理前后的表达量,发现该基因的表达量始终处于较高水平,推测F3′5′H较高的表达水平,催化了更多的黄烷酮生成二氢杨梅素,为矮牵牛素的合成储备更多的前体物质。
植物能响应环境因子、营养元素变化调节花色苷的合成,这个过程可通过影响转录复合物MYB-bHLH-WD40(MBW)的表达量,调节参与合成花色苷的多个结构基因的表达而实现。拟南芥[25]和苹果[26],能响应低氮条件,通过上调AtPAP1(AtMYB75)、AtPAP2(AtMYB90)、AtTT8(bHLH)及MdMYB1的表达,调节花色苷合成通路中多个结构基因的表达,促进植物合成花色苷。苹果经寒冷处理后可调节MdMYB1、MdbHLH3的表达量,调控花色苷合成通路结构基因的表达,进而合成大量花色苷[27]。经NaCl胁迫后,黑果枸杞茎叶中,有11个MYB转录因子及5个bHLH转录因子发生显著变化,这几个转录因子在黑果枸杞花色苷合成过程中的作用,将是后续研究的重点之一。
植物激素可直接调控或通过调控MBW的表达量间接调控花色苷的代谢过程。苹果[28]、桑葚[29]果实成熟过程中,乙烯含量迅速升高,可直接作用于花色苷合成通路结构基因DFR及ANS启动子上的乙烯响应元件,上调花色苷合成的基因表达,促进花色苷的合成与积累。ABA也能调控花色苷的合成。拟南芥经ABA处理后,花色苷含量增加,分析花色苷合成通路关键基因的表达量,AtDFR和AtANS显著上调[30]。非呼吸越变型果实成熟时,施加外源ABA,可积累花色苷,加速果实着色,如蓝莓、葡萄[31-32]。NaCl胁迫后,黑果枸杞茎叶转录组数据中有27个差异表达基因参与了植物激素的信号转导过程。其中,参与ABA信号转导通路的差异表达基因有15个。因此,ABA信号转导通路的基因很可能在黑果枸杞茎叶响应NaCl胁迫,促进花色苷合成过程中发挥重要的调控作用,ABA信号转导通路及与其他植物激素之间的交互调节过程有待深入研究。
综上所述,NaCl胁迫可促进黑果枸杞茎叶合成花色苷,其中矮牵牛素-3-O-芸香糖苷含量最高;通过二代测序技术分析黑果枸杞茎叶在NaCl胁迫后的转录组,结果表明,7个花色苷生物合成的结构基因显著上调,参与植物激素ABA信号转导通路的基因、多个MYB及bHLH转录因子表达量显著改变。这些关键路径基因的表达可能与黑果枸杞茎叶响应NaCl胁迫促进花色苷合成紧密相关。本研究的开展,为深入理解黑果枸杞与盐碱环境的适应机制提供了实验支撑;同时,从植株角度分析黑果枸杞花色苷合成的基因网络,为黑果枸杞的引种驯化及品种选育提供了参考。
4 结论
NaCl胁迫能促进黑果枸杞茎叶合成花色苷,其中矮牵牛素-3-O-芸香糖苷含量最高,推测植物激素ABA信号转导通路基因、多个MYB、bHLH转录因子及花色苷生物合成通路结构基因的显著变化与该过程紧密相关。
