G-三链体可视化核酸传感器用于四环素的检测
2023-01-05刘宁宁王鑫昕兰欣悦褚华硕陈旭常世敏李腾飞许文涛
刘宁宁 王鑫昕 兰欣悦 褚华硕 陈旭 常世敏 李腾飞 许文涛
(1.河北工程大学生命科学与食品工程学院,邯郸 056038;2.中国农业大学营养与健康系 食品精准营养与质量控制教育部重点实验室,北京 100083;3.邯郸学院生命科学与工程学院,邯郸 056005)
四环素(TET)属于四环素类抗生素,是20世纪中期发现的一组广谱抗生素。四环素因其广谱活性和低成本,在畜牧业和水产养殖中被广泛用于预防细菌感染[1],四环素还被用作生长促进剂,以提高动物的生长速度[2]。然而,由于四环素在兽药中的过度和不当使用,导致肉类、牛奶、蜂蜜、鱼、蛋和虾等制品中的抗生素残留[3],严重威胁人类健康,如造成过敏反应、细菌耐药性、肝脏损伤和胃肠功能紊乱等[4]。因此,对动物产品中四环素的残留制定了严格的规定。例如,欧洲联盟(EU)将牛奶中四环素的最高残留限量定为225 nmol/L,其他一些动物产品,如美国对肝脏、肾脏和肌肉组织也设定了最高残留限量(MRL)值[5]。常用的检测方法有仪器分析:高效液相色谱、毛细管电泳和气相色谱-质谱(GC-MS)[6-8]、酶联免疫吸附试验(ELISA)[9]和微生物抑制[10]。仪器分析是抗生素检测中最常用和最灵敏的方法。然而,高效液相色谱、毛细管电泳法和气相色谱-质谱法都需要使用一些大型仪器和有机溶剂,这需要耗费很高的成本并且对人体健康和环境都有巨大的危害。此外,提取过程非常耗时。酶联免疫吸附试验可能获得假阳性结果,因为它可能与具有相似化学结构的物质发生交叉反应[11]。
G-三链体是由Chua等[12]在2013年探究G-四链体TBA(凝血酶适配体)时首次发现的一种不同于之前发现的DNA二级结构。这种结构是将TBA序列[d(GGTTGGTGTGGTTGG)]3′端适当截短,而折叠形成的。Kim等[13]发现G-三链体结构受分子拥挤、金属离子浓度等影响,并证明金属离子对G-三链体的稳定顺序为Ca2+>K+>Mg2+>Na+。2018年Jung等[14]假设G-三链体具有G-四链体相似的化学结构与功能,发现稳定的G-三链体可以结合硫代黄素T(ThT)作为高效的荧光探针。到目前为止,功能研究和应用方面的报道非常有限。因此,G-三链体在生物传感中的应用研究还处于初级阶段。
适配体是通过指数级富集配体的系统进化,从随机序列核酸文库中筛选出来的单链DNA/RNA寡核苷酸,是对靶分子表现出良好亲和力和特异性的生物识别元件[15]。适配体已经成为传统识别元件的有力竞争者,并在疾病诊断和治疗、农业环境监测和食品安全检查领域引起了极大的关注[16]。DNA链可以折叠成典型的结构,包括茎、环、发夹、假结和G-四链体[17]。基于核酸适配体/荧光色素体系的荧光策略因其操作简单、灵敏度高、选择性好等优点而备受青睐。2014年Liu等[18]基于人端粒G-四链序列TEL22(人端粒G-四链序列)的结构转化,以硫代黄素T(ThT)为荧光探针,研制了一种一步开启的K+荧光传感器。在100 mmol/L Na+的干扰下,检出限为1 mmol/L。
硫代黄素T(ThT)是一种市售的水溶性苯并噻唑荧光色素,在游离态下表现出微弱的荧光发射。然而,ThT可以通过插层、沟槽结合和末端堆积识别G-四链体的结构,从而显著增强其荧光强度[19]。ThT以其低成本、可商业化和G-四链体的选择性鉴定而被广泛用于设计无标记荧光适配体传感器[20]。
本文开发了一种基于G-三链体双链竞争内劈裂的新型方法,在四环素适配体5′-CGGTGGTG-3′的3′端加入3个胞嘧啶C,与G-三链体序列5′-GGGCACCAAGGGTTAGGG-3′互补配对,使 G-三链体发生内劈裂,靶标四环素与G-三链体竞争与适配体结合,靶标与适配体结合后,G-三链体序列断开与适配体的互补,重新折叠为G-三链体,从而增强ThT荧光强度,通过测定ThT激发波长为450 nm,发射波长为490 nm处荧光强度,来确定与适配体结合的四环素的量,实现了四环素的检测。适配体的引入提高了检测的特异性,ThT作为信号输出,增强了输出信号,降低了检测成本,本方法可以在25 min内完成,且灵敏度高。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 硫代黄素T(ThT)、四环素、KCl、NaCl、MgCl2、Tris、核酸序列(表1)、甲醇、蒸馏水;本实验所有序列均由北京睿博兴科生物技术有限公司合成。

表1 适配体及G-三链体序列表Table 1 Sequence list of aptamers and G-triplex
1.1.2 主要设备 荧光分光光度计(型号:G9800A),美国安捷伦科技有限公司;基因扩增仪(型号:A300),杭州朗基科学仪器有限公司。
1.2 方法
1.2.1 实验原理 本实验原理图如图1所示,依据G-三链体可以增强ThT荧光强度,在适配体存在情况下,适配体与G-三链体互补配对,形成复杂的双链结构,此时不能增强ThT的荧光强度,加入四环素以后,四环素与适配体结合,破坏了互补双链结构,使富G序列可自由折叠形成G-三链体结构,从而增强ThT荧光强度,依据ThT荧光强度的增强程度对四环素进行灵敏检测。
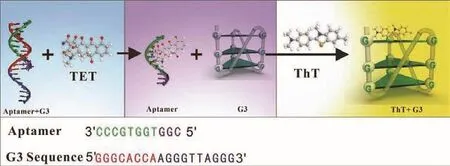
图1 G3-Apt1检测四环素原理图Fig.1 Schematic diagram of detecting tetracycline by G3-Apt1
1.2.2 序列的设计 在四环素适配体5′-CGGTGGTG-3′的3′端加入3个胞嘧啶C,得到新的四环素适配体序列 Apt1:5′-CGGTGGTGCCC-3′;将 G-四链 体 序 列 5′-GGGTTAGGGTTAGGGTTAGGG-3′[21]去掉3′端的“TTAGGG”得到一条G-三链体序列5′-GGGTTAGGGTTAGGG-3′,在 5′端 3 个鸟嘌呤 G之后加入与适配体互补配对碱基并分别对其进行裁短,得到G01-G07,详细名称、序列、碱基数见表1。
1.2.3 适配体亲和能力表征 取10 μL浓度为0.5 mol/L的氯化钠溶液,加入8 μL水,混匀后加入到100 μL 胶体金中 ;取 5 μL 浓度为 2 μmol/L 的适配体和 5 μL水,然后加入 100 μL胶体金 ;取 5 μL 浓度为2 μL的适配体和5 μL浓度分别为1 μmol/L、10 μmol/L、100 μmol/L的四环素于不同离心管(37℃孵育20 min),然后加入100 μL胶体金;室温孵育60 min;最后各加入10 μL浓度为0.5 mol/L的氯化钠溶液。重复3次实验。
1.2.4 G-三链体序列的优化 分别取10 μL浓度为20 μmol/L的G01-G07序列与适配体混匀,30℃退火后,一组加入10 μL浓度为100 μmol/L的四环素溶液;另一组加入10 μL水,然后各加入60 μL浓度为100 μmol/L的氯化钾溶液,37℃孵育20 min后,加入10 μL浓度为100 μmol/L的ThT以激发波长为450 nm测定其490 nm处荧光强度。以F0的大小作为G01-G07序列选取依据。重复3次实验。公式为:F0=Fa/Fb(其中Fa为加入靶标后ThT荧光强度,Fb为不加靶标时ThT荧光强度)。
1.2.5 传感器的制备 取10 μL浓度为20 μmol/L的适配体序列与10 μL浓度为20 μmol/L的G-三链体序列混匀,95℃变性5 min,30℃退火15 min,得到传感器记为G3-Apt1。
1.2.6 G3-Apt1体系的优化 本实验中ThT荧光强度为信号来源,影响ThT荧光强度的因素有体系中离子的种类及浓度、ThT的浓度及ThT荧光强度的测定时间;同时靶标的孵育时间会影响靶标与适配体的结合,从而影响ThT的信号输出。所以需要对体系中离子种类及浓度、ThT浓度及测定时间、靶标孵育时间进行优化。本实验离子体系使用NaCl、KCl、MgCl2、Tris-HCl这 4种物质进行优化,浓度梯度设定为 :1 μmol/L、10 μmol/L、100 μmol/L、1 mmol/L、10 mmol/L、100 mmol/L,时间设定为:0、5、10、20和30 min。重复3次实验。
1.2.7 灵敏度检测及标准曲线的绘制 为了检测G3-Apt1用于四环素的检测能力,在优化得到的最佳条件下,配制浓度为10 mmol/L的四环素溶液,稀释10 000倍后得到浓度为1 μmol/L的四环素溶液,然后分别稀释得到浓度500、100、50、10、5和1 nmol/L的四环素溶液,并加入到制备好的G3-Apt1传感器中,加入 10 μL 浓度为 100 μmol/L 的 ThT,测定以450 nm为激发波长490 nm处ThT的荧光强度,通过测定加入不同浓度四环素后ThT荧光强度,得到四环素检测限及定量限,来验证G3-Apt1传感器的灵敏度,根据加入不同浓度的四环素测定的ThT荧光强度值绘制标准曲线。重复3次实验。
1.2.8 特异性检测 为了检测G3-Apt1传感器的特异性,选取了盐酸四环素、土霉素(四环素类)、氯霉素(酰胺醇类)、链霉素(氨基糖苷类)、林可霉素(林可胺类)在内的5种常见抗生素进行了G3-Apt1方法的特异性分析,采用与四环素溶解相同的方法溶解,并稀释至1 μmol/L,取10 μL与G3-Apt1传感器反应。重复3次实验。
1.2.9 实际样品中检测 为了评价该方法在实际样品中的检测性能,首先将原料奶2 mL放入15 mL离心管中,用水稀释至5 mL,然后加入1 mL的10%三氯乙酸和1 mL的氯仿,在旋涡下混合1 min,沉淀蛋白质,溶解样品基质中的脂肪和其他有机物。混合物在20℃下超声处理15 min,在13 000 r/min下离心10 min以分离沉淀物,取上清液。分别测定加入四环素浓度为1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L牛奶样品与G3-Apt1反应后ThT的荧光强度,进行 3次重复检测,通过计算ThT激发波长为450 nm、发射波长为490 nm处的荧光强度,来计算四环素的回收率,通过回收率来确定方法用于实际样品检测的性能。
2 结果
2.1 适配体亲和能力表征
为了验证在适配体序列5′-CGGTGGTG-3′的3′端加入3个胞嘧啶C,得到新的四环素适配体序列Apt1:5′-CGGTGGTGCCC-3′与四环素亲和能力,利用胶体金进行测定。从图2-A中可以看出,加入四环素以后,胶体金由红色变为紫色,说明由于靶标与适配体的结合,而缺少单链对胶体金的稳定作用,使胶体金易发生聚沉,同时随着靶标浓度的增大胶体金聚沉程度更高,并且1 μmol/L靶标与2 μmol/L适配体即可发生胶体金的沉淀,因此适配体Apt1对四环素具有较好亲和力。
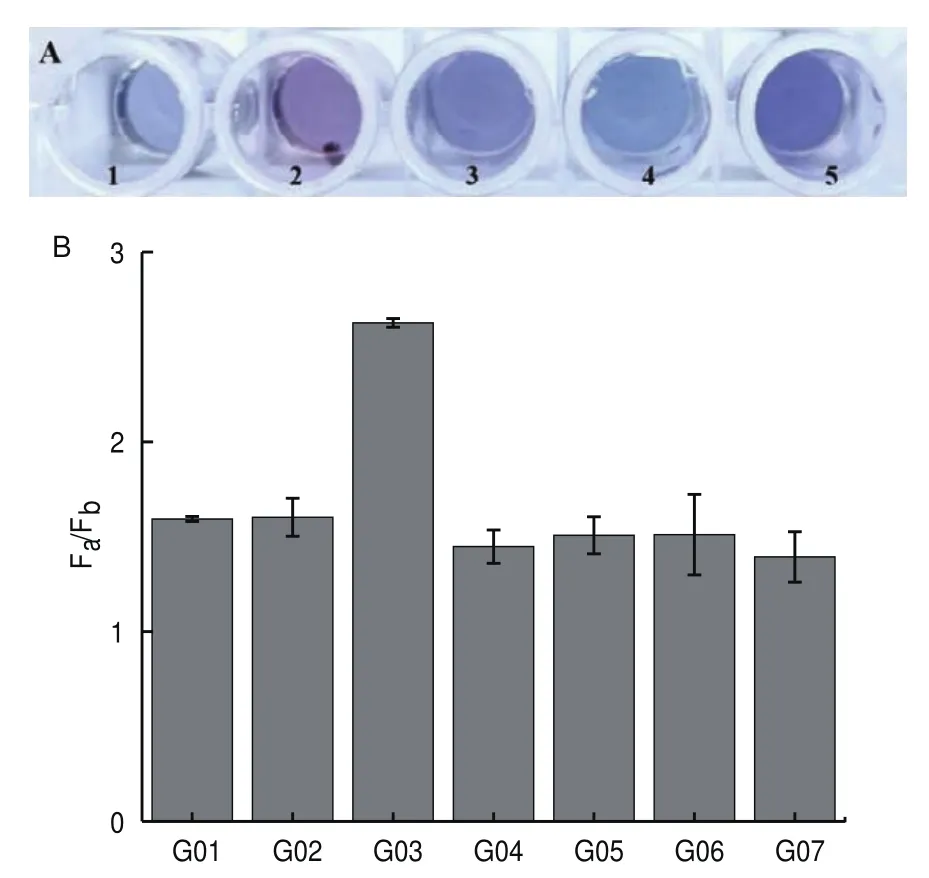
图2 适配体及序列优化图Fig.2 Aptamer and sequence optimization diagram
2.2 G-三链体序列的优化
根据1.2.4中的方法,为了便于明显比较加入靶标后ThT荧光强度的变化,以及不同序列加入靶标后ThT荧光强度变化,以F0值作为判断G-三链体序列性能的依据。得到G01-G07加入靶标前后ThT荧光强度的比值F0,结果如图2-B所示,G03序列的F0值要明显高于其他序列,这可能是由于四环素适配体序列与G-三链体序列在至少互补8对碱基时,已经完全将富G序列封闭为双链结构,但是封闭9对碱基的G02和封闭10对碱基G01序列,却由于封闭过于严密而在加入靶标四环素以后不能将双链打开释放富G序列,导致F0值要比G03序列低。因此,G03序列为传感器制备的最佳序列。
2.3 反应体系的优化
为了探究反应的最佳体系,分别在不同环境中进行反应,得到结果如图3-A所示,ThT荧光强度为本实验的信号输出源,反应体系对ThT荧光强度的增强程度越高,表示反应体系越有利于靶标与适配体的结合,氯化钙、氯化镁、氯化钾3种溶液加入Tris-HCl后(图3-A,1-3),均较不加入(图3-A,5-7)时对ThT荧光强度增强效果较低,可能是因为Tris-HCl的加入会对靶标与适配体的结合产生影响;在不加入Tris-HCl的3种溶液对比中,KCl溶液(图3-A,7)对ThT荧光强度增强效果最好。然后又对KCl浓度进行了优化,如图3-B所示,KCl最佳浓度为100 μmol/L。所以最佳反应体系为100 μmol/L的KCl溶液。
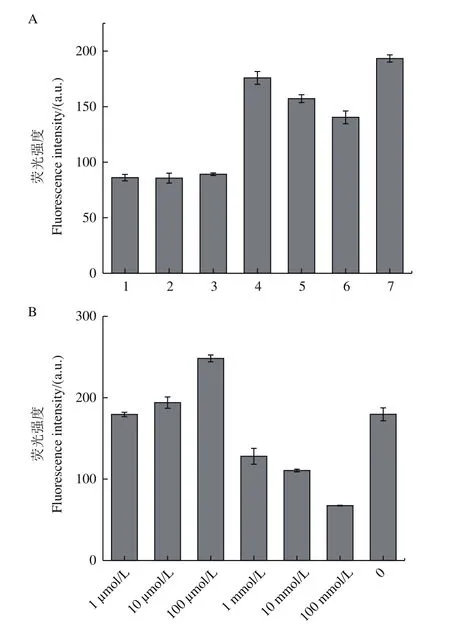
图3 不同条件下ThT荧光强度Fig.3 ThT fluorescence intensities under different conditions
2.4 适配体孵育时间
靶标与适配体的孵育时间会影响靶标与适配体的结合程度,从而影响到G-三链体的形成,进而影响ThT的信号输出。为了优化适配体的孵育时间,本实验通过测定靶标与适配体孵育不同时间时ThT的荧光强度,来选择适配体与靶标孵育的最佳时间。从图4-A中可以看出,随着孵育时间的变化,ThT的荧光强度逐渐增强,直到20 min时达到最强,所以选定20 min为靶标与适配体的孵育时间。
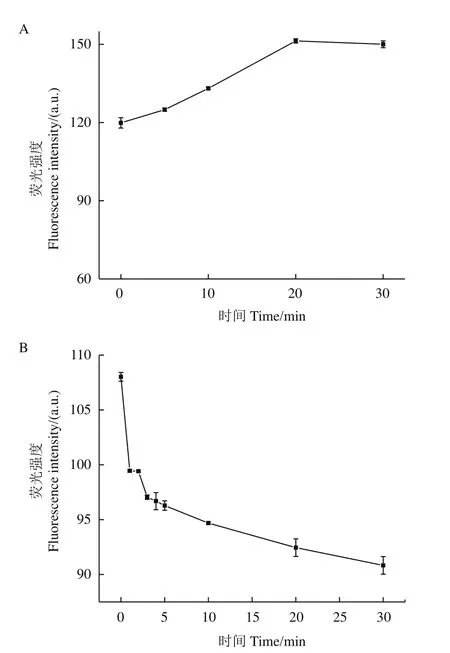
图4 时间的优化图Fig.4 Time optimization
2.5 ThT荧光强度测定时间
作为荧光素,在不同溶液条件下,ThT荧光衰减均非常迅速,甚至可达ps、ns级别,因此,ThT荧光强度会发生快速淬灭。为了探究ThT荧光强度测定的最佳时间,本实验探究了ThT荧光强度随时间变化关系。从图4-B中可以看出随着时间的变化,ThT荧光强度逐渐降低,在2-3 min时有一个短暂的稳定状态,可能是由于ThT的加入,诱导更多的G07序列折叠为G-三链体结构,从而在2-3 min时,ThT荧光强度形成了一个短暂的平衡状态,所以ThT荧光强度会在2-3 min时出现一个稳定期。所以测定ThT荧光强度时一定要把握住时间,在加入ThT后2-3 min内完成荧光强度的测定。
2.6 G3-Apt1反应体系灵敏的测定及标准曲线的绘制
应用基于G3-Apt1传感器获得的ThT荧光强度值如图5-A所示,随着四环素浓度的增加ThT荧光强度逐渐增强,并在1 nmol/L-1 μmol/L之间有良好的线性关系。标准曲线如图5-B所示,ThT荧光强度与四环素浓度之间的线性关系方程为Y=36.67lgX+61.02,R2为0.99,线性关系良好,通过测定加入不同浓度四环素后ThT荧光强度,得到四环素的检测限(LOD)为0.07 nmol/L。
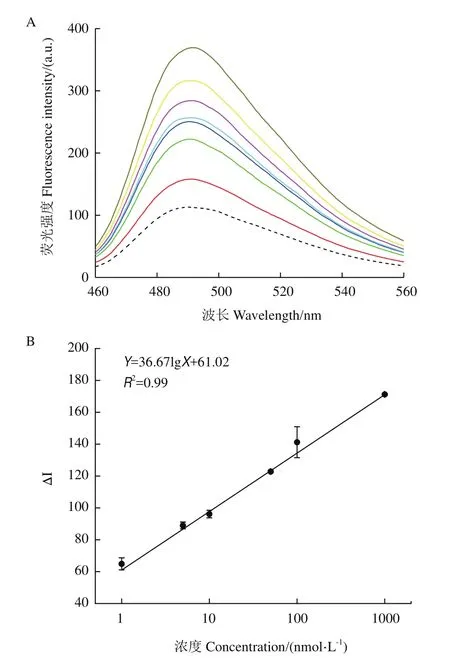
图5 G3-Apt1传感器的建立图Fig.5 Establishment of G3-Apt1 sensor
2.7 特异性检测
从图6中可以看出,四环素和盐酸四环素的荧光差异不大,可能是因为盐酸与四环素反应生成盐酸四环素以后并未破坏四环素与适配体的识别位点,说明该传感器还具有检测盐酸四环素的潜力;土霉素、氯霉素、链霉素、林可霉素荧光强度基本为背景值,明显低于四环素荧光强度,说明传感器具有很好的特异性。

图6 特异性验证图Fig.6 Specificity verification chart
2.8 实际样品检测
通过G3-Apt1传感器得到的四环素在牛奶样品中的回收率表,如表2所示,回收率均低于108%,符合规定,表明G3-Apt1传感器可用于牛奶样品的检测。
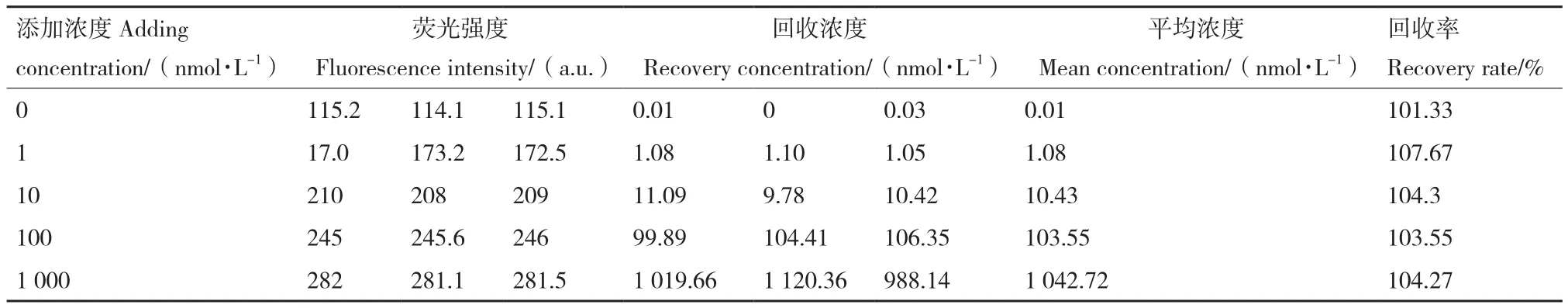
表2 牛奶样品中四环素添加回收表Table 2 Addition and recovery table of tetracycline in milk samples
3 讨论
在不同溶液条件下,ThT荧光衰减均非常迅速,甚至可达ps、ns级别,因此,ThT荧光强度会发生快速淬灭。K+的存在会诱导G07序列折叠为G-三链体结构,ThT会嵌入到G-三链体从而增强ThT的荧光强度[22],但由于ThT荧光强度会自发进行衰减,G-三链体只能减缓这种衰减,而不能停止ThT荧光强度衰减。但由于ThT的加入,诱导更多的G07序列折叠为G-三链体结构,从而在2-3 min时,ThT荧光强度形成了一个短暂的平衡状态,所以ThT荧光强度会在2-3 min时出现一个稳定期。加入ThT以后,要在2-3 min内完成ThT荧光测定,以确保避免同时测量多个孔时,因ThT荧光强度快速衰减造成的误差。
荧光生物传感器最近经常被用于四环素的检测,其中 5-羧基荧光素(fluorescein amidite,FAM)[23]、Cy3[24]、Cy5[25]等作为荧光基团,通常被用于标记型生物传感器的开发,来作为荧光信号的输出,但标记型荧光传感器在标记过程中通常都特别繁琐,而且标记过程也非常耗时耗力,不利于目标物质的快速检测。本方法以荧光素ThT作为荧光信号输出,无需复杂的标记过程,应用于试剂盒以后在25 min内即可对四环素的检测。
Khaled 等[26]建立了全自动固相微萃取法用于四环素的检测,但此方法检测限为 10 μg/kg;De Faria等[27]建立了一种使用盐酸沉降蛋白后分离上清液,注入柱交换系统,上清液流经含限制性碳纳米管的萃取柱,借助六通阀实现转换管路,并使用梯度流动相净化萃取柱后洗脱检测的方法,此方法检测限为 9.22-13.20 μg/L ;Zhao 等[28]合成了新型HLB 柱填料 CTPCC-TP,这种方法检测限为8.0-16.8 μg/kg。噻唑橙(TO)荧光探针能够与四环素G-四链体适配体结合,嵌入到四环素适配体中,2018年 Sun 等[29]利用TO建立了一种灵敏、快速、无标记的四环素荧光适配体传感器,此方法检测限为29 μg/L。2020年 Dai等[30]基于四环素适配体的 G-四链结构和ThT,研制了一种用于四环素快速检测的无标记荧光适配体传感器,此方法检测限为0.44 μg/L。本文开发的以ThT荧光强度为信号输出,通过G-三链体与四环素适配体竞争结合实现G-三链体内劈裂的方法用于四环素的检测,检测限低至0.03 μg/L。
G3-Apt1方法的检测无需大型仪器,操作简便,并且引物无需任何修饰,成本低廉,符合快速检测以及商业化的应用,有望推广于其他药物及生物分子的检测,对盐酸四环素有很好的特异性,具有检测盐酸四环素的潜力。
4 结论
成功构建了基于G- 三链体的双链竞争内劈裂可视化核酸传感器定量检测四环素。检测范围为1 nmol/L-1 μmol/L,R2达到0.99以上,检测限低至0.07 nmol/L,并且在25 min内可以完成检测,选择了盐酸四环素、土霉素、氯霉素、链霉亲和素、林可霉素与传感器反应,发现该方案特异性良好,并且还具有检测盐酸四环素的潜力。
