饲料中添加新型金藻对虹鳟幼鱼肝脏抗氧化性能的影响
2023-01-05常洪淼马淑伟邱广文刘红柏韩世成陆绍霞王常安刘洋
常洪淼,马淑伟,邱广文,刘红柏,韩世成,陆绍霞,王常安,刘洋
(1.中国水产科学研究院黑龙江水产研究所,黑龙江省水生动物病害与免疫重点实验室,黑龙江 哈尔滨 150070;2.大连海洋大学,辽宁 大连 116000;3.南京农业大学无锡渔业学院,江苏 无锡 214000;4.东北农业大学动物科技学院,黑龙江 哈尔滨 150030)
鲑鳟鱼类是世界上主要的水产养殖类群,2020年全球养殖产量超过300 万t[1]。近年来,我国鲑鳟鱼类养殖产业发展较为迅速,据2020 年度中国渔业统计年鉴显示,年产量已超过4 万t,其中主要的产量来自虹鳟。虹鳟隶属于鲑科太平洋鲑属,是鲑鳟鱼类的代表种类,是世界上养殖范围最广泛的鱼类之一,也是我国鲑鳟鱼类的主要养殖种类。虹鳟是典型的冷水性鱼类,对生存水质和养殖条件要求较高,在养殖生产中较易受到病害的威胁[2]。国家和消费者对食品安全高度重视,自2020 年7 月1 日起,我国饲料“禁抗令”全面施行,寻求绿色、高效的抗生素替代品和免疫增强剂已成必然趋势。
微藻种类繁多、营养丰富,易于大规模定向培养,占耕地面积小,已有多种微藻被广泛应用于食品、养殖、医药、化妆品等领域[3]。一些含有多糖和生理活性物质的微藻用作水产养殖饲料添加剂,可以提高鱼体免疫力、影响抗氧化酶活性、改善鱼体健康水平。研究表明,饲料中添加适当比例的小球藻(Chlorella vulgaris)提取物可以显著提高香鱼(Plecoglossus altivelis)的抗应激能力[4];以添加了巨藻(Macrocystis pyritera)提取物的饲料喂养鲑点石斑鱼(Epinephelus coicoides),可显著提升鱼体SOD活性[5];在饲料中添加5%的鼠尾藻(Sargassum thunbergii)粉可显著提高大菱鲆(Scophthalmus maximus)幼鱼的抗氧化能力与非特异性免疫力[6];在饲料中添加1%与2%的螺旋藻(Spirulina)粉分别提高了尼罗罗非鱼[7](Oreochromis niloticus)与杂交黄颡鱼[8]的抗氧化能力以及抗病能力。
机体的抗氧化酶防御体系包含超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)等多种抗氧化酶,在清除超氧自由基、H2O2和过氧化物以及阻止或减少羟基自由基形成等发挥重要作用[9]。SOD 是一种含金属离子的酶,可以使O2-发生歧化反应生成H2O2,再在CAT 的作用下分解生成H2O 和O2。GPX 可以与SOD、CAT 协同作用,清除体内多余自由基,保护机体免受氧化损伤[10]。丙二醛(Malondialdehyde,MDA)是机体内氧自由基与多不饱和脂肪酸生成的一种脂质过氧化物,MDA 含量可以反映机体内脂质过氧化的程度与机体细胞受自由基攻击的严重程度[11]。
本实验在饲料中添加不同比例的富含β-葡聚糖的新型金藻,比较研究其对三倍体虹鳟杀鲑气单胞菌(Aeromonas salmonicida)攻毒前后肝脏抗氧化性能的影响,旨在评价该新型金藻作为虹鳟饲料免疫增强剂的潜力,并为虹鳟的绿色健康养殖提供理论与技术支撑。
1 材料与方法
1.1 实验微藻与饲料
实验用微藻为富含β-葡聚糖(55%)的新型金藻,来自中国科学院水生生物研究所藻类生物技术和生物能源研发中心。实验基础饲料以鱼粉、豆粕等为主要蛋白源,以大豆油和鱼油作为主要脂肪源,以面粉为主要糖源。所有固体原料混合前粉碎,过40 目筛,采用逐级扩大法预混合。准确称量两种油脂,加入到预混好的粉状物中,充分混匀后挤压制粒,65℃烘干后装袋保存于-20℃冰柜中待用。饲料配方见表1。
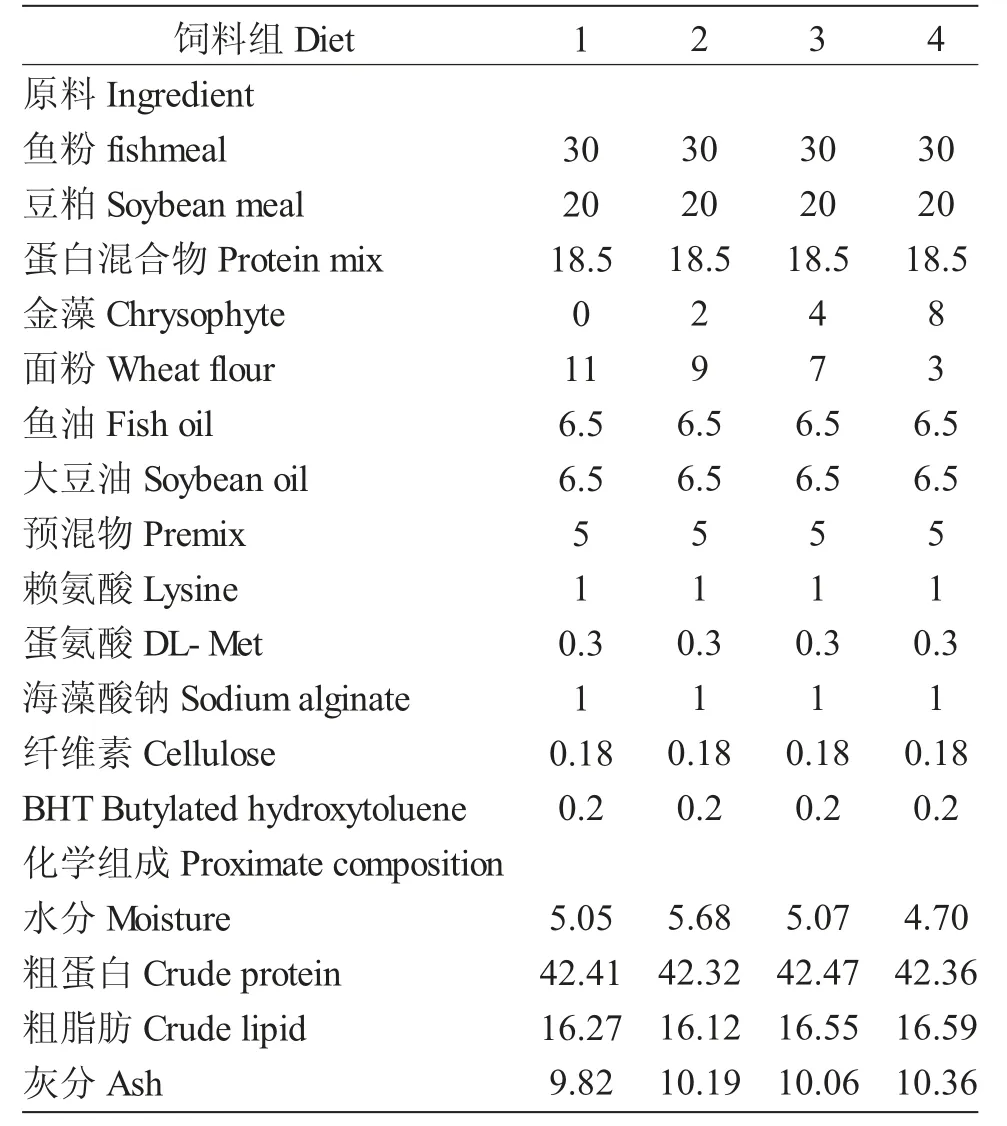
表1 实验饲料配方及生化组成(%干重)Tab.1 Ingredients and proximate composition of the experimental diets(% dry matter)
1.2 饲养管理
实验在中国水产科学研究院黑龙江水产研究所(哈尔滨)循环水养殖车间进行。养殖系统由30个直径0.76 m、水深0.25 m,总水体约8 m3的圆柱形培育缸组成。实验用三倍体虹鳟购自辽宁本溪艾格莫林公司。实验前投喂山东汉业产商品饲料4周,暂养驯化,之后使用对照组饲料投喂2 周。选取体格健壮,体质量(10.40±0.13)g 的个体300 尾,放入12 个培育缸中,每缸25 尾,随机分为4 组,每组3 个重复,分别投喂在基础饲料中添加0%、2%、4%、8%藻粉的等氮等脂的饲料。试验期间,每日9:00和16:00 各投喂一次至表观饱食,水温为(14±0.5)℃,水流速度控制在0.4 m/s,溶解氧含量大于8 mg/L,pH 为8.5~9.0,光照周期为12L∶12D,每日换水量为水体总体积的15%~20%。实验周期为8 周。
1.3 攻毒实验
养殖实验结束时,每组随机取鱼50 尾,麻醉后腹腔注射浓度为7.2×108CFU/mL 的杀鲑气单胞菌(Aeromonas salmonicida)菌液0.1 mL,统计3 d 与7 d 致死率。
1.4 样品采集
养殖实验结束时,实验鱼饥饿24 h 后,从每个养殖缸中随机取2 尾样品,采集(每个处理取6 尾)肝脏,并分别于攻毒后第3 d 和第7 d 再次采集各处理组肝脏样品,每个处理取6 尾。采样时,用200 mg/L MS-222 麻醉实验鱼,迅速收集肝脏并放入液氮中保存待测。
1.5 样品分析
肝脏样品从液氮中取出,置于冰上化冻,加入9倍体积的生理盐水,在冰浴条件下制成10%组织匀浆,低温高速离心10 min(4℃,3 500 r/min),取上清液,将上清液分批稀释保存后用于后续测定。
SOD 活性采用WST-1 法测定,CAT 活性采用钼酸铵法测定,GPX 活性采用比色法测定,MDA 含量采用TBA 法测定,组织蛋白浓度采用考马斯亮蓝法测定。上述测定所用试剂盒均购自南京建成生物工程研究所。具体计算公式如下:
SOD 活性(U/mg prot)=[(A对照-A对照空白)-(A测定-A测定空白)]/(A对照-A对照空白)/2×反应体系稀释倍数(0.24 mL/0.02 mL)/待测样本蛋白浓度;
CAT 活性(U/mg prot)=(对照ODf-测定OD值)×235.65/(60×取样量)/待测样本蛋白浓度;
GPX 活性(μmol/mg prot)=(非酶管OD 值-酶管OD 值)/(标准管OD 值-空白管OD 值)×标准管浓度×5/反应时间/(取样量×待测样本蛋白浓度);
MDA 含量(nmol/mg prot)=(测定OD 值-对照OD 值)/(标准OD 值-空白OD 值)×标准品浓度/待测样本蛋白浓度;
待测样本蛋白浓度(mg/mL)=(测定OD 值-空白OD 值)/(标准OD 值-空白OD 值)×标准品浓度×样本测试前稀释倍数
1.6 数据分析
特定生长率和攻毒前后成活率分别按照下列公式计算:
特定生长率(SGR,% d-1)=100×[ln(终末体质量)-ln(初始体质量)]/饲养天数;
攻毒前死亡率(%)=100×死亡鱼数量/(起始数量-采样数量);
攻毒后死亡率(%)=100×死亡鱼数量/(起始数量-采样数量)。
特定生长率和抗氧化指标均用平均值±标准误(Mean±S.E.)表示,应用SPSS 21 对数据进行单因素方差分析(One-Way ANOVA),利用Duncan 检验各组间方差同质性,显著性水平为P<0.05。
2 结果与分析
2.1 摄食添加不同含量金藻饲料对虹鳟幼鱼生长与死亡率的影响
各处理组的特定生长率分别为2.74±0.08、2.58±0.08、2.68±0.05、2.43±0.23,其中8%处理组的特定生长率显著低于对照组(P<0.05)外,其余各组间无显著性差异(P>0.05)。各处理组死亡率均低于3%,组间没有显著性差异(P>0.05)。攻毒3 d 死亡率分别为25%、16%、16%、32%,攻毒7 d 死亡率分别为30%、16%、16%、41%(表2)。

表2 摄食不同实验饲料对虹鳟幼鱼攻毒后死亡率的影响Tab.2 Effects of different experimental diets on mortality after infection of rainbow trout
2.2 摄食添加不同含量金藻饲料对虹鳟肝脏SOD活性的影响
养殖实验结束时,2%组与4%组虹鳟肝脏SOD活性显著高于对照组(P<0.05),攻毒7 d 后各组间无显著性差异(P>0.05)。各组SOD 活性均随攻毒时间延长呈先升高后降低的趋势,在攻毒7 d 时显著低于未攻毒与攻毒3 d 时(P<0.05)(图1)。

图1 摄食不同实验饲料时三倍体虹鳟肝脏SOD 的活性Fig.1 SOD activity in liver of triploid rainbow trout fed different diets
2.3 摄食添加不同含量金藻饲料对虹鳟肝脏CAT活性的影响
养殖实验结束时,2%组与4%组虹鳟肝脏CAT活性较对照组均有提高,2%组显著高于对照组和8%组(P<0.05),攻毒3 d 时8%组CAT 活性显著高于其余组(P<0.05),在攻毒7 d 时各组间无显著性差异(P>0.05)。
攻毒3 d 时对照组CAT 活性显著提高(P<0.05),2%组在不同时间点并未出现显著性差异(P>0.05),4%组在攻毒7 d 时CAT 活性显著高于未攻毒时与攻毒3 d 时(P<0.05)。8%组CAT 活性随攻毒时间呈先升高后下降的趋势,在攻毒3 d 时达到最大值,显著高于未攻毒时与攻毒7 d 时(P<0.05)(图2)。

图2 摄食不同实验饲料时三倍体虹鳟肝脏CAT 的活性Fig.2 CAT activity in liver of triploid rainbow trout fed different diets
2.4 摄食添加不同含量金藻饲料对虹鳟肝脏GPx活性的影响
养殖实验结束时,2%组与4%组GPx 活性高于对照组,且2%组显著高于对照组(P<0.05),攻毒7 d 时8%组GPx 活性显著低于其余组(P<0.05)。对照组与8%组GPx 活性在攻毒7 d 时显著低于未攻毒组与攻毒组3 d 时(P<0.05),2%组GPx 活性在攻毒后显著下降(P<0.05)(图3)。
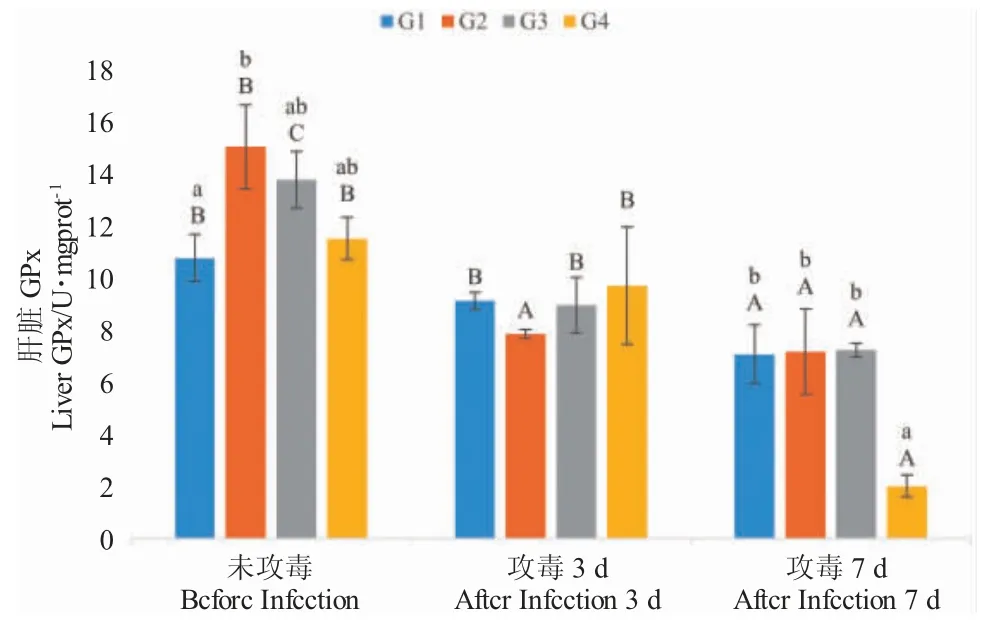
图3 摄食不同实验饲料时三倍体虹鳟肝脏GPx 的活性Fig.3 GPx activity in liver of triploid rainbow trout fed different diets
2.5 摄食添加不同含量金藻饲料对虹鳟肝脏MDA含量的影响
养殖实验结束时,虹鳟肝脏中MDA 含量随饲料中新型金藻添加量增加呈上升趋势,4%组与8%组显著高于对照组(P<0.05);攻毒后,8%组肝脏MDA 含量显著升高,且显著高于其余组(P<0.05),而其他各处理组MDA 含量在攻毒前后没有显著差异(P>0.05)(图4)。
图4 摄食不同饲料时三倍体虹鳟肝脏MDA 的含量Fig.4 MDA content in liver of triploid rainbow trout fed different diets
3 讨论
由于富含氨基酸、不饱和脂肪酸以及多糖等有益成分,多种微藻被用做饲料添加剂改善水产动物的机体健康。饲料中添加一定含量的螺旋藻与裂壶藻均可以提升红草金鱼(Carassius auratus var.red)的非特异性免疫力与机体抗氧化能力[12];饲料中添加4%~5%的螺旋藻显著提升了花鲈(Lateolabrax japonicus)的抗氧化能力[13]。以上研究结果均表明,饲料中添加微藻可以通过提升水产动物的非特异性免疫功能、影响抗氧化能力等方式改善机体健康。
β-葡聚糖是葡萄糖单体通过糖苷键连接而成的同型多糖,主要以细胞结构成分的形式广泛存在于细菌、酵母、蘑菇和藻类等生物中,具有提高免疫力与抗氧化性能的作用[14],可以作为多种水产动物的免疫增强剂,改善水产动物机体健康。研究表明β-葡聚糖可改善亚东鲑(Salmo trutta fario)抗氧化性能,增强机体健康和抗病力[15];在饲料中添加0.2%β-葡聚糖增强了虹鳟的免疫调节功能,提高虹鳟感染杀鲑气单胞菌后的成活率[16,17]。β-葡聚糖可以提高花鲈的非特异性免疫力与抗氧化能力[18],也可促进齐口裂腹鱼(Schizothorax prenanti)的生长及免疫功能[19]。然而,不同来源的β-葡聚糖对动物健康的影响存在一定的差异。对从啤酒酵母、燕麦与猴头菇中提取的β-葡聚糖进行对比试验表明,啤酒酵母源β-葡聚糖对小鼠机体抗氧化能力与免疫功能的影响优于燕麦与猴头菇[20]。
本研究中,饲料中添加2%和4%的富含β-葡聚糖的新型金藻显著地影响了攻毒前后肝脏抗氧化能力,提高了虹鳟抗杀鲑气单胞菌的能力。经过8周的饲养,饲料中添加2%与4%的新型金藻提高了虹鳟肝脏SOD、CAT 和GPx 活性,并受到攻毒时长的影响。这与王永宏[21]的研究结果相近。纪利芹等[22]的研究也发现,虹鳟感染杀鲑气单胞菌之后血清MDA含量显著升高,这说明机体受到一定程度的氧化损伤,而H2O2等过氧化物为机体受到氧化损伤后的产物[23],因而虹鳟在感染杀鲑气单胞菌后肝脏CAT 与GPx 活性增强以维持机体稳定。SOD、CAT 和GPx是抗氧化酶系的重要组成成员。SOD 是生物体内的一种抗氧化金属酶。它能够通过催化超氧阴离子自由基平衡机体的氧化和抗氧化水平,可与CAT 和GPx 协同作用,清除体内多余的自由基,减轻机体受到的氧化损伤[10]。本研究的结果表明,饲料中适宜比例的新型金藻具有提高虹鳟肝脏抗氧化能力和降低虹鳟感染杀鲑气单胞菌后死亡率的作用。
MDA 是自由基作用于脂类物质发生过氧化反应的终产物,可反映机体脂质过氧化程度,具有细胞毒性,也可间接反映出细胞损伤程度。本实验中,2%组与4%组虹鳟肝脏MDA 含量在攻毒后没有显著提高,说明适量的新型金藻添加对虹鳟肝脏的氧化损伤的影响比较有限。但高剂量处理组(8%)虹鳟肝脏MDA 含量显著高于其他各组,特别是攻毒后MDA 含量大幅度提高,提示杀鲑气单胞菌感染显著增加了高含量金藻饲喂虹鳟的肝脏氧化损伤[24],这可能是该组虹鳟细菌感染后成活率下降的重要原因之一。然而,有研究表明,连续两周给鲤(Cyprinus carpio)投喂添加了200 μg/mL β-葡聚糖的饲料,降低了鲤的抗病力[25],这与其在亚东鲑[15]和花鲈[18]中的研究结果不同,与本实验中所得结果也有较大差异,提示β-葡聚糖对鱼体免疫功能的作用可能受到养殖动物种类和养殖条件的影响。
综合抗氧化结果、攻毒后死亡率以及添加成本,在虹鳟的饲料中添加2%该新型金藻较为适宜,但该新型金藻用作虹鳟饲料添加剂的具体使用方法以及作用机制仍有待进一步研究。
