东北碳酸盐型盐碱池塘耐(嗜)碱微生物的筛选及功能分析
2023-01-05张瑞罗亮王世会郭坤徐伟赵志刚
张瑞,罗亮,王世会,郭坤,徐伟,赵志刚
(中国水产科学研究院黑龙江水产研究所,黑龙江省冷水性鱼类种质资源及增养殖重点开放实验室,黑龙江 哈尔滨 150070)
以松嫩平原盐碱地为代表的东北地区盐碱地是世界三大著名的碳酸盐型盐碱地之一。该地区的盐碱水域以高pH(≥8.5)、高碱度(20~30 mmol/L HCO3-)、低盐度(1‰~3‰ Na+)为特点,难以进行水产养殖。高pH 的水质不仅直接影响水产动物健康生长[1],还会导致水体中氨氮的毒性升高,增加对水产动物的危害[2,3]。因此,通过水质调控有效改善盐碱水质环境,成为开发与利用盐碱水域,推动盐碱水渔业绿色发展的主要途径之一。一直以来,微生物水质调控技术因其高效、绿色、安全的特点被广泛应用于水产养殖[4-6],而“原位”功能性微生物的筛选和应用,是实现微生物水质调控的重要途径[7]。
长期以来,国内外学者多以高盐浓度耐受为关注点,针对海水、盐湖、盐碱地等不同盐碱环境开展了大量耐(嗜)盐碱菌的多样性分析工作[8-14],分离鉴定了大量中度嗜盐菌、轻度嗜盐菌等具有重要研究价值的高盐(碱)耐受菌株[8-14],并在2.5%(w/v)甚至更高的盐(NaCl)浓度下分析菌株的耐碱能力[9,12]。值得注意的是,微生物要在强碱性条件下生长,就必需调节并维持细胞内pH 范围以满足其生命活动的需要。而通过细胞膜上的Na+/H+、K+/H+等逆向转运蛋白,在Na+等的跨膜运输的同时调节细胞内的pH,是耐(嗜)碱菌最主要的抗逆途径之一[15]。因此环境中盐浓度在很大程度上影响着菌株的耐碱能力。
迄今,尚未有以低盐度、高pH 为筛选条件,针对碳酸盐型盐碱水环境特点进行的耐(嗜)碱微生物筛选及多样性分析的报道,也缺少菌株在低盐浓度下耐碱能力的分析。本研究对大庆连环湖——典型碳酸盐型盐碱地区池塘水体和底泥中的耐(嗜)碱微生物进行筛选分离、鉴定分类,分析其低盐度下耐碱能力及pH 调节功能,为以“原位”功能微生物为核心的原位水质调控技术提供微生物资源保障,为碳酸盐型盐碱渔业的绿色发展提供支撑。
1 材料和方法
1.1 培养基及仪器试剂
富集培养基(3% Sehgal-Gibbons):胰蛋白胨5 g,酵母粉10 g,酸水解酪蛋白5 g,柠檬酸三钠3 g,KCl2 g,MgSO4·7H2O20 g,NaCl30 g,加水定容至1 000 mL,用NaOH 调pH 至8.0,灭菌备用。
筛选培养基(LB):胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,琼脂15 g,加水定容至1 000 mL,用NaOH调pH 至8.5,灭菌备用。
耐碱上限测试培养基:液体LB 培养基,用NaOH 调至不同pH(7.0、7.5、8.0、8.5、9.0、9.5、10、11、12),灭菌备用。
pH 调节能力测试培养基:葡萄糖20 g,酵母粉5 g,蛋白胨5 g,NaCl 50 g,配置固体培养基时额外加入琼脂15 g,加水定容至1 000 mL,用NaOH 调pH 至7.0,灭菌备用。
PCR 仪购自Bio-Rad 公司;凝胶成像分析仪购自Bio-Rad 公司;全温振荡培养箱购自沧州莱玻特瑞仪器设备有限公司(ZQPL-200);生化培养箱购自上海博迅实业有限公司(SPX-100B-Z);紫外分光光度计购自上海佑科仪器仪表有限公司(752N);便携式pH 计购自上海沛瑞仪器有限公司(PH400);通用引物由北京华大基因研究院合成;PCR 预混合溶液购自上海圣生物科技有限公司。
1.2 样品采集
2020 年6 月,从大庆连环湖地区的9 口养殖池塘中随机采集水样(嫩江水水源)与底泥样(距离水底0~10 cm)共12 份,分别装入无菌三角瓶中,带回实验室立即进行菌株富集与分离。
1.3 菌株富集与分离
将各采集样品混合均匀,称取3 g(3 mL)置于200 mL 富集培养基中,30℃150 r·min-1振荡培养2~3 d 后,将富集的菌悬液在无菌水中逐级稀释至10-4、10-5、10-6和10-7倍,然后取各稀释度的菌悬液0.1 mL 分别涂布于pH 8.5 的筛选培养基平板上,在30℃静置培养。3~5 d 后,挑取单菌落进行多次划线纯化。最后根据菌落形态、颜色以及显微形态等表型特征鉴定为纯培养后,将纯培养菌液保藏于-80℃。
1.4 基于16S rRNA 基因序列的系统发育分析
采用菌液PCR 法扩增纯培养细菌的16S rRNA基因序列。扩增引物采用扩增细菌16S rRNA 的通用引物Eubac27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和Eubac1492R(5’-GGTTACCTTGTTACGACT T-3’)。PCR 以过夜培养菌液为模板,反应体系参照2×Hieff PCR Master Mix 使用说明书配置。反应程序:95℃10 min;94℃l min,55℃30 s,72℃1.5 min,30 个循环;72℃10 min。PCR 产物经电泳检测后送北京华大基因研究院测序,测序引物与扩增引物相同。
测序所得序列提交GenBank 数据库,获取序列号(Accession number)。采用Nucleotide Blast 在线分析,找出各序列在NCBI 数据库中同源性最高的已鉴定菌株序列,用MEGA 6.0 中的Clustal X 程序进行多序列比对,然后用Neighbor-Joining 方法选择Bootstrap 为1 000 个重复构建系统发育学进化树。
1.5 菌株耐碱上限测试
所有待试菌株经LB(pH 7.0)培养基过夜活化后,分别按1%接种量接种于不同pH 培养基中,在30℃150 r·min-1震荡培养24 h 后观察生长情况。
1.6 菌株pH 调节能力验证
所有待试菌株经活化后,分别按1%接种量接种于200 mL 培养基中验证pH 调节能力,培养液于30℃150 r·min-1震荡培养,每隔4 h 取20 mL 培养菌液测定pH 与OD600吸光度,直至24 h 结束。
2 结果与分析
2.1 菌株的筛选与分离
从本次采集的12 份样品中共筛选出纯培养菌株49 株,经16S rRNA 基因序列鉴定,最终共确定菌株24 株。它们分属于气单胞菌属(Aeromonas)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)、微小杆菌属(Exiguobacterium)、盐单胞菌属(Halomonas)、赖氨酸芽孢杆菌属(Lysinibacillus)、动性球菌属(Planococcus)以及假单胞菌属(Pseudomonas)共9 个菌属。其中芽孢杆菌属与微小杆菌属为优势菌属,分别为7 株与6 株,占总菌株量的29.17%和25.00%(图1)。其次是动性球菌属(Planococcus)3 株,占总菌株量的12.50%;肠球菌属与肠杆菌属各2 株,分别占8.33%;气单胞菌属、盐单胞菌属、赖氨酸芽孢杆菌属以及假单胞菌属各1 株,分别占菌株总量的4.17%。
2.2 基于16S rRNA 基因序列的系统发育学分析
用DNAMAN6.0 软件分别比对分析上述24 株菌的16S rRNA 基因序列及其已鉴定的最近缘种菌株的同源性。结果表明:CT-WN-B17 与已鉴定的最近缘种菌株同源性为96.35%,CT-MH6-7 与已鉴定的最近缘种菌株同源性为96.84%,而其余同源性均在99.58%~100%之间。碳酸盐型池塘耐(嗜)碱菌菌群中所有菌株与已鉴定近缘菌株在系统发育进化树上也稳定聚簇(图2)。上述结果支持将除CTWN-B17、CT-MH6-7 以外的22 株菌株认定为各自相应的已鉴定最近缘种,而菌株CT-WN-B17 和CT-MH6-7 的16S rRNA 序列与已鉴定最近缘种同源性较低,系统进化关系较远,具有新种潜质,需进行进一步鉴定,因而暂将它们分别命名为Lysinibacillus sp.与Enterococcus sp.(表1)。
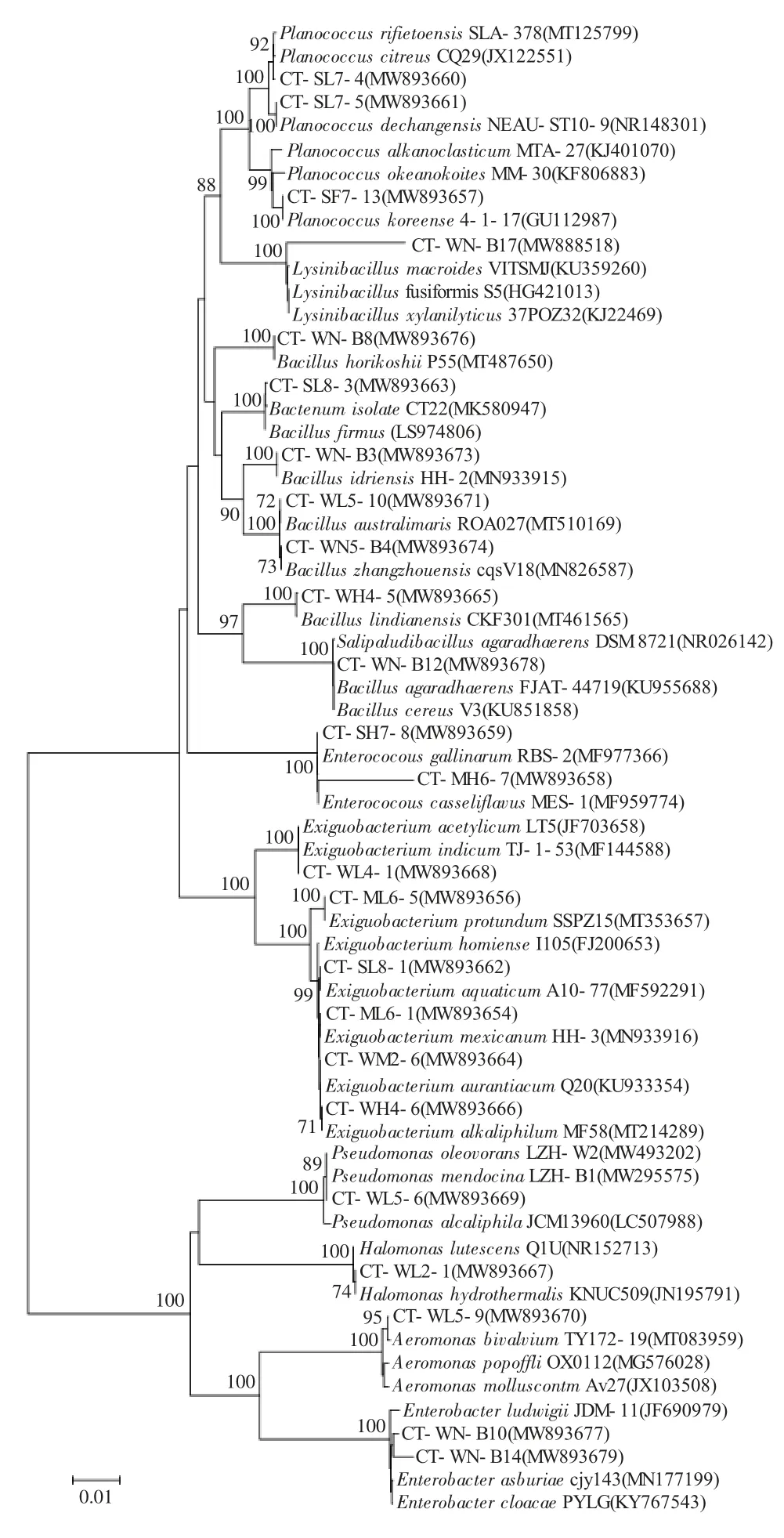
图2 东北地区碳酸盐型盐碱池塘中耐(嗜)碱细菌群落的系统发育树Fig.2 Neighbor -Joining tree of alkalitolerant(alkaliphilic)bacteria in carbonate saline-alkali ponds in northeast China
2.3 耐碱上限测定
以上24 株菌株分属于细菌域的2 个门——变形菌门(Proteobacteria)和厚壁菌门(Firmicutes);9个属——气单胞菌属、芽孢杆菌属、肠杆菌属、肠球菌属、微小杆菌属、盐单胞菌属、赖氨酸芽孢杆菌属、动性球菌属以及假单胞菌属。其中厚壁菌门为优势类群,菌株占比达79.17%;芽孢杆菌属与微小杆菌属为优势菌属,菌株占比分别为29.17%和25.00%。
以上24 株菌株在1%NaCl 浓度下的耐碱上限在pH 9.0~10.0 之间,其中7 株能耐受pH9.0,芽孢杆菌属为最优势菌属(4/7);10 株能耐受pH9.5,其中芽孢杆菌属为最优势菌属(3/10);7 株能耐受pH10.0,其中微小杆菌属为最优势菌属(4/7)(表1)。上述所有菌株并未表现出对碱性pH 的生长依赖性,均属于耐碱菌。

表1 东北地区碳酸盐型盐碱池塘中的耐(嗜)碱细菌及其耐碱能力分析Tab.1 Alkalitolerant(alkaliphilic)bacteria and their alkaline-tolerance capacity in carbonate saline-alkali ponds in northeast China
2.4 pH 调节能力测定
碳酸盐型盐碱池塘耐碱细菌群落中有两大优势菌属,分别为芽孢杆菌属和微小杆菌属。后者的功能之一就是可以利用葡萄糖等碳源产酸[16],导致培养环境的pH 下调。为探究盐碱池塘中优势菌群菌株,即芽孢杆菌属与微小杆菌属菌株的pH 调节能力,以葡萄糖为补充碳源培养菌株,测定随菌株繁殖的培养基pH 的变化。
随24 h 内微小杆菌属菌株的不断生长繁殖,菌株CT-WL4-1 将培养基pH 下调了2.5 个单位(图3-A);尽管菌株CT-WH4-6 最终的繁殖水平与CT-WL4-1 相差无几,但仅将培养基pH 下调了0.6个单位(图3-B);菌株CT-SL8-1、CT-WH2-6、CT-ML6-1 和CT-ML6-5 繁殖不十分旺盛(OD600≤1.0),24 h 内培养基pH 下调了1.3~1.5 个单位(图3-C~F)。
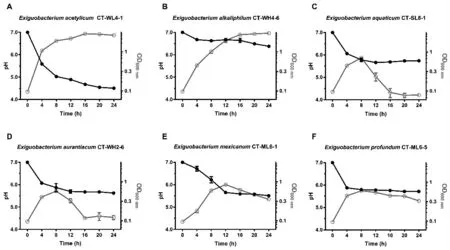
图3 东北地区碳酸盐型盐碱池塘微小杆菌属细菌的pH 调节能力Fig.3 pH regulation of Exiguobacterium strains in carbonate saline-alkali ponds in northeast China
芽孢杆菌属菌株也具有不同程度调节pH 的能力。如图4 所示,菌株CT-WN-B4、CT-WL5-10 在24 h 内繁殖旺盛,分别使培养基pH 下调了1.1 和1.3 个单位(图4-A、B);菌株CT-WH4-5、CT-WN-B12 在实验条件下生长较为微弱,均仅将培养基pH 下调了不足1 个单位(图4-C、D);菌株CT-SL8-3、CT-WN-B3 和CT-WN-B8 的繁殖并不十分旺盛(OD600≤1.1),在24 h 内将培养基pH 分别下调了1.8、1.9 和1.2 个单位(图4-E~G)。上述结果显示,在本实验条件下,已筛选鉴定的6 株微小杆菌属菌株与7 株芽孢杆菌属菌株中,微小杆菌属菌株CT-WL4-1 具有最强的pH 调节能力,芽孢杆菌属菌株CT-SL8-3 和CT-WN-B3 次之。

图4 东北地区碳酸盐型盐碱池塘中芽孢杆菌属细菌的pH 调节能力Fig.4 pH regulation of Bacillus strains in carbonate saline-alkali ponds in northeast China
3 讨论
本研究以高pH、低盐度为条件从典型碳酸盐型盐碱池塘水体和底泥样品中定向富集、筛选耐(嗜)碱菌,通过16S rRNA 基因同源性比对和系统发育学分析进行菌株鉴定分类,获取耐(嗜)碱菌多样性信息。结果表明,东北地区碳酸盐型盐碱池塘中耐碱菌种群丰富,共分离到的49 个菌株,分属于细菌域中2 个门(Firmicutes、Proteobacteria)、9 个属、24 个种。其中多数菌株属于厚壁菌门(Firmicutes),两个优势属分别为芽孢杆菌属(7 株,占总菌株的29.17%)和微小杆菌属(6 株,占总菌株的25%)。绝大多数菌株的16S rRNA 基因序列与已鉴定的最近缘种序列同源性在99.58%~100%之间。仅肠球菌属菌株CT-MH6-7 与赖氨酸芽孢杆菌属菌株CT-WN-B17 的16S rRNA 序列与已鉴定的最近缘种菌株同源性较低,分别为96.35%、96.84%,且系统进化关系较远,认为其具有新种潜质。
多年来,科研工作者围绕多个盐碱环境开展了耐(嗜)盐菌的多样性研究,已在碳酸盐型盐碱土壤中筛选鉴定出34 株耐(嗜)盐菌。这些菌株大多具有5%~10%的耐盐能力和不同程度的耐碱能力[9]。与之相比,本研究获得的碳酸盐型盐碱池塘耐碱菌多样性并不十分丰富。比较二者菌群结构,发现其均包含芽孢杆菌属、微小杆菌属、盐单胞菌属、肠杆菌属、假单胞菌属和动性球菌属(Planococcus),这表明上述6 个菌属的菌株在碳酸盐型盐碱土壤中和水体中均有分布。不同的是,土壤中的最优势菌属葡萄球菌属(Staphylococcus)并不包含在池塘样品中,而盐碱池塘中的优势菌属微小杆菌属(Exiguobacterium),在土壤仅分离到1 株。这似乎并不是由菌株筛选条件所致。根据现有研究背景,微小杆菌属菌株可以耐受0%~10%浓度的NaCl[16],即采用耐(嗜)盐菌的筛选条件也可将其分离出,相似的耐(嗜)碱菌的筛选条件也可将葡萄球菌属菌株分离出来。因此,可以认为两群落结构的差异是由不同菌属微生物对生存环境的偏好性选择导致。微小杆菌属曾因并未在其他盐碱环境中被筛选得到而被认为是属于东北地区松嫩平原盐碱土壤的独特耐盐菌群类[9],因此建议,微小杆菌属可作为东北地区碳酸盐型盐碱水体环境的代表性耐盐碱菌属。
一直以来对于耐碱菌与嗜碱菌的定义并不明确和统一。本研究根据众多科研工作者的分类习惯,将能在高pH 条件下生长,但最适值并不在碱性pH 范围内的归类为耐碱菌;而最适生长pH 在9.0以上,pH 耐受高达10~12 的则称之为嗜碱微生物[17]。本研究获得的所有菌株并未表现出碱性条件的生长依赖性,pH 耐受上限介于9.0~10.0 之间,属于耐碱菌。本结果显然低于一些现有的研究背景[9,18-20],这是因为本实验条件中更低的盐浓度影响了菌株的耐碱能力上限。但本研究的结果更接近菌源环境的实际条件,更有菌株的原位应用指导意义。
菌群中优势的、且更强耐碱能力的微小杆菌属菌株,其另一重要功能就是可以利用葡萄糖等碳源产酸[16]。本研究以葡萄糖为补充碳源,以pH 调节能力为目标,在两大优势菌属中筛选出3 株具有较强pH 调节能力的耐碱菌(包括1 株微小杆菌属菌株,2 株芽孢杆菌属菌株),能够在24 h 内将培养基pH下调1.8~2.5 个单位,具有微生物水质调控应用潜力。然而这些菌株是否通过利用葡萄糖合成有机酸来调节pH;有些菌株是否也可以利用其他碳源产酸来调节pH,这些问题均需进一步验证与探究。
本研究填补了我国东北地区碳酸盐型盐碱水土环境——盐碱池塘的耐碱菌多样性的研究空白,在优势菌属中筛选出了具有较强pH 调节能力的耐碱菌株,为碳酸盐型盐碱养殖水质调控技术的研发提供支撑。
