木质素水热法协同制备碳量子点和多孔碳材料的实验研究
2023-01-05朱玲莉沈德魁
朱玲莉 曹 瑾 沈德魁
(东南大学能源热转换及其过程测控教育部重点实验室,南京 210096)
自从20世纪80年代富勒烯被成功合成以来,多孔碳、碳纳米管、石墨烯、碳纳米洋葱等碳材料因其特殊的物理化学性质而备受关注.其中,碳量子点(CQDs)作为一种零维的碳纳米发光材料,其尺寸小于10 nm,具有毒性低、稳定性好、生物相容性强和荧光性能优异等优点.CQDs在传感、生物成像、催化、光电器件等领域得到了广泛的应用[1-2].CQDs可以通过自上而下或自下而上法制备,前者是将块状石墨切割成纳米尺寸的CQDs颗粒;后者是以有机分子为碳源,经过聚合-碳化反应形成CQDs[3].
至于制备CQDs的碳源,大多数有机物价格昂贵且危害自然环境和人类健康,如多环芳烃就是强致癌物[4].以低成本、可再生的生物质作为碳源,既可以缓解能源危机,也可以合理处置固体废弃物.已有大量研究表明,牛油果[5]、香蕉皮[6]、银杏叶[7]、淀粉[8]、甘蔗渣[9]、半纤维素[10]等天然的生物质可用于CQDs的绿色制备.其中,木质素作为农林类生物质的三大组分之一,具有天然的芳香结构,有利于CQDs的高效制备[11].Zhang等[4]采用一步水热法,以碱木质素和乙二胺为原料制备了相对荧光量子产率(QYs)为17.60%的N掺杂CQDs.高学霞等[12]采用了两步法,将碱木质素在浓H2SO4与浓HNO3体积比为3∶1的强酸环境下酸解,再进行水热处理,制备出QYs为17.3%的N、S共掺的CQDs.Ding等[13]同样采用HNO3酸解木质素再水热的两步法,获得了QYs为21%的N掺杂CQDs.酸性环境促进了木质素的水解,所制备的CQDs表现出优异的荧光性能.然而,上述方法均涉及强酸的使用,其成本效益不高且易腐蚀,对生态环境和人体健康造成威胁.目前对CQDs的研究大多都集中在获得单一目标产物上,原料的转化效率和CQDs的产率都不高.生物质在水热制备CQDs过程中往往产生大量的副产物水解碳,其利用价值尚未得到有效开发.事实上,经过酸解和水热后的水解碳,具有高含氧量和低程度的芳香结构,通过物理化学活化易于获得具有分级孔结构的多孔碳材料(PCs)[14].PCs由于其孔隙结构发达、导电性强、化学稳定性好等优势,已经在吸附、催化、储能等领域被广泛应用[15].利用生物质原料同时制备CQDs和PCs的研究还很少,如何将生物质高效转化为高值化的碳材料仍是一项艰巨的挑战.
本文以木质素为碳源,温和的邻氨基苯磺酸为掺杂剂,采用两步水热法协同制备CQDs和PCs碳材料.研究了不同酸解温度对CQDs的QYs和产率的影响规律.通过对比不同CQDs的形貌特征和结构特性,分析了CQDs荧光性能差异的原因.通过比表面积、孔容、孔径分布的表征,评估了PCs的吸附性能.研究结果为木质素的综合利用以及碳材料的绿色、大规模生产提供了理论依据.
1 材料与方法
1.1 实验原料
碱木质素(质量分数不小于96%)采用西格玛试剂;邻氨基苯磺酸(质量分数99%)来自毕得药业;氢氧化钾(质量分数95%)采用阿拉丁试剂;透析袋(截留分子量为1 000 Da)来自美国Viskase;聚四氟乙烯微孔滤膜(孔径为0.1 μm)来自天津津腾;所有试剂均为分析纯,使用前未经再处理.
1.2 样品制备
1.2.1 木质素的酸解
将0.3 g邻氨基苯磺酸分散于30 mL去离子水中,并缓慢加入0.3 g木质素粉末.然后将混合溶液在不同温度(30、50、70、90、110 ℃)的水浴锅中加热1 h,搅拌速率为350 r/min.反应后的溶液用高速离心机离心10 min,转速为12 000 r/min.所得上层清液和固体残渣分别用于下一步碳材料的制备.
1.2.2 碳量子点的制备
首先将上层清液和固体残渣分别分散在30 mL去离子水中,然后将其转移至50 mL聚四氟乙烯内衬的高压反应釜中,200 ℃持续加热12 h.反应物自然冷却至室温后,经过真空抽滤分离出CQDs溶液和固体碳(SCs).所得CQDs溶液先微孔过滤后透析48 h,最后在-60 ℃下冻干成粉末.由上层清液和固体残渣制备的CQDs分别标记为G-CQDs和B-CQDs,从上清液和固体残渣中获得的SCs分别标记为G-SCs和B-SCs.所得2种SCs在60 ℃下烘干至恒重,用于下一步PCs的制备.
1.2.3 多孔碳的制备
上述所得的G-SCs和B-SCs分别在质量分数50%的KOH溶液中活化12 h(浸渍比1∶3),然后在60 ℃下烘干成固体.将固体放入管式炉中在流速为150 mL/min的氩气氛围下于700 ℃加热2 h,升温速率为10 ℃/min.活化后的PCs用浓度为 1.0 mol/L的HCl进行多次洗涤以去除无机杂质,再用去离子水洗涤,直至滤液呈中性,最后将PCs在60 ℃下真空干燥12 h.由G-SCs和B-SCs分别活化获得的PCs标记为G-PCs和B-PCs.目标碳材料的产率可以通过下式计算:
(1)
(2)
Y=YG-CQDs+YB-CQDs
(3)
式中,YG-CQDs、YB-CQDs、Y分别表示G-CQDs、B-CQDs和总的碳材料产率;MG-CQDs、MB-CQDs和Mr分别表示G-CQDs、B-CQDs和原料(木质素和邻氨基苯磺酸)的质量.
1.3 表征仪器
采用Tecnai G2 F20型高分辨率透射电子显微镜(HR-TEM,美国FEI公司)观察CQDs的形貌;采用DXR 2xi型共聚焦拉曼光谱仪(Raman,美国ThermoFisher公司)在InGaN激光532 nm激发下测试CQDs的石墨化结构;采用Nicolet Is5型傅里叶变换红外光谱仪(FT-IR,美国ThermoFisher公司)和K-Alpha型X射线光电子能谱仪(XPS,美国ThermoFisher公司)表征CQDs的表面化学组成;采用UV-5200型紫外-可见分光光度计(UV-vis,中国元析公司)和Cary Eclipse型荧光分光光度计(PL,美国Agilent公司)测试CQDs的光学性质;采用ASAP 2460型氮气吸附测量原理(BET,美国Micromeritics公司)测试PCs的比表面积和孔径分布;采用SU8220型场发射扫描电子显微镜(SEM,日本Hitachi公司)观察PCs的表面形貌.
1.4 相对荧光量子产率计算
CQDs的QYs可以通过下式计算[16]:
(4)
式中,φx、φstd分别表示CQDs和硫酸奎宁的QYs值;ηx、ηstd分别表示CQDs和硫酸奎宁的折射率(水的折射率为1.33);Ax、Astd分别表示CQDs和硫酸奎宁在激发波长340 nm下的吸光度;Ix、Istd分别表示CQDs和硫酸奎宁的荧光发射强度.硫酸奎宁作为参比溶液,溶解在浓度0.1 mol/L的H2SO4中(φstd=54%).为了减少重吸收效应的干扰,将CQDs溶液在激发波长340 nm处的吸光度控制在0.05.
2 结果与讨论
2.1 酸解温度的影响
不同酸解温度下2种CQDs的QYs变化规律如图1所示.随着酸解温度从30 ℃升高至90 ℃,G-CQDs的QYs从16.3%提高至23.7%,B-CQDs的QYs从3.8%提高至5.2%.当酸解温度继续升高至110 ℃时,G-CQDs和B-CQDs的QYs均呈下降趋势,这些结果与文献[11]的研究结果一致.在酸解温度为90 ℃时,G-CQDs和B-CQDs分别具有最佳的QYs,为23.7%和5.2%.不同酸解温度下2种CQDs的产率与QYs的变化规律相似(见表1).当酸解温度为90 ℃时,G-CQDs和B-CQDs的最佳产率分别为30.6%和15.2%,总产率高达45.8%.基于此,选择酸解温度90 ℃下制备的CQDs进行进一步的形貌、结构和光学性能的表征研究.
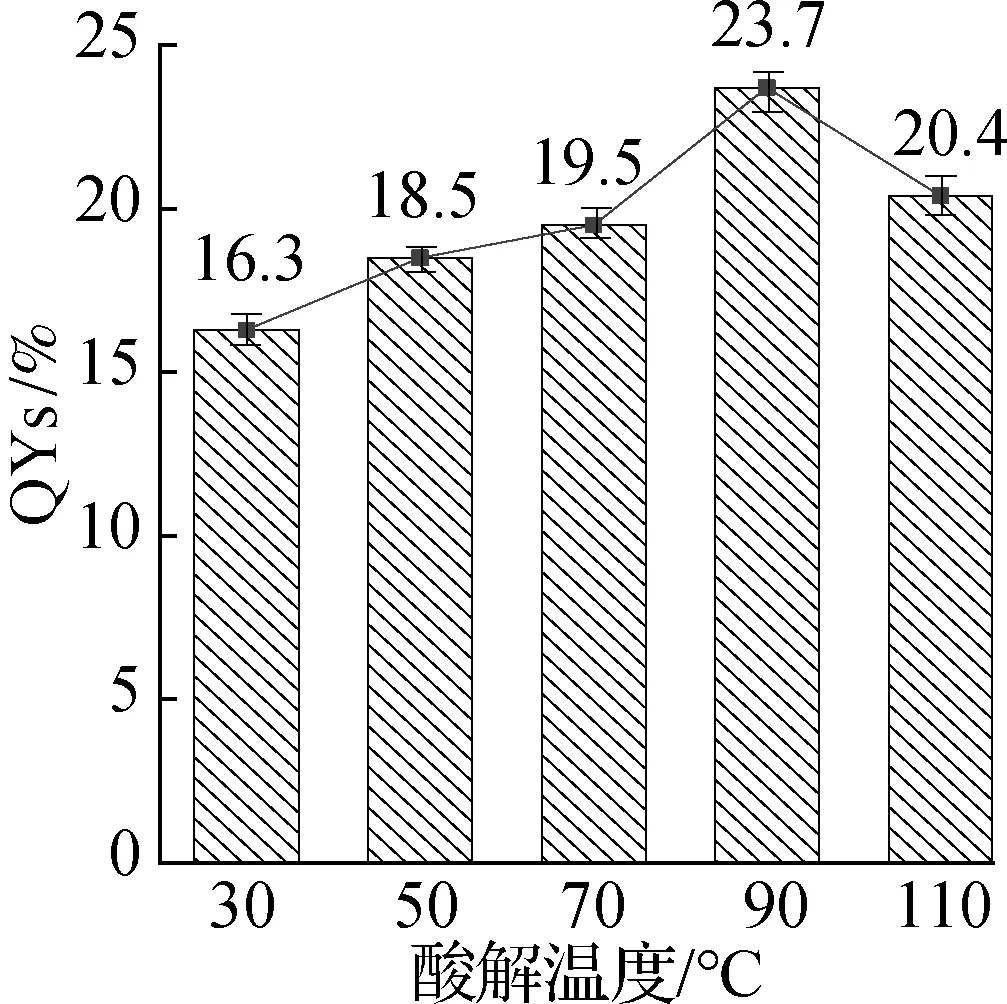
(a) G-CQDs
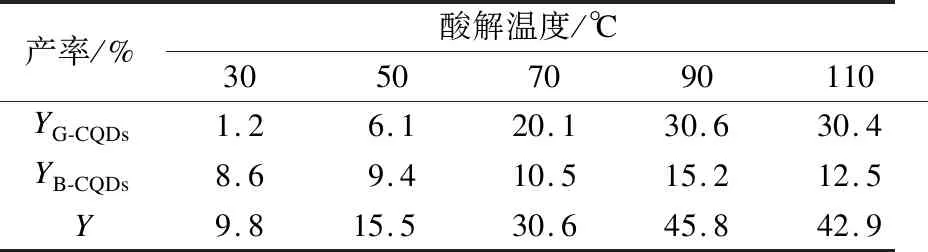
表1 不同酸解温度下碳材料的产率分布
2.2 碳量子点的形貌与结构特征
TEM和HR-TEM图像清晰地展现了2种CQDs的微观形貌(见图2).从TEM图可以看出,G-CQDs和B-CQDs在水溶液中分散均匀,呈球状颗粒.通过计算约200个颗粒的粒径,得到了CQDs的粒径分布(见图3),G-CQDs和B-CQDs的平均粒径分别为5.57和6.10 nm.2种CQDs的HR-TEM图像均有明显的晶格条纹,晶格间距为0.32 nm,对应于(002)石墨晶面,这与大部分生物质基CQDs相似[17].Raman光谱进一步证实了2种CQDs的石墨结构.如图4所示,在1 350/1 377 cm-1处和1 583/1 587 cm-1处的拉曼峰对应的是D峰和G峰,分别代表无序sp3碳和石墨化sp2碳的振动.G-CQDs和B-CQDs的峰强度比ID/IG分别为0.92和0.76,表明G-CQDs的缺陷或无序结构较多,而B-CQDs的石墨化程度更高[18].

(a) G-CQDs
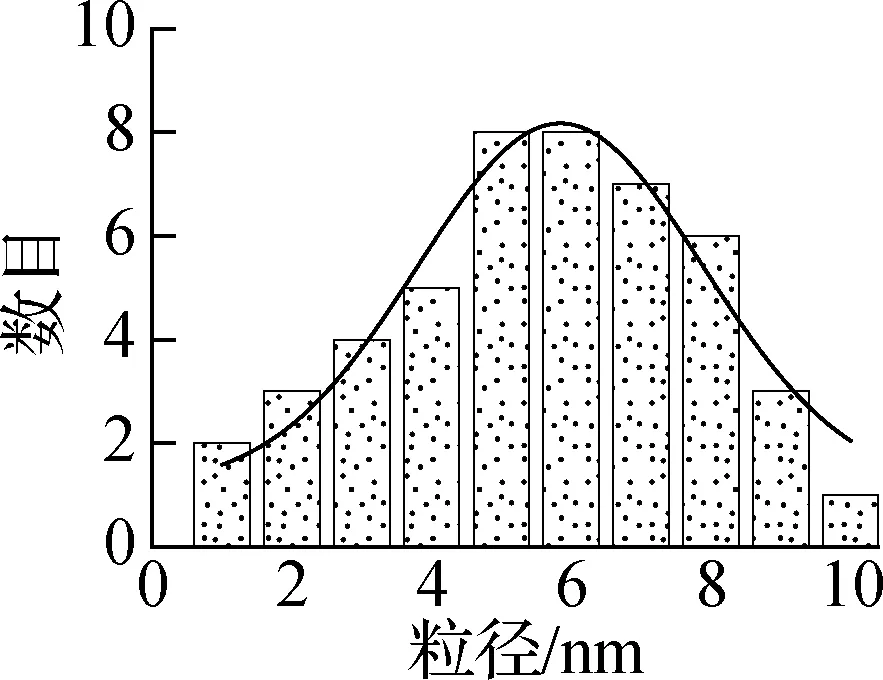
(a) G-CQDs
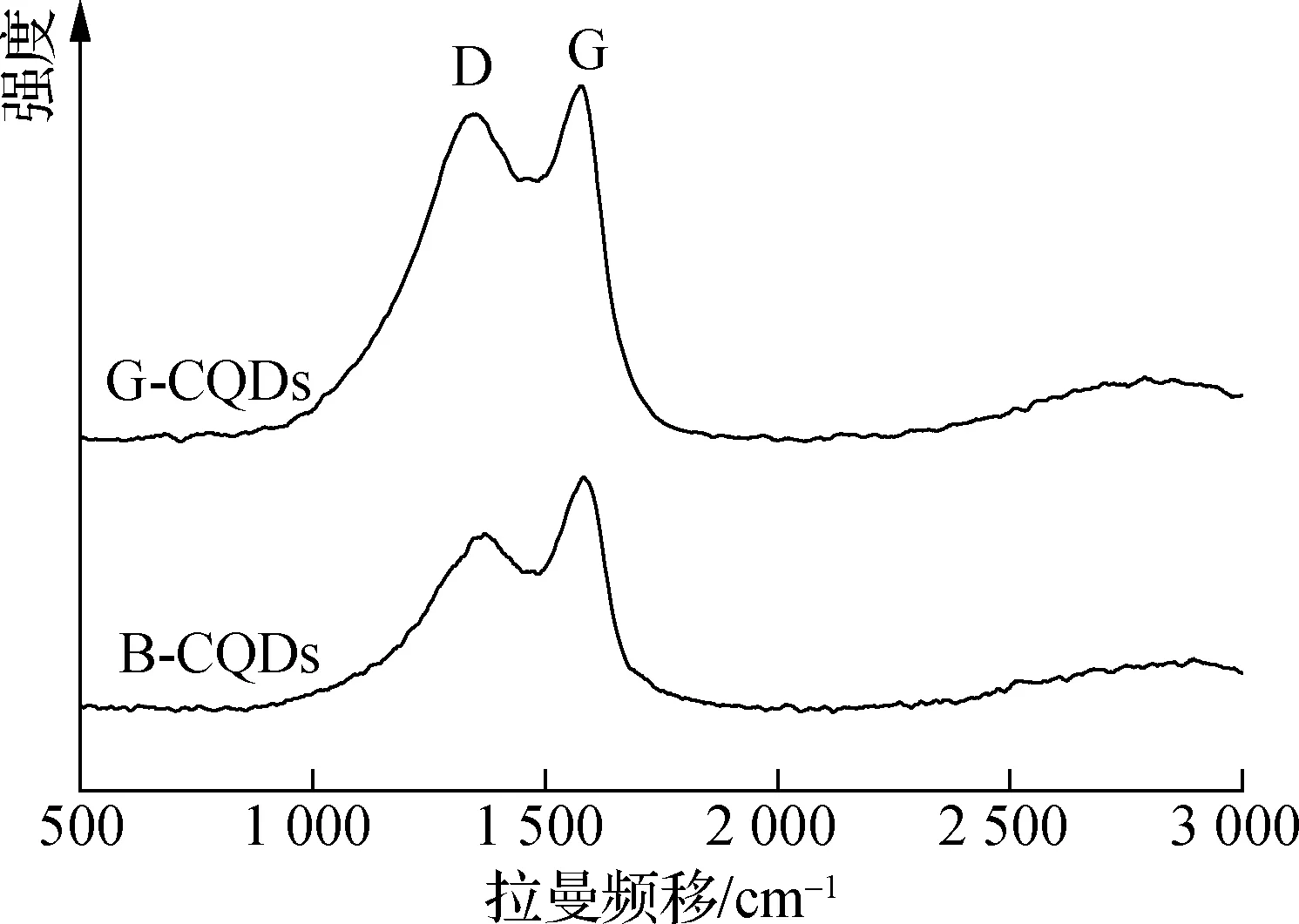
图4 2种CQDs的Raman光谱

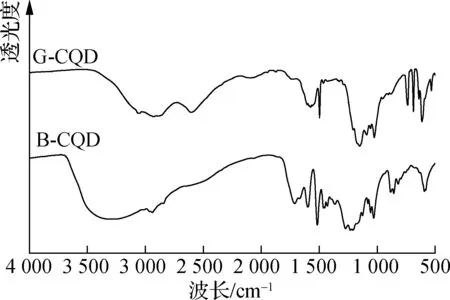
图5 2种CQDs的FTIR光谱

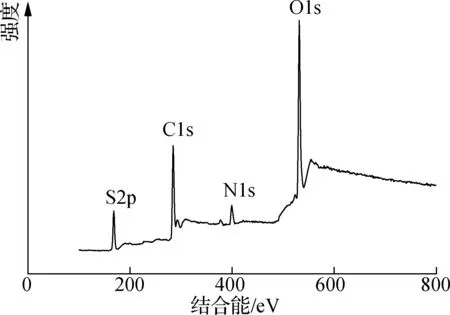
(a) XPS全谱
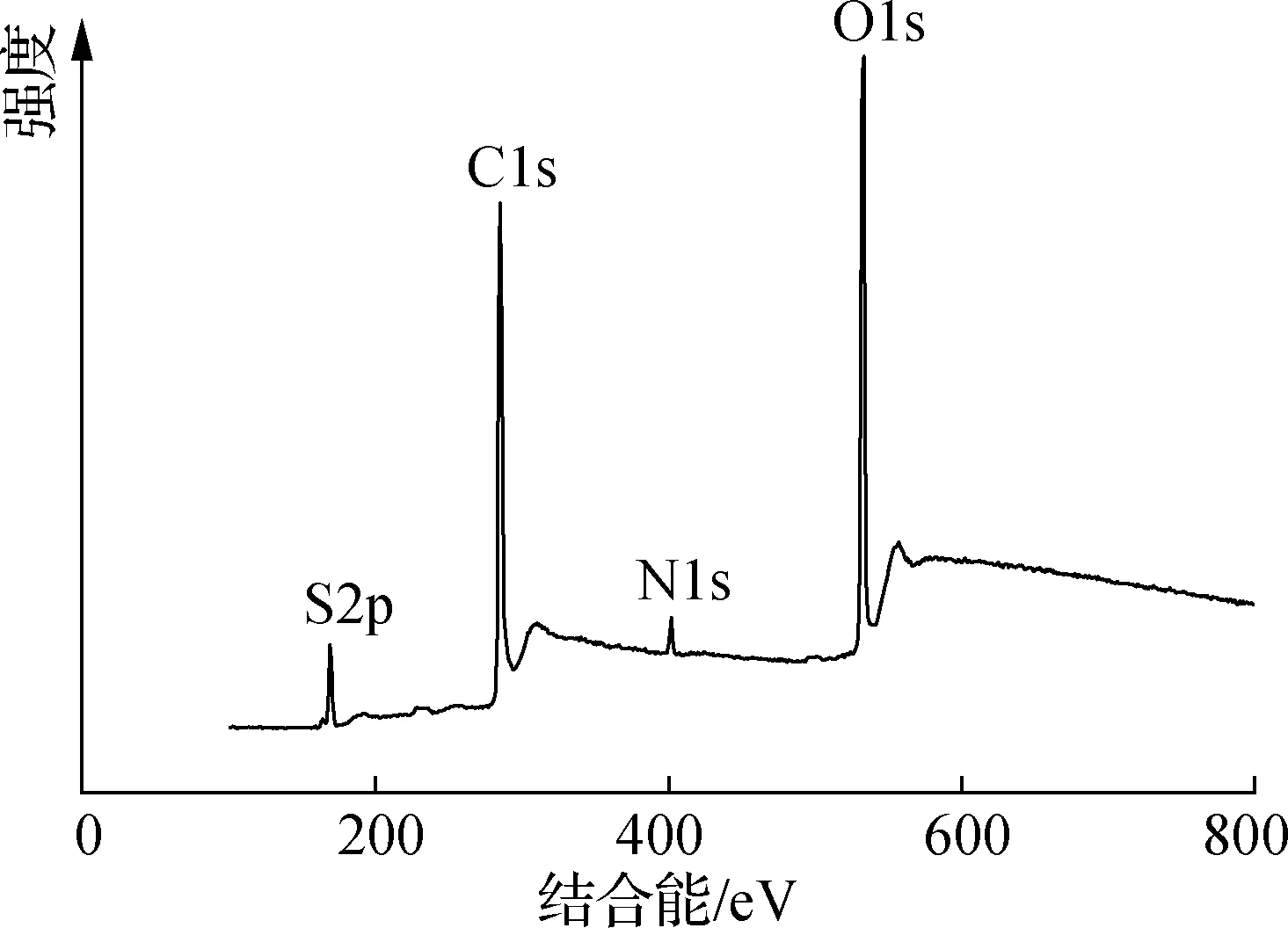
(a) XPS全谱
2.3 碳量子点的光学特性

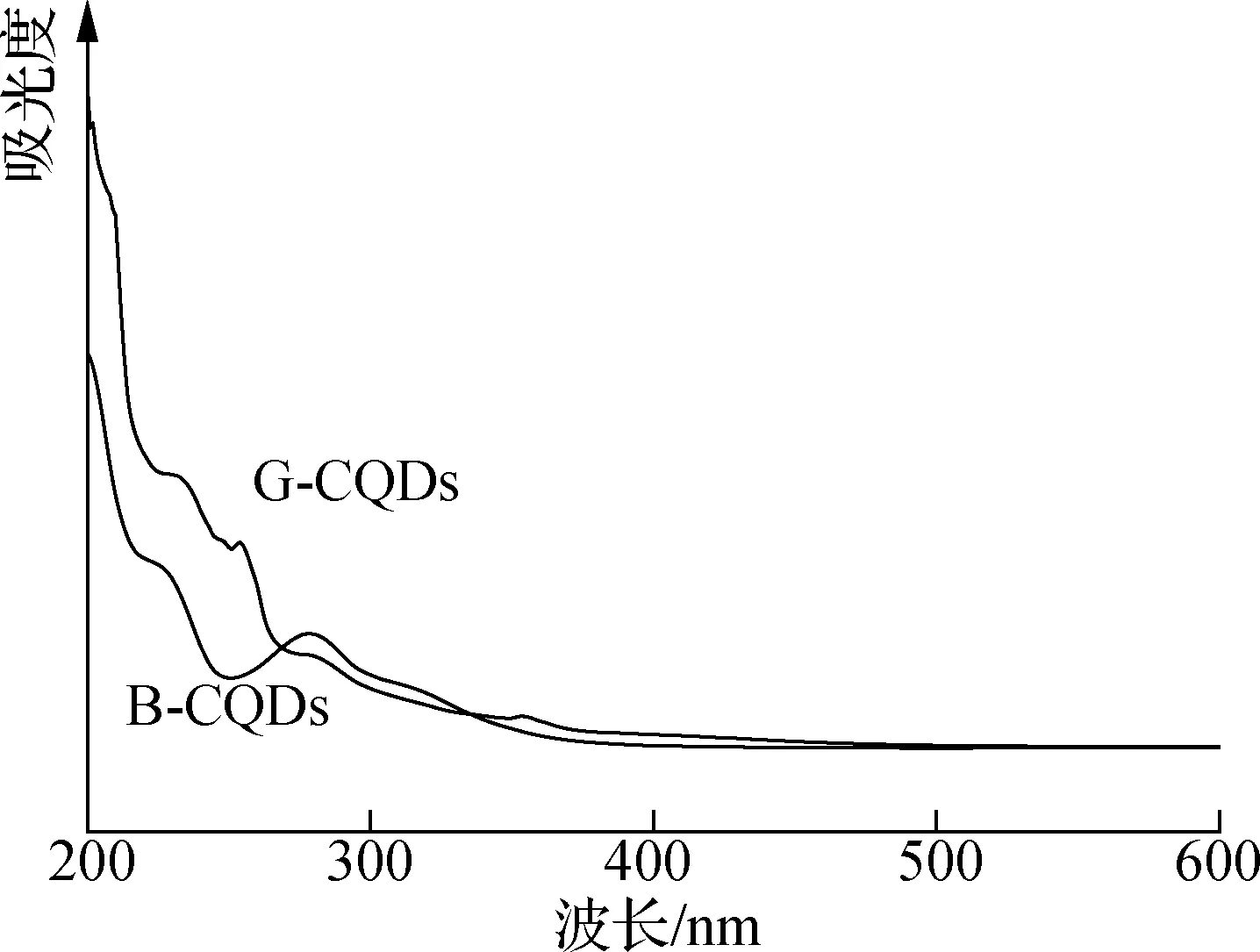
图8 CQDs的UV-vis吸收光谱
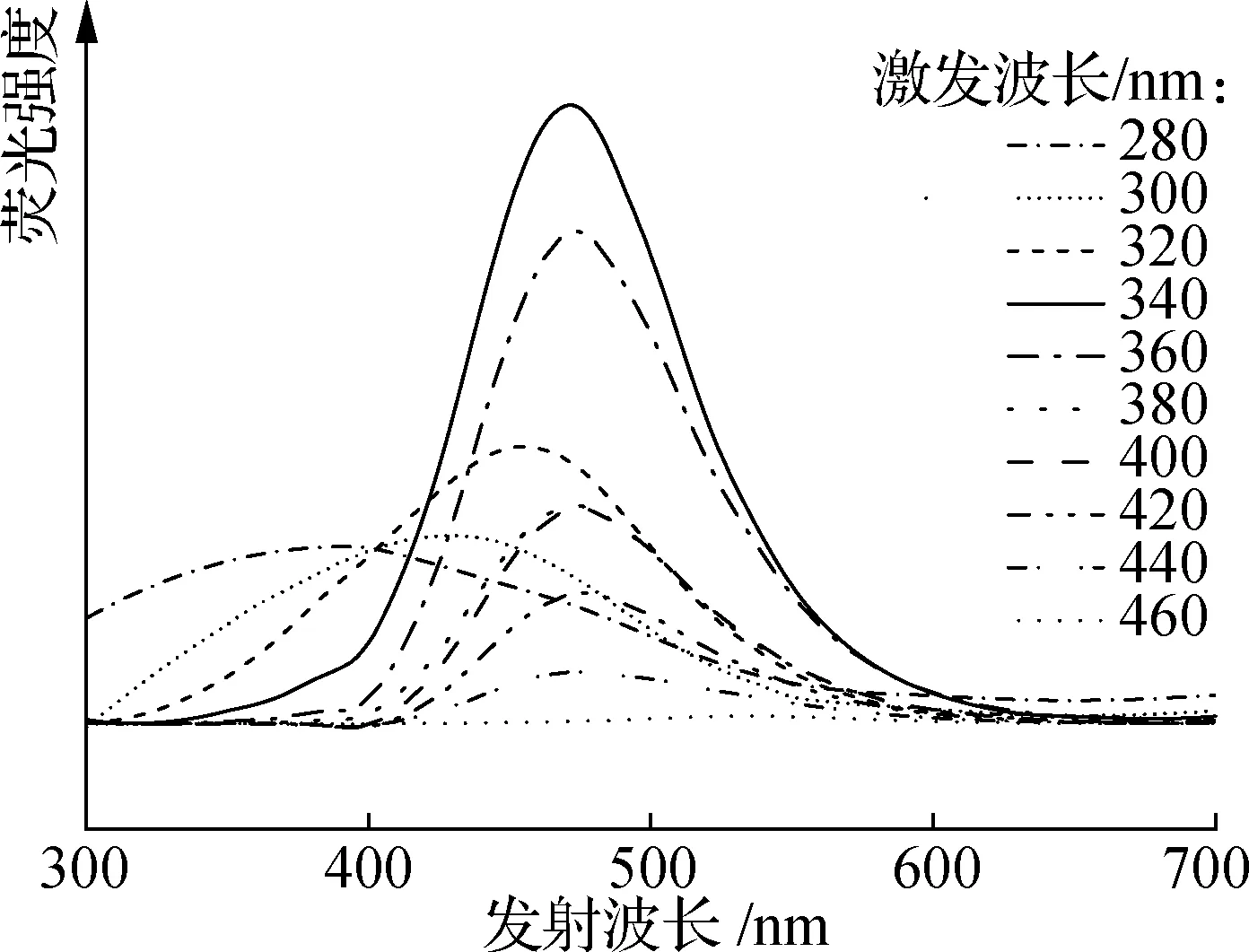
图9为2种CQDs不同激发波长下的荧光发射光谱.当激发波长从280 nm增加至460 nm,间隔为20 nm,G-CQDs的最大发射波长从392 nm红移至536 nm,B-CQDs的最大发射波长从350 nm红移至524 nm.这种激发波长依赖性是由表面杂原子官能团引起的表面缺陷和尺寸的差异造成的.2种CQDs的发光强度随着激发波长的增加均呈现先增加后降低的趋势.其中,G-CQDs在340 nm激发下获得最大发射波长为475 nm,呈现亮绿色荧光.B-CQDs在320 nm激发下获得最大发射波长为420 nm,呈现蓝色荧光,绝大部分生物质基CQDs的荧光发射都集中在蓝绿色范围[3,10].
(a) G-CQDs
2.4 多孔碳的理化特性
通过BET对SCs和PCs的比表面积和孔径分布进行研究.SCs和PCs的吸附-脱附等温线如图10所示,G-PCs对N2的吸附量大于B-PCs.所有样品均呈典型的Ⅳ型等温线的特征,存在H4型滞回环.在整个吸附过程中,所有样品的N2吸附量都随着相对压力的增大而增大.在较小的相对压力(小于0.02) 下,产物的气体吸附量呈直线性增长并达到一个较高的吸附平台,这归因于产物中大量微孔结构的吸附作用.在较高的相对压力(0.02~0.99)下,产物气体吸附量仍在增加但增速较缓,且出现明显的滞回环,这表明PCs中存在部分中孔结构.最后出现吸附终止平台,不再发生多层吸附,这与文献[21]的研究结果一致.SCs和PCs的孔径分布可以显示出更详细的信息.如图11所示,水热碳化后,微孔含量丰富,而中孔较少.在微孔(孔径不大于2 nm)区域,PCs的孔容远大于SCs.B-PCs具有超微孔(孔径小于1 nm),在一定程度上增大了比表面积.具体如表2所示,与原始SCs相比,经活化后的PCs的多孔结构有了明显的变化.其中,比表面积从G-SCs、B-SCs的157.21、82.35 m2/g增加到G-PCs和B-PCs的1 505.8、1 082.6 m2/g.总孔容Vt也从G-SCs、B-SCs的 0.08、0.04 cm3/g增加到G-PCs和B-PCs的0.74、0.51 cm3/g.G-PCs和B-PCs的孔隙结构主要以微孔形式存在,其微孔孔容Vmic分别达到了0.71和0.50 cm3/g,而中孔孔容Vmes相对很小.SCs和PCs的表面形貌通过SEM进行观察.如图12所示,G-SCs和B-SCs呈现相对光滑的大颗粒球体,而G-PCs和B-PCs则较为松散,表面有许多微孔,这样的多孔结构有利于传质和一些气体分子的吸附.总之,CQDs制备过程中产生的副产物水解碳经过活化后在吸附方面具有很大的应用价值.
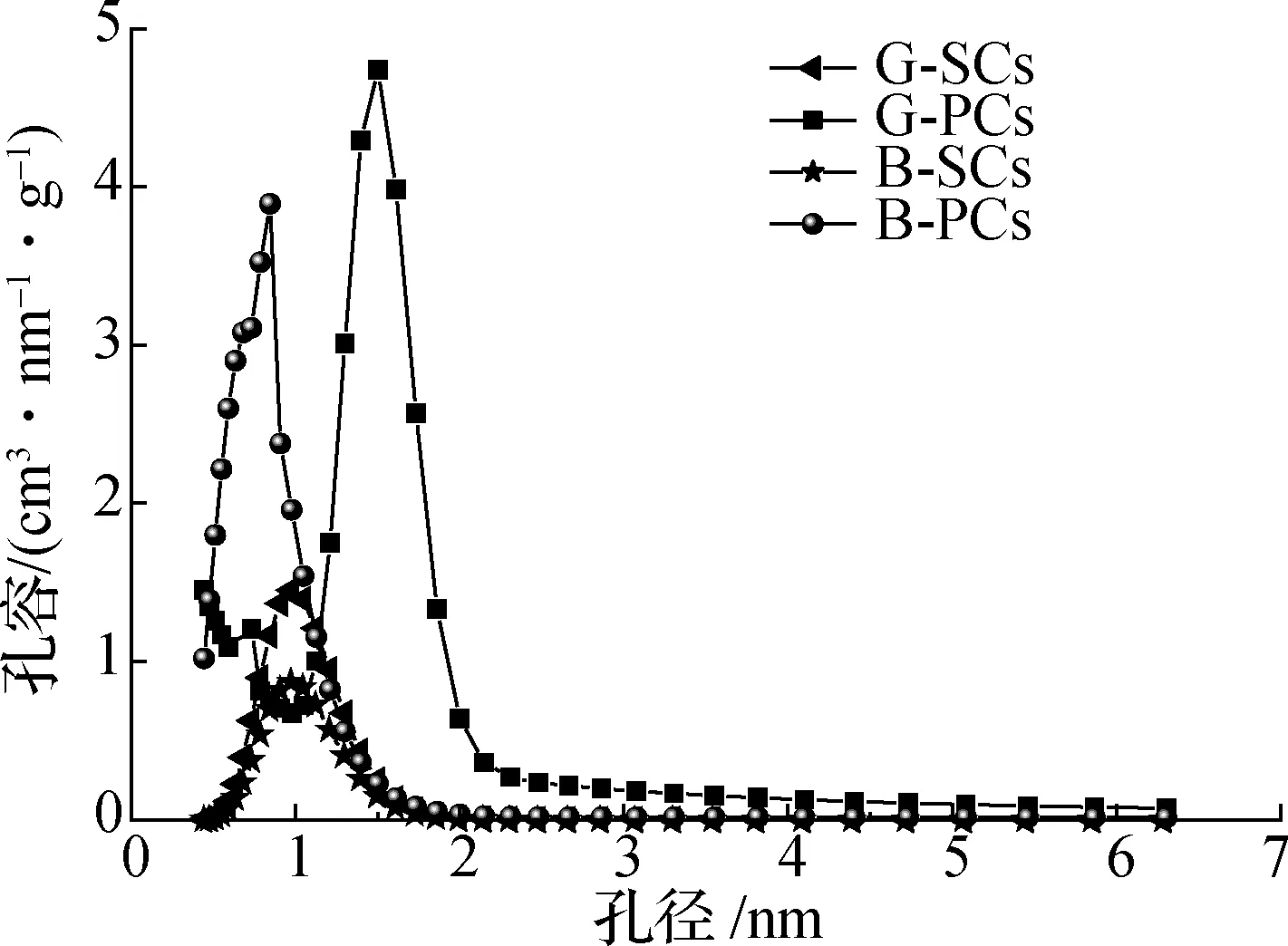
图11 PCs和SCs的孔径分布
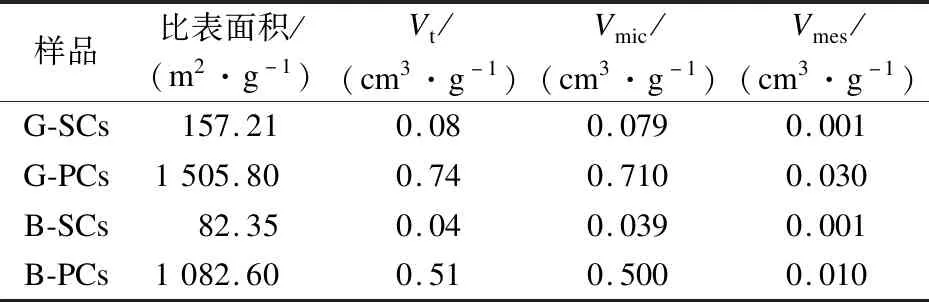
表2 SCs和PCs的比表面积和孔容

(a) G-SCs
3 结论
1)随着酸解温度从30 ℃升高至110 ℃,G-CQDs和B-CQDs的QYs均呈现先上升后下降的趋势.在酸解温度为90 ℃时,G-CQDs和B-CQDs达到最佳QYs,分别为23.7%和5.2%.CQDs的产率变化规律相似.当酸解温度为90 ℃时,G-CQDs和B-CQDs的最佳产率分别为30.6%和 15.2%,总产率高达45.8%.
2)G-CQDs在340 nm激发时发射亮绿色的荧光,而B-CQDs发射蓝色的荧光.2种CQDs荧光性能的差异可能归因于G-CQDs比B-CQDs具有更丰富的含O、N和S表面官能团,而B-CQDs结构的石墨化程度高于G-CQDs.
3)协同制备的G-PCs和B-PCs的比表面积高达1 505.8、1 082.6 m2/g,总孔容Vt分别为0.74、0.51 cm3/g.G-PCs和B-PCs的孔隙结构主要以微孔形式存在,其微孔孔容分别为0.710和0.500 cm3/g,在气体分子的吸附应用上具有很大的前景.
