鼻内滴注与气管滴注PM2.5建立大鼠急性肺损伤模型的比较研究*
2023-01-05张行行孙欠欠赵安东周甜雨刘继平
张行行,赵 麓,孙欠欠,赵安东,周甜雨,王 川,刘继平,王 斌
(陕西中医药大学,陕西省中医药管理局中药药效机制与物质基础重点研究室,陕西 咸阳 712046)
细颗粒物(particulate matter 2.5,PM2.5)是指空气动力学直径小于2.5 μm的大气颗粒物,是目前我国空气污染物的主要组成。近年来空气污染成为社会性热点。由于PM2.5粒径极小,可以经鼻腔、呼吸道而到达肺,一部分在上呼吸道和肺泡腔沉积引起肺部损伤和炎症反应[1],另一部分经肺循环进入全身血液,引起严重的心血管疾病[2]。相关研究表明,大气中PM2.5水平与呼吸系统疾病发病率及死亡率密切相关,大气中PM2.5浓度每增加10 μg/m3,哮喘病患者人数增加1.5%[3];动物实验结果也表明,急性或慢性暴露于PM2.5均能引发肺部炎症[4-5]。因此,PM2.5对人体健康的危害程度远大于其他粒径较大的颗粒物,也成为一个研究热点,使得高效、简易、计量准确的造模方法成为研究该领域的迫切需要。
气道染毒是构建肺部损伤模型、研究呼吸系统疾病的重要手段,而目前气道染毒没有统一的方式,常用的气道给药方式包括暴露式气管滴注、非暴露式气管滴注和鼻内滴注[6]。通过这3种方式给予PM2.5均能造成肺损伤,但暴露式气管滴注需暴露组织,且适用于单次染毒,故不在本次实验研究范围。非暴露式气管滴注通过气管插管将PM2.5混悬液直接注射入肺腔导致肺损伤,而鼻内滴注利用重力和大鼠呼吸吸入使PM2.5到达肺部而引起肺损伤。因此,本课题组拟通过对比这2种方式给予相同剂量PM2.5混悬液对大鼠Th2应答影响,为研究呼吸系统疾病染毒方式的选择提供参考。
材料和方法
1 动物
24只SPF级SD大鼠,雄性,(220±20)g,购自成都达硕实验动物有限公司[许可证号为SCXK(川)2020-030],饲养于陕西中医药大学中药药理实验动物房内,温度23~25℃,相对湿度45%~55%,自由摄食与饮水,昼夜各半,适应性饲养1周。实验过程中对动物的处置符合《实验动物福利伦理审查指南》(GB/T 35892-2018)、《关于善待实验动物的指导性意见》及陕西中医药大学伦理委员会规定和相关管理条例。
2 主要试剂和仪器
白细胞介素6(interleukin-6,IL-6)和转化生长因子β(transforming growth factor-β,TGF-β)ELISA试剂盒,以及酸性磷酸酶(acid phosphatase,ACP)、碱性磷酸酶(alkaline phosphatase,AKP)和乳酸脱氢酶(lactate dehydrogenase,LDH)标准比色试剂盒均购于武汉博士德生物科技有限公司;IL-17和TGF-β抗体均购于武汉赛维尔生物科技有限公司;HE染液购于南昌雨露实验器材有限公司;RNA提取、反转录及实时荧光定量PCR试剂盒均购于均购自TaKaRa;戊巴比妥钠购于天津兰洪新能源科技有限公司。
DNP-9052恒温箱(上海精宏试验设备有限公司);PW-812洗板机(深圳市汇松科技发展有限公司);SH01D高速离心机(上海知信实验仪器技术有限公司);XH-C漩涡混合器(江苏大唐医疗器械有限公司);Multiskan FC酶标仪(Thermo Fisher);TH-1000CⅡ智能大流量空气颗粒采样器(武汉市天虹仪表有限责任公司);Scientz-10N型真空冷冻干燥机(宁波新艺生物科技股份有限公司);TKY-TKB摊片烤片机(湖北泰康医疗设备有限公司);RM2235石蜡切片机(Leica);BX53光学显微镜(Olumpus);XMP102H型超声波清洗机(昆山超声仪器有限公司);UPHW-Ⅱ-90T超纯水机(成都超纯科技有限公司);Exicycler 96实时荧光定量PCR仪(Bioneer)。
3 PM2.5的采集与处理
于陕西中医药大学四号教学楼楼顶,使用天虹大流量采样器采集大气PM2.5于玻璃纤维膜上,采样高度为20 m。将载有PM2.5的玻璃纤维膜剪掉边缘部分,裁剪为1 cm×1 cm大小,分装于50 mL离心管中,加入纯水至40 mL,低温超声震荡60 min,将PM2.5洗脱,1 800目筛过滤,滤液真空冷冻干燥,4℃保存备用。临用前,称取适量PM2.5溶于生理盐水,配成50 g/L混悬液,紫外灯下照射30 min。
4 方法
4.1 气管滴注操作方法将19G号灌胃器针头处磨平至圆滑,与1 mL医用注射器组成进样器,乙醚麻醉大鼠后(麻醉深度以用有齿镊捏夹大鼠皮肤或脚趾无收缩反应为准),迅速呈仰卧位固定于自制鼠板上,四肢和上切牙均用橡皮筋固定,直立鼠板,使大鼠头部朝上垂直于桌面,用组织镊将大鼠舌头向嘴角一侧拉出口腔直至感觉阻力,插入可视采耳棒,调整角度,使大鼠口腔环境呈现于手机或其他智能设备上,再插入进样器,使灌胃器针头部插入气管口1 cm左右,缓慢推注所需剂量PM2.5混悬液,滴注完成后立即拔出插管,保持大鼠直立,并轻轻左右晃动5 s,使混悬液扩散均匀,大鼠呼吸带有湿啰音说明滴注成功,放回鼠笼内待苏醒。注射器量取所需PM2.5混悬液时,可额外抽取0.5 mL空气,然后手指轻堵灌胃针口,将药液甩至空气底部,注入空气可使滴注液向肺组织深处扩散。见图1。

Figure 1.Operation process of unexposed tracheal instillation in rats.A:experimental equipment;B:a fixed rat;C:a view of the throat.图1大鼠非暴露式气管滴注操作过程
4.2 动物分组及给药24只SD大鼠随机分为对照组(control)、鼻内滴注组(nasal)和气管滴注组(tracheal),每组8只。其中,nasal组大鼠无需麻醉,抓取固定大鼠后,用10~100 μL移液枪吸取200 μL/kg的PM 2.5混悬液(10 mg/kg),缓慢滴入大鼠鼻腔,使其自然吸入呼吸道进行染毒;tracheal组大鼠经乙醚麻醉后,按4.1所述方法滴注200 μL/kg的PM2.5混悬液(10 mg/kg)。滴注每3 d一次,共10次。
4.3 观察一般情况观察滴注期间各组大鼠活动、毛色、饮食和呼吸状态,记录大鼠体重、滴注量、所需时间(气管滴注从开始麻醉算)、一次滴注成功率和终成功率。
4.4 血清中IL-6和TGF-β含量的测定末次染毒完成后,禁食12 h,大鼠麻醉后,腹主动脉取血,室温静置30 min,3 000 r/min离心10 min,收集上清液。采用ELISA检测IL-6和TGF-β含量,操作步骤严格按照试剂盒说明书进行。用酶标仪测定450 nm处的吸光度,绘制标准曲线,计算实际样品中IL-6和TGFβ水平。
4.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中ACP、AKP和LDH活性的测定取血处死大鼠后,结扎左侧支气管,采用5 mL注射器分三次吸取10 mL预冷的PBS对大鼠右肺进行灌洗(回收率达80%为合格),4℃、3 000 r/min离心10 min,回收上清液,按照试剂盒操作步骤检测各样本中ACP、AKP和LDH活性。
4.6 肺组织病理学观察收集完BALF后,取右上肺组织置于4%多聚甲醛溶液中固定,石蜡包埋,切片,HE染色,中性树脂封片,于光学显微镜下观察病理变化。
4.7 肺组织中TGF-β和IL-17蛋白表达的检测取肺组织蜡块,在二甲苯溶液中脱蜡,并在梯度递减的乙醇溶液中水化,然后用柠檬酸盐抗原修复溶液处理切片,用0.5% Triton X-100溶液透化20 min,用3%H2O2溶液孵育,5%牛血清白蛋白封闭20 min,再与IL-17和TGF-β抗体(1∶500)37℃下温育1 h,PBS洗涤后,将切片与羊抗兔IgG(1∶1 000)在37℃温育20 min,经DAB显色、复染、脱水、透化、固定后,显微镜下观察,并封片、拍照,以ImageJ软件测定平均积分吸光度。
4.8 肺组织中IL-17和叉头框蛋白P3(forkhead box protein P3,Foxp3)mRNA表达的测定取各大鼠余下肺组织,TRIzol试剂提取大鼠肺组织总RNA,紫外分光光度测定RNA浓度及鉴定纯度;PrimeScript RT kit将0.5 μg总RNA反转录成cDNA。以cDNA为模板,用Exicycler 96实时荧光定量PCR仪检测mRNA表达。以β-actin为内参照,用2-ΔΔCt法计算IL-17和Foxp3的mRNA相对表达量。引物序列见表1。
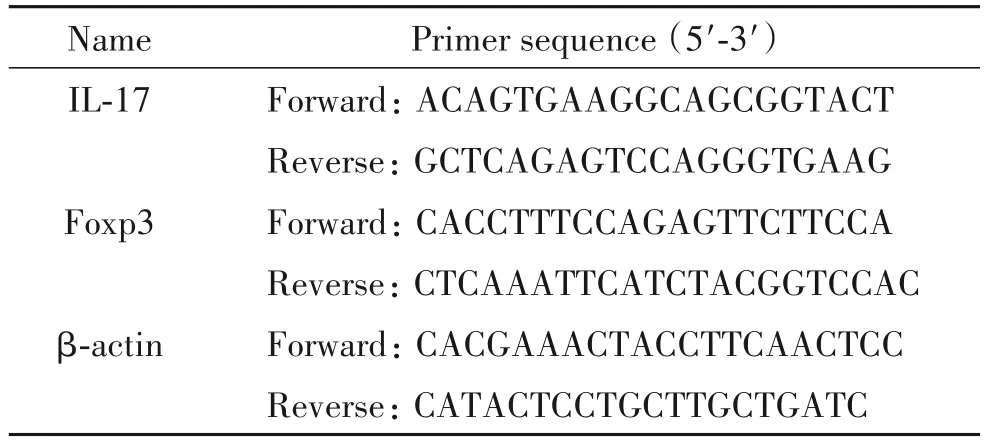
表1 引物序列Table 1.The primer sequences
5 统计学处理
采用SPSS 26.0软件进行分析。计量资料均符合正态分布,以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析;两两比较,数据方差齐用LSD法,方差不齐用Tamhane T2法。以P<0.05为差异有统计学意义。
结 果
1 一般情况
滴注过程中,control组大鼠毛色、饮食和行动正常,呼吸顺畅平稳,无其他明显异常状态;nasal组和tracheal组大鼠在滴注4次后毛色变暗、呼吸急促、变得暴躁,且随着染毒次数的增多,上述症状逐渐加重,但饮食未见明显异常。3组大鼠体重增长情况良好,无显著差异(P>0.05);nasal组和tracheal组大鼠滴注操作时间、一次成功率和终成功率见表2。滴注过程中,鼻内滴注组4号死亡,解剖发现肺部病变,但不能确定具体死因。

表2 滴注过程中大鼠一般情况Table 2.General conditions of rats during instillation(Mean±SD)
2 肺组织病理学观察
HE染色结果显示,control组大鼠肺组织结构完整清晰,肺泡腔内无渗出物,肺间质无水肿,肺泡间隔均匀且光滑,未见明显的病理变化和炎性细胞浸润;与control组相比,nasal组大鼠肺组织部分肺泡结构被破坏,伴有程度不一的萎缩及扩张,腔内可见少量炎症细胞及红细胞浸润;tracheal组大鼠肺组织可见肺泡结构明显破坏,肺泡间隔明显增厚,肺水肿、肺出血,以中性粒细胞为主的炎症细胞在肺组织内大量浸润,肺部正常的组织形态结构消失,提示tracheal组大鼠肺部损伤较nasal组更为严重,见图2。
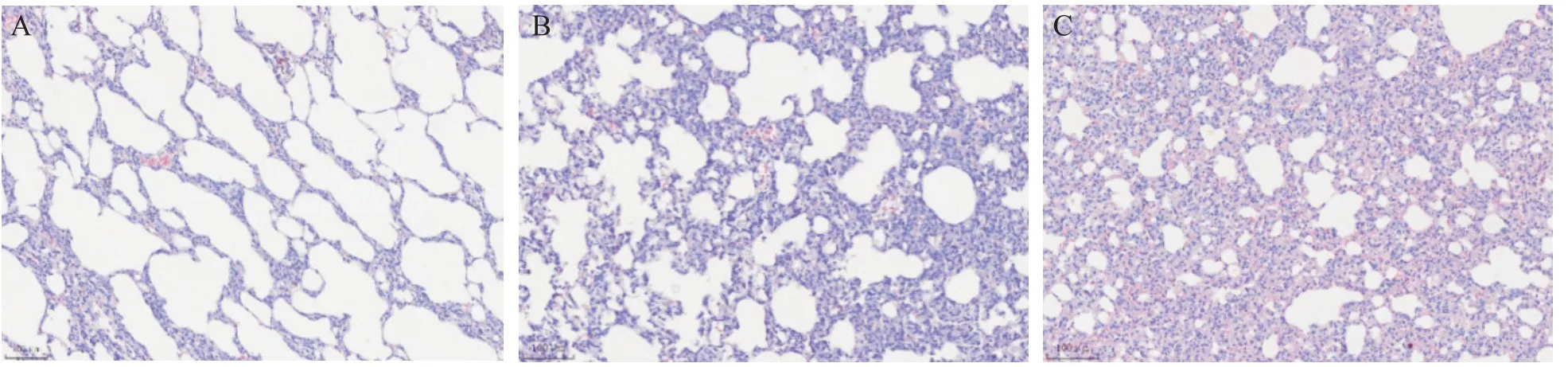
Figure 2.Histopathological examination of SD rat lungs(HE staining,×100).A:control group;B:nasal group;C:tracheal group.图2 SD大鼠肺组织病理学检查
3 BALF中ACP、AKP和LDH活性
与control组 比 较,nasal组 和tracheal组 大 鼠BALF中的ACP、AKP和LDH活性均显著升高(P<0.05);两种不同部位滴注相比,tracheal组大鼠BALF中ACP活性显著较nasal组高(P<0.05),但AKP和LDH活性无显著差异(P>0.05),见图3。
4 血清中IL-6和TGF-β含量
与control组比较,nasal组和tracheal组大鼠血清IL-6含量显著升高,TGF-β含量显著下降(P<0.05);两组不同部位滴注组相比,tracheal组大鼠血清IL-6含量显著较nasal组高(P<0.05),但TGF-β含量无显著差异(P>0.05),见图4。
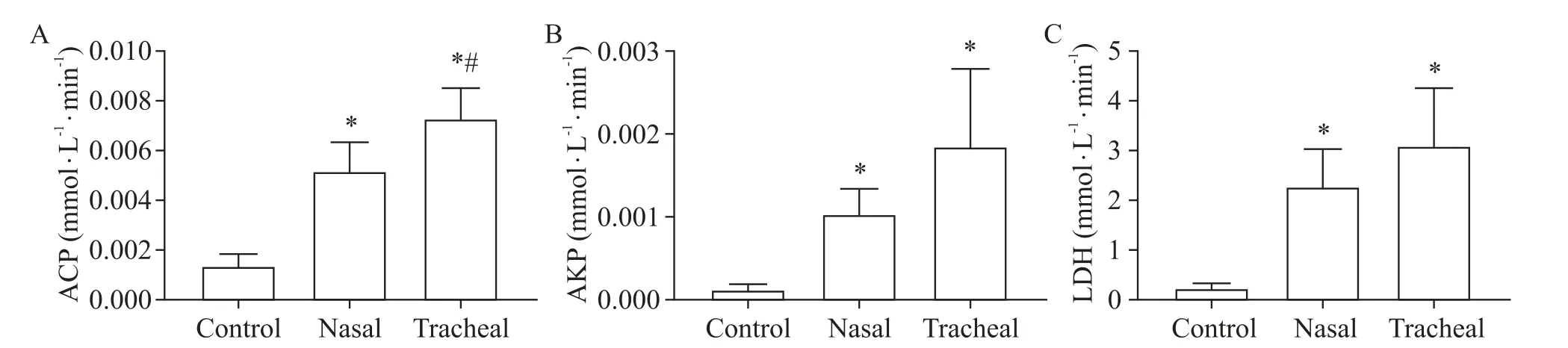
Figure 3.Effects of intranasal and tracheal instillation of PM2.5 suspension on the activity of ACP,AKP and LDH in BALF of rats.Mean±SD.n=8 in control and tracheal groups;n=7 in nasal group.*P<0.05 vs control group;#P<0.05 vs nasal group.图3鼻内滴注和气管滴注PM2.5混悬液对大鼠BALF中ACP、AKP和LDH活性的影响
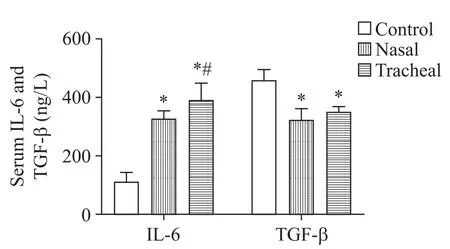
Figure 4.Effects of intranasal and tracheal instillation of PM2.5 suspension on the serum levels of IL-6 and TGF-β in rats.Mean±SD.n=8 in control and tracheal groups;n=7 in nasal group.*P<0.05 vs control group;#P<0.05 vs nasal group.图4鼻内滴注和气管滴注PM2.5混悬液对大鼠血清中IL-6和TGF-β含量的影响
5 肺组织IL-17和TGF-β的蛋白表达
与control组比较,nasal组和tracheal组大鼠肺组织中IL-17蛋白表达显著升高,TGF-β蛋白表达显著下降(P<0.05);两组不同部位滴注组相比,IL-17蛋白表达无显著差异(P>0.05),tracheal组TGF-β蛋白表达较nasal组显著下降(P<0.05),见图5。
6 肺组织IL-17和Foxp3的mRNA表达
与control组比较,nasal组和tracheal组大鼠肺组织中IL-17 mRNA表达量和Th17/Treg比值显著升高(P<0.05),Foxp3 mRNA表达量显著下降(P<0.05);与nasal组相比,tracheal组大鼠肺组织中IL-17和Foxp3的mRNA表达分别有升高和下降的趋势,但无显著差异(P>0.05),Th17/Treg比值显著升高(P<0.05),见图6。
讨 论
近些年来,多位研究者相继建立了多种气道染毒方法,主要包括暴露式气管滴注、非暴露式气管滴注和鼻内滴注。暴露式气管滴注需要分离颈部皮肉,利用医用注射器直接将药液注射入气管,成功率高,剂量准确,但易造成感染,有少量死亡,且适用于单次染毒;非暴露式气管滴注需要将大鼠麻醉,通过气管插管将滴注液输送到肺部,无需手术切口暴露气管,染毒剂量准确且对实验动物伤害较小,可进行多次染毒,但一般需要光纤、喉镜、头戴式放大镜、内窥镜等特殊设备,部分仪器价格过高,且对操作者的技能要求较高;鼻内滴注通过采用移液枪或小量程注射器将药液液滴缓慢滴至鼻腔,利用重力和大鼠呼吸吸入,模拟了正常呼吸途径染毒,但操作过程耗力,大鼠喷出引起剂量不准确,且多次染毒后,易造成鼻腔肿胀,大鼠变得脾气暴躁,操作难度加大。因此,本实验选择能长期多次滴注的非暴露式气管滴注和鼻内滴注,开展两种滴注方式构建的肺损伤模型的比较研究,对研究PM2.5损伤呼吸道疾病提供参考。在本次实验中,随着滴注时间的延长,nasal组大鼠鼻腔开始肿大,性情狂躁,且因体型增大,在只用手抓取固定过程中,大鼠挣扎,难以控制。而tracheal组,待操作人熟练了后,麻醉后从固定到插管滴注只需要十几秒,大多数时间花费在大鼠的麻醉上,但麻醉过程乙醚浓度过高,易引起大鼠呼吸衰竭和循环障碍,造成死亡,需把握好乙醚浓度和麻醉时间。
多项研究表明,PM2.5随呼吸进入呼吸道和肺部以后,可在呼吸道沉淀积累,通过氧化应激或炎症损伤等机制破坏肺泡腔血管基底膜和毛细血管膜结构,改变肺泡细胞膜形态结构和功能,增加细胞膜通透性,导致细胞内各种蛋白酶等内容物漏出[7]。通过检测BALF中的ACP、AKP和LDH水平,可反映肺组织细胞膜受损程度[8]。本次实验中,相较于control组,nasal组和tracheal组BALF中ACP、AKP和LDH活性显著增加,这表明两种滴注组大鼠肺部结构破坏,肺组织细胞膜通透性增加。肺组织病理学观察也显示肺泡结构被破坏,肺间质明显增厚,大量炎症细胞浸润,亦表明该染毒组大鼠肺部出现了严重的病理损伤。但两种染毒组大鼠肺损伤程度存在一定差异,tracheal组大鼠肺损伤程度较nasal组更为明显,推测是鼻内滴注过程中,鼻腔内黏膜组织吸附了一部分的颗粒物,使实际进入到肺组织的颗粒物减少,这也致使了该组大鼠鼻腔肿胀,但此方法模拟了正常呼吸道发病过程,而气管滴注是直接将PM2.5混悬液送至气道,到达肺组织,没有经过从鼻、呼吸道到肺的过程,损伤更为显著。

Figure 5.Effects of intranasal and tracheal instillation of PM2.5 suspension on the protein expression of IL-17 and TGF-β in rat lung tissues(immunohistochemical staining,scale bar=20 μm).Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs nasal group.图5鼻内滴注和气管滴注PM2.5混悬液对大鼠肺组织IL-17和TGF-β蛋白表达的影响
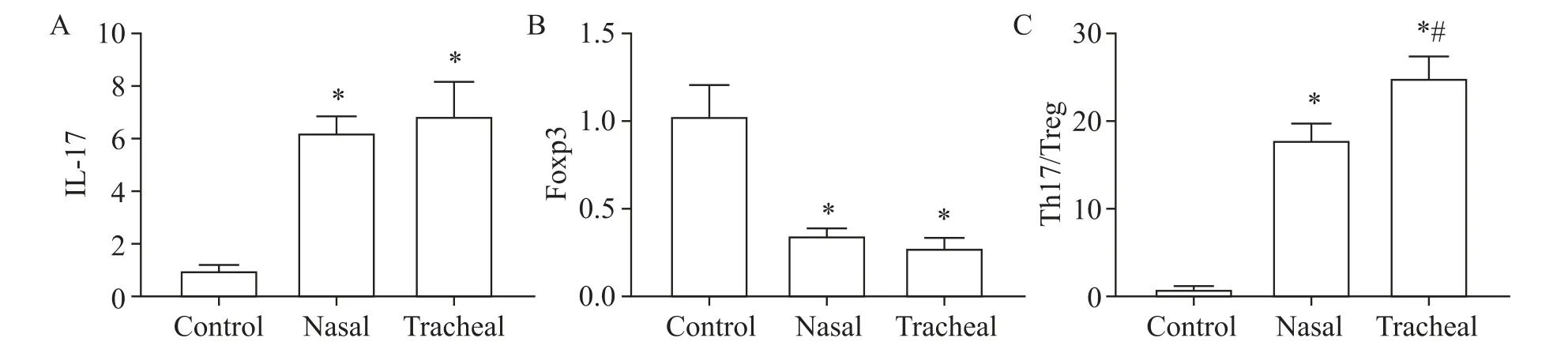
Figure 6.Effects of intranasal and tracheal instillation of PM2.5 suspension on the mRNA expression of IL-17 and Foxp3 in rat lung tissues.A:the mRNA expression of IL-17;B:the mRNA expression of Foxp3;C:the ratio of IL-17(representing Th17 cells)/Foxp3(representing Treg cells).Mean±SD.n=8 in control and tracheal groups;n=7 in nasal group.*P<0.05 vs control group;#P<0.05 vs nasal group.图6鼻内滴注和气管滴注PM2.5混悬液对大鼠肺组织IL-17和Foxp3 mRNA表达的影响
Th17和Treg均由CD4+T淋巴细胞分化而来,在正常条件下,Th17和Treg的动态平衡调节体内自身免疫,而在肺损伤等呼吸系统炎症性疾病的发生发展过程中均发现伴随Th17/Treg平衡的失调[9]。Th17细胞可以释放IL-17,促进T细胞增殖和IL-6等炎症介质的表达,增强Th2应答;而Treg细胞主要通过分泌抗炎细胞因子发挥免疫抑制作用,并可与Th17细胞相互拮抗。Foxp3是识别Treg细胞的常规标志物,是Treg细胞分化和表达功能的关键因子,可通过分泌TGF-β等抑炎因子,减轻炎症浸润,促进病毒清除,避免过度非特异免疫应答,抑制Th2应答,在抵抗胞外病原体入侵和抑制自身免疫中起着保护作用[10-12]。本次实验结果表明,相较于control组,nasal组和tracheal组大鼠血清中IL-6和TGF-β含量显著升高;肺组织中IL-17的蛋白和mRNA表达及Th17/Treg比值显著升高,TGF-β蛋白和Foxp3 mRNA表达量显著下降,提示两种方式滴注PM2.5混悬液均能引起肺部炎症反应,加强Th2应答;但两种滴注方式相比,tracheal组大鼠血清中IL-6表达量和肺组织中Th17/Treg比值较nasal组显著升高,TGF-β蛋白表达降低,其余指标无显著差异。
综上所述,鼻内滴注和气管滴注PM2.5混悬液均能增加肺泡细胞膜和肺泡上皮-毛细血管膜通透性,导致细胞内各种蛋白酶等内容物漏出,对肺泡细胞产生毒作用;此外,还可增加促炎细胞因子的产生,使Th17/Treg比值升高,加强Th2应答,导致肺部炎症损伤,进一步促进肺部损伤或肺部乃至多器官的衰竭。两种滴注方式相比,本研究所采用的利用可视挖耳勺代替内窥镜的气管内滴注法具有剂量准确、可视等优点,所构建的模型大鼠肺损伤更加明显,但忽略了ALI正常发病过程;鼻内滴注法具有无需麻醉、易上手、无需借助其他工具、模拟了ALI正常发展过程等优点,但对操作者较为耗费精力,且剂量不准确。两种滴注方式具体在剂量和时间上对大鼠肺组织损伤影响的差异,还需进一步研究。
