铜过载介导骨骼肌萎缩的机制及治疗新进展*
2023-01-05邓云锋范晶晶
杨 威,李 畅,邓云锋,胡 昊,王 娟,范晶晶△
(1武汉体育学院运动医学院,湖北武汉430079;2长沙卫生职业学院公共教学部,湖南长沙410100;3湖北省中医院脊柱外科,湖北武汉430074)
铜是一种必需的微量元素,同时也是一种过渡金属,具有氧化还原属性,通过接受和转移电子并以离子形式参与所有的生物学事件,对哺乳动物的能量代谢、活性氧去除、铁吸收和信号转导等生命过程至关重要[1]。铜的内稳态受肝脏代谢的严格调控,在糖尿病、肥胖、心力衰竭、神经退行性疾病、肿瘤等病理状态下表现为含量显著升高即铜过载;铜过载是细胞内铜代谢失衡而呈现出铜离子毒性的病理过程,是多种疾病干预的重要靶点[2-6]。作为人体内最大的氨基酸储存库,骨骼肌在动力输出和姿势维持上具有不可替代的决定作用,其关键组成部分肌蛋白和线粒体对外界刺激信号高度敏感,在多种病理状态下铜过载和肌萎缩同步发生[7-12],据此推测铜代谢异常可能与骨骼肌萎缩存在着某种机制关联。目前,铜过载介导的骨骼肌萎缩的潜在机制尚不完全清楚,而多种用于降低机体铜离子水平的铜螯合药理学技术有显著发展,我们在此梳理并绘制了铜过载介导肌萎缩的相关机制图谱,为临床上运用铜螯合技术治疗和缓解骨骼肌萎缩提供机制线索。
1 骨骼肌萎缩发生及机制
骨骼肌萎缩是多种慢性疾病如肥胖、糖尿病、心力衰竭、毒品成瘾等的常见并发症,病理学表现为肌肉的质量丢失和力量衰退,其发病机制复杂,可能与蛋白质代谢失衡、神经肌肉接头失活、线粒体丢失等密切联系[13]。肌萎缩不仅影响人类的正常步态和运动能力,严重威胁生活质量,还关联着多种疾病的发生、进展及预后,决定着多种慢性疾病状态下的死亡率[14]。目前的研究显示,拮抗病理状态下的骨骼肌萎缩是治疗某些疾病本身的间接疗法[15]。因此,探寻骨骼肌萎缩的新型干预靶点(如铜代谢)而有益于其治疗显得尤为重要。
骨骼肌是以氨基酸为基本组成单位、富含线粒体的运动器官,在正常成人中约占身体质量的40%,其质量维持是骨骼肌发挥代谢功能的物质基础。骨骼肌可对外界病理刺激信号做出响应并形成萎缩表型,肌蛋白质和线粒体的稳态失衡是其发生萎缩的根本诱因[16]。正常生理状态下,骨骼肌蛋白质处于不断合成与降解的动态平衡中,同时线粒体通过不断融合与分裂实现其质量控制,病理条件能够打破相关的代谢平衡,诱导肌蛋白的降解多于合成、线粒体的分裂多于融合,即发生肌萎缩。这些代谢程序涉及到不同的调控机制,其中骨骼肌蛋白质合成主要依靠生长因子(如睾酮、生长激素、胰岛素样生长因子)介导的促合成信号,降解则主要依靠泛素-蛋白酶体、自噬、凋亡以及钙蛋白酶的活动等降解途径;线粒体的融合与分裂则是通过各自的上游靶点蛋白即线粒体融合蛋白和分裂蛋白的动态平衡来予以精确控制[17]。这些机制信号是骨骼肌萎缩治疗药物研发的关键理论基础。
2 铜过载与骨骼肌萎缩
2.1 骨骼肌中铜的来源及作用铜是机体内多种必需酶的辅助因子,以离子形式参与细胞内所有的生化反应,对于维持器官的正常代谢至关重要,细胞内铜离子代谢稳态接受铜转运体和伴侣蛋白的共同调控,其中转运体基因7A型铜离子转运ATP酶(copper-transporting ATPase 7A,ATP7A)和7B型铜离子转运ATP酶(copper-transporting ATPase 7B,ATP7B)的突变会导致铜缺失和铜过载而诱发Menkes病和肝豆状核变性(Wilson病)[18]。外源性铜是机体内铜的主要来源,主要通过食物获取,这种蛋白结合型的食源性有机铜可经消化道细胞吸收至体内。铜代谢主要包含两个代谢阶段:第一阶段,食源性铜在人体小肠部位吸收并进入血液与血清中的小分子如组氨酸、α2-巨球蛋白、白蛋白等相结合形成铜贮存池;第二阶段,铜贮存池中的铜离子大部分经门静脉入肝经过加工以铜蓝蛋白的形式进入血液循环并转运分配至全身的铜依赖器官[19],包括大脑和骨骼肌,剩余部分的铜在血清中依然以与小分子相结合的形式存在。铜蓝蛋白的降解通常也在肝脏中进行,肝内皮细胞可通过转胞吞作用捕获血清中的铜蓝蛋白,导致其寡糖N端处的唾液酸残基完整去除,脱唾液酸化的铜蓝蛋白通过脱唾液酸糖蛋白受体的作用随后被排入狄氏间隙并被肝细胞所内吞,通过肝细胞溶酶体的降解作用并释放出铜离子;为了维持铜离子代谢平衡,多余的铜离子可通过肝脏外排进入胆汁并被胆汁酸盐所固化并排出体外,这是铜外排的主要途径[20]。
铜离子不仅对于成肌细胞的增殖和分化必不可少,对于分化后的肌细胞维持正常的代谢稳态也至关重要[21]。作为一种重要的静态辅助因子,铜离子可利用自身的氧化还原属性参与多种铜酶(如氧化还原酶、加氧酶、羟化酶、转移酶等)的构建和形成,这些酶类可利用灵活的活化位点来最大化电子转移和传递。最经典的铜酶是细胞色素C氧化酶(cytochrome C oxidase,CCO),作为电子传递链的终端酶,可通过细胞色素C的氧化和氧的还原来耦合电子传递,加强质子泵在线粒体膜上的穿梭促进ATP的生成[22]。伴随着电子传递过程是氧化压力的产生,肌细胞中抵御氧化压力的重要铜酶是位于胞质中的Cu,Zn超氧化物歧化酶(Cu,Zn superoxide dismutase,SOD1),该酶可利用一个铜离子催化超氧化物的歧化反应,从而抑制氧化应激对细胞的损伤。铜离子在细胞中的另一个存在部位是铜分泌通路的相关机制途径,如高尔基体反面网状结构(trans-Golgi network,TGN)、内吞溶酶体、分泌颗粒和铜储存囊泡,铜分泌通路使不同类型的细胞激活铜依赖性激酶执行不同的功能。此外,在某些铜依赖细胞中铜离子还可以调节激酶如Unc-51样蛋白激酶1/2(Unc-51-like protein kinase 1/2,ULK1/2)、丝裂原活化蛋白激酶激酶1(mitogen-activated protein kinase kinase 1,MEK1)和 磷 酸 二 酯 酶3B(phosphodiesterase 3B,PDE3B)的活性,从而影响自噬相关基因(autophagyrelated genes,ATGs)的表达、自噬体的形成、增殖和代谢活动[20],其中某些激酶可能涉及到铜过载诱导的骨骼肌细胞萎缩相关信号通路[23]。
2.2 骨骼肌中铜离子代谢的调控骨骼肌是铜离子高度依赖且代谢旺盛的器官,同时也是铜的主要分布器官[24]。需铜性器官(包括骨骼肌)对铜离子的摄取遵循共同生理原则,由细胞内铜转运体(copper transporter,CTR)和铜伴侣蛋白共同调控,其中铜转运体(CTR1、CTR2和CTR3)负责铜离子的摄取,将经细胞膜上特定还原酶还原的铜离子跨膜转运至胞内。另两种铜转运体ATP7A和ATP7B的表达具有组织差异性,除了肝细胞,在大多数细胞中ATP7A的表达比ATP7B要丰富[24],两者主要负责胞内铜离子的分布、储存和排出。铜伴侣蛋白则可以与胞内铜离子相结合而抵消中和其毒性并将其传递给特定的靶蛋白,最重要的三种铜伴侣蛋白包括细胞色素C氧化酶17(cytochrome C oxidase 17,COX17)、抗氧化1铜伴侣(antioxidant 1 copper chaperone,ATOX1)和超氧化物歧化酶型铜伴侣(copper chaperone for superoxide dismutase,CCS),不同的铜伴侣蛋白在胞内介导不同的铜离子传递通路。
铜离子在骨骼肌中的代谢涉及铜转运体和铜伴侣蛋白的调控,其中CTR1、ATP7A和ATP7B已被证明在骨骼肌细胞广泛表达[25]。CTR1是最重要的铜摄入转运蛋白,而CTR2的表达具有细胞特异性,可能更多地涉及到细胞内的铜离子转运,但在肌细胞中的表达情况及其调节铜离子摄入的相关机制尚不清楚。人类的CTR1由190个氨基酸和含有特定的金属连接序列的片断组成,其中的蛋氨酸43和45区域是介导铜离子摄取的关键[26],可通过内吞和离膜性位置迁移来调节膜上CTR1的表达和丰度调控细胞铜离子摄取,当胞内铜离子含量升高时,细胞会增强网格蛋白(clathrin)和发动蛋白(dynamin)依赖的内吞作用,降低细胞膜上CTR1的丰度,同时会向远离膜边缘的方向进行位置迁移,两方面共同作用可抑制细胞对铜离子的捕获和摄取[24],避免铜过载对细胞的损伤,这种自动化感应机制可能是通过特异蛋白1(specificity protein 1,Sp1)作为中间物来介导完成的[27]。铜离子通过CTR1入胞后与其分离,随后利用不同的铜伴侣蛋白介导多种铜离子传递途径,其中COX17和非蛋白配体CuL对线粒体靶向的铜离子传递发挥纽带作用。COX17通过还原其自身的半胱氨酸残基与铜离子结合,将铜离子传递至线粒体膜间隙,并与两种细胞色素C氧化酶合成蛋白(synthesis of cytochrome C oxidase proteins,SCO)——SCO1和SCO2相互作用参与CCO代谢途径[28];胞质中的CuL与铜离子结合后可穿过线粒体外膜进入膜间隙,用于CCO的装配、SOD1的成熟及线粒体的进一步摄取和储存[22],两者可共同调控线粒体的铜离子代谢平衡。此外,ATOX1可将铜离子传递至分泌途径膜结构处的ATP7A和ATP7B的N端区域,增强铜离子分泌途径的转运活动,并调节铜离子在细胞内的分布[29]。CCS通过形成一种高度特异性的复合物将铜离子传递至SOD1,并在特异性位点完成金属取代和双硫键的形成,拮抗超氧化物对细胞的损伤[30]。细胞内铜离子的分布主要是通过ATP7A和ATP7B在胞内TGN、内吞体、黑色体等不同结构间的跨膜转运,这一步骤对于铜酶的激活、铜离子的储存及过量铜离子的排出至关重要,是细胞内铜稳态调控的关键[31]。
2.3 铜过载的可能机制细胞内的铜离子摄取和外流在相关蛋白包括Ctr1、ATP7A及ATP7B的调控作用下维持着精确的动态平衡,当铜离子摄取作用优于外流作用时,即可发生铜过载。铜过载是铜离子代谢发生机制障碍而呈现铜毒性的生物学事件,其涉及到多种人类疾病如神经退行性疾病、心血管疾病、癌症等[32]。目前铜过载的准确调控机制尚不清晰,可能涉及到多种不同的信号通路及分子机制,是铜代谢生理学亟待解决的关键问题之一。衰老是铜过载发生的相关病理模型,为病理状态下细胞内铜过载提供了机制线索[33]。正常生理状态下,胞外铜过载会引起胞内铜稳态调控相关的应答机制反应:一方面网格蛋白和发动蛋白依赖的内吞作用增强,降低细胞膜上铜转动体CTR1的丰度并使其向远离膜边缘的方向进行位置迁移,从而抑制细胞对铜离子的捕获和摄取,减少铜离子的入胞效应,另一方面,铜转运体ATP7A及ATP7B会加强对铜离子的排出代谢活动,两者共同作用维持细胞内的铜稳态,避免铜过载的发生[24]。多种慢病状态下可见循环性铜蓝蛋白的显著增加,从而对骨骼肌细胞形成胞外铜过载,病理状态可能通过破坏上述铜稳态维持机制导致铜离子摄取和排出代谢障碍,进而诱发胞内铜过载,氧化还原失衡和自噬功能障碍可能涉及到这一途径[33]。由此可见,铜过载不是单一因素的调控结果,而是多种信号级联事件的共同作用产生的,深入探究并阐明相关分子机制是铜代谢生理下一步的研究方向。
2.4 铜过载在肌肉萎缩中的作用及相关信号机制铜离子不仅参与铜蛋白的构建,还可参与机体内糖、脂代谢的调控。铜缺乏时胰岛素分泌抑制和糖耐量受损揭示了铜在糖稳态维持中的关键性角色[34],作为一种内源性的脂肪分解调节器,铜离子可直接结合PDE3B的半胱氨酸位点并导致其活性抑制,进而通过环腺苷酸依赖的途径促进脂解效应[35]。
此外,铜离子参与介导糖与脂肪代谢,高糖环境可显著增强铜蓝蛋白对低密度脂蛋白的氧化作用[36]。骨骼肌是糖类和脂肪代谢的关键器官,骨骼肌萎缩的发生往往伴随着能量代谢障碍[37],铜离子在其中的调控作用值得关注。
2.4.1 铜过载通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激 酶B(protein kinase B,PKB/Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路抑制骨骼肌蛋白合成PI3K/Akt/mTOR是主导肌蛋白合成的关键信号通路,其信号转导过程如下:在生长因子的作用下,PI3K可磷酸化肌细胞膜上的二磷酸脂酰肌醇,从而形成三磷酸磷脂酰肌醇,进一步引起下游靶点Akt的磷酸化激活。Akt的激活可通过两条不同的信号通路诱导肌蛋白合成:一方面可以通过mTOR非依赖性方式直接抑制糖原合酶激酶3β(glycogen synthase kinase 3β,GSK3β)并活化真核起始因子2B(eukaryotic initiation factor 2B,eIF2B),从而促进肌蛋白质合成;另一方面,Akt还可磷酸化激活主要由mTOR复合物1(mTOR complex 1,mTORC1)和mTORC2构成的下游靶点mTOR,其中mTORC1具有雷帕霉素敏感性,可磷酸化并活化p70 S6激酶,从而促进核糖体S6蛋白的高能磷酸化并最终诱导mRNA的转录和翻译,促进肌蛋白质合成;此外,活化的mTORC1还可磷酸化eIF4E结合蛋白1并抑制其活性,同样可促进mRNA翻译并增加肌蛋白质合成[38]。铜过载可显著抑制PI3K/Akt/mTOR信号通路进而削弱骨骼肌的蛋白合成,这种效应可能是通过氧化应激标志物活性氧簇(reactive oxygen species,ROS)来介导的。铜过载是ROS的强力诱导因子,ROS可直接激活NF-κB来促进肌肉生长抑制素myostatin的高表达,myostatin可通过某种未知机制抑制miR-486的表达,从而激活磷酸酶及张力蛋白同源物(phosphatase and tensin homolog,PTEN)的活性,进一步抑制Akt的募集与磷酸化[39]。因此,ROS可通过myostatin的介导作用形成miR-486/PTEN/PI3K/Akt信号级联而抑制肌蛋白合成,这是铜过载诱导骨骼肌萎缩的可能机制之一。
2.4.2 铜过载扰乱骨骼肌线粒体稳态线粒体是一种铜依赖性细胞器,每个线粒体大约含有45 000~50 000个铜离子,线粒体需要铜离子维持CCO和膜间隙中SOD1的正常代谢功能。铜离子主要分布于线粒体的膜间隙和基质中,前者中的铜离子主要依靠铜伴侣蛋白COX17、CCS和替代性配体谷胱甘肽(glutathione,GSH)、非蛋白配体CuL对胞质中铜离子的捕获及转运,后者中的铜离子则仅来源于CuL,其在胞质中结合的铜离子可穿越膜间隙通过位于线粒体内膜上的特定铜转运受体SLC25A3的介导进入基质而储存,在铜离子缺乏时转运释放至膜间隙和胞质中进行循环代谢[22],但线粒体内膜上介导铜离子从基质转出至膜间隙的铜转运受体目前尚不明确。铜稳态对于骨骼肌线粒体维持正常的融合与分裂代谢至关重要,铜离子参与CCO的电子传递活动及线粒体的氧化磷酸化生成ATP的程序[40],病理状态可引起线粒体总量、数目和功能的重塑与改变,间接影响肌肉的力量输出和质量维持,铜过载在其中的调控作用值得关注。
线粒体依赖自身不断进行的融合与分裂以应对生理环境的改变和病理环境的刺激,融合与分裂的动态平衡可形成利于ATP生成的最佳线粒体功能网络[41]。融合是指不同线粒体在融合蛋白的作用下产生连接从而引起其内容物包括代谢物、蛋白、mtDNA的混合和重新分配,其主要接受线粒体融合蛋白1/2(mitofusin 1/2,MFN1/2)及视神经萎缩蛋白1/2(optical atrophy 1/2,OPA1/2)的调控,融合时两侧反应的线粒体膜是相同的,属于同源融合,其中MFN1/2主导外膜融合而OPA1/2主导内膜融合[42],MFN1/2的抑制足以诱导线粒体缺失性mtDNA堆集和肌肉萎缩[43],由此可见,线粒体融合对于骨骼肌质量维持至关重要,融合缺陷是骨骼肌萎缩的重要诱因;分裂是指线粒体在分裂蛋白的作用下将不可逆损伤或不必要部分进行网格化隔离,以便于通过自噬-溶酶体途径进行降解和清除[44],其主要通过细胞质中的发动蛋白相关蛋白1(dynamin-related protein 1,DRP1)与位于线粒体外膜上的对应受体包括线粒体裂变因子1(mitochondrial fission factor 1,MFF1)、裂变蛋白1(fission protein 1,FIS1)、49/51 kD线粒体动力蛋白(mitochondrial dynamics proteins of 49/51 kD,MiD49/51)的结合并触发相关信号级联来完成。线粒体分裂状态与骨骼肌质量密切联系,裂变的过度激活也会产生蛋白过度分解、线粒体功能缺陷和肌萎缩表型[45]。
融合与分裂失衡是异常线粒体产生的主要来源,同时也是骨骼肌萎缩的前体诱因。铜过载扰乱线粒体质量控制是通过两方面的途径实现的:一方面,铜过载可通过ROS的介导显著上调骨骼肌中DRP1 mRNA和蛋白表达水平并抑制MFN1/2及OPA1的表达,同时引起线粒体形态异常[46];另外,铜离子是MEK1/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号的激动剂,活化的ERK可通过调节MFN1的寡聚化而抑制线粒体融合并促进分裂[38]。这些证据提示铜过载可削弱线粒体融合并加剧分裂,同时可引起线粒体结构异常和功能缺陷,是肌肉萎缩的可能机理。
2.4.3 铜过载通过ULK1/2介导骨骼肌自噬程序的过度激活自噬是指细胞将自己细胞质的一部分(如线粒体和毒性蛋白)包裹起来形成自体吞噬泡,进而被转移至溶酶体依靠水解酶将其分解成氨基酸等代谢产物。适度的细胞自噬有助于骨骼肌蛋白和线粒体的更新和稳态维持,自噬过度激活则会诱导肌肉丢失萎缩[47]。ULK1/2是高度保守的丝/苏氨酸激酶活性的蛋白,ULK1/2蛋白激酶、200 kD的黏着斑激酶家族相互作用蛋白(focal adhesion kinase family interacting protein of 200 kD,FIP200)、ATG13和ATG101构成的Atg1复合物是哺乳动物细胞自噬的启动子,可通过激活自噬相关蛋白泛素样结合系统来促进自噬体双膜结构的形成和延展,ULK1/2的第180位苏氨酸磷酸化及去磷酸化是这一细胞程序发生的关键[20],铜过载在诱导自噬程序中扮演着重要角色,这一途径可能涉及到直接和间接两种机制:一方面,铜离子是ULK1/2激酶的重要调控因子,ULK1/2上含有铜共价结合的氨基酸残基序列并可直接与铜离子连接,ULK1/2铜连接位点的突变会使其失活并丧失对下游底物ATG13的激活能力,同时铜螯合处理或废除铜离子和ULK1/2的相互作用会导致自噬抑制,这些结果表明铜过载可直接激活ULK1而加剧自噬活动;另一方面,氨基酸和能量状态是ULK1/2的重要上游调控因子,可分别通过mTORC1和AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)来调控ULK1/2介导的自噬活动,铜过载可显著抑制骨骼肌细胞的Akt/mTORC1并伴有自噬相关基因下游底物beclin-1的磷酸化及自噬激活[48]。上述证据确认了ULK1/2在铜过载激活细胞自噬而诱导骨骼肌丢失中的关键性角色,可此研究基础上以肌细胞为模型的进行进一步的实验验证。
2.4.4 铜过载促进细胞凋亡参与肌肉萎缩细胞凋亡是一种程序性的细胞死亡过程,受调节蛋白、内切酶、蛋白酶抑制剂和半胱天冬酶caspase的共同调控并引起下游信号转导,形成凋亡小体,导致细胞发生非炎症性自我毁灭[49]。细胞死亡刺激时,启动型caspase(即caspase-8、-9和-12)被动员和活化,激活执行型caspase(即caspase-3、-6和-7)并诱发细胞降解和DNA碎片化。根据刺激信号的来源可区分为外源性凋亡和内源性凋亡,外源性凋亡是由细胞表面死亡受体(如肿瘤坏死因子受体)与其配体(如肿瘤坏死因子α)的相互作用触发的,内源性凋亡涉及线粒体或内质网的参与,其主要诱导因子包括DNA损伤、缺氧和代谢应激。值得注意的是,线粒体可以通过不依赖caspase的激活,即释放凋亡诱导因子(apoptosis-inducing factor,AIF)和内切酶G对DNA进行切割和碎片化诱导凋亡发生[50]。在骨骼肌中,由于肌细胞的多核特性,凋亡级联信号的激活会导致单个肌核和部分肌浆的清除,这一过程被称为肌核凋亡,肌核凋亡不会导致细胞死亡但会诱导肌纤维萎缩。此外,研究显示凋亡信号还可能通过激活泛素-蛋白酶体系统触发肌蛋白降解程序,诱导肌纤维萎缩[51]。事实上,肌肉萎缩时通常伴随着凋亡和蛋白质降解的同步发生。骨骼肌肌纤维的另一个特点在于存在两个在生物能量和结构上截然不同的线粒体亚群:位于肌膜下的线粒体和肌纤维中的线粒体。这两个亚群对凋亡刺激呈现出不同的易感性,因此可能分别参与了骨骼肌萎缩的不同发病机制[52]。
铜过载与凋亡发生的相关研究尚不多见,人类细胞模型显示,高剂量的铜离子处理会诱发核仁磷酸蛋白和纤维原蛋白在核质中的异常分布,损害核糖体RNA(ribosomal RNA,rRNA)的加工处理,观察到来自A2位点切割的异常34S rRNA增加,下游的pre-rRNA减少,60S亚基的积累不足,进一步的转录组分析显示铜过载还可扰乱核糖体生物合成相关基因的表达,最终通过诱导核仁压力和p53非依赖性途径来促使细胞凋亡[53]。在骨骼肌样本中,铜过载不仅可直接促使肌溶解,还可通过同时激活启动型caspase-12、执行型caspase-3及多种内质网压力相关蛋白的表达等途径来增加内网质压力而诱发细胞凋亡[54],据此推测铜过载引起的肌纤维降解丢失可能主要是通过内源性凋亡途径实现的,外源性凋亡、肌核凋亡、线粒体亚群的差异性紊乱是否参与这一病理程序尚需进一步的实验验证。
2.4.5 铜死亡(cuproptosis)在肌肉萎缩中的可能作用铜死亡是一种不同于凋亡、焦亡、坏死及铁死亡的新型细胞死亡形式[55],是继铁死亡(ferroptosis)之后又一金属离子相关的死亡途径。缺氧可抑制铜离子载体诱导的细胞死亡,这一效应可被低氧诱导因子脯氨酰羟化酶抑制剂所阻断,同时糖酵解条件下细胞呈现对铜离子杀伤作用的抵抗,这些证据表明细胞呼吸是介导铜死亡发生的关键,对铜离子暴露的ABC1细胞代谢物进行分析后观察到多种与三羧酸循环相关的代谢途径紊乱,而对铜离子呈现抗性的A549细胞则无变化,暗示铜死亡与线粒体代谢之间的密切关联。采用全基因组成簇的规律性间隔的短回文重复序列(clustered regularly interspersed short palindromic repeats,CRISPR)技术分析发现铁氧化还原蛋白1(ferredoxin 1,FDX1)和蛋白质脂酰化是铜过载诱导细胞死亡的关键调控因子,FDX1负责编码的一种还原酶可将二价铜离子还原为更具毒性的一价铜离子,蛋白质脂酰化主要发生在调节三羧酸循环的四种酶上,是一种高度保守的赖氨酸翻译后修饰。同时,鉴于FDX1基因敲除可通过抑制丙酮酸脱氢酶和α-酮戊二酸脱氢酶的三羧酸循环而导致蛋白质脂酰化完全丧失,表明FDX1是蛋白质脂酰化的上游调控因子。进一步的研究显示,铜离子可直接结合并诱导脂酰化的二氢硫辛酸转乙酰基酶的寡聚化,同时导致铁硫簇蛋白的失衡触发蛋白毒性应激。总之,铜死亡主要是通过铜离子与三羧酸循环(tricarboxylic acid cycle,TCA)的脂酰化成分直接结合而发生,这可促使脂酰化蛋白聚集和铁硫簇蛋白丢失,从而诱发蛋白质毒性应激并导致细胞死亡[56]。目前对于铜过载状态下骨骼肌细胞的铜死亡机制尚不清晰,根据现有的研究证据,铜过载介导肌萎缩的可能机制如图1所示。
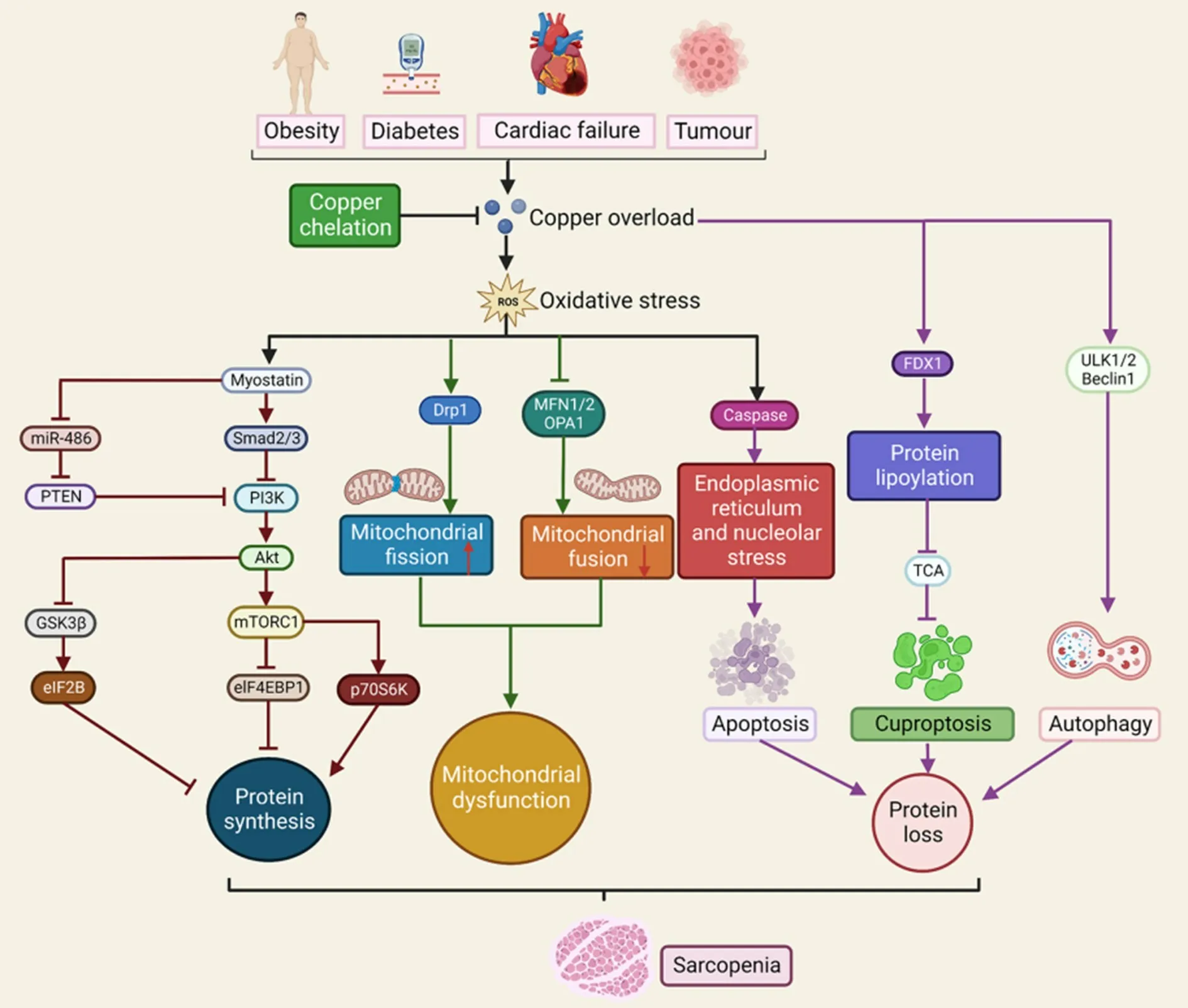
Figure 1.The mechanism pathways of copper overload-mediated skeletal muscle atrophy.ROS:reactive oxygen species;PTEN:phosphatase and tensin homolog;PI3K:phosphatidylinositol 3-kinase;Akt:protein kinase B;mTORC1:mammalian target of rapamycin complex 1;GSK3β:glycogen synthase kinase 3β;eIF2B:eukaryotic initiation factor 2B;eIF4EBP1:eukaryotic initiation factor 4E-binding protein 1;p70S6K:70 kD ribosomal protein S6 kinase;Drp1:dynamin-related protein 1;MFN1/2:mitofusin 1/2;OPA1:optical atrophy 1;FDX1:ferredoxin 1;TCA:tricarboxylic acid cycle;ULK1/2:Unc-51-like protein kinase 1/2.图1铜过载介导肌萎缩的机制通路
3 降铜治疗方案
上述研究表明,铜过载与肌萎缩具有内在机制上关联性,推测利用铜螯合降铜离子水平可能是延缓肌萎缩的有效手段。Wilson病是铜过载的经典病理模型,铜螯合及其替代性方案对于其临床治疗具有显著意义[57]。铜螯合剂通常是一类具有特殊结构的化合物,其能够特异地结合铜离子并形成稳定的复杂环状结构。铜螯合剂调控机体内过高的铜水平涉及不同的机制,其中青霉胺、曲恩汀和二巯基琥珀酸可通过与铜离子形成复合物并随尿液排出,而四硫钼酸盐则是促进胆道铜离子的排泄实现降铜效应。此外,锌作为人体所必需的另一种微量元素,可通过诱导金属硫蛋白的高表达进而紧密连结铜离子并被肠上皮细胞捕获,最终通过芽脱落的形式促进铜离子的清除[58],作为铜离子的有效螯合剂,补充锌剂是实现降铜效果的一种辅助替代方案。
低铜饮食是降铜治疗的重要方法,铜在不同类型食物中的丰度具有广谱差异性,通常在动物肝脏、贝类水产、豆类、坚果及奶酪中含量较高[59]。鉴于铜超载在肌萎缩中的可能角色,制定健康科学食谱,避免摄入高铜食物对于防止肌肉萎缩是必要的。铜螯合剂由于其特殊的生物化学性质导致其具有一定的细胞毒性而呈现出不同的副作用[60-61]。目前尚未检测到天然的铜螯合剂,但多种可食用性天然化合物显示出拮抗铜过载的巨大潜力:在黑腹果蝇模型中,姜黄素对铜离子过载诱导的氧化压力和线粒体凋亡具有抑制效应[62];火龙果提取物能够改善秀丽杆线虫和斑马鱼模型中的抗氧化系统,削弱铜过载状态下的细胞死亡和脂质过氧化[63-64]。这些证据揭示某些天然化合物作为食物补充物在预防铜氧化损伤,修复临床铜中毒中具有潜在的应用前景和常用价值,寻找绿色天然的降铜物质改善肌萎缩是食品科学研究领域未来的努力方向。
4 总结与展望
越来越多研究观察到体内铜离子代谢异常会导致一系列疾病的发生发展,包括肥胖症、神经退行性疾病、心血管疾病、肿瘤等[65],铜过载参与肌萎缩的相关机制逐渐引起关注。肝脏是外源性铜摄取及内源性铜离子稳态调控的关键器官,糖尿病、心力衰竭、癌症状态时的能量代谢障碍通常伴随着肝脏应激代偿并主要以铜蓝蛋白的形式形成胞外铜超载,当细胞内铜离子稳态调控的关键靶点蛋白CTR1、ATP7A、ATP7B不足以代谢过多的铜离子时会形成胞内铜过载并触发相关的病理程序。本文首次结合相关研究证据,对铜过载诱导肌萎缩的信号通路及可能机制进行了系统归纳阐述(图1)。鉴于骨骼肌是哺乳类动物最大的氨基酸储存库,显示铜离子作为中间介导物调节机体能量障碍时的氨基酸代谢、通过其自身稳态调控充当能量传感器的新颖角色,此外,骨骼肌作为一种内分泌和解毒器官,可通过分泌多种肌细胞因子如成纤维细胞生长因子21(fibroblast growth factor 21,FGF-21)、鸢尾素(irisin)、肌肉素(musclin)及Apelin肽,同时在运动时通过促进有毒的犬尿氨酸转化为抗氧化的犬尿酸参与肝脏的能量代谢和相关病理调控[66-69],由此可见,深化铜生理研究对于建立和推动“肝-肌轴”理论学说具有重要学术价值(图2)。
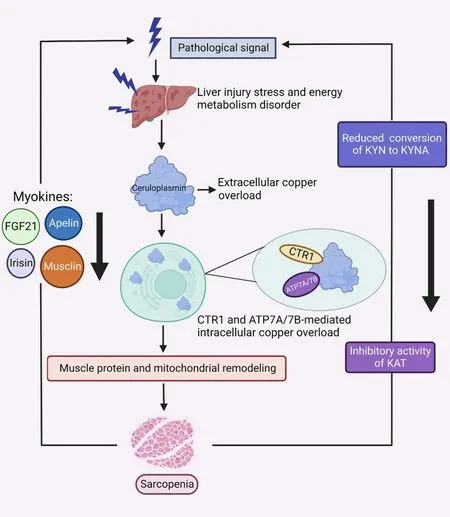
Figure 2.The metabolism mechanism of copper overload-mediated liver-brain axis.FGF21:fibroblast growth factor 21;CTR1:copper transporter 1;ATP7A/7B:copper-transporting ATPase 7A/7B;KYN:kynurenine;KYNA:kynurenic acid;KAT:kynurenine aminotransferases.图2铜过载介导的肝-脑轴代谢机制图
事实上,铜过载作为氧化应激ROS的强力诱导因子,与骨骼肌蛋白质代谢紊乱和线粒体功能失调的相关机制紧密相连:一方面,ROS可激活肌肉萎缩盒F基因(muscle atrophy F-box,MAFbx)和肌肉环状指基因1(muscle ring finger 1,MuRF l)参与的泛素蛋白酶体和Ca2+依赖的蛋白酶体的活性,加剧骨骼肌蛋白质丢失;另一方面,ROS可通过抑制沉默信息调节子(silent information regulator 1,SIRT1)/过氧化物酶体增殖物激活受体γ辅激活因子1(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)信号通路而降低线粒体的生物合成,并通过触发线粒体DNA损伤、电子转移链和膜电位的异常等途径加剧线粒体的降解、丢失[70],其与铜过载诱导的骨骼肌萎缩的机制关联性有待进一步研究。
本文首次关注铜过载在肌萎缩中的作用,为铜螯合改善肌萎缩提供了机制基础。基于以上理论,采用铜螯合剂可能是治疗和改善多种病理状态下肌萎缩的一种潜力疗法,具体疗效尚需进一步的临床验证。
