GDF9在PCOS患者成熟卵泡中的表达及其与内分泌激素的相关性*
2023-01-05蔡晶晶吴金香罗湘闽
蔡晶晶,吴金香,罗湘闽
(福建医科大学附属第二医院生殖医学科,福建 泉州 362000)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄妇女最常见的内分泌疾病,表现为月经稀发或闭经、卵巢多囊样改变、且多伴有持续性高黄体生成激素(luteinizing hormone,LH)及高雄激素等典型特征[1]。PCOS患者卵母细胞发育潜能低下被认为是生育力下降的风险因素,卵泡发育异常和成熟障碍是其重要特征,但其病因及发病机制仍然不清。以往研究多集中在下丘脑-垂体-卵巢轴对卵泡形成的整个阶段的同步化协调和反馈作用,包括血清卵泡刺激素(follicle-stimulating hormone,FSH)、LH、LH/FSH和抗缪勒管激素(anti-Mullerian hormone,AMH)反映性轴在PCOS卵泡发育异常机制中的作用。最近有更多的研究证实卵母细胞自分泌、旁分泌形成的卵泡微环境对卵母细胞和颗粒细胞的生长发育发挥关键作用。卵泡微环境是影响卵母细胞发育的重要因素,卵母细胞和颗粒细胞之间具有双向联系,可进行营养物质及信号的交换,其含有各种生物化学成分、细胞因子和氧化/抗氧化产物,在调节促进卵泡生长,控制卵巢功能的各个方面发挥重要作用[2]。优化卵泡微环境可以提高卵母细胞质量,调控优势卵泡的形成,改善妇女的妊娠结局[3]。研究表明GDF9是重要的卵泡发育调控因子,在卵泡发育阶段调节卵丘细胞及卵泡膜细胞的生长、分化和功能,并在卵母细胞的发育成熟、排卵、以及黄体功能发挥关键作用,从而影响卵巢功能[4-5]。
以往文献表明GDF9的生物学功能主要是通过Smad2/3信号通路作用于卵丘细胞引起卵丘的生长分化和卵丘复合物的扩展[4-5]。也有研究报道在PCOS卵巢中,GDF9表达水平降低抑制着卵泡的生长,可能与激素水平有关[6-8]。Dewailly等[9]系统阐述了PCOS卵巢内分泌紊乱的三角模式,并影响着卵泡的发育,但由于PCOS病因不清,不能局限于内分泌因素,这个模式不能完全解释PCOS产生的病理生理机制,需要更多探讨PCOS卵泡生长发育的其他环境的影响,认为内分泌激素和卵源性因子的相互联系也发挥着重要作用。然而,GDF9表达与内分泌激素在PCOS卵泡发育的相互关系鲜见详细报道和明确解释。
卵泡液是卵母细胞赖以生存的微环境[10],参与调控生殖功能的重要体液。而卵丘细胞可以通过缝隙连接和卵母细胞进行信号传递[11],将卵母细胞分泌的细胞因子和RNA等物质运输到卵泡液中,丰富了卵泡微环境的营养物质从而提高卵母细胞的质量。本实验收集进行体外受精(in vitrofertilizaion,IVF)周期患者的卵泡液和卵丘细胞以研究PCOS患者成熟卵泡GDF9表达水平,分析PCOS卵巢内卵泡微环境GDF9表达情况,以及GDF9水平和PCOS内分泌激素之间相关性在卵泡发育中的作用,为PCOS发病机制提供更多的理论依据。
材料和方法
1 一般资料
选择2019年12月~2022年8月在福建医科大学附属第二医院生殖医学中心就诊的接受IVF/ICSI治疗的115例患者,其中PCOS患者61例和卵巢功能正常的患者54例(对照组)。本研究方案经本院伦理委员会批准,所有患者均签署知情同意书(编号:2019-222)。PCOS的诊断根据2003年鹿特丹标准[12]。对照组患者的选择标准:月经规律,正常排卵,超声显示卵巢形态正常,为同期输卵管因素的不孕患者。同时排除合并卵巢功能早衰、内异症、高泌乳素血症、甲状腺功能异常等;曾接受过卵巢手术或放化疗者。
2 方法
2.1 激素水平检测采集患者月经后第3~5天的空腹静脉血,离心分离血清。采用Abbott I 2000化学发光分析仪检测基础内分泌值:睾酮(testosterone,T)、FSH、LH、雌二醇(estrodiol,E2)和催乳素(prolactin,PRL)。采用ELISA法检测AMH水平,试剂盒购自贝克曼二代公司。
2.2 人卵泡液和卵丘细胞的收集根据患者不孕原因、年龄、卵泡刺激素水平和腔卵泡计数等临床资料,主要采用早卵泡期长效长方案和拮抗剂方案,进行促排卵。给予促性腺激素释放激素激动剂(博福益普生公司)和重组FSH(雪佛兰公司)刺激卵巢后,当至少3枚卵泡直径达到17 mm左右,肌肉注射人绒毛膜促性腺激素(珠海丽珠制药厂)5 000~10 000 U,36 h后超声引导下经阴道穿刺取卵。由于卵母细胞可用于胚胎培养和移植,所以留取相应的卵泡液和卵丘细胞来分析GDF9的表达。从穿刺获得的第一个直径大于17 mm的卵泡中捡取卵丘-卵母细胞复合物,收集废弃的卵泡液。卵泡液样品置于水平离心机,4℃、300×g离心10 min;取1 mL上清液转移到冷冻管中,保存在-80℃冰箱,用于后续的GDF9蛋白浓度测定。获取的每个卵丘-卵母细胞复合物用16号显微解剖针[13]机械去除分离部分卵丘细胞,经PBS漂洗后均匀涂布于防脱载玻片上制成卵丘细胞涂片,用于免疫组织化学染色检测卵丘细胞的GDF9表达水平。
2.3 人类卵泡液GDF9浓度的测定将卵泡液用PBS 1∶5比例稀释,然后按照生产说明书使用人GDF9 ELISA试剂盒(Elabscience)进行测定。在自动96孔微孔板阅读器下读取450 nm波长的吸光度(A)。用标准曲线计算卵泡液GDF9浓度。
2.4 免疫组织化学染色根据操作说明书(博士德生物科技有限公司),采用免疫组化染色法检测GDF9在卵丘细胞的分布。用4%多聚甲醛固定卵丘细胞涂片15 min,然后用3%过氧化氢浸泡以阻断内源性过氧化物酶活性,加山羊血清阻断非特异性结合1 h。用兔抗GDF9Ⅰ抗(Abcam;1∶100)4℃孵育过夜,用PBS冲洗3次,室温下与生物素标记的兔抗Ⅱ抗孵育30 min。最后,与过氧化物酶底物DAB在室温下孵育,直到达到所需的染色强度,用苏木素轻度染色,覆盖盖玻片。涂片通过预实验确定最佳染色时间和抗体滴度。空白涂片采用不含Ⅰ抗的卵丘细胞涂片进行孵育。用显微镜(Leica MZ16FA)对染色结果进行检测和拍照留取图片。使用ImageJ 6.0软件对图片染色进行半定量分析,每张图片随机选取3~5个视野,测定平均吸光度(A)。
3 观察指标
对比PCOS组和对照组卵泡液GDF9浓度和卵丘细胞GDF9表达水平。分析成熟卵泡卵泡液GDF9与患者血清T、FSH、LH、LH/FSH和AMH的相关性。
4 统计学处理
采用软件SPSS 22.0进行统计分析。Shapiro-Wilk检验判断数据的正态性。符合正态分布的计量资料以均数±标准差(mean±SD)表示,组间比较采用t检验。非正态分布的数据以中位数(第25百分位数,第75百分位数)[median(P25,P75)]表示,组间比较采用Mann-WhitneyU检验,使用多变量偏相关分析非正态变量间的关系。以P<0.05为差异有统计学意义。
结 果
1 两组患者基本资料的比较
本研究纳入标准的患者共115例,其中对照组54例,PCOS组61例。两组患者间基础T、基础AFC、基础AMH、基础LH和LH/FSH比值差异均有统计学意义(P<0.01),两组患者间年龄、BMI、基础FSH、E2、PRL和促排卵Gn总量差异均无统计学意义(P>0.05),见表1。
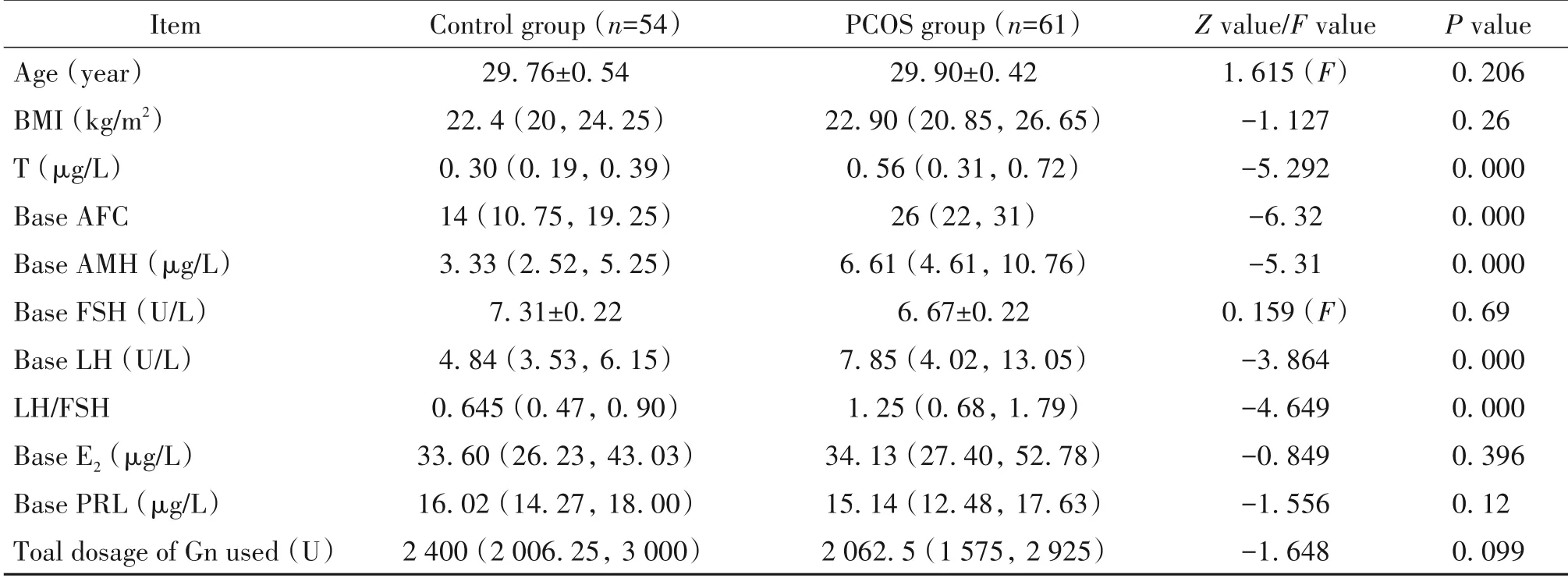
表1 两组患者基本资料的比较Table 1.Comparison of general data between the two groups[Mean±SD or median(P25,P75)]
2 两组患者成熟卵泡卵泡液GDF9蛋白浓度比较
PCOS组患者成熟卵泡卵泡液GDF9蛋白浓度是(6.83±0.53)μg/L,低于对照组的(11.05±0.82)μg/L(P<0.01),见图1。
3 两组患者成熟卵泡卵丘细胞GDF9蛋白水平
PCOS组和对照组的卵丘细胞免疫组化染色显示,两组患者卵丘细胞中均存在有GDF9蛋白阳性表达,可见在细胞质棕色染色。PCOS组卵丘细胞GDF9蛋白阳性染色平均吸光度值为0.18±0.01,明显低于对照组的0.28±0.01(P<0.01),见图2。
4 成熟卵泡卵泡液中GDF9浓度与血清T、FSH、LH、LH/FSH和AMH水平的相关性
对PCOS组成熟卵泡卵泡液中GDF9浓度与血清T、FSH、LH、LH/FSH和AMH的相关性分析,结果显示,PCOS组成熟卵泡卵泡液GDF9浓度与T(r=0.303,P<0.05)和FSH(r=0.309,P<0.05)呈正相关;与LH(r=-0.290,P<0.05)、LH/FSH(r=-0.418,P<0.01)和AMH(r=-0.281,P<0.05)呈负相关,见图3。而在正常对照组中,GDF9与T、FSH、LH、LH/FSH和AMH无显著相关性(P>0.05),见图4。
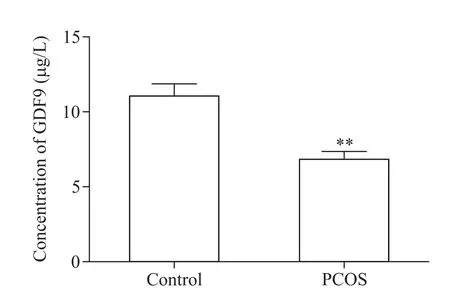
Figure 1.The expression of GDF9 in follicular fluid from the PCOS patients(n=61)and controls(n=54).Mean±SD.**P<0.01 vs control group.图1两组患者成熟卵泡卵泡液GDF9蛋白浓度
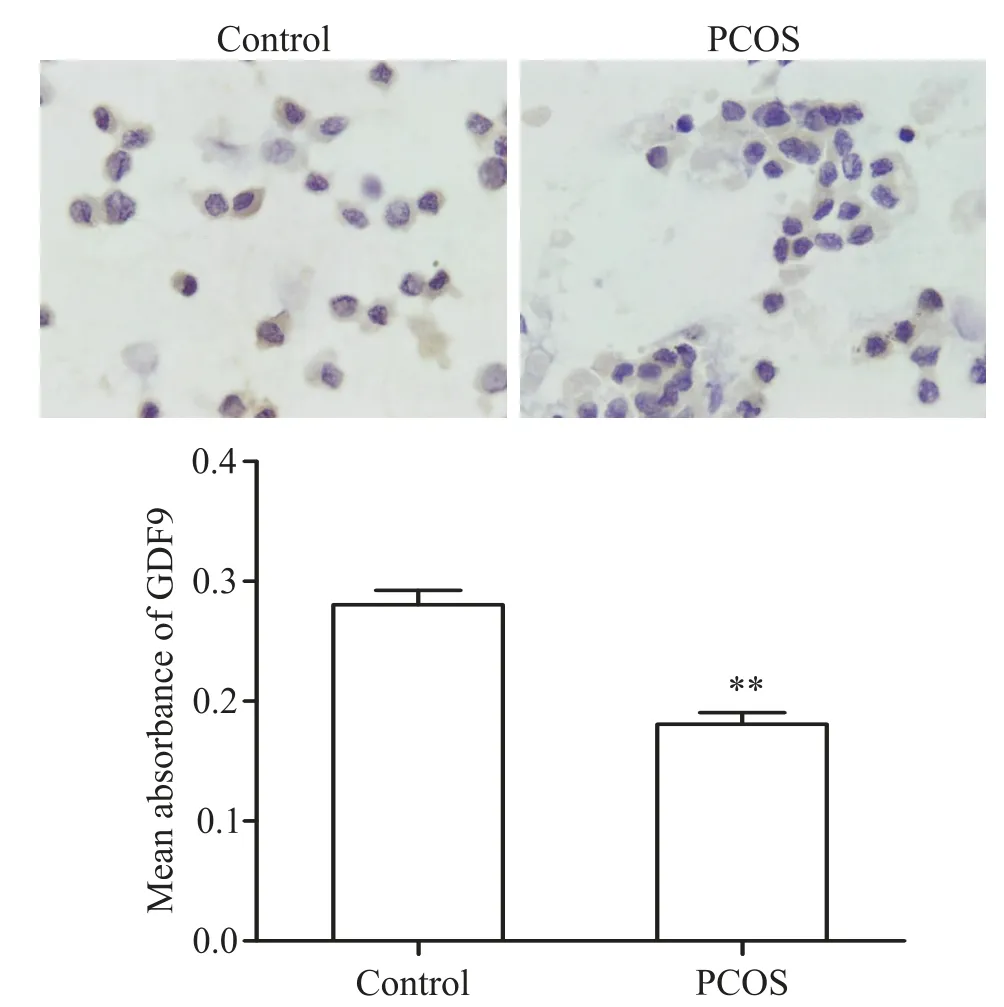
Figure 2.The expression of GDF9 in cumulus cells(×400)of PCOS patients(n=61)and controls(n=54).Mean±SD.**P<0.01 vs control group.图2两组患者成熟卵泡卵丘细胞GDF9蛋白表达水平
讨 论
在卵泡发育的各个阶段,从初级卵泡到次级卵泡的转化,都可以检测到GDF9的表达,在成熟卵泡表达水平最高,卵母细胞通过GDF9的合成和分泌调节颗粒细胞增殖和分化[14-16]。所以本研究收集直径≥14 mm卵泡的卵泡液和卵丘细胞,即成熟卵泡的卵泡液和卵丘细胞,以分析PCOS患者中卵泡成熟阶段GDF9表达水平,对卵母细胞质量进行预测评估。本研究结果显示,PCOS组卵泡液GDF9的含量低于对照组,同时还发现PCOS患者卵丘细胞的GDF9表达与卵泡液GDF9表达是一致的。魏丽娜等[8]的研究显示刺激周期PCOS组成熟卵母细胞和正常卵巢对照组比较,卵母细胞GDF9 mRNA表达水平明显降低。随后她们用免疫组化验证GDF9在PCOS妇女的卵巢组织中的表达,也发现组织中GDF9表达也是呈低水平状态[7]。另有国外学者研究显示在行控制性促排卵的PCOS患者,卵丘细胞GDF9的mRNA表达降低[17]。本实验结果和这些已报道研究一致,用不同的实验方法进一步验证了控制性卵巢刺激可以促进正常排卵妇女卵泡GDF9的表达,但对于PCOS患者的成熟卵泡GDF9表达仍未能达到正常水平。近年,GDF9在诱导卵母细胞与颗粒细胞之间的信号转导,促进卵母细胞的成熟和排卵发挥重要调节作用不断被认知[7,18-19]。PCOS患者中低表达的GDF9导致卵泡发育的促进作用受到抑制,可能会引起卵母细胞的质量低下。PCOS患者虽然经过外源性Gn促排刺激以及LH峰的扳机作用,卵母细胞发生核成熟并排出第一极体,但减弱的GDF9表达水平可能会引起胞质发育不成熟,核质发育不平衡,减弱本身的减数分裂能力、抑制正确的受精和形成的早期胚胎发育能力[20-21]。
近期有文献报道首次用ELISA方法定量检测无促排刺激卵巢中的小窦卵泡GDF9浓度[22],但国内目前尚缺乏此类的数据分析。本研究也应用ELISA方法观察到GDF9浓度在PCOS患者个体间差异较大,甚至部分患者的GDF9表达水平并不比正常对照低,与此文献报道的一致。这可能与PCOS疾病的临床特点和高度异质性有关系,说明有些温和的PCOS表型可能有不同的致病途径,它们的生殖能力和卵母细胞质量并不比正常妇女差,治疗也应该个体化处理[23]。PCOS不仅影响女性生殖功能,而且是一种多系统、复杂的慢性疾病。患者之间个体差异大,具有不同的临床表现,涉及轻微症状到伴有严重的代谢紊乱疾病,如肥胖、高胰岛素血症、胰岛素抵抗以及持续的低度慢性炎症。这些并发症或多或少伴随着PCOS疾病的发生,增加PCOS的严重性,而且影响着PCOS的生殖能力和卵母细胞的质量[5]。所以本研究通过定量检测多样本的GDF9浓度,在评估PCOS患者群体生殖能力方面,更能体现PCOS临床的多变性和特异性。
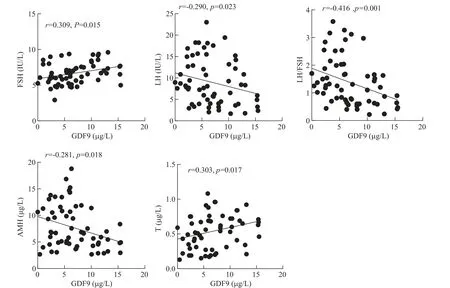
Figure 3.Correlations of GDF9 concentration in follicular fluid of mature follicles and serum T,FSH,LH,LH/FSH and AMH levels in PCOS patients.图3 PCOS组成熟卵泡卵泡液GDF9浓度与血清FSH、LH、LH/FSH和AMH水平的相关性
Figure 4.Correlations of GDF9 concentration in follicular fluid of mature follicles and serum T,FSH,LH,LH/FSH and AMH levels in control patients.图4对照组成熟卵泡卵泡液GDF9浓度与血清T、FSH、LH、LH/FSH和AMH水平的相关性
卵母细胞的生长发育受到内分泌环境和卵泡微环境的共同调控,深入了解这一复杂的卵泡生长环境的相互作用为探索PCOS的发生发展提供更多的理论依据。PCOS患者内分泌紊乱是其主要特征之一[24-26]。有研究指出卵源性因子的表达受到内分泌激素的调控,过度分泌的AMH可能直接抑制或者阻断FSH对卵源性因子的产生,使PCOS患者卵母细胞中卵源性因子的表达处于较低水平[9]。也有文献报道,GDF9在原始卵泡阶段就开始表达,通过非性腺激素依赖途径调控卵泡生长发育的微环境,卵泡的生长状况必定会影响各种内分泌激素产生和受体的表达[27]。总之,PCOS出现多指标的异常表达,但因果关系尚不清楚。本研究发现PCOS患者卵泡液GDF9水平与T和FSH呈正相关;与LH、LH/FSH和AMH呈负相关,而在对照组中不存在任何相关性,实验中两组结果对比表明PCOS患者GDF9的产生与T、FSH、LH、LH/FSH和AMH表达可能存在某种相互调节或相互作用的机制,如果这种正常的平衡状态被某种因素打破就可能发生的一系列连锁反应,导致各种生物指标的异常表达[28]。虽然有文献表明雄激素水平过高可抑制卵泡发育[29],但也有研究显示雄激素在卵泡发生的早期和排卵前阶段是必不可少的[30]。本研究中PCOS患者的GDF9表达水平与睾酮成正相关,它们可能在PCOS原始卵泡阶段就开始共同决定着卵泡的命运。
本文从卵源性因子的角度以及内分泌激素水平探索PCOS患者在控制性卵巢刺激排卵周期的卵泡生长调节过程,确定两者之间的相关性,进一步研究影响PCOS卵母细胞质量和PCOS患者生育力的因素和内在联系,或许将GDF9与T、FSH、LH、LH/FSH、AMH联合检测,以监测控制性卵巢刺激促排卵中卵泡的生长情况,为指导PCOS患者的IVF临床治疗提供更多的实验室数据依据,为PCOS的治疗提供新思路。
