氯气制备及性质探究实验装置的改进
2023-01-04隋颖
隋 颖
(江苏省常州市北郊高级中学 江苏 常州 231022)
一、问题提出
氯是高中化学中重要的非金属元素,氯气及其化合物在生产和生活中具有广泛的应用。《普通高中化学课程标准(2017年版)》对于氯气相关实验的要求是通过实验探究,了解氯及其化合物的重要性质。[1]氯气是一种有毒的黄绿色气体,按照苏教版化学必修1中氯气的实验室制法,即利用二氧化锰与浓盐酸加热制备氯气,需要在实验室通风橱中进行,需要制备的氯气量较大,有关氯气溶解性、氧化性、漂白性等性质探究实验也需要消耗大量氯气,浪费能源和原料,不符合绿色化学理念。
化学实验是学生获得化学知识、掌握实验操作技能的学习方法,学生分组实验能使学生体验科学探究的过程,激发对化学学习的兴趣,强化科学探究的意识,促进学习方式的改变,在实践中培养学生的实践能力和创新精神。[2]但由于氯气、氯水的毒性,很多教师选择播放实验视频或者口述的方式讲解实验,学生死记硬背,未能发挥实验的功能。本文展示了两组氯气制备和性质探究的微型实验装置,可用于学生分组实验,同时实现密闭装置中铁粉在氯气中燃烧,经过实践均可用于课堂教学。
二、研究现状
为了进一步探索氯气制备及性质探究实验的新方法,笔者查阅了大量期刊和文献。大多数实验改进装置集中于氯气制备及性质探究的一体化上。阎润鸿老师[3]、李猛老师[4]、张泽志老师[5]的一体化装置分别如图1、图2、图3 所示。一体化实验装置把氯气的制备和性质探究实验浓缩于同一体系,减少了氯气的用量,注重尾气的处理,实验装置设计各有千秋。但是一体化实验装置所需仪器较多,操作繁琐,特殊仪器难以获得,装置气密性难以控制,可复制性和实用性有待商榷,更不可能实现学生分组实验;一体化实验装置实现多个实验同时进行,学生同时观察记录多个现象,“手忙脚乱”,迷失学习目标,不利于学生的认知发展和高阶思维发展,不利于科学探究核心素养的发展。中学化学实验的改进是为教学服务,而大多数实验改进已偏离教学本身,呈现“难、繁、偏”特征,将简单的问题复杂化。[6]
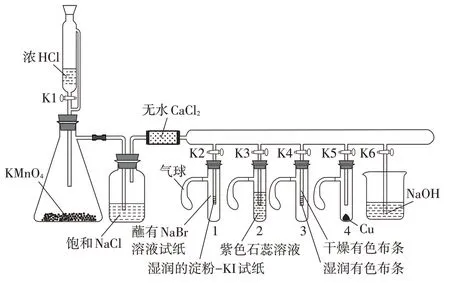
图1 阎润鸿老师设计的实验装置

图2 李猛老师设计的实验装置
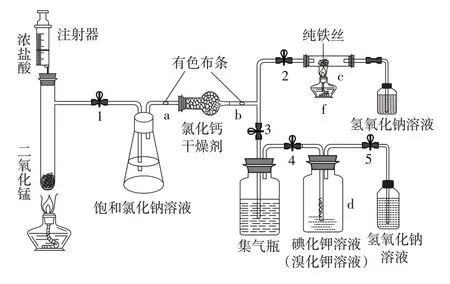
图3 张泽志老师设计的实验装置
三、实验装置的优化与改进
1.实验设计目标
(1)通过微型化实验,实现学生分组实验制备氯气、探究氯水成分。
(2)简化氯气在水中的溶解实验。
(3)实现铁粉在氯气中燃烧,实验绿色化。
2.实验仪器及药品
实验仪器:西林瓶、输液针、注射器、铁架台、石棉网、酒精灯、离心管。
实验药品:浓盐酸、KMnO4固体、NaOH溶液、蒸馏水、淀粉-KI 试纸、pH 试纸、稀HNO3酸化的AgNO3溶液、铁粉、脱脂棉、无水CaCl2固体、NaBr溶液、CCl4。
3.实验服务教学
(1)制备氯气的原理
2KMnO4+16HCl(浓)2MnCl2+2KCl+5Cl2↑+8H2O
(2)氯气性质检验
①与金属反应:在加热条件下氯气能与铁粉反应生成氯化铁。
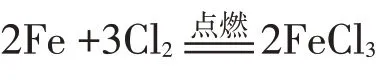
②氯气检验:氯气可使湿润的淀粉碘化钾试纸变蓝。

③酸性:氯气与水反应生成盐酸,可以使pH试纸变红,与稀硝酸酸化的硝酸银溶液反应生成氯化银。
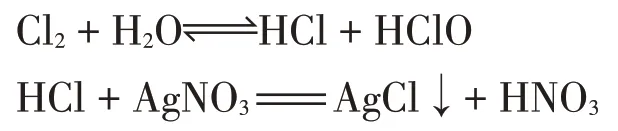
④氧化性:氯气可与溴化钠溶液反应生成溴单质,CCl4层显黄色。

⑤漂白性:氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性。
⑥与碱反应:氯气可与氢氧化钠溶液反应,用于氯气尾气处理。
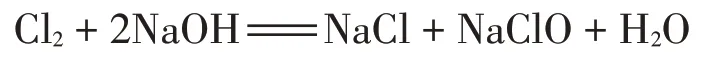
四、实验装置图及实验原理
(1)铁粉在氯气中燃烧实验装置如图4 所示。左侧西林瓶中套有一装有KMnO4固体的离心管,底部装有少量铁粉(注意铁粉用量不宜过多)。右侧西林瓶中装有氢氧化钠溶液,为尾气处理装置。

图4 铁粉在氯气中燃烧实验装置
(2)学生分组实验制备氯气及性质检验装置如图5。通过注射器向高锰酸钾固体中加入浓盐酸即可制备少量氯气,氢氧化钠溶液为尾气处理装置。通过注射器向水中注入少量氯气即可获得氯水,如果氯水中含有氯气分子即氯气溶于水会使淀粉碘化钾试纸变蓝,氯水能使pH 试纸变红说明氯气并不是简单的溶于水,还与水发生了化学反应生成盐酸。氯水可使溴化钠溶液(含四氯化碳)下层变黄,说明氯水中氯气分子具有氧化性。

图5 氯气制备及性质检验分组实验装置
(3)氯水漂白性成分探究分组实验装置如图6所示。左侧为氯气发生装置,中间西林瓶上方为用脱脂棉包裹的无水氯化钙固体,用于干燥氯气,下方为固定在瓶壁两侧的干燥和湿润的红纸,右侧西林瓶为尾气处理装置。

图6 氯水漂白性成分探究分组实验装置
五、实验操作要点及实验现象
(1)如图4所示安装好仪器(气密性良好),向离心管中缓慢加入浓盐酸,注意液体不能溢出离心管,可以观察到西林瓶中产生黄绿色气体,反应一段时间后,停止滴加。通过石棉网加热西林瓶,一段时间后,观察到铁粉开始燃烧(及时撤走酒精灯),产生棕黄色烟。实验结束后向西林瓶中注入氢氧化钠溶液吸收多余氯气。
(2)如图5 所示安装好实验仪器。用蓝色注射器(1 mL)吸取0.1 mL 浓HCl(严格控制浓盐酸用量以控制氯气的量)全部注入高锰酸钾中,拔出注射器。反应约30秒后,用另一个白色注射器(2.5 mL)抽取2 mL左右瓶内气体,并将其慢慢打入蒸馏水中,轻微振荡使其混合均匀。此时白色注射器无需拔出,直接吸取约1 mL 氯水,向装有淀粉-KI 试纸的西林瓶中滴加1 滴,可观察到试纸变蓝;向装有pH试纸的西林瓶中滴加1滴,可观察到pH 试纸中间变白,周围略带红色;同样操作下,可观察到稀HNO3酸化的AgNO3溶液中产生白色沉淀;溴化钠溶液中(含四氯化碳)下层呈黄色。
(3)如图6 所示安装好仪器,滴加约0.1 mL 浓盐酸,一段时间后可以观察到干燥的红色纸条几乎无变化,湿润的红色纸条颜色变成黄色。关于红色纸条的选择:本实验中选择的是颜色比较深、吸水性较好的红色宣纸,可较快观察到褪色现象。pH 试纸颜色较浅,不易观察实验现象;有色布条吸水性较差,观察到颜色变化需要较长时间。
六、实验特点与反思
1.实验特点
本实验以西林瓶、注射器为主要仪器,设计了氯气制备及性质探究的学生分组实验,以及密闭环境中铁粉在氯气中的燃烧实验。该实验呈现以下特点:(1)药品微量、现象明显:原料的利用率高,学生分组实验所用氯气量少,现象明显,体现了节约理念;(2)可操作性强:实验装置主要利用西林瓶和注射器,所用仪器种类少,器材无需组装,操作简单。学生分组实验盒如图7所示;(3)绿色环保:装置几乎全封闭,反口胶塞具有非常好的密闭性能,学生实验几乎不会有氯气泄漏问题,实现了绿色环保无污染;(4)可控性强:实验中通过控制浓盐酸用量,保证以最少的药品达到最佳的实验效果,减少浪费;(5)普适性强:该装置可用于其他有毒气体的制备及气体性质检验实验、卤素间置换反应实验等。
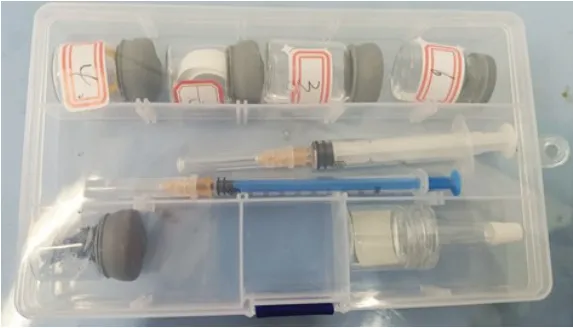
图7 分组实验盒
2.实验反思
实现学生亲手制备氯气、氯水,进而探究其性质是设计本实验的初衷。课堂实践表明学生分组实验效果现象明显,成功率高,学生无需因氯气有毒而回避,亲身体会到实验探究的乐趣,改变当前化学实验重结论轻过程、重理论轻体验的现状。[7]实验改进是手段,在“绿色化、微型化、可操作性强、现象明显”原则下,实验改进的目的是发展学生“科学探究与创新意识”的核心素养。
