‘全红’杨PdHY5转录因子基因的克隆及功能分析
2023-01-04付妍妍赵志明徐立人王进茂
付妍妍,赵志明,徐立人,王进茂*
(1 河北农业大学 林学院,河北保定 071000;2 北京林业大学 生物科学与技术学院,北京100083)
花青素是一类重要的而且天然存在的植物次生代谢产物,是广泛存在于植物体中的一类水溶性色素,属于黄酮类化合物[1]。花青素生物合成通路受到结构基因和转录因子的调控,结构基因直接编码花青素代谢生物合成途径中所需要的酶,主要包括苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮-3-羟化酶(F3H)、黄烷酮-3′-羟化酶(F3′H)、黄烷酮-3′5′-羟化酶(F3′5′H)、花色苷合成酶(ANS)、二氢黄酮醇还原酶(DFR)和类黄酮糖基转移酶(UFGT)等[2]。转录因子通过与结构基因启动子中相应顺势元件结合,调控花青素的生物合成过程中一个或多个基因的表达[3]。HY5(ELONGATED HYPOCOTYL 5)转录因子主要通过3种方式在花青素的生物合成与积累中发挥重要的调控作用[4]。第一种方式为植物的光感受器在感受到光信号后,直接激活类黄酮合成途径中结构基因的转录,从而促进花青素的积累;另一种方式为HY5通过结合 MYB 转录因子及 MYB-bHLH-WD40 (MBW) 三者复合体间接地影响花青素的合成与积累;第三种方式为通过与其他转录因子(如BBX)形成蛋白复合体共同调控结构基因的表达,间接调控花青素的积累。苹果MdHY5蛋白可以结合MdMYB10 基因启动子区域的G-box(CACGTC) 元件,从而促进其结构基因MdDFR、MdUF3GT及MdF3H等表达, 进而促进了苹果中花青素的积累[5]。相似地,在光诱导下,血橙中的CsHY5通过与一种MYB 转录因子Ruby的启动子结合,间接促进了其果皮中花青素的积累[6]。草莓FvHY5通过诱导bHLH 类转录因子FvbHLH9 的转录,同时FvHY5 也能与 FvbHLH9蛋白互作,共同激活结构基因FvCHS及FvDFR的转录表达[7]。
杨树(Populus)属于杨柳科(Salicaceae),具有分布广、适应性强、品种多等特点,是世界人工林发展的三大速生树种之一[8]。杨树生长迅速、繁殖容易、适应性强,有重要的生态价值和经济价值。‘全红’杨(Populusdeltoides‘Quanhong’)是由美洲黑杨‘中林2025’(Populusdeltoidescv. ‘Zhonglin 2025’)芽变而成的红叶品种,因其较高的观赏价值而备受关注。‘中林2025’叶片呈绿色,而‘全红’杨的叶片随季节由紫红色-紫绿色-橙色逐渐变化,具有良好的观赏特性[9-10]。研究红叶杨的成色机理是林木叶色育种工作的重中之重,本研究在课题组前期对‘全红’杨转录组的研究基础上,筛选出了可能参与叶色调控的关键转录因子PdHY5,构建过表达载体pNP1302-35S-PdHY5并遗传转化烟草,对其进行功能验证。利用qRT-PCR进一步分析了各过表达株系中外源PdHY5和内源花青素合成途径中结构基因的表达水平,同时测定了各株系叶片中的花色素苷含量,为彩叶新树种的创制及遗传改良工作提供重要的理论依据及基因资源。
1 材料和方法
1.1 材 料
供试的材料为栽植于河北省保定市河北农业大学试验苗圃(38.83°N,115.45°E)的‘全红’杨植株,于2018 年 7 月对‘全红’杨品种进行叶片采集和RNA的提取。
1.2 方 法
1.2.1 ‘全红’杨PdHY5基因的生物信息学分析‘全红’杨PdHY5基因CDS序列由载体构建过程中测序结果获得。利用DANMAN进行序列比对,利用ExPASy对PdHY5蛋白的理化性质进行预测,利用TMHMM预测蛋白是否具有跨膜区域;利用网站SOMPA分析蛋白质的二级结构,利用MEGA7软件构建系统进化树。为预测PdHY5基因潜在的功能,利用在线网站STRING进行PdHY5互作蛋白预测。
1.2.2 ‘全红’杨PdHY5基因表达载体的构建利用RNA提取试剂盒(张家口赛诺生物有限公司)提取‘全红’杨总RNA,使用生物分析仪(Agilent 2100)测定 RNA 样品的浓度和质量。使用“哧溜”极速反转录试剂盒(北京聚合美生物科技有限公司)合成cDNA。在NCBI网站上搜索毛果杨PtHY5基因序列,设计含NcoⅠ和PmlⅠ限制性核酸内切酶位点的引物F(5′-CCATGGATGCAAGAACAA-GCAGCCAGTT-3′)和R(5′-CACGTGTCATGA-AGAGCCATCTGCATTAGCAC-3′)用于‘全红’杨cDNA的扩增。扩增体系为模板5 μL,2×M5 Hiper plus Taq HiFi PCR mix 50 μL,正反引物各2.5 μL,ddH2O 40 μL。反应程序为:95 ℃预变性3 min;94 ℃变性 25 s,58 ℃ 退火25 s,72 ℃延伸1 min,36个循环;72 ℃延伸5 min。最后用1%琼脂糖凝胶对PCR产物进行检测并回收。
将回收的PCR产物连接pUCm-T载体,并转化大肠杆菌DH5α感受态细胞中,挑取单菌落进行菌液PCR检测,将条带正确的菌液送至公司测序,测序结果与毛果杨PtHY5基因比对。提取比对结果正确的菌液质粒和pCAMBIA1302质粒,使用NcoⅠ和PmlⅠ限制性核酸内切酶酶切两种质粒。用1%琼脂糖凝胶电泳检测,回收条带正确的酶切产物。用T4连接酶连接后转化大肠杆菌感受态细胞,置于37 ℃恒温培养箱中培养。挑取阳性单菌落进行鉴定,并送至公司测序。将测序验证正确的菌液提取质粒,转化至EHA105农杆菌感受态细胞中,挑取单菌落进行 PCR 鉴定,并命名为pNP1302-35S-PdHY5。对于PCR检测正确的菌液加入1/2体积的75%甘油置于-80 ℃冰箱保存。
1.2.3 遗传转化和再生培养基的配制共培养培养基(1 L):MS+30 g/L蔗糖+7.5 g/L琼脂。
筛选培养基(1 L):MS+0.3 mg/L 6-苄基腺嘌呤(6-BA)+0.1 mg/L吲哚丁酸(IBA)+ 10 mg/L潮霉素(Hyg)+ 300 mg/L特美汀(Tim),调节pH至5.8~ 6.2。
生根培养基(1 L):MS+0.3 mg/L IBA +10 mg/L Hyg + 300 mg/L Tim,调节pH至5.8~6.2。
农杆菌培养基:LB液体培养基+50 mg/L卡那霉素(Kan)+50 mg/L利福平(Rif)。
1.2.4 烟草的遗传转化及PCR鉴定采用农杆菌介导的叶盘法进行烟草遗传转化,将含有pNP1302-35S-PdHY5重组质粒的农杆菌,于恒温振荡培养箱中28 ℃活化培养 16~18 h 至OD600在0.4~0.6之间用于转化。将剪好的烟草叶片在农杆菌中侵染8 min,无菌滤纸吸干多余菌液,平铺于共培养培养基上。置于黑暗条件下2~3 d后转入筛选培养基上,待再生芽长至1 cm时剪下接入生根培养基中,待根系健壮移栽至温室并进行分子鉴定。
转基因植株的DNA提取采用DNA 提取试剂盒(康为世纪),以引物35S-F、PdHY5-R检测目的基因PdHY5,以引物HPTⅡ-F、HPTⅡ-R检测标记基因HPTⅡ,引物序列如表1所示。以pNP1302-35S-PdHY5重组质粒作为阳性对照,野生型烟草叶片 DNA 作为阴性对照,对转基因苗进行PCR检测。
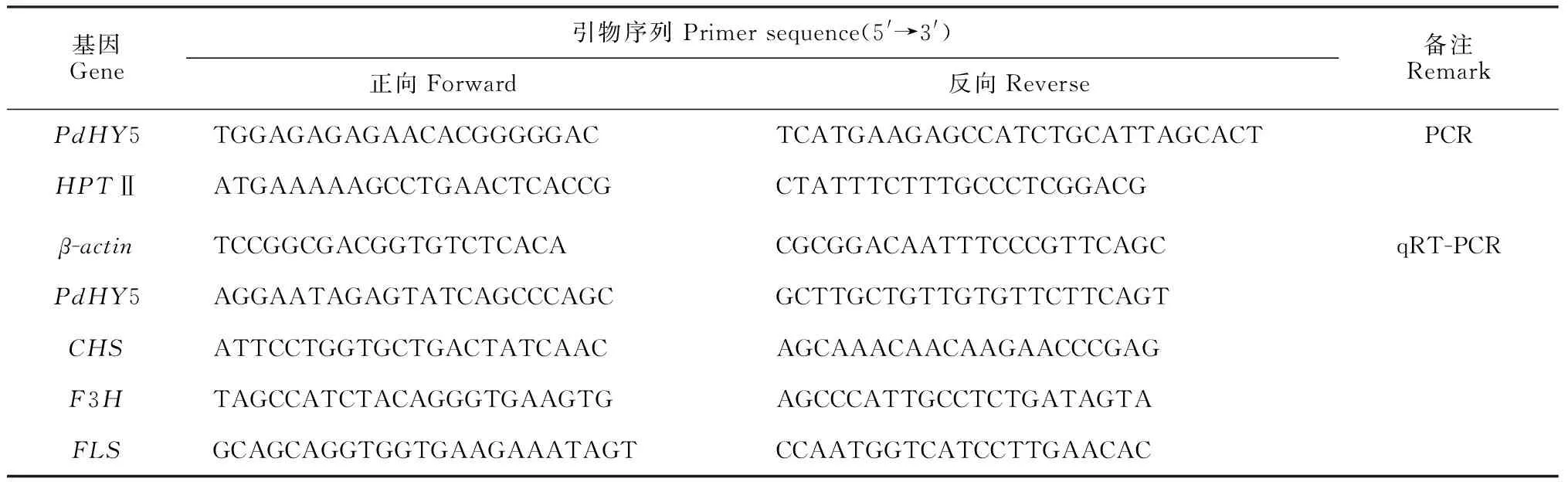
表1 引物序列表
1.2.5 转基因烟草的荧光定量qRT-PCR分析对PCR鉴定为阳性的植株,利用RNA提取试剂盒提取野生型和转基因烟草的叶片RNA,利用‘哧溜’反转录试剂盒反转录成cDNA,以烟草β-actin为内参基因,利用DNAMAN软件设计PdHY5基因和花青素合成通路中关键酶基因的qRT-PCR引物如表1。配制体系如下:2×MagicSYBR Mixture 10 μL,前后引物各0.4 μL, Template cDNA 1 μL,ROX Reference Dye I 0.2 μL,ddH2O 8 μL。反应程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环。每个处理3次重复,利用公式2-ΔΔCt法计算野生型及转基因烟草中PdHY5基因和花青素合成通路中关键酶基因的相对表达量。
1.2.6 花色素苷相对含量的测定选取野生型烟草和转基因烟草株系第一片成熟叶片,参照Rabino等[11]的方法,进行叶片花青素相对含量的测定。首先用电子天平称取剪碎的叶片0.1 g, 置于 15 mL离心管中,加入10 mL 1%盐酸甲醇提取液,32 ℃恒温箱中提取4~5 h。离心后取上清液,测定在530和657 nm的吸光值A530和A657,每个处理3个重复。花色素苷相对含量计算公式为:ΔA=(A530-1/4A657)/W;式中,W表示叶片鲜重。
2 结果与分析
2.1 PdHY5转录因子序列分析
毛果杨PtHY5与‘全红’杨PdHY5基因序列比对结果如图1所示,PdHY5基因有3个单碱基突变(SNP位点),分别位于5′端第151位、283位和289位。碱基的突变造成‘全红’杨氨基酸序列第51位由A(丙氨酸)突变成T(苏氨酸),151位由R(精氨酸)突变成G(甘氨酸)。其余位置氨基酸一致。

图中黑色表示完全保守的核苷酸序列,序列顺序为5′到3′图1 基因PtHY5(毛果杨)与PdHY5(‘全红’杨)序列比对The black represents the completely conserved nucleotide sequence, the sequence order is 5′ to 3′.Fig.1 Sequence alignment of PtHY5 (Populus trichocarpa) and PdHY5 (Populus deltoides ‘Quanhong’) gene
2.2 PdHY5蛋白的理化性质及结构预测
利用在线软件ExPASy分析可知,PdHY5基因共编码169个氨基酸,该蛋白分子式为C763H1278N252O271S4,蛋白分子量为18 446.31 Da,理论等电点为9.59,此蛋白不稳定系数为72.36,将其分类为不稳定蛋白。亲水性平均值(GRAVY)为-1.183,该蛋白为亲水性蛋白。HY5蛋白的二级结构由45.56% 的α-螺旋、2.37% 的β-折叠、52.07% 的无规则卷曲构成,该蛋白不包含延伸链结构。TMHMM分析该蛋白不存在跨膜螺旋结构,表明PdHY5蛋白为膜内蛋白。
2.3 PdHY5蛋白的多序列比对和系统进化分析
PdHY5蛋白的序列比对结果(图2)显示,筛选到与其相近的几个物种的HY5蛋白序列,分别为毛果杨(Populustrichocarpa)、旱垂柳(Salixmatsudana)和芒果(Mangiferaindica)等,其中PdHY5蛋白与毛果杨PtHY5相似性最高(98.82%)。采用NJ法构建PdHY5与其他物种HY5蛋白的系统发育树,结果(图3)表明,PdHY5蛋白与毛果杨(Populustrichocarpa)属于同一分枝,亲缘关系最为接近。

图3 PdHY5蛋白与其他植物HY5蛋白的系统进化分析Fig.3 Phylogenetic analysis of PdHY5 protein and HY5 protein in other plants
2.4 PdHY5基因功能预测
为了预测PdHY5基因潜在的功能,鉴于‘全红’杨PdHY5蛋白与毛果杨PtHY5蛋白仅存在2个氨基酸残基的差异及目前尚无‘全红’杨参考基因组,因此将本研究获得的PdHY5蛋白序列导入STRING数据库,以毛果杨为参考基因组,进行互作蛋白预测。结果(图4)表明,至少预测出了5个与PdHY5互作的蛋白。这些蛋白参与了花青素的合成代谢、形态发生及光合作用等生物过程,同时,与之互作的转录因子hy5样异构体、E3泛素蛋白连接酶RFWD2及光调节锌指蛋白COP1均参与了花青素的合成代谢,这也进一步提示,PdHY5蛋白可能确实具有直接或间接调控花青素的生物合成及代谢的功能。

节点之间的连线表示两个蛋白有助于共同的功能,其中,蓝色关联线表示来自数据库中的关联;紫色关联线为实验确定;黄色关联线为文本挖掘;黑色关联线为共表达;灰色关联线表示互作蛋白之间具有同源性图4 以毛果杨蛋白数据库为参考构建的PdHY5蛋白的互作网络图The lines between the nodes indicate that the two proteins contribute to a common function, where the blue lines represent the association from the database; the purple lines are experimentally determined; the yellow lines are text mining; the black association lines are co-expression and the grey lines indicate homology between interacting proteinsFig.4 Interaction network map of PdHY5 protein based on P. trichocarpa protein database
2.5 重组表达载体的构建
以‘全红’杨cDNA为模板,PCR扩增后利用1%琼脂糖凝胶电泳检测到510 bp的条带,与目的条带大小一致(图5,A)。对重组过表达载体pNP1302-35S-PdHY5用NcoⅠ 和PmlⅠ 进行酶切检测,电泳结果(图5,B)显示,目的条带位置准确,过表达载体构建成功。将重组表达载体 pNP1302-35S-PdHY5转化农杆菌后挑取单个菌落摇菌,进行PCR验证。由图5,C可以看出,在510 bp处有一条清晰的条带,证明重组质粒pNP1302-35S-PdHY5成功转化入农杆菌中。图6为构建成功的载体示意图, 以PdHY5基因为目的基因,潮霉素磷酸转移酶基因(hygromycin phosphotransferase gene;HPTⅡ)作为标记基因。
A. PdHY5基因克隆;B. 过表达载体的酶切检测;C. 过表达载体转化农杆菌的检测图5 重组表达载体构建过程A is the cloning of PdHY5 gene, B is the enzyme digestion detection of the overexpression vector, and C is the detection of Agrobacterium transformed by the overexpression vectorFig.5 Construction process of recombinant expression vector

RB. T-DNA 右边界;35S. CaMV35S polyA;tNOS. 终止子;LB. T-DNA 左边界图6 植物转化载体的构建示意图RB. T-DNA right border; 35S. CaMV35S polyA; tNOS. Nopaline synthase terminator; LB. T-DNA left border Fig.6 Schematic diagram of the construction of plant transformation vector
2.6 转PdHY5基因烟草的获得及鉴定
图7为以未转化叶片为对照,用含有pNP1302-35S-PdHY5重组质粒的农杆菌侵染烟草叶片,经过潮霉素筛选得到抗性植株及移栽到温室的过程。

A和B分别为野生型烟草在不含Hyg和含10 mg/L Hyg的分化培养基上的结果;C为转化叶片在含10 mg/L Hyg的筛选培养基上出芽;D为得到的转基因植株;E为转基因烟草在10 mg/L的生根培养基中生根;F为转基因烟草移栽至温室图7 非转化叶片为对照以及转化叶片出芽到转基因烟草的获得A and B are the results of wild-type tobacco on differentiation medium without Hyg and with 10 mg/L Hyg, respectively; C is the result of transformed leaves sprout on the medium containing 10mg/L Hyg; D shows the obtained transgenic plants; E shows the transgenic tobacco rooting in 10 mg/L rooting medium; F shows the transgenic tobacco transplanted to the greenhouseFig.7 Non-transformed leaves as controls and transformed leaves sprouted into transgenic tobacco
对过表达烟草植株提取DNA,扩增目的基因
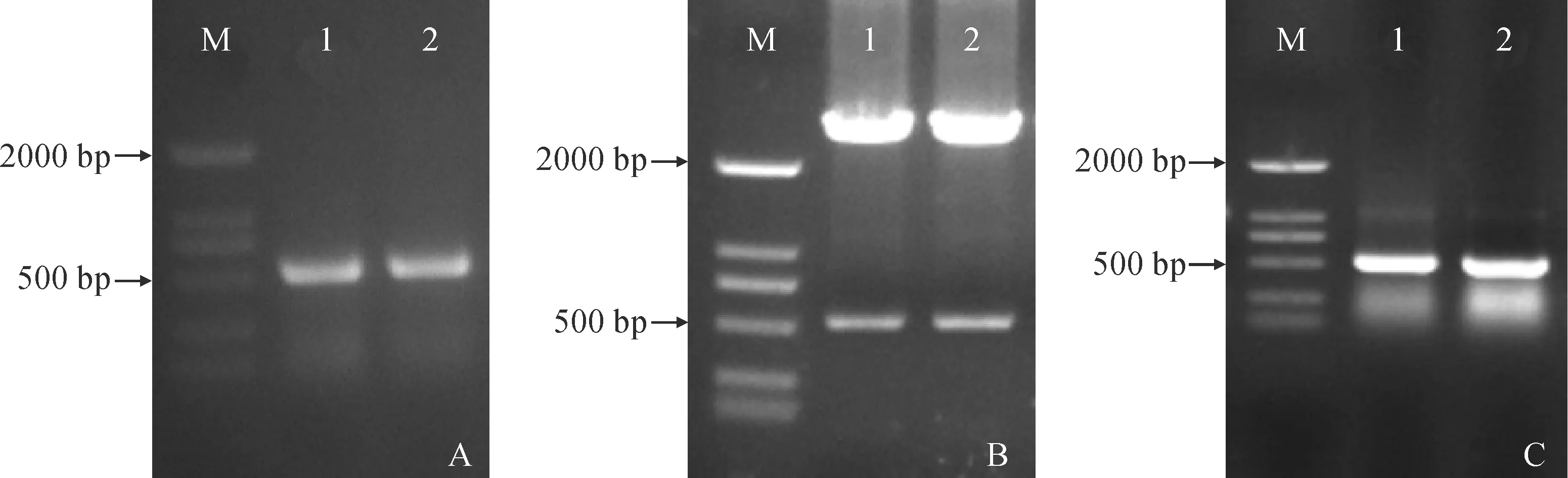
PdHY5和标记基因HPTⅡ,结果如图8所示,共获得4个过表达株系,均扩增出与阳性对照一致的510 bp目的基因条带(图8,A)和1000 bp左右HPTⅡ 基因条带(图8,B),表明目的基因插入烟草基因组中并稳定存在,将它们分别命名为S1、S2、S3、S4。
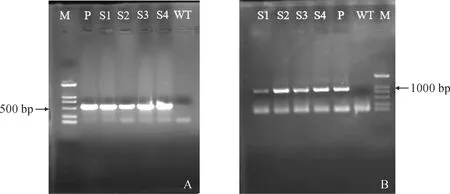
将野生型烟草基因表达量定为“1”,对4个转基因株系进行PdHY5基因和花青素合成通路中关键酶基因CHS、F3H及FLS的表达量检测,如图9所示,过表达PdHY5基因的烟草中花青素合成通路中的3个关键酶基因表达量较野生型均显著上调,其中S4株系上调最多,PdHY5、CHS、F3H、FLS相对表达量分别为对照的109.57、25.41、18.53和12.94倍。这表明过表达‘全红’杨PdHY5基因能调控烟草本身花青素合成通路中关键酶基因的表达。本研究选择PdHY5表达量较高的3个株系(S2、S3、S4)进行花色素苷含量的测定。
M.DL2000;P.阳性质粒;WT. 野生型烟草; S1、S2、S3、S4. 4个转基因株系 图8 转基因烟草的PCR鉴定M. DL2000; P. Positive plasmid; WT. Wild-type tobacco; S1, S2, S3,and S4. 4 transgenic tobacco linesFig.8 PCR identification of transgenic tobacco
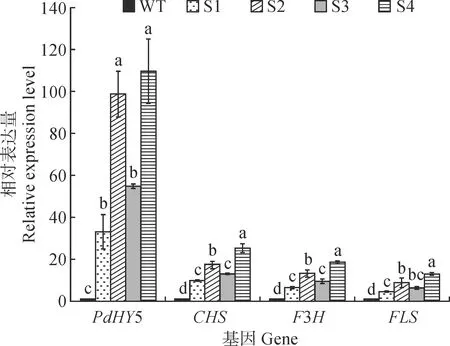
柱上不同小写字母表示差异显著(P<0.05),图10同图9 转基因烟草外源PdHY5基因和内源花青素合成途径关键酶基因的表达Different normal letters on the columns indicate significant differences (P<0.05), the same as Fig.10Fig.9 Expression analysis of exogenous PdHY5 gene and endogenous anthocyanin synthesis pathway key enzyme genes in transgenic tobacco
2.7 花色素苷含量的测定
进一步对烟草进行花色素苷含量进行测定(图10)。结果表明3个过表达株系S2、S3、S4的花色素苷含量分别比对照显著增加了128.23%、97.36%和134.20%,表明异源过表达‘全红’杨PdHY5基因对烟草本身叶片中花色素苷含量具有明显积累作用。
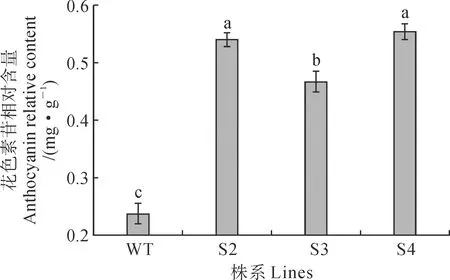
图10 不同烟草株系花色素苷相对含量对比Fig.10 Comparison of the relative content of anthocyanins in different tobacco lines
3 讨 论
HY5属于bZIP家族,是第一个被发现的参与光形态建成的转录因子[12-13],近年来被证实在其他方面也发挥着重要的作用。例如,花青素的合成调控[14]、响应光信号转导[15]等。本研究在‘全红’杨中克隆的PdHY5基因CDS序列长510 bp,共编码169个氨基酸。对PdHY5进行蛋白序列比对,匹配到的均为木本植物,与同属的毛果杨亲缘关系最近,曹诗梦等[16]在对葡萄风信子MaHY5蛋白与其他植物HY5蛋白的系统发育分析中也发现,HY5蛋白分为单子叶和双子叶两个进化枝,同科属植物首先聚为一类。这从进化的角度验证了不同科属植物间的亲缘关系以及HY5在进化过程中的保守性。
本研究通过构建过表达载体并遗传转化烟草,获得的转基因株系中花色素苷相对含量显著高于野生型。这与HY5在其他植物中促进花青素积累的研究结果一致。桃中 PpHY5 能够激活花青素合成途径中的结构基因PpCHS1、PpCHS2、PpDFR1 的表达,最终促进桃中花青素的积累[17]。B-box(BBX)家族是一组锌指蛋白,毛果杨PtBBX23 对花青素合成途径中的结构基因CHS、F3H及 MYB 转录因子 MYB115、MYB119 具有转录激活的作用,HY5 通过 C 端 bZIP 结构域与PtBBX23 基因 N 端的第二个 B-box 相互作用来增强对下游基因的激活活性,从而诱导花青素的合成[18]。CHS被广泛认为是花青素生物合成途径中第一个重要的酶[19-21],并且CHS的转录是通过HY5蛋白依赖的方式和光介导的[22-24]。本研究发现,转PdHY5基因烟草在花青素合成通路中结构基因CHS、F3H、FLS表达量显著上调,说明异源过表达‘全红’杨PdHY5基因,调控了烟草本身花青素合成途径中结构基因的转录表达,从而促进了转基因烟草中花青素的合成与积累。
虽然花色素苷的含量升高,但转基因烟草未发现变红的现象。推测其原因可能与外源基因整合的位点有关,当整合到与生长发育有关的基因附近时,外源基因的表达就会受生长发育基因的调控,而转基因烟草培育时间较短,导致其相关表型还未完全体现。此外,qRT-PCR结果显示PdHY5基因虽然在转基因株系中过表达,但可能是由于受到泛素化降解等某些途径的抑制,导致其蛋白水平较低,还有待于通过Western Blot方法检测蛋白含量来进一步验证。另外,可能是因为影响植物变色的因素有很多,许多植物在较低的温度下才能呈现出彩叶效果。史宝胜研究表明,昼夜温差大于15 ℃有利于美人梅、紫叶李表现出彩叶[25]。张少平等[26]研究表明在高温和强光环境下,紫背天竺叶片会退变成绿色。土壤的酸碱度对叶片呈色也有一定的影响,一些植物在微碱性或中性土壤中促进呈色,酸性土壤则会生长不良[27]。综上,植物叶片呈色的过程可能是受生长发育调控和环境因子共同作用的结果。
本研究对‘全红’杨PdHY5基因在花青素合成调控过程中的功能进行了验证,发现其在一定程度上能促进花青素的合成,这也为今后分子手段培育林木彩叶植物提供了一定的理论参考。
