CPNE3调控非小细胞肺癌细胞增殖、迁移、侵袭及其相关机制研究
2023-01-03刘泽毅黄建安
蔡 馨,刘泽毅,黄建安
215006 江苏 苏州,苏州大学附属第一医院呼吸与危重症医学科,苏州大学呼吸疾病研究所
肺癌在全世界范围内是导致癌症相关死亡的最主要病因,2020年全世界约有180万人死于肺癌[1]。根据临床组织病理分型,肺癌患者中约85%被诊断为非小细胞肺癌(non-small cell lung cancer, NSCLC)[2]。近年来,肺癌的诊疗工作获得了长足的进步,靶向治疗和免疫治疗的应用显著提高了晚期NSCLC的治疗效果,但NSCLC患者总体的生存及预后仍未见明显改善,最新统计数据显示肺癌患者的预计5年生存率仅21%[3-4]。因此,进一步寻找影响NSCLC增殖和转移的关键分子并探究其分子机制对于寻找新的药物靶点、提高疗效和改善患者预后都有十分重要的作用。
CPNE3是钙依赖性的膜结合蛋白家族——Copines中的一员,在各种组织和器官中普遍表达。结构上,CPNE3在其N-端包含两个串联C2结构域,作为钙依赖性磷脂结合基序,参与细胞信号传导或膜泡运输;在其C-端包含的A结构域发挥蛋白结合结构域的作用[5]。从作用机制来讲,CPNE3表现出激酶活性,可以磷酸化H1组蛋白和碱性磷脂蛋白,激活下游信号通路,从而发挥生物学功能[6]。CPNE3在多种癌症中发挥的作用已被证实,但CPNE3在NSCLC中发挥作用的具体分子机制仍有待进一步研究。因此,本研究旨在通过体外细胞实验和体内动物实验两个方面探索CPNE3在NSCLC中发挥的作用及其具体机制。
1 材料与方法
1.1 主要仪器与试剂
Lipofectamine 2000转染试剂(Thermo Fisher Scientific公司);CPNE3干扰序列(苏州吉玛基因股份有限公司);CCK-8试剂(碧云天公司);RPMI-1640培养基(Hy-clone公司);胎牛血清(Gibco公司);结晶紫染液(上海生工公司);CPNE3、β-actin抗体(Proteintech公司)、p-AKT、AKT、p-ERK、ERK、p-EGFR、EGFR抗体(CST公司);山羊抗鼠IgG、山羊抗兔IgG(北京康为世纪生物科技有限公司);空白对照和过表达CPNE3慢病毒(上海吉凯公司)。
1.2 细胞培养
人肺癌细胞株(A549、H1299、H460、H520)和正常支气管上皮细胞株(BEAS-2B)均从上海中国科学院细胞库购买。细胞均在含有10%FBS和1%双抗(100 U/mL青-链霉素)的RPMI-1640的完全培养基中、37 ℃、5% CO2条件下恒温培养。
1.3 瞬时转染
将A549细胞接种在6孔板中,当细胞密度达到40%~60%时,按照Lipofectamine 2000转染试剂说明书进行转染。48~72 h后,收集细胞用于进一步实验。CPNE3的干扰序列如下:si-CPNE3-1 siRNA:5′-GGG-ACUGGUCAUUCAAGAUTT-3′; si-CPNE3-2 siRNA:5′-GCAAUGGAAUCCAAGGCAUTT-3′。
1.4 CCK-8法检测细胞实验
将A549细胞以每孔3×103个细胞的密度接种在96孔板中,每组设置3个复孔,分别在铺板后24、48、72 h加入10 μL CCK-8试剂,继续放到培养箱中培养2 h,然后用酶标仪测定细胞在450、630 nm的吸光度(OD值)。
1.5 克隆形成实验
将A549细胞以1×103/mL的密度接种于小皿中,摇匀后放入培养箱培养,5~7 d后显微镜下观察,待每个细胞克隆含有约10~15个细胞数时,取出培养皿,PBS洗涤后甲醇固定30 min,再用结晶紫染色2 h,使用相机拍照并计数。
1.6 Transwell实验
将A549细胞接种在6孔板中,转染48 h,待细胞密度达到90%,消化细胞并使用含1% FBS的培养基重悬细胞,进行细胞计数。向基质胶包被的小室上室中加入200 μL含6×104细胞的细胞悬液,向无基质胶的小室上室加入200 μL含3×104细胞的细胞悬液,下室均加入800 μL完全培养基。培养24 h,取出小室,PBS洗涤后甲醇固定30 min,再用结晶紫染色2 h,用棉棒轻轻擦去上室表面细胞,于显微镜下观察拍照并计数。
1.7 Western blot实验
在A549细胞中瞬时转染干扰序列后,使用RIPA法提取细胞总蛋白。以每孔50 μg蛋白样品量加样,用湿转法将蛋白转至NC膜上,4 ℃过夜孵育一抗,次日TBST洗4次,每次5 min,室温孵育二抗2 h,TBST洗4次,每次5 min,显影液孵育数秒后,使用化学发光成像仪检测蛋白表达。
1.8 动物模型实验
选用4~6周龄,体质量16~20 g的雌性BALB/c nude小鼠10只(由上海斯莱克实验动物有限公司提供,批号:0051246)。在A549细胞中使用慢病毒侵染细胞构建CPNE3的过表达稳转细胞株。培养对照组和CPNE3过表达细胞株,待细胞处于对数生长期时消化,离心后使用无血清的培养基重悬。计数并调整细胞浓度为4×106/50 μL,取等体积的基质胶混合,随后迅速置于冰上备用。在无菌条件下吹打细胞混匀,随后用1 mL胰岛素注射器分别吸取100 μL细胞混悬液接种于裸鼠的两侧肋下,使其成为一皮丘,5~7 d后待皮丘消退,观察小鼠成瘤情况。密切记录成瘤时间,以后每隔2天使用游标卡尺测量肿瘤长径和短径值,按照计算公式:V(mm3)=a×b2/2计算体积,其中a为长径,b为短径。同时观察裸鼠体质量及生长状态等。待肿瘤体积达800 mm3时处死裸鼠,取裸鼠皮下瘤体拍照、称重,并研磨组织蛋白,Western blot检测相关蛋白表达水平。
1.9 生物信息学分析
从癌症和肿瘤基因图谱(the cancer genome atlas,TCGA)数据库(https://portal.gdc.com)获得NSCLC组织的RNA-seq数据和临床信息,并与配对癌旁组织的RNA-seq数据对比,得到配对差异分析结果,使用Rstudio软件v4.0.3进行统计分析,P值<0.05被认为具有统计学意义。Kaplan-Meier生存分析比较上述两组或多组之间的生存差异。对于Kaplan-Meier曲线,P值和具有95%CI的风险比(hazard ratio,HR)通过logrank检验和单变量Cox回归得出。
1.10 统计学分析

2 结果
2.1 NSCLC组织中CPNE3高表达并与患者的不良预后相关
基于来自TCGA数据库获得的NSCLC组织的RNA-seq数据和临床信息进行生信分析,结果显示,与配对癌旁组织相比,CPNE3在NSCLC组织中表达水平显著升高(P=0.024,图1A),且与患者的不良预后相关(HR=2.198 7,P=0.001 2,图1B)。
2.2 NSCLC细胞株中CPNE3表达升高
通过Western blot检测CPNE3在正常支气管上皮细胞株BEAS-2B和NSCLC细胞株A549、H1299、H460和H520中的表达水平(图2)。与正常支气管上皮细胞相比,CPNE3在NSCLC细胞的表达显著升高。选取表达量中等的A549细胞进行后续实验。
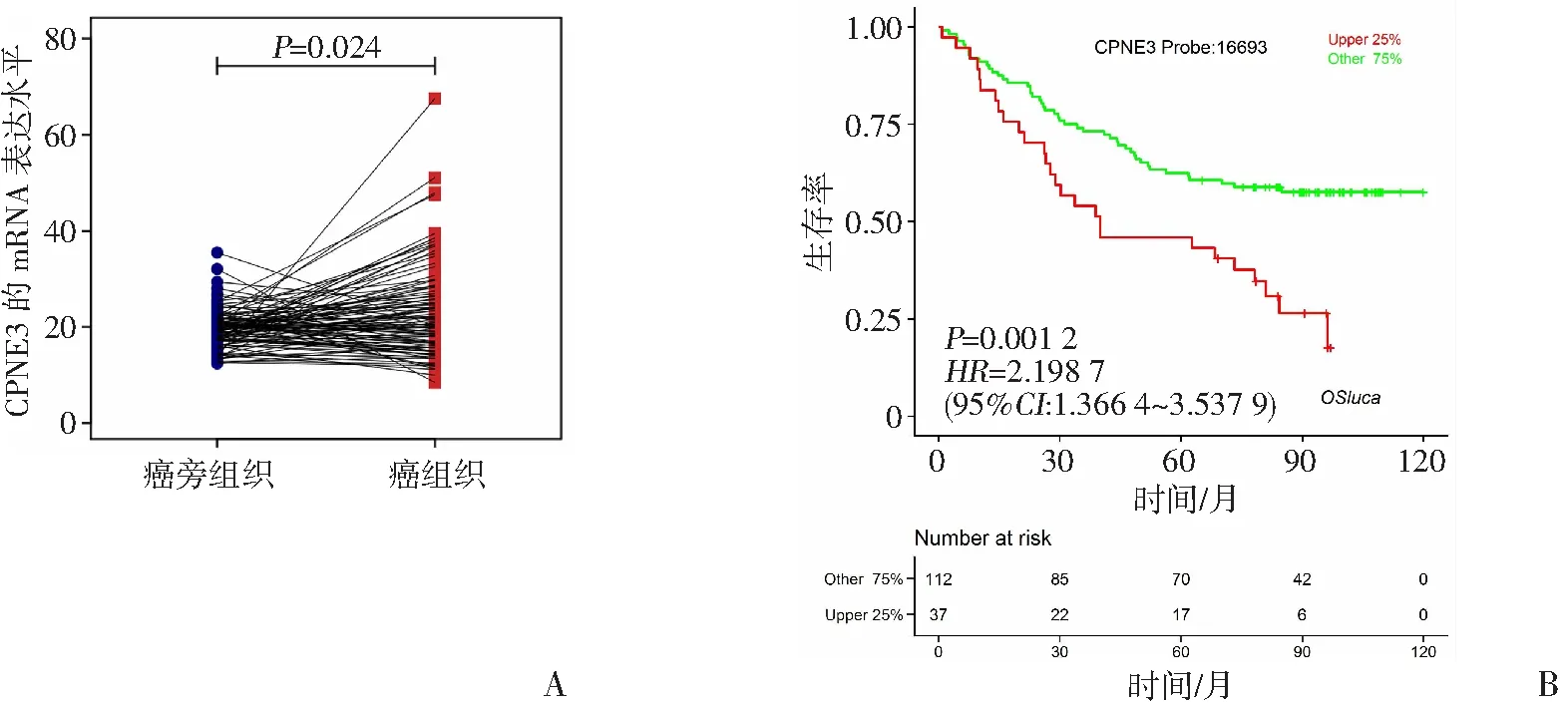
A:TCGA数据库分析配对的106对癌/癌旁组织中CPNE3的mRNA表达情况(n=106);B:TCGA数据库中CPNE3表达情况与NSCLC患者预后的相关性
2.3 干扰CPNE3抑制A549细胞的增殖、迁移和侵袭
在A549细胞株中转染干扰序列,Western blot检测CPNE3蛋白水平显著降低(图3A),通过CCK-8实验和克隆形成检测发现,与si-NC组相比,si-CPNE3-1和si-CPNE3-2组A549细胞的增殖能力显著降低(P<0.001,P<0.001,图3B、C)。Transwell实验表明si-CPNE3-1组和si-CPNE3-2组的细胞较si-NC组相比,迁移和侵袭能力亦显著降低(P<0.001,P<0.01,图3D)。
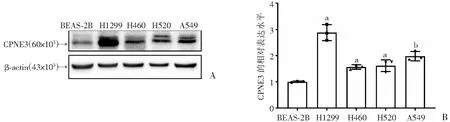
a:P<0.001,b:P<0.01,与BEAS-2B比较
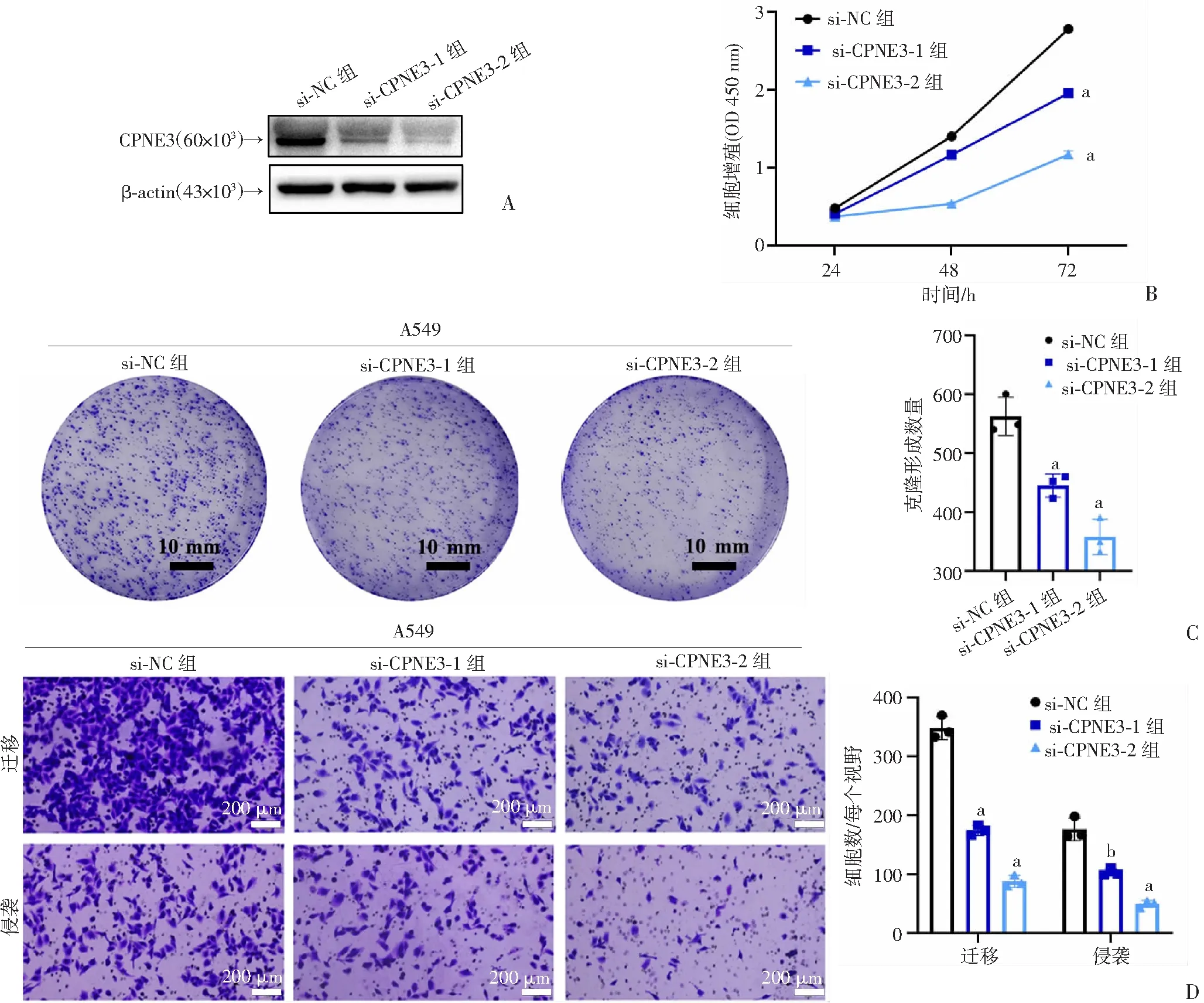
A:Western blot检测CPNE3干扰后蛋白水平;B:CCK-8法检测干扰CPNE3后细胞的增殖能力a:P<0.001,与si-NC组比较;C:克隆形成实验检测干扰CPNE3后细胞的增殖能力 a:P<0.01,与si-NC组比较;D:Transwell实验检测干扰CPNE3后细胞的迁移和侵袭能力 a:P<0.001,b:P<0.01,与si-NC组比较
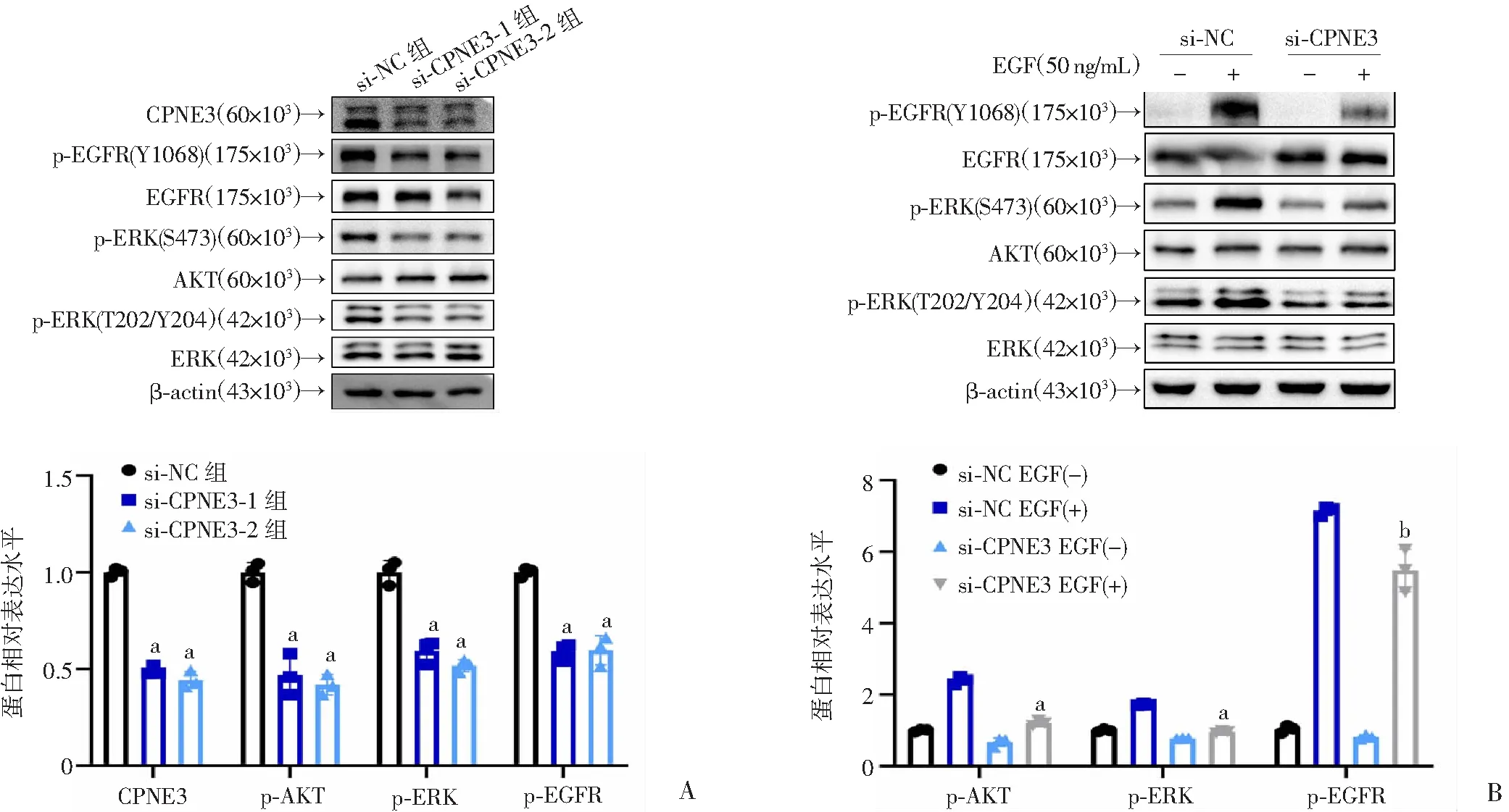
A:Western blot检测A549细胞干扰CPNE3后各组之间CPNE3和下游蛋白的表达和定量结果 a:P<0.001,与si-NC组比较;B:Western blot检测EGFR磷酸化水平及其下游相关信号通路蛋白的表达和定量结果 a:P<0.001,与si-NC EGF(+)组比较;b:P<0.01,与si-NC EGF(+)组比较
2.4 CPNE3对AKT/ERK和EGFR信号通路的影响
在A549细胞中干扰CPNE3后,通过Western blot检测增殖和转移相关蛋白标志物的表达水平变化。结果显示,与si-NC组相比,si-CPNE3组AKT、ERK和EGFR的磷酸化水平显著下降,而总AKT、ERK和EGFR的表达并没有显著变化(图4A)。为了进一步验证CPNE3和EGFR信号通路的关系,在CPNE3干扰组加入外源性EGF(50 ng/mL)刺激,30 min后提取总蛋白。Western blot结果显示,与si-NC EGF(+)组相比,干扰CPNE3后,外源加入EGF所诱导的EGFR磷酸化及其下游相关信号通路的激活被抑制(图4B)。证明干扰CPNE3后可以通过EGFR信号通路抑制NSCLC细胞的增殖、迁移和侵袭。
2.5 过表达CPNE3在体内增强A549细胞的增殖能力
通过构建裸鼠皮下移植瘤模型,观察皮下移植瘤生长速度、肿瘤重量,发现与NC组相比,过表达CPNE3组的瘤体生长速度明显更快,瘤体重量也高于NC组(图5A~C)。通过Western blot检测瘤体组织的蛋白表达情况,发现过表达CPNE3组AKT、ERK和EGFR的磷酸化水平显著上升(图5D)。证明过表达CPNE3可以增强A549细胞在体内的增殖能力,这与EGFR信号通路的激活相关。
3 讨论
本研究首先通过TCGA数据库生信分析发现:CPNE3在NSCLC组织中表达明显升高,并且其高表达与NSCLC患者的不良预后显著相关,提示CPNE3可能作为癌基因在NSCLC中发挥促癌作用,并可能对患者的预后有一定指导意义。随后通过一系列体外表型实验和体内动物实验进行研究探索,发现干扰CPNE3可以抑制A549细胞的增殖、迁移和侵袭能力,伴随着AKT/ERK、EGFR的磷酸化水平的下降;提示CPNE3通过影响EGFR及其下游信号通路发挥作用。体内动物实验进一步证实了过表达CPNE3可以在裸鼠体内促进移植瘤的生长。以上结果证实了CPNE3这一膜结合蛋白家族成员,在肿瘤的发生发展中发挥重要作用,有潜力成为全新的治疗靶点或者评估患者预后的分子标志物。
Copines是一个钙依赖性的膜结合蛋白家族,在真核生物中普遍存在,具有高度保守、可溶性的特点。目前已确定该家族中有九个成员,越来越多的证据表明,Copines家族成员参与了多种癌症的发生和进展[7]。
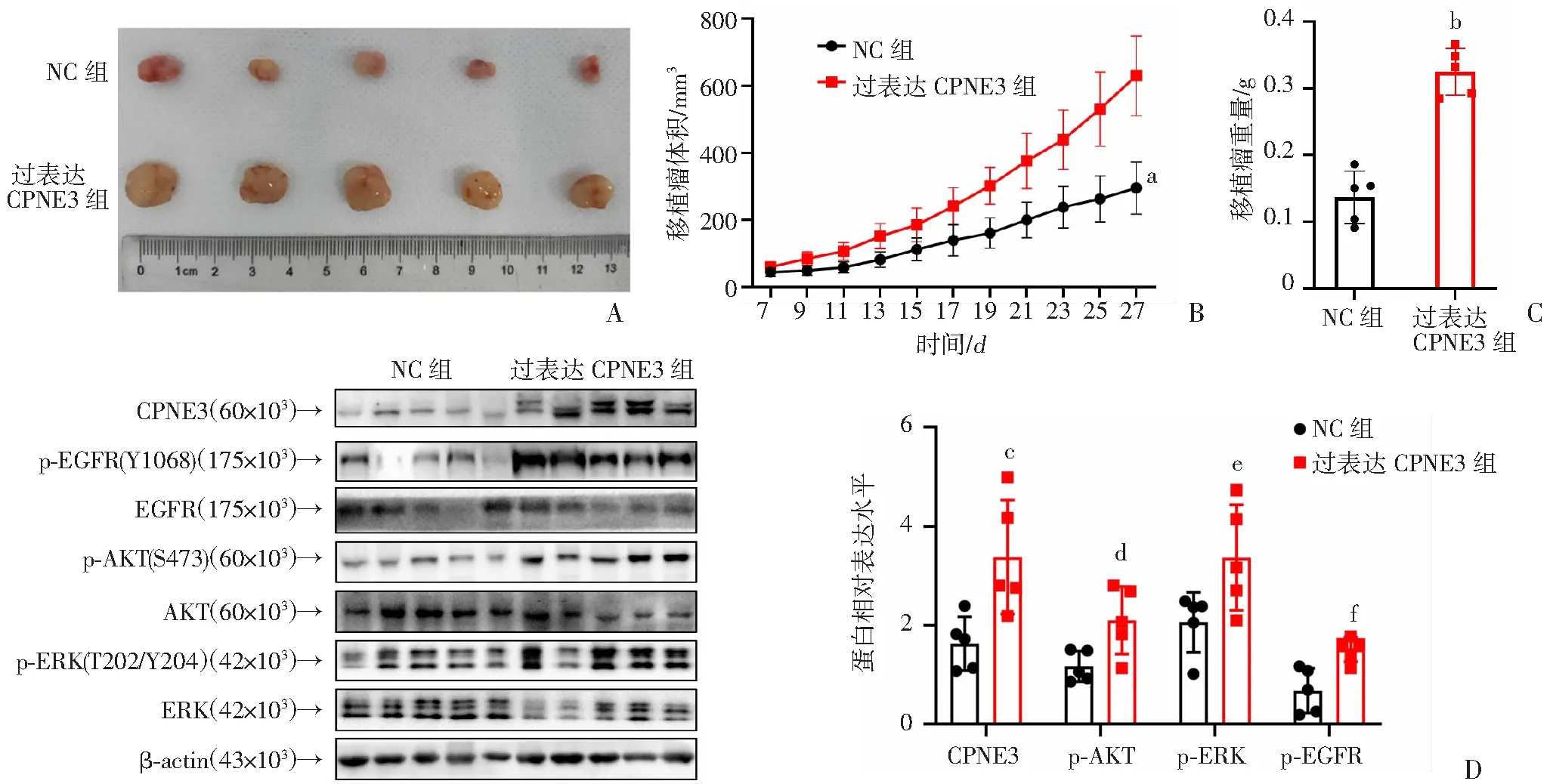
a:P<0.001,与NC组比较;b:P<0.001,与NC组比较;c:P<0.05,与NC组比较;d:P<0.05,与NC组比较;e:P<0.05,与NC组比较;f:P<0.01,与NC组比较
在本文中重点研究的CPNE3是该家族中的一员,其在肿瘤发生发展中的作用得到越来越多的关注。已有文献报道,在乳腺癌中,CPNE3可以通过激活ErbB2蛋白诱导上皮-间充质转化(epithelial mesenchymal transition, EMT),继而促进乳腺癌细胞侵袭和迁移[8]。在结直肠癌中,相关研究发现外泌体中CPNE3水平较低的结直肠癌患者的无病生存期和总生存期明显更好,提示CPNE3可能作为诊断和评估结直肠癌患者预后的生物标志物[9]。在肝细胞癌中,有研究证实敲低CPNE3的表达会增强肝细胞癌细胞对分子靶向药物索拉非尼的敏感性[10]。在胶质母细胞瘤中,研究表明CPNE3可以通过激活PI3K/AKT通路促进肿瘤细胞的增殖、迁移和侵袭[11]。在NSCLC中,CPNE3可以与RACK1相互作用并激活黏着斑激酶(focal adhesion kinase, FAK)信号通路,促进NSCLC的增殖和转移[12]。
CPNE3在多种癌症中发挥的促癌作用提示其可能与重要肿瘤相关信号通路存在潜在联系,其机制亟需进一步探索,为肿瘤靶向治疗的临床实践提供新的线索。
