不同二代ALK -TKIs二线治疗ALK阳性晚期非小细胞肺癌的耐药基因变异分子图谱差异
2023-01-03徐晓波周洁白刘子龙张东辉李佳旻
丁 宁, 徐晓波, 周洁白, 张 勇, 刘子龙, 刘 洁, 张东辉,2,李佳旻, 胡 洁,2
200032 上海,复旦大学附属中山医院呼吸与危重症医学科1;201104 上海,上海市老年医学中心呼吸与危重症医学科2
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌一种分子亚型,占比3%~7%[1]。ALK基因与其他基因发生断裂后重排,产生ALK融合蛋白,通过激活PI3K-AKT、RAS、JAK-STAT信号通路,促进肿瘤增殖,被认为是肺癌的驱动基因之一[2-3]。间变性淋巴瘤激酶-酪氨酸激酶抑制剂(anaplastic lymphoma kinase-tyrosine kinase inhibitor,ALK-TKIs)通过与激酶域特定区域(三磷酸腺苷结合口袋)结合,进而抑制其激酶活性,阻断ALK融合蛋白激活下游通路,从而发挥抗肿瘤作用[2-3],进而显著提高ALK阳性晚期NSCLC患者的生存率。但ALK-TKIs治疗后肿瘤细胞可进化获得耐药性,仍会导致疾病复发。研究表明,ALK-TKIs的获得性耐药机制通常为ALK依赖型及非ALK依赖型[4-6]。第二代ALK-TKIs后线治疗的耐药机制中有相对较高比例的ALK激酶域二次突变发生(50%~70%)[5-7]。而体外细胞株研究结果显示,不同二代ALK-TKIs对不同突变位点的活性存在差异和交叉耐药[7-9]。因此,有必要深入了解不同二代ALK-TKIs耐药机制之间的差异,从而对临床用药的全局化管理提供佐证。
本研究为观察性研究,ALK阳性晚期NSCLC患者在二代ALK-TKIs后线治疗耐药后再活检的肿瘤组织或液体活检样本的肿瘤相关基因变异情况,比较不同二代ALK-TKIs的耐药机制差别,以期指导未来的治疗决策。
1 资料与方法
1.1 研究对象
研究纳入103例2014年1月至2020年10月本中心确诊的ALK融合阳性非小细胞肺癌患者。受试者入组标准:所有患者经病理组织学检查确诊为NSCLC患者;初诊时具有完整的影像学和内镜检查结果,根据国际肺癌研究协会 (International Association for the Study of Lung Cancer, IASLC)第8版TNM分期明确为IV期或不可根治治疗的III期患者; 初始诊断时肿瘤组织标本采用以下任意一种或多种方法检测为ALK阳性:Ventana免疫组化染色、原位免疫荧光杂交(FISH)、聚合酶链式反应(polymerase chain reaction,PCR)或二代测序技术(next generation sequencing,NGS);接受一代ALK-TKI克唑替尼治疗后,按实体瘤的疗效评价标准(RECIST 1.1)评估确认为疾病进展,并紧接着以二代ALK-TKIs(阿来替尼、色瑞替尼、布格替尼、恩沙替尼)为后续治疗者;在二代ALK-TKIs治疗后以RECIST 1.1标准确认为疾病进展,且具有足够符合标准的生物学标本进行NGS检测,并具有完整临床相关信息资料者。排除标准:非ALK+肺癌患者;患者未采取二代TKI作为二线靶向治疗方案。本研究经复旦大学附属中山医院伦理委员会批准(B2017-142R),患者均知情同意。
1.2 研究方法
为比较4种二代ALK-TKIs的耐药后的基因组图谱,送检标本包括肿瘤组织、血浆、脑脊液和胸腔积液。为了克服肿瘤异质性,本研究汇集了在同一时间点收集的所有类型合格标本中检测到的基因改变进行分析。所有样本与全血样本匹配,作为阴性对照。生存随访:无进展生存期(progression-free survival,PFS)定义为从开始特定ALK-TKIs治疗之日起至疾病进展或最后一次随访之日。
1.3 基因检测NGS方法
样本检测采用基于靶向425或139个癌症相关基因的基因组DNA提取和杂交捕获。如以往研究报道进行 DNA 提取、文库制备和基于杂交的靶向富集,以及测序和数据分析[10]。2个基因panel均覆盖ALK基因所有外显子(包括侧翼内含子区域)和融合相关内含子。
肿瘤组织原始中位平均测序深度1310X(128X-4992X),去dup后中位平均测序深度802X(36X-3728X);血浆ctDNA和胸水或脑脊液上清cfDNA原始中位平均测序深度5827X(1096X-40334X),去dup后中位平均测序深度2528X(438X-10158X)。白细胞对照原始平均测序深度>100X。
不同样本类型基因扩增定义阈值不同,肿瘤组织基因扩增定义为≥4.0拷贝数,血浆ctDNA和胸水/脑脊液上清样本基因扩增定义为≥3.2拷贝数。
1.4 统计学分析
本研究采用Fisher精确检验用于比较不同药物治疗组别患者之间以及不同变异体组别患者之间的基因突变频率,使用R软件(4.0.3版本)进行相关统计分析。
2 结果
2.1 患者基线特征
本研究纳入2014年1月至2020年10月共计103例符合入组标准的ALK融合阳性晚期NSCLC患者,均为一线克唑替尼治疗耐药后、二线接受二代ALK-TKIs治疗后再次耐药,且行再活检进行下一代测序(NGS)检测。中位年龄48(25~76)岁, 大部分为65岁以下、女性、不吸烟、腺癌,其中99例(阿来替尼组56例、色瑞替尼组25例,布加替尼组15例、恩沙替尼组3例)检测到ALK变异和具有临床意义的其他肿瘤驱动基因变异纳入耐药后基因变异分子图谱分析。阿来替尼、色瑞替尼、布加替尼3组患者的中位PFS分别为7.5、6.5和14.2个月,因恩沙替尼仅3例患者,故未统计PFS。具体患者信息见表1。
2.2 二线二代ALK-TKIs 治疗后耐药突变图谱复杂多样
66.7%(66/99)检出ALK激酶结构域耐药突变,其中G1202R/K比例最高,占18.2%(18/99),L1196M其次,占14.1%(14/99,图1);21.2%(21/99)患者检出旁路和下游信号通路活化,其中包括PIK3CA(5/99)、KRAS(4/98)、PTEN(4/99)、MET(3/99)。12.1%(12/99)患者出现2种ALK耐药突变,有5.1%(5/99)患者出现多个ALK耐药突变(见表2)。此外,有33.3%(33/99)患者耐药原因为非ALK依赖型。
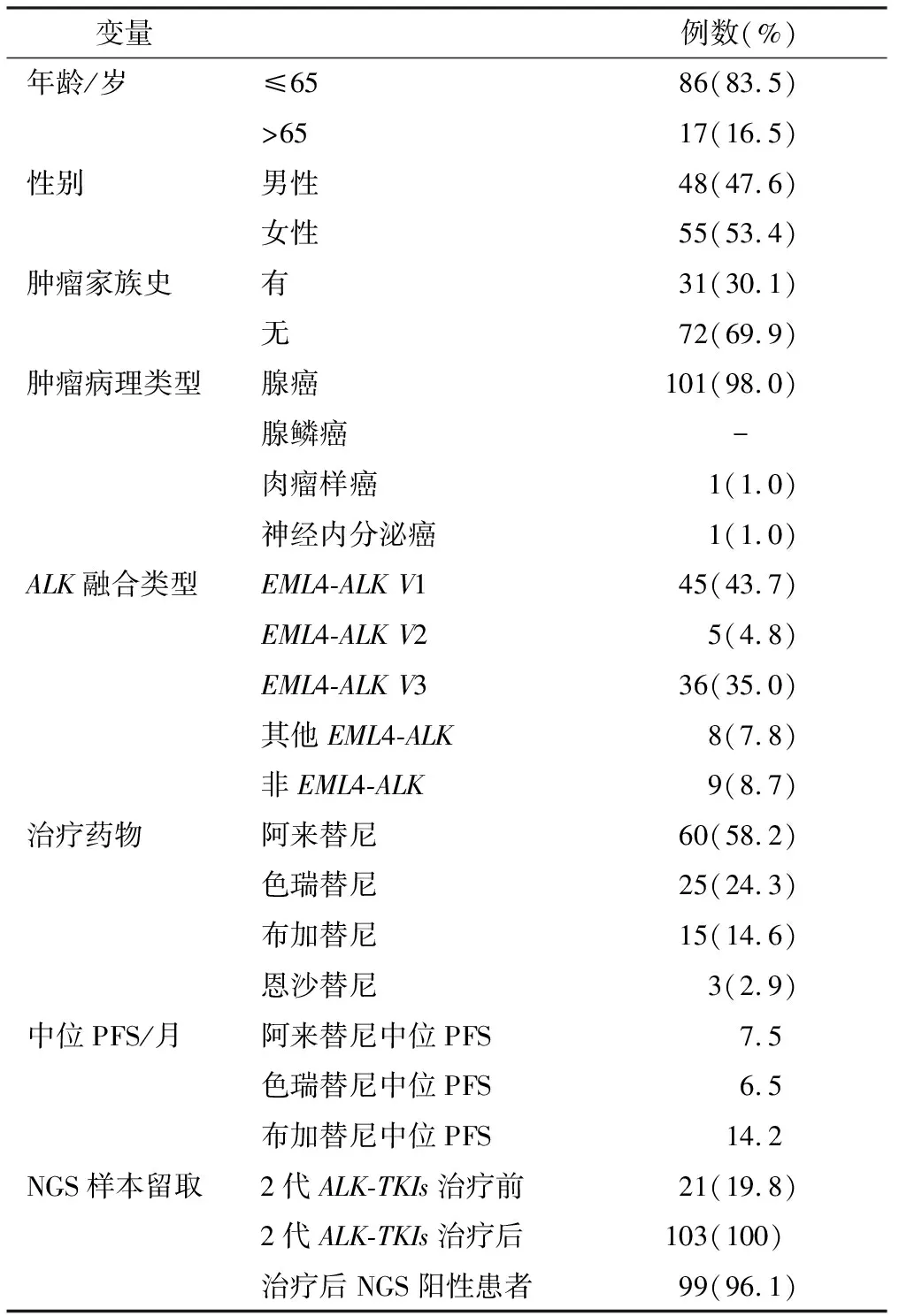
表1 103例应用二代ALK-TKIs二线治疗ALK阳性晚期
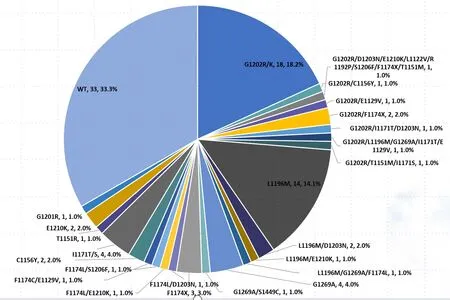
图1 二代ALK-TKIs 二线治疗ALK 阳性晚期NSCLC耐药后基因变异图谱比例图
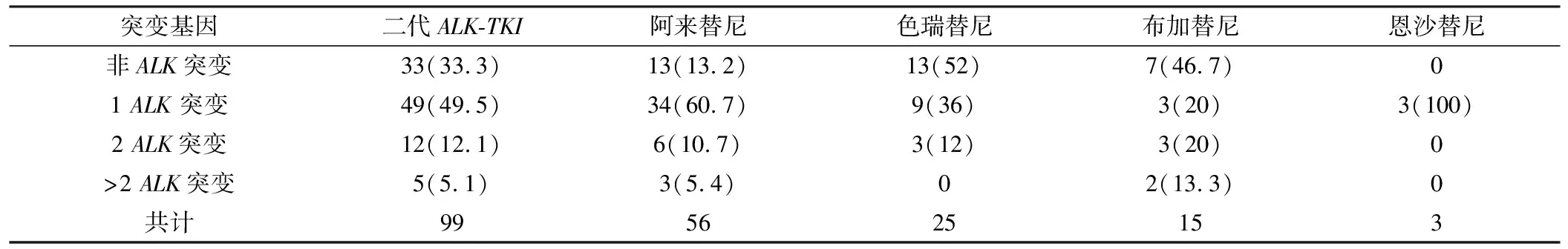
表2 不同ALK-TKIs治疗组二线治疗ALK阳性晚期NSCLC耐药后的ALK突变数量 [n =99,例(%)]
注:饼图的比例是把所有患者检测到的ALK突变个数相加,计算ALK激酶域每个突变占比
2.3 不同EML4-ALK融合变体不同耐药基因发生率存在显著差异
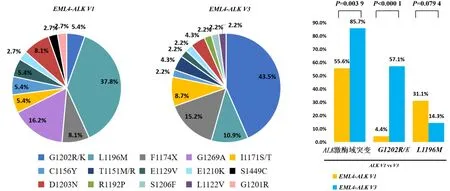
45例V1型变异体和35例V3型变异体经过一代克唑替尼和二代ALK-TKIs二线治疗后,ALK继发突变发生率存在显著差异。V3型患者更易发生ALK激酶结构域继发性突变,发生率为85.7%(30/35),而V1型发生率则仅为55.6%(25/45)(P=0.003 9)。V3型的G1202R/K突变发生率显著高于V1型,分别为57.1%(20/35)、4.4%(2/45),差异具有统计学意义(P<0.000 1)。L1196M发生率则在V1型中相对更为常见(31.1%,14/45),V3型为14.3%(5/35)(P=0.079 4,图2)。
2.4 不同二代TKI二线治疗耐药突变图谱存在差异
因为此次入组的恩沙替尼患者只有3例,不具代表性,因此主要分析了其余3种二代TKIs的耐药后基因变异图谱(图3)。阿来替尼、色瑞替尼和布加替尼3种药物二线治疗耐药后的主要差异之一为ALK继发突变发生率不同,分别为76.8%(43/56)、48%(12/25)、53.3%(8/15)(P=0.02),其中阿来替尼的ALK继发突变发生率最高。
其次是耐药位点存在差异:其中G1202R发生率分别为31.6%(阿来替尼),33.3%(色瑞替尼)及10.0%(布加替尼),但P值无显著差异(P=0.24);G1269A(7/56)均发生在阿来替尼组(P=0.07),其中有2例为与其他ALK位点的复合突变;色瑞替尼G1202R、L1196M、F1174X和C1156Y发生率较高;而布加替尼F1174X、D1203N、E1210K发生率较高。D1203N(P=0.000 2)和E1210K(P=0.003 5)主要发生在布加替尼耐药后,布加替尼组F1174X发生率也高于阿来替尼和色瑞替尼组(P=0.13,图4)。
3 讨论
3.1 ALK-TKIs治疗ALK阳性晚期NSCLC耐药后基因变异图谱具有共性
本研究为目前最大样本量、根据耐药后再活检的NGS结果,比较同期接受不同二代ALK-TKIs治疗耐药后基因变异图谱异同的真实世界研究。虽然目前对ALK-TKI的获得性耐药机制基本已有初步认识[4,11],主要为以下四种类型:①ALK激酶结构域的耐药突变;②旁路及下游信号通路的激活(如EGFR扩增、IGF1R过表达、HER2扩增、MET扩增、BRAFV600E突变等);③组织学转化(如腺癌-小细胞癌转化等);④一代ALK-TKIs药物的药代动力学因素导致的耐药,但一代ALK-TKIs与二代ALK-TKIs的上述各耐药机制发生占比有所差异[6],二代ALK-TKIs耐药后ALK激酶结构域的耐药比例达50%~60%,远高于一代ALK-TKIs的20%~30%。有研究报道克唑替尼最常见的ALK获得性耐药突变为G1269A、F1174X和L1196M;而接受过一种或多种二代ALK-TKIs治疗患者主要的ALK耐药突变为G1202R/del。我们此次研究的结果也进一步佐证了这一现象。
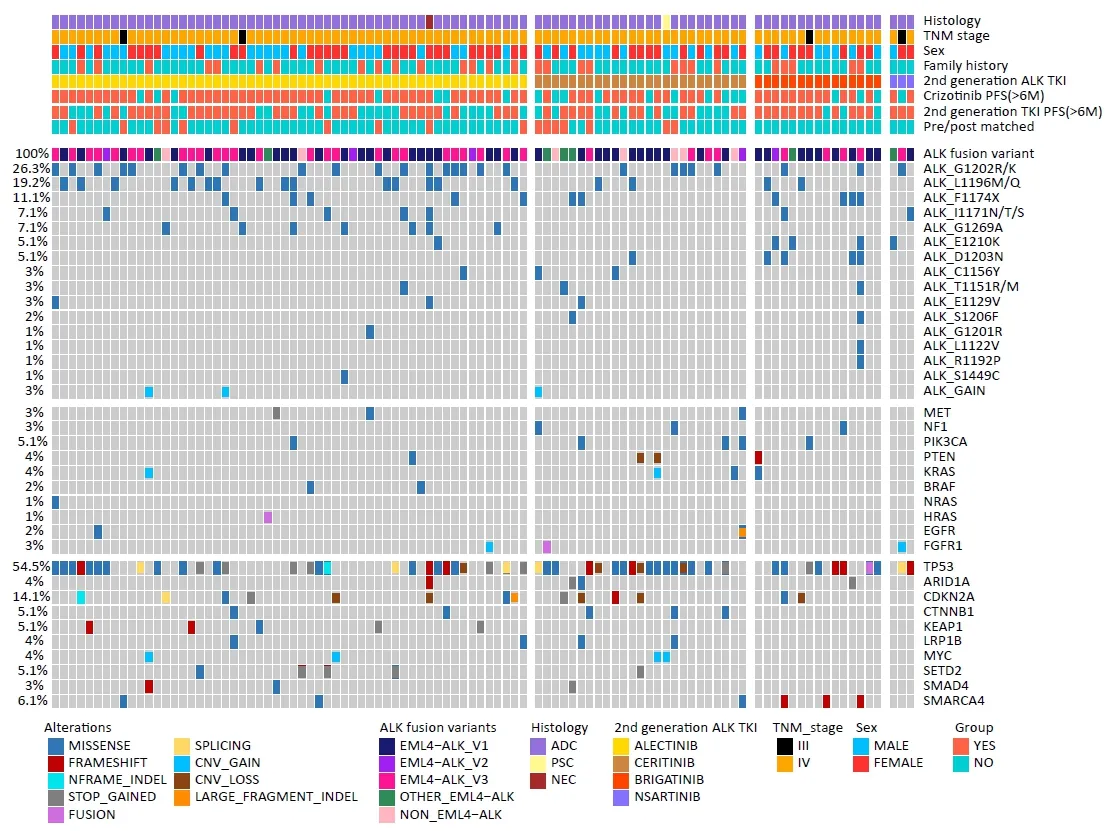
图3 二代ALK-TKIs二线治疗ALK阳性晚期NSCLC耐药后基因突变图谱

注:饼图的比例是把所有患者检测到的ALK突变个数相加,计算ALK激酶域每个突变占比
3.2 不同变异体ALK阳性晚期NSCLC二代ALK-TKIs二线治疗后的耐药基因图谱存在显著差异,提示临床治疗决策时需要充分考虑ALK变异的异质性
本研究比较了V1和V3型患者接受二线二代ALK-TKIs治疗后的耐药机制差异。V1及V3型是ALK融合患者最常见的两种变体,本研究纳入的V1及V3型患者占总研究人群的78.7%,两者间的耐药机制存在差异:V3型患者的ALK激酶结构域突变比例明显高于V1型,且V3的G1202R突变型明显高于V1型,具有统计学差异。这与既往报道相一致[16]。本研究亦观察到V1型患者的L1196M突变明显高于V3型患者的趋势。这些发现有助于为ALK阳性晚期NSCLC患者的精准分层治疗提供依据,例如,V3亚型的患者是否可以优先推荐三代ALK-TKI的前线应用,从而规避后续获得性G1202R耐药,以期延长患者的PFS甚至OS。
3.3 不同二代ALK-TKIs用于二线治疗ALK阳性晚期NSCLC的耐药突变图谱差异明显,且复合突变比例高,无法充分发挥其特异性抑制ALK变异的优势
本研究结果进一步发现不同二代ALK-TKIs的ALK耐药突变存在差异。阿来替尼耐药后ALK激酶结构域突变比例最高。对于二代ALK-TKI治疗患者最常见的耐药突变G1202R突变,则更常见于阿来替尼和色瑞替尼,这也是符合既往文献的分析报道[6]。G1296A(7/56)突变则全部发生在阿来替尼组,其中有3例患者同时存在G1296A位点和其他位点的复合突变,2例患者同时存在PTEN等旁路或下游信号通路激活,其他2例患者仅仅找到G1296A的单一位点突变。因此对于G1296A是否为阿来替尼独有的耐药机制需作以下思考:① 在ALK-TKIs的体外试验显示色瑞替尼和阿来替尼均能有效抑制G1296A突变,但体外试验的结论并不能完全替代药物的临床疗效,因此在色瑞替尼组无一例出现G1296A突变,反之验证了G1296A可能是阿来替尼获得性耐药的重要位点[7];②G1296A也常见于克唑替尼耐药后,因本试验缺乏克唑替尼耐药后的基因数据做参考,无法确定G1296A出现的与治疗相关的时间节点[6];③对于同时存在其他ALK复合突变及旁路或下游信号通路活化的患者,需考虑除外G1296A,存在阿来替尼多重耐药机制的可能;④ 存在其他没有检测到的耐药基因(如血液样本检测对MET扩增检测的挑战)。另外,布加替尼组耐药突变D1203N(4/15)、E1210K(3/15)发生率高于阿来替尼组和色瑞替尼组。同样从体外试验来看,单一的D1203N及E1210K突变均对布加替尼敏感[7],而本试验布加替尼组耐药后出现的D1203N及E1210K突变比例最高。仔细分析可以看到本组试验人群中其中D1203N突变均为ALK复合突变,而3例E1210K突变有2例为ALK复合突变,这也能解释布加替尼的耐药原因。二代ALK-TKIs二线治疗耐药机制的异同,进一步佐证了多种ALK-TKIs的先后应用可能会导致后续产生多种复杂的耐药机制共存的现象,如包含ALK的复合突变与ALK合并其他旁路下游通路激活等同时发生。这一复杂耐药机制必将增加后续治疗难度。二代ALK-TKIs的交替应用,或三代ALK-TKI也未必能全面克服这些多种耐药机制共存的复杂局面。
本研究中出现ALK位点的复合突变比例较文献报道略高,可能的原因一是与连续的ALK-TKIs的应用导致ALK的复合突变有关,也可能是由于NGS检测平台探针设计覆盖ALK基因所有外显子(包括侧翼内含子区域)和融合相关内含子,使ALK检出率提高,但更为重要的是,复合突变无疑会增加后线药物治疗难度。
因此二代ALK-TKIs应用于二线治疗无疑较难发挥他们特异性抑制ALK基因变异的优势。本研究中阿来替尼、色瑞替尼、布加替尼三组的中位PFS分别仅为7.5,6.5及14.2个月,与目前已报道的二代ALK-TKI二线治疗临床研究报道中位PFS相仿[12-15],远不如二代ALK-TKIs一线治疗ALK阳性晚期NSCLC的数据。临床上有必要将高效的特异性抑制剂前线使用,发挥最大疗效。同时,也必须重视基因的动态监测在ALK阳性患者治疗过程中的重要性,帮助临床医生明确患者耐药机制,采用针对性的新一代靶向治疗,或采用基于化疗或其他靶点的联合治疗,当然这都需要未来临床研究进一步验证。
3.4 本研究的局限性
因本研究开展的时间和药物的可及性因素影响,入组的患者均采用克唑替尼作为一线治疗。当今ALK阳性晚期NSCLC患者一线治疗优先推荐二代或者三代ALK-TKIs,因此我们还需要深入研究新一代ALK-TKIs一线治疗的耐药机制差异,助力对ALK阳性晚期NSCLC患者一线精细分层精准治疗和全程治疗策略的全局把握。
本研究还具有以下几个局限性:①本研究缺少克唑替尼耐药后样本,比较遗憾无法分辨克唑替尼一线治疗和二代ALK-TKIs二线治疗耐药诱导的ALK耐药突变。②由于组织可及性有限以及血浆检测MET扩增的挑战性,我们无法对所有患者进行MET突变分析,可能对MET扩增耐药机制的发生率会有一定影响。
总之,本研究深入分析了几种2代ALK-TKIs药物作为二线治疗ALK阳性晚期NSCLC患者的获得性耐药基因变异图谱的共性与差异。再次验证了ALK激酶结构域的耐药突变是二代ALK-TKIs最主要的获得性耐药机制;发现不同的变体如V1及V3型患者的耐药突变谱有所不同;且不同的2代ALK-TKIs耐药谱亦有差异,不仅加深了对ALK-TKIs耐药机制的理解,而且为临床制定ALK阳性晚期NSCLC治疗方案的决策提供了重要参考。
