GALNS蛋白在肝细胞癌中的临床意义及体外生物学功能
2023-01-03刘泽宇罗袁登谢传明张雷达
刘泽宇,罗袁登,李 勋,谢传明,张雷达
400038 重庆,陆军军医大学(第三军医大学)第一附属医院全军肝胆外科研究所
肝癌是一种高度侵袭性的原发性恶性肿瘤,是世界范围内第三大癌症死亡原因,患病率居第六位[1-4]。70%~85%的原发性肝癌为肝细胞癌。虽然检测和检验的技术手段不断发展,但如今肝癌的早期诊断仍具有挑战性,患者诊断出肝癌时往往已是晚期[5-8],而术后5年肿瘤复发的发生率可高达70%[9-14]。因此,为了改善肝癌患者的预后,亟待需要新的生物标志物出现[15],以帮助早期诊断,风险评估和靶向治疗[14, 16]。N-乙酰半乳糖胺-6-硫酸盐硫酸酯酶(N-acetylgalacto-samine-6-sulfatase, GALNS)是一种溶酶体酶,能够水解糖胺聚糖,如软骨素-4-硫酸酯和硫酸角蛋白[17-19]。有研究报道称,GALNS基因突变可促进了细胞外基质中硫酸角蛋白的积累[20-21],进而引起肿瘤发生[22]。另外以往的研究中也已发现在几种恶性肿瘤患者的血清中存在高水平的GALNS,并且证明其可作为诊断肺癌的潜在生物标志物[23]。但目前对GALNS与肝细胞癌的临床关系尚不清楚,本研究收集西南医院肝癌术后随访患者的临床病理数据,首次探究GALNS在肝细胞癌的临床意义及体外生物学功能。
1 材料与方法
1.1 一般资料
采用回顾性队列研究,收集陆军军医大学第一附属医院2008年至2014年间的72例肝细胞癌患者,其中男性49例,女性23例;中位年龄为47岁,年龄范围为19~73岁。患者术中取新鲜冰冻肝癌组织及癌旁组织标本。本研究通过中国人民解放军陆军军医大学第一附属医院伦理委员会审批,批件号:KY2020127。
1.2 纳排标准及病例筛选流程图
纳入标准:①肝癌患者行肝癌切除术;②术后组织病理学检查为肝细胞癌;③临床病理资料完整。
排除标准:①非肝癌因素死亡;②围手术期死亡的患者;③合并其他恶性肿瘤;④术前行介入栓塞或其他治疗。
病例筛选流程图见图1,入组72例患者基本资料见表1。

表1 入组病例基本资料表 (n=72)
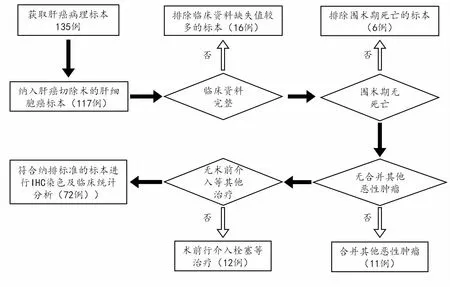
图1 病例筛选流程图
1.3 实验方法
1.3.1 免疫组织化学染色 将收集的标本以福尔马林溶液固定,石蜡包埋,5 μm连续切片。采用DAB染色方法,操作步骤参照试剂盒说明书进行染色。GALNS抗体浓度为1∶150。由两位独立的病理科医师进行双盲阅片,评估染色结果。
1.3.2 RT-qPCR 通过TRIzol法提取细胞总RNA,采用TaKaRa公司反转录试剂盒将总RNA反转录为cDNA后,以GAPDH为内参对照,检测GALNS mRNA的表达水平,采用2-ΔΔCt法分析定量PCR结果。
1.3.3 细胞体外迁移实验 Huh7细胞和LM3细胞分别转染siGALNS与siCtrl,48 h后将细胞消化接种于24孔板的Transwell小室内。24孔板内加入600 μL完全培养基,小室内加入200 μL无血清培养基重悬的细胞悬液,常规培养24 h。采用4%多聚甲醛固定20 min,结晶紫染色30 min,擦拭去室内未穿过的肝癌细胞。在100倍视野下拍照计数。
1.3.4 细胞增殖实验 Huh7细胞和LM3细胞接种于96孔板中,转染siGALNS与siCtrl。培养72 h后,用酶标仪检测波长450 nm下吸光度(OD值)。
1.4 观察指标和评价标准
1.4.1 观察指标 ①肝癌组织和癌旁组织GALNS表达及其与临床病理特征的关系,包括性别、年龄、淋巴结转移、远处转移、肿瘤长径、美国癌症联合会(American Jiont Committee on Cancer, AJCC)TNM分期、血管侵犯、病理分期和肝内转移。②肝癌患者预后及影响因素分析:GALNS表达、性别、年龄、淋巴结转移、远处转移、肿瘤长径、血管侵犯、病理分期和肝内转移。③体外实验验证GALNS对肝癌细胞迁移与细胞增殖的影响。
1.4.2 评价标准 免疫组织化学染色结果以染色强度及阳性细胞百分比进行评分,0分为阴性表达,1~4分为弱表达,5~8分为中表达,9~12分为高表达,将阴性表达、弱表达和中表达统一为低表达。
1.5 统计学分析
采用IBM SPSS Statistics 26 for Windows和R4.2.1统计分析及画图软件。分类计数资料,采用χ2检验来分析GALNS表达与临床病理特征之间的关系。采用独立样本t检验分析连续性变量的差异。Cox风险回归分析用于单因素和多因素分析肝细胞癌危险因素,并评估风险比(HR)和95%置信区间(CI)。P<0.05为差异有统计学意义。
2 结果
2.1 肝癌组织和癌旁组织GALNS表达及其与临床病理特征的关系
肝癌组织芯片免疫组织化学染色结果显示:如表2,GALNS在72例肝癌组织中低表达40例(阴性表达、弱表达、中表达分别为2、12、26例),高表达32例;GALNS在72例癌旁组织中低表达68例(阴性表达、弱表达、中表达分别为44、13、11例),高表达4例。通过卡方检验,较癌旁组织,GALNS于肝癌组织中高表达,差异有统计学意义(χ2=20.250,P<0.05)。免疫组化染色结果显示GALNS主要位于细胞质,见图2。
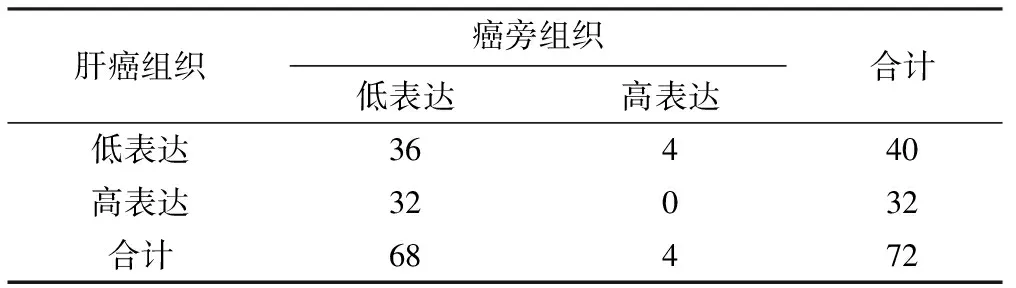
表2 肝癌患者癌与癌旁组织GALNS蛋白表达的
肝癌组织中GALNS蛋白高表达和低表达分别为32、40例,肿瘤长径为≤5 cm和>5 cm分别为19、53例,TNM分期为Ⅰ+Ⅱ期和Ⅲ+Ⅳ期分别为34、38例,无肝内转移与有肝内转移的分别为61、11例。GALNS蛋白高表达与肿瘤长径、TNM分期和肝内转移有关,差异均有统计学意义(χ2=20.649,14.849,5.667,P<0.05),性别、年龄、淋巴结转移、远处转移、血管侵犯和病理分期与GALNS蛋白高表达无关,差异均无统计学意义(P>0.05),见表3。

图2 GALNS蛋白在HCC癌旁组织和肝癌组织中的表达
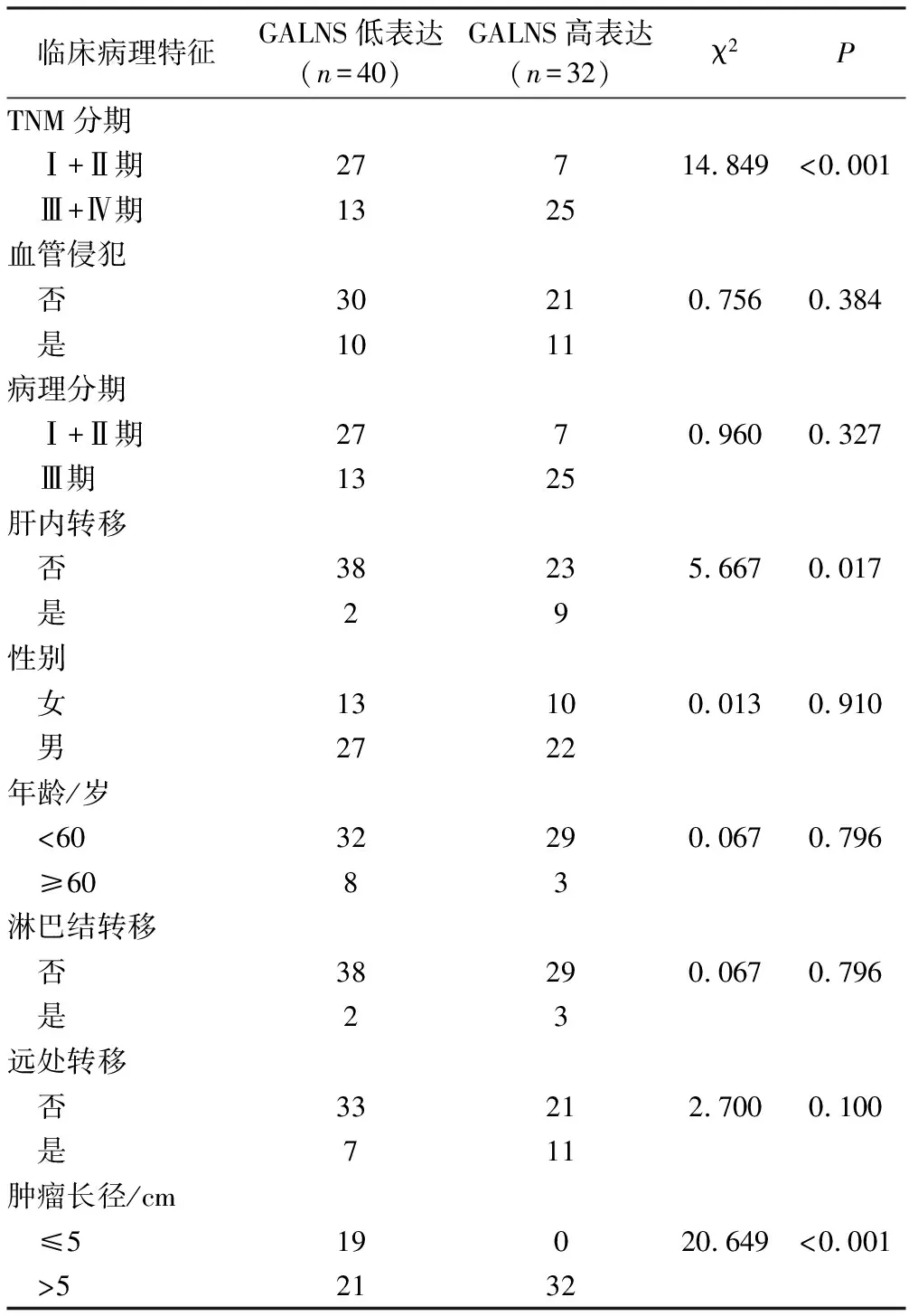
表3 GALNS低表达与高表达肝癌患者临床病理特征比较
2.2 肝细胞癌患者的预后及危险因素分析
72例患者均获得门诊或电话随访,术后中位随访时间为16.9个月。GALNS蛋白低表达和高表达肝癌患者,术后1、3、5年生存率分别为87.50%、42.50%、40.00%和37.50%、12.50%、3.13%。GALNS低表达组的生存率优于高表达组,两组比较差异有统计学意义(χ2=9.268,P<0.05),见图3。
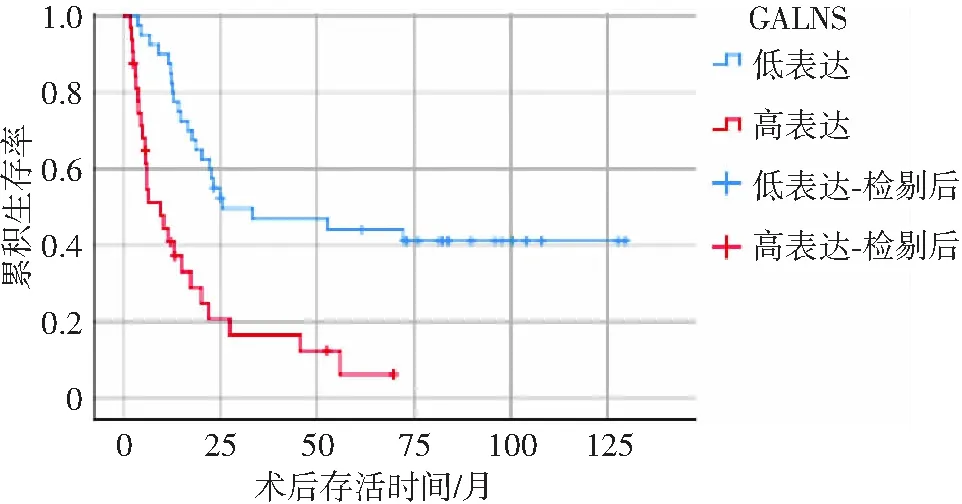
图3 肝癌患者中GALNS低表达与高表达患者术后生存曲线
单因素Cox风险分析结果显示:GALNS、远处转移、肿瘤长径、TNM分期、血管侵犯和病理分期是影响肝癌患者术后总体生存率的相关因素(P<0.05),性别、年龄、淋巴结转移、肝内转移不是影响肝癌患者术后总体生存率的相关因素(P>0.05),见表4。多因素Cox风险回归分析,采用逐步回归法筛选变量,结果提示:GALNS、远处转移、血管侵犯和病理分期均为肝细胞癌患者的独立危险因素,见表5。

表4 影响72例肝癌患者术后总体生存率的单因素分析
2.3 抑制GALNS表达对肝癌细胞增殖与迁移的影响
2.3.1 qRT-PCR检测siGALNS敲低GALNS mRNA效果 转染siGALNS和siCtrl的Huh7细胞中,GALNS mRNA的相对表达量分别为(31.35±3.6)%和(100±13.86)%。采用独立样本t检验比较,siGALNS可显著敲低GALNS mRNA表达水平,差异有统计学意义(t=6.66,P<0.05)。转染siGALNS和siCtrl的LM3细胞中,GALNS mRNA的相对表达量分别为(27.4±3.53)%和(100±8.25)%,采用独立样本t检验比较siGALNS可显著敲低GALNS mRNA表达水平,差异均有统计学意义(t=10.26,P<0.05)。

表5 影响72例肝癌患者术后总体生存率的多因素分析
2.3.2 CCK-8检测细胞增殖情况 Huh7细胞分别转染siGALNS和siCtrl后继续培养72 h,CCK-8吸光度值分别为(0.67±0.08)和(1.18±0.12),敲低GALNS可显著抑制Huh7细胞增殖能力,差异有统计学意义(t=7.05,P<0.05)。LM3细胞分别转染siGALNS和siCtrl后继续培养72 h,CCK-8吸光度值分别为(0.86±0.07)和(1.25±0.18),敲低GALNS可显著抑制LM3细胞增殖能力,差异有统计学意义(t=4.51,P<0.05),见图4。
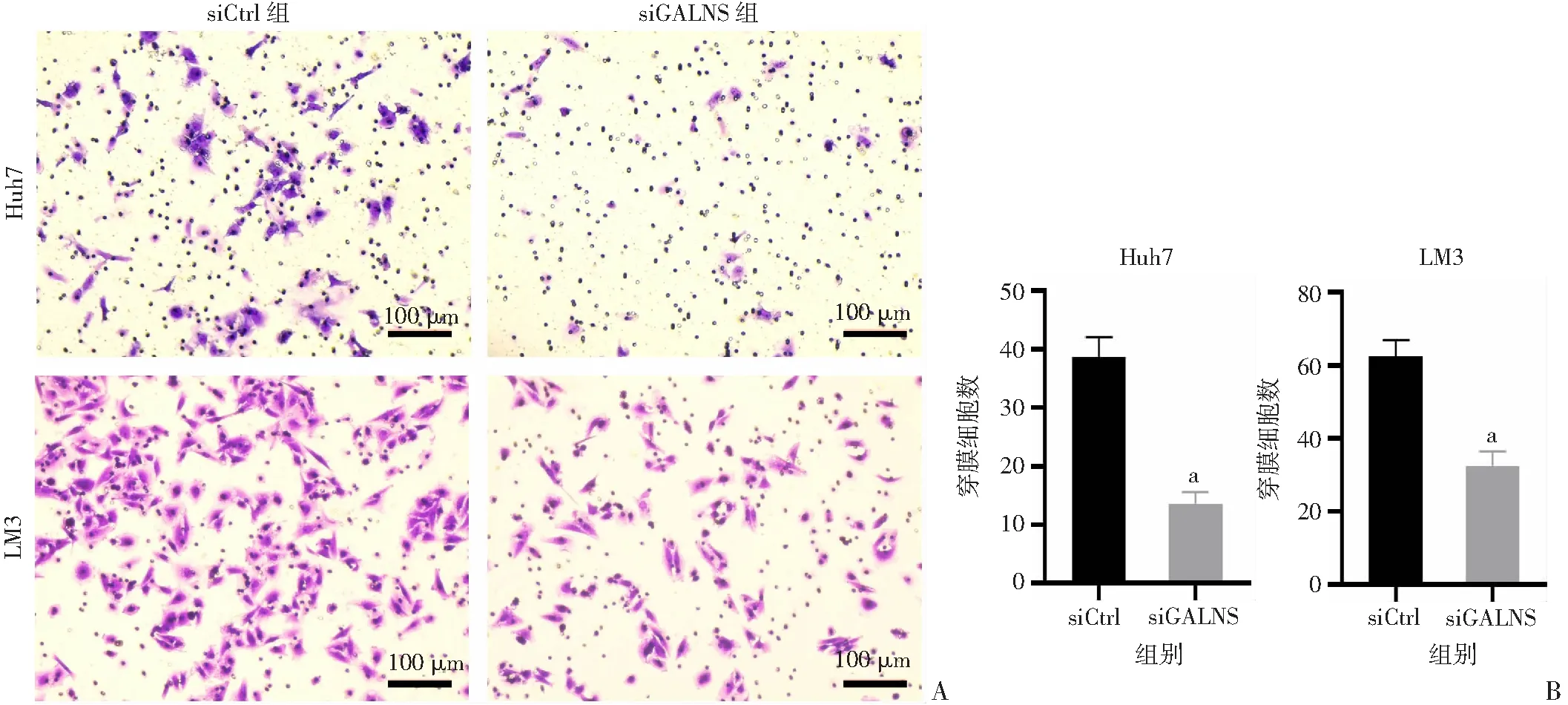
A:Transwell检测敲低GALNS后对Huh7和LM3细胞迁移能力的影响(结晶紫);B: Huh7、LM3细胞迁移能力分析 a:P<0.05,与siCtrl组比较
2.3.3 Transwell实验检测细胞迁移情况 分别转染siGALNS和siCtrl的Huh7细胞,穿膜细胞数分别为(13.5±1.85)和(38.46±3.25),敲低GALNS可显著抑制Huh7细胞迁移能力,差异有统计学意义(t=10.61,P<0.05)。分别转染siGALNS和siCtrl的LM3细胞,穿膜细胞数分别为(32.59±3.62)和(62.49±4.5),敲低GALNS可显著抑制LM3细胞迁移能力,差异有统计学意义(t=8.72,P<0.05)。见图5。
3 讨论
肝癌是全球第三大癌症死亡原因,患病率居第六位。肝细胞癌占肝癌总数的75%~85%。其起病隐匿,早期症状不典型,患者确诊时肿瘤常已发生远处转移,失去根治性手术机会导致预后较差。因此研究肝细胞癌预后标志物具有重要意义。
肿瘤微环境是肿瘤发展的细胞环境,除肿瘤细胞本身以外,肿瘤微环境还包括了细胞类型、细胞外基质、生长因子、蛋白水解酶及其他信号分子[24-25]。其中细胞外基质与肿瘤细胞之间的相互作用常常与肿瘤发生、进展和患者预后有着显著关联[26]。异常的胞外基质表达可促进癌细胞的迁移[22, 27]。软骨素-4-硫酸盐是一类糖胺聚糖,可共价连接在蛋白质上形成蛋白聚糖,也是细胞外基质的成分之一。不少研究报道其与胶质瘤[22]、前列腺癌[28]和乳腺癌[29]等恶性肿瘤均有关。既往有报道称致癌性HRAS信号通路活化可导致C4S减少,促进肿瘤细胞迁移能力增强和患者恶性肿瘤的易感性提高[30]。而GALNS是一类硫酸酯酶可去除C4S的硫酸盐基团,引起C4S水解[31-32],这提示GALNS可能与肿瘤发生发展有关。 “癌化”的微环境可给肿瘤生长和转移提供“温床”,癌细胞分泌的各种酶类可诱导细胞周围基质的变化[33-34]。相对稳定的细胞外基质是一个成分丰富的大分子网络,为细胞提供机械支架,介导信号分子的传递以维持细胞功能。周围基质的降解导致细胞外基质的重塑有利于肿瘤细胞的侵袭转移[35-36]。而GALNS作为消化糖胺聚糖的酶,其表达水平增高导致C4S等糖胺聚糖过度水解,引起细胞外基质成分的变化,有助于肿瘤侵袭转移的发生。
因此,本研究通过临床病理资料分析及体外实验验证GALNS在肝细胞癌中的临床意义及生物学功能:GALNS在大部分肝癌患者的肿瘤组织中表达水平升高;进一步分析了肝细胞癌患者临床病理因素与GALNS蛋白的关系发现:GALNS与肿瘤长径、TNM分期和肝内转移有关,提示GALNS的异常高表达与肝细胞癌患者的不良临床病理特征及预后密切相关;多因素Cox风险回归分析结果表明:GALNS表达、远处转移[37]、血管侵犯[38]和病理分期[39]是影响肝癌患者总体生存率的独立危险因素。由于GALNS与肿瘤长径、肝内转移有关,通过体外细胞实验检测发现GALNS具有促进肝癌细胞增殖和迁移的能力,敲低GALNS可有效抑制肝癌细胞增殖与迁移。今后深入研究GALNS在肝癌中的分子作用机制,未来有望作为诊断肝癌及靶向治疗的潜在生物标志物。
利益冲突所有作者声明不存在利益冲突
