细菌不同处理方式对16S rRNA基因PCR结果的影响
2023-01-03焦显芹刘红英
焦显芹,金 钺,刘红英
(河南农业大学动物医学院,河南 郑州 450046)
针对目前本科实验教学中实验经费不足、实验课时偏少的情况下,提高实验教学质量,需要不断更新实验内容,创新实验方法,培养学生的创新思维和创新能力。近几年新型冠状病毒的持续传播,新冠病毒核酸检测已成日常。PCR对新冠病毒的检测发挥着重大作用,紧跟时代发展需求,为学生快速熟悉和掌握先进的实验技术创造条件。对本科生庞大的群体而言,采用市售试剂盒提取细菌基因组DNA 做模板进行PCR 扩增是一笔不小的实验经费开支。在有限实验课时、有限实验经费的情况下,创新实验方法不仅可以解决目前实验教学中存在的不足,也能启发学生创新性解决问题,锻炼学生的创新思维和创新能力。
目前细菌性感染仍是养殖业造成巨大经济损失的重要因素,随着集约化畜牧业的发展,细菌性感染引起的疾病也越来越复杂,临床上对细菌性疾病的不恰当治疗及抗生素的滥用是耐药菌产生与耐药基因快速传播的主要原因[1],动物源耐药细菌的日趋严重,细菌感染甚至成为养殖业中的一个顽症,每年给养殖行业造成巨大损失[2]。目前抗生素对症治疗仍是控制细菌性感染的重要途径。筛选感染性细菌的敏感药物对控制和治疗疾病起至关重要的作用,细菌的鉴别诊断是对症治疗的基础,细菌培养纯化、形态学、组织学、生物化学和免疫学的检测是确定病原菌种类的常用方法,但都有一定的缺陷和不足。随着生物技术的迅猛发展,从分子水平对病原菌进行基因诊断,已发展为感染性疾病诊断的主要方式[3],其中PCR技术为兽医临床快速、准确、高效的诊断提供了技术手段[4]。
生产实践所需和培养学生创新能力目标的高度契合,探索用菌液经过简单处理直接作为PCR技术实验项目是切实可行的方法。
核糖体上的16S rRNA的保守区基因片段在各种细菌中具有种属的高度保守性,可变区在遗传上具有灵活的变异性,保守区和可变区交叉排列,16S rRNA序列分析是细菌分类、基因鉴定的主要靶序列[5-7]用过夜培养的菌液为模板,采用16S rRNA 通用引物PCR 16S rRNA 基因,琼脂糖凝胶检测显示革兰氏阴性菌和革兰氏阳性菌PCR扩增结果均不理想。革兰氏阴性菌和革兰氏阳性菌细胞壁的成分、厚薄及坚固程度是影响试验结果的主要因素[8]。经过试验探索,将细菌经过不同处理,采用处理过的菌液做模板,PCR 16S rRNA基因,琼脂糖凝胶电泳均能获得大小约1500 bp的清晰条带。
1 材料和方法
1.1 试验用细菌
动物源大肠杆菌、沙门氏菌、金黄色葡萄球菌、芽孢杆菌由微生物教研室保存的菌种提供。
1.2 菌种的复苏培养(见图1)

图1 编号1-4 分别为沙门氏菌、大肠杆菌、金黄色葡萄球菌、芽孢杆菌
将4 种菌分别接种到普通营养肉汤培养基中,置于37℃恒温摇床中培养16~18 h;再分别将沙门氏菌、大肠杆菌、金黄色葡萄球菌、芽孢杆菌接种到SS 琼脂平板、麦康凯琼脂平板、Baird-Parker 琼脂平板和甘露醇卵黄多粘菌素琼脂平板培养基上,置于37℃恒温培养箱中过夜培养16~18 h;挑取单个菌落革兰氏染色进行镜检;确保菌种的纯化无污染。
1.3 菌液处理方式
1.3.1 菌液未做任何处理
将1.2肉汤培养过夜复苏后的菌液做PCR模板,采用16S rRNA的通用引物:
27F:5'-AGAGTTTGATCCTGGCTCAG-3';
1492R:5'-CGGTTACCTTGTTACGACTT-3'
PCR扩增的反应体系和参数见表1、表2。

表1 PCR扩增反应体系(30ul)

表2 PCR扩增参数
取10 μl 扩增产物用1%的琼脂糖凝胶电泳检测,150V 恒压,电泳25 min,凝胶成像系统下观察PCR 扩增结果。
1.3.2 菌液煮沸处理
吸取上述1.2 中4 种隔夜培养的菌液各300 μl 于4 个EP 管中,EP 管盖用针头扎几个小孔,外用保鲜膜包裹后放沸水中煮10 min,然后再快速冰浴2 min,待室温后做PCR扩增模板,按1.3.1反应体系和参数进行PCR扩增,琼脂糖凝胶电泳、凝胶成像观察PCR扩增结果。
1.3.3 菌液用丙酮处理
取上述1.2过夜培养的4种菌液分别加入4个离心管中,10 000 r/min,离心2 min,弃上清,沉淀中加入300 μl ddH2O,再分别加入300 μl丙酮溶液,混匀,EP管盖扎孔,保鲜膜封口,再沸水浴10 min,后放冰浴2 min,10 000 r/min,离心2 min,留上清做PCR 模板,最后按1.3.1 反应体系和参数PCR扩增、琼脂糖凝胶电泳、凝胶成像观察结果。
1.3.4 菌液超声破碎处理
取上述1.2 过夜培养的4 种菌液分别加入离心管离心,后用PBS洗涤3次,再按原菌液体积的1/6加入裂解液重悬菌体,最后按1.3.1的体系和参数PCR扩增、电泳。
2 结果与分析
2.1 结果
菌液未做处理、菌液煮沸、丙酮处理、菌液超声破碎处理后分别做PCR 模板,凝胶检测结果分别如图2、图3、图4、图5。
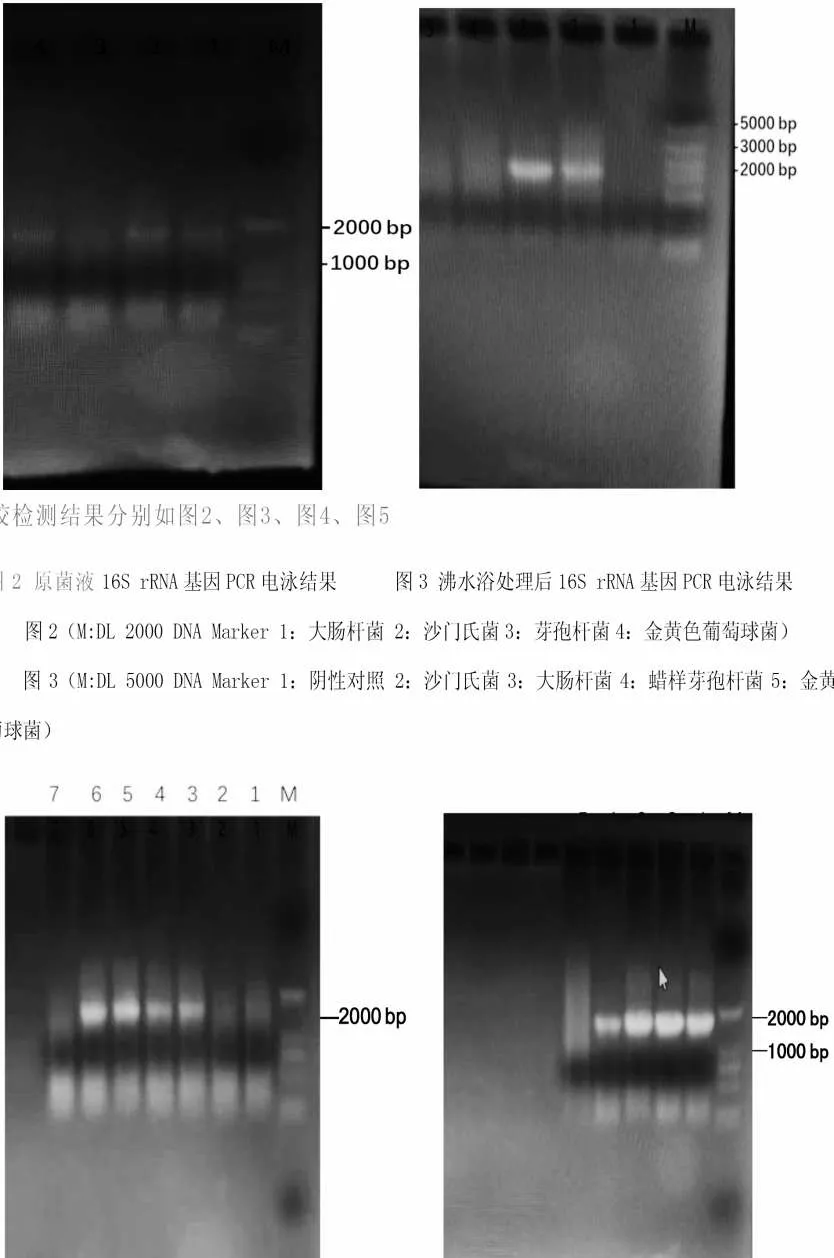
图2 原菌液16S rRNA 基因PCR 电泳结果
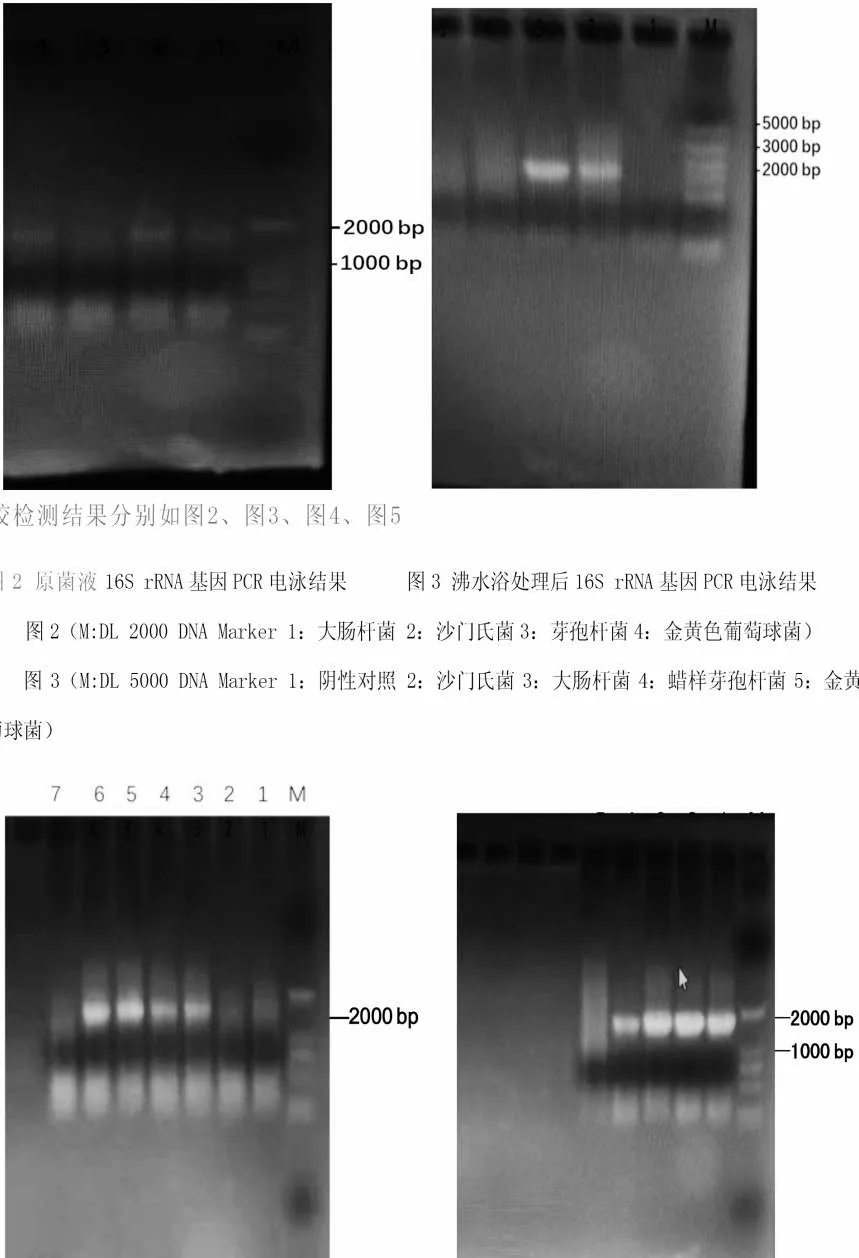
图3 沸水浴处理后16S rRNA 基因PCR 电泳结果
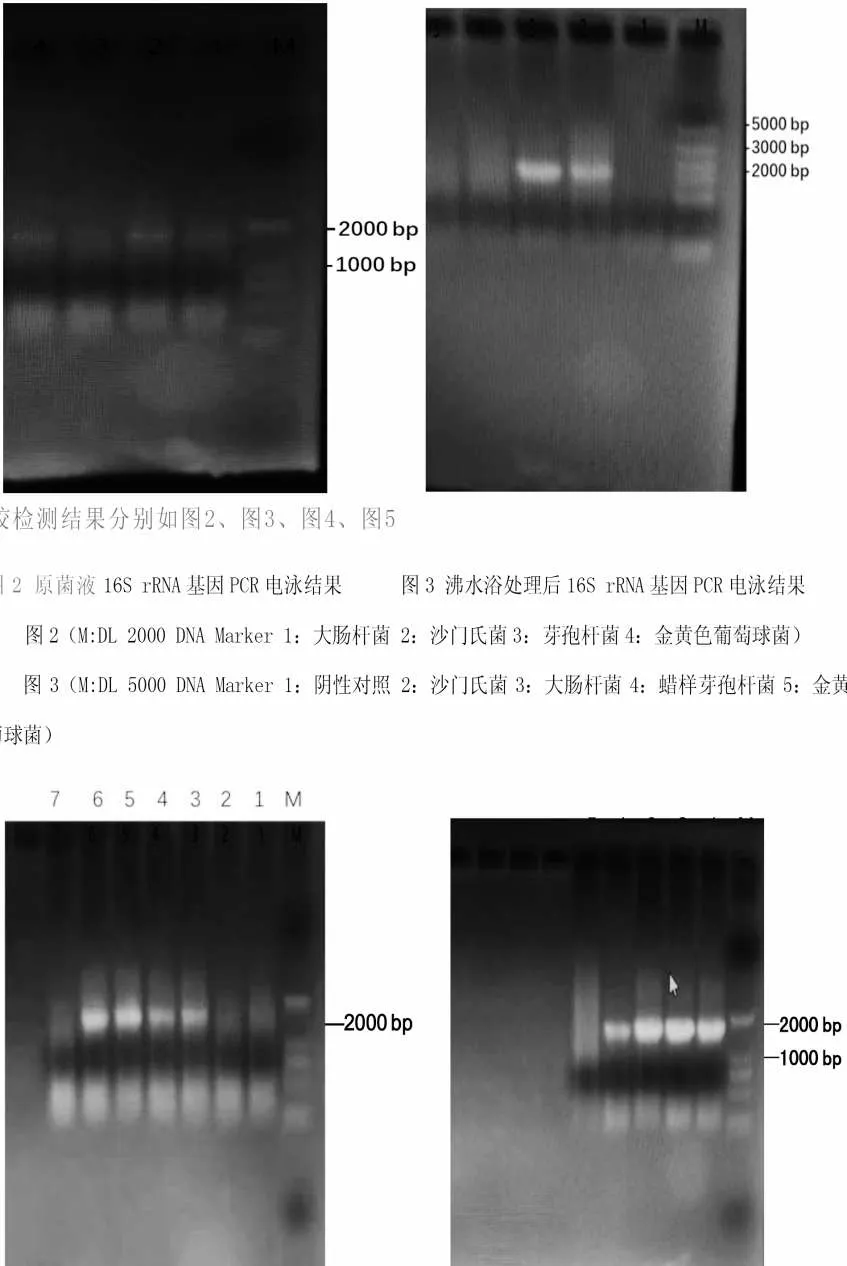
图4 丙酮处理后16S rRNA 基因PCR 结果

图5 超声破碎后16S rRNA 基因PCR 结果
2.2 分析
由图2 可知,将未经处理的菌液做模板PCR 扩增,沙门氏菌、大肠杆菌有较浅不清晰的条带,金黄色葡萄球菌和芽孢杆菌没有任何条带出现。分析认为,沙门氏菌和大肠杆菌属于革兰氏阴性菌,细胞壁相对较薄,PCR扩增预变性10 min,细菌的细胞壁可能部分被破坏,结果出现了微弱不清晰的条带,而金黄色葡萄球菌和芽孢杆菌属于革兰氏阳性菌,细胞壁相对较厚,即使PCR预变性10 min,也不足以破坏细胞壁使DNA释放出来,PCR扩增无结果。
由图3可以看出,菌液煮沸10 min,冰浴2 min后,沙门氏菌和大肠杆菌均出现了较清晰的条带,说明PCR 扩增16S rRNA 成功,金黄色葡萄球菌和芽孢杆菌PCR 没有结果,分析认为,金黄色葡萄球菌和芽孢杆菌即使煮沸细胞壁也很难被破坏,核糖体内的DNA释放不出来,故扩增不成功。
图4 显示,4 种菌经处理后的电泳结果均出现大小约1 500 bp 明亮清晰的条带,表明经丙酮和沸水处理后,革兰氏阴性菌和革兰氏阳性菌的细胞壁均能被破碎,4种细菌PCR扩增成功。
图5表明,4种菌液经超声破碎后也均出现了约1500 bp清晰的条带,说明菌液经过超声破碎后16S rRNA PCR也得到了理想的结果。
3 讨论
细菌的检验和鉴定主要依据细菌的形态特征、生化反应和免疫学检测,这些方法都需要对细菌进行复杂的培养,耗费时间长,某些细菌也常常得不到理想结果。随着分子生物学技术的广泛应用,PCR 技术因其快速、敏感和特异性等优点迅速在微生物检测领域得到广泛应用[9]。
细菌根据革兰氏染色分为革兰氏阴性菌和革兰氏阳性菌,革兰氏阳性菌(G+)细胞壁含大量的肽聚糖,独含磷壁酸,不含脂多糖,细胞壁较厚;革兰氏阴性菌(G-)含极少肽聚糖,独含脂多糖,不含磷壁酸,细胞壁较薄。由于两种菌的成分和结构不同,使得革兰氏阴性菌和阳性菌细胞壁的坚固程度不同,革兰氏阳性菌的细胞壁更难以被破坏[10]。
丙酮是一种极性很强的有机溶剂,能以任意比例与水混溶,被广泛用于多种化合物的分离、沉淀,特别是对于膜上与脂质结合的脂蛋白或膜内脂蛋白的分离有着重要的作用。由于丙酮在破菌过程中溶解了菌体细胞壁磷脂内大量的脂类化合物,特别是含脂较多的菌种,所以丙酮脱脂及破菌效果比较彻底[11]。
通过煮沸、加入丙酮试剂、超声破碎等手段破坏细菌坚固的细胞壁,使细胞内的核酸释放,16S rRNA PCR扩增结果达到预期目的。从经济、耗费时间和需要的仪器设备等方面对上述处理方法进行比较,丙酮和煮沸相结合的处理方式对本科实验项目开展提供了较好方案。
4 结语
高校作为培养创新人才的重要阵地,培养学生创新精神,就是要营造尊重创新、注重创新的良好氛围,激发学生创新欲望,培养学生创新意识。在实践教学过程中,应立足于学生的创新能力、综合素质和实践能力的培养,拓宽学习渠道,在实验课之余为学生提供更多的实践学习平台,以增加学生发挥主观能动性的机会,开放一些实验室或研究室开展一些探索性试验[12],有利于调动学生的积极性、主动性和创造性。在进行课堂内实验教学改革的同时,应进一步加强课堂外学生实验创新能力的培养。
由于本科实验受实验经费、实验课时、实验仪器设备的限制,开展一些高质量实验项目存在一定的困难,所以需要采用创新性的实验技术手段,为学生提供更多的锻炼机会。
