甲状腺球蛋白检测联合超声扫查用于甲状腺滤泡性肿瘤的诊断价值
2023-01-03代权伟纪飞虹赵圆圆邱新光
代权伟 纪飞虹 赵圆圆 邱新光
郑州大学第一附属医院甲状腺外科 郑州 450052
来源于滤泡细胞的甲状腺滤泡状腺癌(follicular thyroid carcinoma, FTC)和甲状腺滤泡状腺瘤(follicular thyroid adenoma, FTA)统称为甲状腺滤泡性肿瘤[1]。其中FTC占15%~30%[2],易血运转移到远处器官[3],远处转移率为3%~30%[4],但其临床、影像及细胞学特征与FTA相似,约有20% FTC患者误诊为FTA[5]。术前仅通过临床表现、超声和细胞学检查不能从滤泡性肿瘤中鉴别FTC[6]。基于此,本研究通过回顾性分析,探讨甲状腺球蛋白检测联合超声扫查用于甲状腺滤泡性肿瘤的诊断价值。
1 资料与方法
1.1研究对象回顾性分析2015-01—2021-12我院甲状腺外科收治的甲状腺滤泡性肿瘤患者的临床资料。纳入标准:(1)均为首次行甲状腺手术治疗的患者。(2)临床资料齐全,均经术后石蜡切片病理学检查确诊。排除标准:(1)合并其他部位的恶性肿瘤。(2)外院手术或于我院行二次手术患者。根据术后石蜡切片病理学检查结果分为FTC组(99例)和FTA组(67例);依据有无远处转移将FTC患者分为转移性(metastatic)FTC组(mFT组,13例)和非转移性(nonmetastatic)FTC组(nmFTC组,86例)。
1.2仪器与方法
1.2.1 超声扫查 采用TOSHIBA APlio500彩色多普勒超声诊断仪,线阵探头,频率5.0~14.0 MHz。选择合适切面进行扫查并记录超声特征。
1.2.2 血液检验 患者入院后第1天早晨抽取空腹静脉血送检,包括甲状腺球蛋白(Thyroglobulin,Tg)、促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb),肿瘤异常糖链蛋白(tumor abnormal protein,TAP)。
1.3统计学分析采用 SPSS 21.0软件进行统计分析。计数资料以例数和率(%)表示,行χ2检验及 Fisher精确概率法进行组间比较;正态检验采用 K-S检验,不符合正态分布的计量资料使用中位数表示,组间比较使用 Mann-Whitney 秩和检验。采用Logistic回归进行多因素分析,筛选独立危险因素,建立多因素诊断模型,并用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析多因素模型的诊断效能及血清 Tg诊断FTC及mFTC最佳截断值。检验水准α=0.05,P<0.05为有统计学意义。
2 结果
2.1临床及检验资料FTC组与 FTA组患者的年龄、血清Tg水平差异有统计学意义(P<0.05),性别和血清TSH、TAP、TPOAb、TgAb阳性率差异无统计学意义(P>0.05)。mFTC组和nmFTC组患者的血清Tg差异有统计学意义(P<0.05),年龄、性别和血清TSH、TAP、TPOAb、TgAb阳性率差异均无统计学意义(P>0.05)。见表1。作ROC 曲线得到血清 Tg 诊断FTC和mFTC的最佳截断值分别为259.20 ug/L (图 1) 和1 062.55 ug/L (图2)。

图1 血清Tg诊断FTC的ROC 曲线
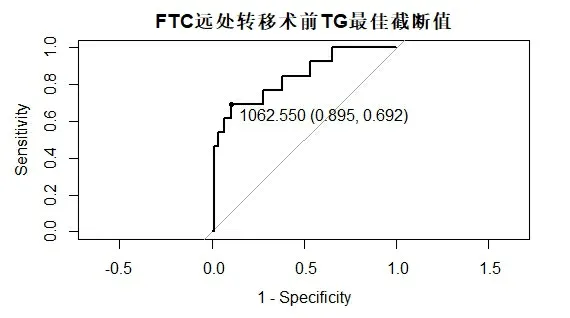
图2 血清Tg预测FTC远处转移的ROC 曲线

表1 各组患者临床及检验资料比较
2.2超声特征FTC组的TI-RADS分级较FTA组高,且2组形态差异有统计学意义(P<0.05);结节位置、大小、回声均匀性、内部结构、钙化、血流信号等差异均无统计学意义(P>0.05)。mFTC组与nmFTC组仅形态差异有统计学意义(P<0.05)。见表2。

表2 FTC(包括mFTC和nmFTC)与FTA超声特征[n(%)]
2.3Tg联合超声构建多因素诊断模型将FTC组与FTA组单因素分析中差异有统计学意义的5个变量(年龄、血清Tg、结节形态、边界、TI-RADS分级)纳入多因素Logistic回归分析,筛选出FTC的独立危险因素(血清Tg、形态不规则,见表3),列入方程建立模型为:Logit(P) =-0.610+0.002×血清Tg +1.319×形态不规则。绘制多因素模型的ROC 曲线,曲线下面积(Area Under the Curve,AUC)为0.748(图3)。同法将在mFTC组与nmFTC组单因素分析差异有统计学意义的血清Tg、形态不规则2个变量纳入多因素Logistic回归分析,筛选出独立危险因素列入方程建立模型并绘制ROC曲线,AUC为0.863。

图3 多因素模型诊断FTC的ROC曲线
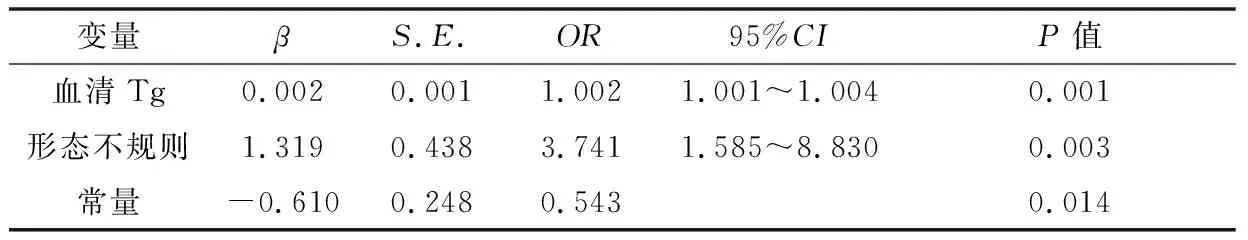
表3 血清Tg联合超声诊断FTC多因素模型
3 讨论
本研究中冰冻切片检查诊断FTA和FTC与石蜡切片检查的符合率分别为46.3%和4.0%。对甲状腺滤泡性肿瘤,冰冻切片检查的符合率低,对于指导手术范围并不可靠[7]。故本研究拟通过血液化验指标联合超声扫查及临床特征,提高FTC术前诊断准确率及远处转移的识别。
本研究中,FTC组男女比例1∶2.4,接近既往报道的1∶2.3[8];FTA组男女比例为 1∶3.8,差异无统计学意义。与Zhang JZ等[9]的研究一致。我们还发现mFTC组与nmFTC组性别差异也无统计学意义。因此,性别是否为FTC的危险因素尚待进一步研究。FTC好发于>50岁的女性患者[10]。谢文婷[11]报道FTC平均发病年龄较FTA大。本研究中,FTC组中位年龄为53岁,FTA组为46岁,差异有统计学意义。有报道年龄>55岁是FTC远处转移的独立危险因素[12],单独肺和骨转移FTC患者的中位年龄均为59岁[13]。本研究mFTC组的中位年龄为54岁,但mFTC组与nmFTC组年龄差异无统计学意义,考虑与纳入mFTC的例数较少有关。
甲状腺是产生Tg的唯一来源,故有学者认为血清Tg可作为甲状腺癌的生物标志物[14]。Chen Z等[15]亦发现血清 Tg 是滤泡性肿瘤中 FTC 的独立危险因素。本研究结果显示,血清Tg>259.20 ug/L为FTC的独立危险因素(OR=1.002,95%CI: 1.001~1.004,P=0.001)。Oltmann 等[16]的研究中,6例血清 Tg>5 000 ug/L的甲状腺癌病例均出现转移,提示血清Tg显著升高可能与肿瘤转移有关。有研究发现首次手术血清Tg达1 000 ug/L 为FTC远处转移的危险因素[17]。本研究血清Tg>1 062.55ug/L为mFTC独立危险因素。因此,血清 Tg可作为FTC与FTA鉴别诊断及判断FTC远处转移的标准之一。
覃业志等[18]认为FTC与FTA超声表现是不同的,FTC典型的超声表现为边界不清、形态欠规则、无细晕、内部回声不均匀、有钙化(主要存在粗大钙化)。我们发现超声表现为结节形态不规则、边界不清、TI-RADS分级高对诊断FTC有意义,且形态不规则是FTC 鉴别于 FTA 的独立危险因素。结节形态在本研究中具有较高诊断价值,在FTC与FTA及mFTC与nmFTC之间差异均有统计学意义。研究发现[19],78%的FTC局部或全部边缘呈微小分叶或不规则,此特征可以与 FTA相鉴别。TI-RADS分级的建立使甲状腺结节的评估更规范化,FTC在TI-RADS 4级及以上多见,而FTA的TI-RADS级别较低,多为3级,与Di Ou[8]等的研究结果类似。虽然FTC归为4级的情况多于FTA,但仍有少数被归为3级。Di Ou还发现超过一半的FTC超声未能显示出主要的恶性倾向,所以对一些TI-RADS 3 级的结节仍应提高警惕。
综上所述,甲状腺球蛋白检测联合超声扫查对FTC与FTA鉴别具有较好的诊断效能,有助于早期发现FTC远处转移,对临床治疗决策有指导意义。
