低敏宠物核心料对食源性过敏小鼠的作用效果评价
2023-01-03刘佳仪王福正王承志张明月陈思琪朱嘉欣吴高峰杨建成
刘佳仪,王福正,王承志,杜 鹏,张明月,陈思琪,朱嘉欣,孙 旭,吴高峰*,杨建成*
(1.沈阳农业大学动物科学与医学学院,沈阳 110866;2.辽宁海辰宠物有机食品有限公司,朝阳 122312)
随着宠物饲养量的逐年增加以及其生活环境变化和食物种类不断丰富,宠物过敏的发生率也不断增加。据兽医临床统计,约70%的宠物犬是过敏性体质。宠物食源性过敏(food allergy, FA)与其他过敏类型不同,是由于食用了某些食物或者食物添加剂引起的一种特殊的免疫反应,除了伴有皮肤反应引起的瘙痒外,还会在肠道或其他组织产生局部炎症,造成消化功能紊乱[1],严重时还会导致呼吸窘迫危及生命。因而,通过合理的配方饮食及功能性物质的添加提高动物的免疫机能,起到抗过敏的作用,是宠物饲养中亟待解决的问题。
本试验采用的低敏宠物核心料在满足宠物日常营养需求基础上,添加了酵母水解物、牛磺酸、二十二碳六烯酸(DHA)、复合益生菌和低聚木糖等活性物质。酵母水解物可促进氨基酸等营养物质的吸收,促进机体分泌消化酶并提高机体免疫力[2]。牛磺酸丰富的生理功能已被熟知[3-5],对机体的消化、内分泌和免疫系统均具有积极的作用[6]。乳酸菌和双歧杆菌等可以防止肠道高通透性,降低脂多糖依赖性的慢性低度炎症。DHA是Omega-3不饱和脂肪酸的主要活性形式之一,由于其在哺乳动物体内的转化效率比食物的摄取率低,而且富含这类脂肪酸的食物并不常见,因此常被建议额外添加作为营养补充剂。添加有益菌和Omega-3脂肪酸可以调节肠道微生物群[7],调节肠道免疫,对改善老年人和肥胖者的肠道炎症具有潜在作用。而低聚木糖能够选择性的促进肠道双歧杆菌增殖活性[8],同时对大肠杆菌、沙门氏菌等病原菌具有吸附作用,可以携带附着的病原菌从肠道排出体外,从而防止病原菌集群在体内,起防止腹泻的作用[9]。综上,低敏宠物核心料中含有的生物活性物质均具有不同程度的提高机体免疫机能、抗炎和改善肠道菌群结构的作用。因而本试验旨在研究该低敏宠物核心料对肠道过敏小鼠的作用,并初步探讨其可能的抗过敏机制。
1 材料与方法
1.1 试验材料
海辰低敏宠物核心料:主要含有酵母水解物、DHA、牛磺酸等成分,由辽宁海辰宠物有机食品有限公司提供。卵清蛋白(OVA,A8040,北京索莱宝科技有限公司);甲苯胺蓝染色液(细胞专用)(G3660,北京索莱宝科技有限公司);小鼠血清丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、免疫球蛋白E(immunoglobulin E,IgE)、免疫球蛋白E(immunoglobulin G,IgG)、组胺(histamine,HIS)、白细胞介素4(interleukin 4,IL-4)、白细胞介素10(interleukin 10,IL-10)试剂盒购于武汉伊莱瑞特生物科技股份有限公司。
1.2 试验设计
80只体重(20±2)g雌性SPF级BALB/c小鼠购自辽宁长生生物技术有限公司[SCXK(辽)2020-0001],饲养于沈阳农业大学动物实验中心,维持室温状态,湿度保持在50%左右,预饲养7 d后随机分为4组。试验总共36 d,在试验开始第0和7天腹腔注射OVA,从第14天开始每隔2 d灌喂2 mL OVA诱导食源性过敏小鼠模型,一共灌胃5次。试验日粮均由辽宁海辰宠物有机食品有限公司提供,所有小鼠日粮符合国际标准日粮配方,其中正常对照组小鼠(C)饲喂标准日粮;低敏宠物核心料对照组小鼠(H)饲喂含有低敏宠物核心料的全价日粮;食源性过敏模型组小鼠(M)根据上述模型制备方法给予OVA致敏,饲喂标准日粮;干预组小鼠(MH)在致敏的同时给予含有低敏宠物核心料的全价日粮。
1.3 试验方法
1.3.1 日增重、采食量 试验期间,每周固定一天分别对每组进行空腹称重,计算平均日采食量(average daily feed intake,ADFI)、平均日增重(average daily gain,ADG)。
1.3.2 肠道组织形态学观察 试验结束后,采集小鼠空肠,4%多聚甲醛固定48 h以上,制备石蜡切片,HE染色观察小鼠肠道组织结构变化。
1.3.3 一般状态观察 试验期间观察小鼠过敏状态,包括面部状态、活动及腹泻情况等,在激发致敏40 min后,根据过敏症状评分表(表1)对每组小鼠的症状进行评分,计算小鼠腹泻率,同时测量每只小鼠的直肠温度。

表1 过敏评分
1.3.4 免疫器官指数 试验结束后,取小鼠胸腺、脾,PBS冲洗后,滤纸吸干称重,计算小鼠胸腺和脾指数(TI和SI)。
1.3.5 血清相关因子检测 试验结束后,眼球取血,收集血清,按照说明书检测血清中IgE、IgG、His、IL-4、IL-10、T-SOD、GSH-PX、MDA水平。
1.3.6 腹腔灌洗液中脱颗粒肥大细胞计数 无菌条件下向腹腔注射无菌PBS,小心揉捏腹部使其充分接触,吸取20 μL滴于载玻片涂开,37 ℃晾干,滴加200 μL甲苯氨蓝染色液5 min,光镜下以肥大细胞周围有明显紫色渗出物为脱颗粒的肥大细胞,显微镜下每张标本计数100个肥大细胞,计算脱颗粒比率。
1.3.7 数据统计分析 整理后的数据用SPSS 22.0和Origin 2021进行分析,按照平均数单因素方差法(AVOVA)分析组间的差异性,多重比较后采用事后检验,计算数据用“平均数±标准差(Mean±SD)”表示,并用GraphPad Prism 8.0软件绘制图片,数据P<0.05具有统计学意义。
2 结 果
2.1 生长性能检测结果
由图1可见,各组小鼠ADFI无显著差异(P>0.05);与C组小鼠相比,H组小鼠ADG无显著差异(P>0.05),M组小鼠平均ADG极显著降低(P<0.01),MH组与M组相比,小鼠ADG极显著增加(P<0.01),随着时间的增长各组小鼠体重逐渐增加,其中,M组与其他组相比增长缓慢,且M组小鼠体重与C组相比,在第4周显著降低(P<0.05),MH组与M组相比,小鼠体重极显著增加(P<0.01)。说明该低敏宠物核心料可以促进营养物质的消化吸收,在不增加日采食量的基础上提高小鼠的日增重。
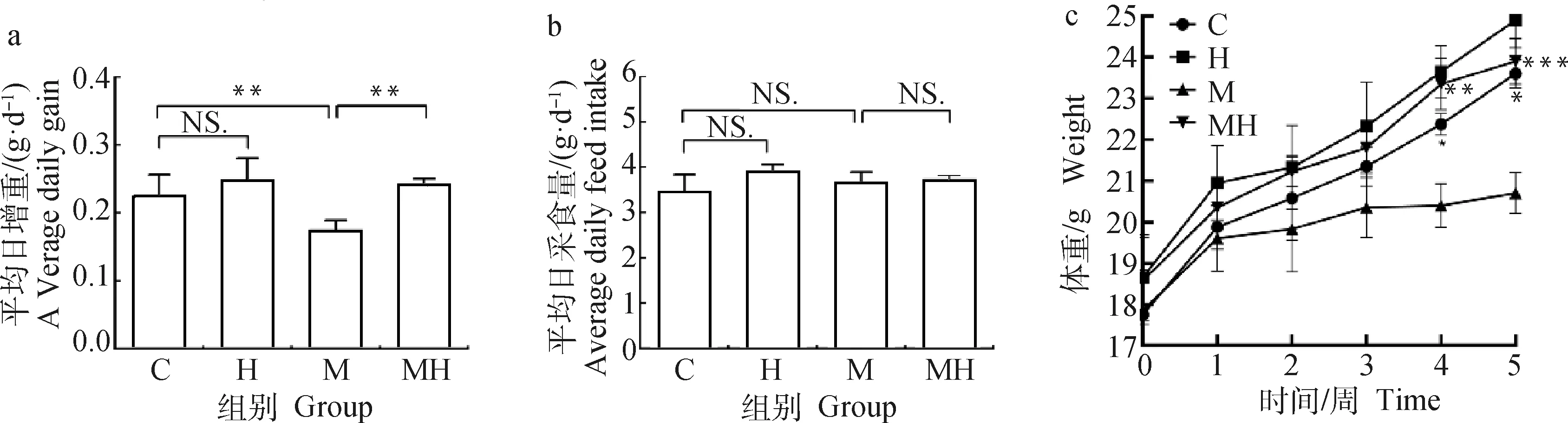
a.平均日增重;b.平均日采食量;c.体重。C.对照组;H.低敏宠物核心料对照组;M.食源性过敏模型组;MH.干预组(同时进行M组和H组的处理)。*. P<0.05,**. P<0.01,NS. P>0.05。分组及统计学标注同样适用于下图a. Average daily weight gain; b. Average daily feed intake; c. Weight. C. Control group; H. Hypoallergenic pet core material group; M. Food-borne allergic group; MH. Intervention group (combining treatment of M and H groups). *. P<0.05,**. P<0.01,NS. P>0.05. Grouping and statistical annotation are also applicable to the following figures图1 低敏宠物核心料对小鼠生长性能的影响Fig.1 The effect of hypoallergenic pet core diet on the growth performance of mice
2.2 肠道组织形态学观察
如图2所示,C组与H组肠道组织结构完整,无明显的炎性细胞浸润;M组肠黏膜上皮脱落、不完整,肠上皮细胞排列不整齐,杯状细胞数量减少,并伴有少量的炎性细胞浸润;MH组与M组相比,肠黏膜状态有所改善,肠黏膜结构完整,杯状细胞数量无明显变化。说明添加低敏宠物核心粮能够改善过敏小鼠肠道组织的结构形态,减少炎性细胞的浸润。

图2 各组小鼠肠道组织HE染色切片(400×)Fig.2 Results of HE staining of intestinal tissue of mice in each group (400×)
由图3可见,与C组小鼠相比,H组小鼠绒毛长度极显著升高(P<0.01)、隐窝深度无差异(P>0.05)、V/C值显著升高(P<0.05),M组小鼠绒毛高度极显著降低(P<0.01)、隐窝深度显著降低(P<0.05)、绒毛高度隐窝深度比值(V/C)值极显著降低(P<0.01);与M组相比,MH组小鼠绒毛高度显著增加(P<0.05)、隐窝深度无显著差异(P>0.05)、V/C值极显著增加(P<0.01)。以上结果说明OVA致敏后能够破坏肠道屏障的完整性,使肠道屏障通透性增强,添加低敏核心料能够改善过敏小鼠肠道组织结构状态。
2.3 低敏核心料对OVA诱导的过敏反应的影响
从图4a可见,C组和H组小鼠直肠温度始终维持在36.9 ℃左右,无显著变化(P>0.05);M组小鼠随着时间的增加直肠温度降低,致敏20 min后,M组小鼠体温为36.3 ℃,MH组小鼠体温为36.5 ℃,差异不显著(P>0.05),致敏60 min后,MH组小鼠体温较M组显著升高(P<0.05),增加0.44 ℃。说明低敏核心料可以抑制OVA致敏导致的小鼠直肠温度降低,有效抑制过敏反应的发生。
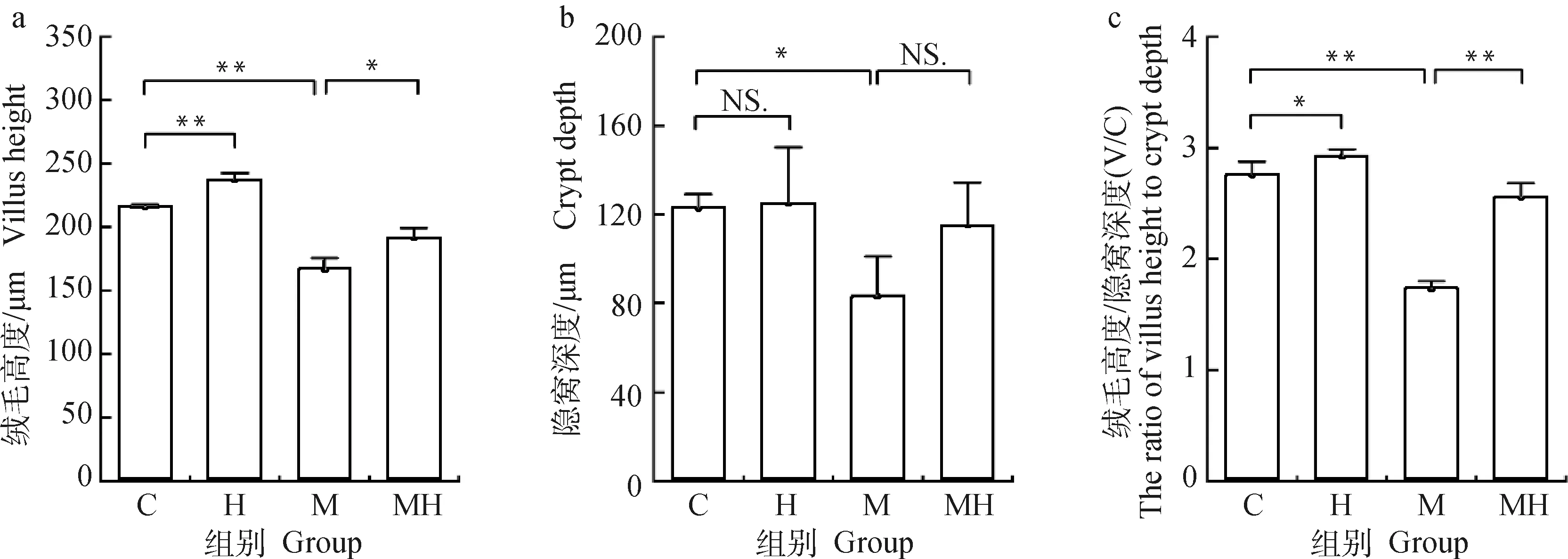
a.小肠绒毛高度;b.小肠隐窝深度;c.绒毛高度隐窝深度比值a. The height of the small intestinal villi; b. The depth of the small intestinal crypts; c. The ratio of villus height and crypt depth图3 低敏宠物核心料对小鼠肠道形态的影响Fig.3 The effect of hypoallergenic pet core material on the intestinal morphology of mice
如图4b所示,C组和H组小鼠无腹泻的发生,随致敏次数的增加,M组腹泻率与C组相比极显著升高(P<0.01),在第3次致敏后腹泻率达到86%,而MH组与M组相比显著降低(P<0.05),腹泻率为45.56%,说明该低敏核心料可以显著改善小鼠的肠道过敏状态,降低腹泻的发生。
图4c可见,C组和H组小鼠几乎无过敏现象发生,综合评分为0,M和MH组小鼠过敏反应评分随着致敏次数的增加呈现先增加后降低的趋势,第3次致敏后,M组小鼠的过敏反应评分较C组极显著升高(P<0.01),第5次致敏后,MH组较M组显著降低(P<0.05)。
以上结果表明,OVA可以诱导小鼠的过敏反应的发生,饲喂该低敏宠物核心料可以显著抑制OVA导致的小鼠过敏反应,减轻过敏症状。
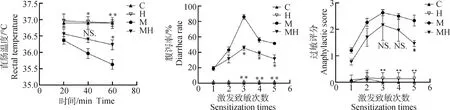
a.直肠温度;b.腹泻率;c.过敏评分。与M组相比,*. P<0.05,**. P<0.01,NS. P>0.05a. Rectal temperature of mice; b. Diarrhea rate of mice; c. Anaphylactic score. Compared with the M group, *. P<0.05,**. P<0.01,NS. P>0.05图4 低敏宠物核心料对小鼠过敏反应症状的影响Fig.4 The effect of hypoallergenic pet core material on allergic reaction symptoms in mice
2.4 低敏核心料对组胺、细胞因子及肥大细胞脱颗粒的影响
由图5和6可见,与C组小鼠相比,M组小鼠血清IgE、IgG、His、IL-4水平极显著上升(P<0.01),脱颗粒肥大细胞数显著增加(P<0.05),IL-10水平极显著下降(P<0.01);与M组相比,MH组小鼠血清IgE、IgG、His、IL-4水平较M组显著降低(P<0.05或P<0.01),肥大细胞脱颗粒比率显著减少(P<0.05)。IL-10水平无差异(P>0.05),但具有上升趋势;说明该低敏宠物核心料可显著抑制由OVA诱导的Th2型细胞的激活,进而抑制B细胞释放IgE及IgG,减少肥大细胞脱颗粒和组胺的释放,减轻小鼠的过敏反应及其症状,并且能通过抑制IL-4的升高,减轻炎性反应。
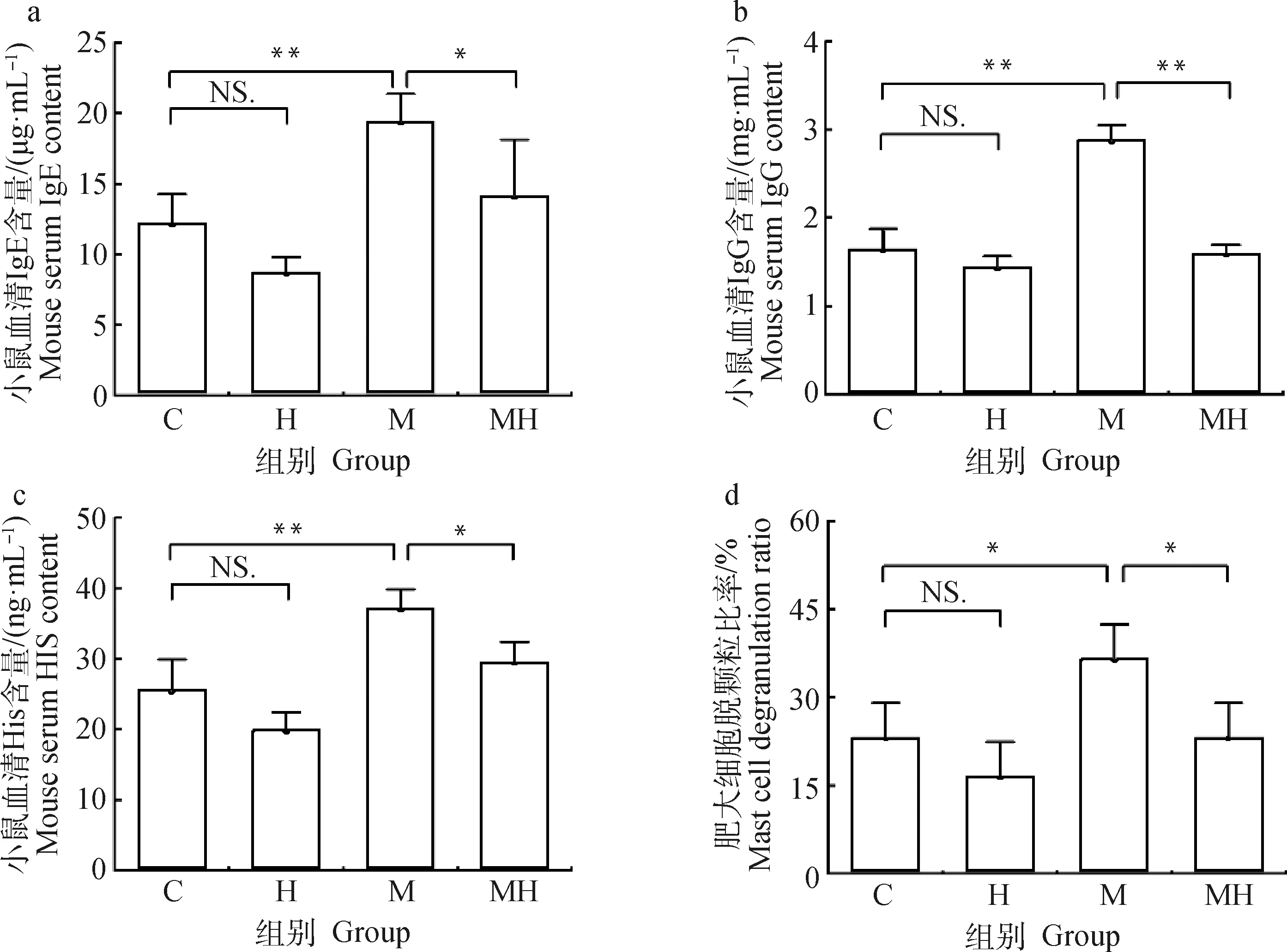
a.血清IgE水平;b.血清IgG水平;c.血清组胺水平;d.腹腔灌洗液脱颗粒肥大细胞比率a. Serum immunoglobulin E level; b. Serum immunoglobulin G level; c. Serum His level; d. Ratio of degranulated mast cells in peritoneal lavage fluid图5 低敏宠物核心料对小鼠过敏反应相关指标的影响Fig.5 The effect of hypoallergenic pet core diet on the indexes related to allergic reaction in mice
2.5 低敏宠物核心料对免疫器官指数的影响
由图7可见,与C组小鼠相比,M组小鼠SI、TI极显著降低(P<0.01),M组小鼠胸腺、脾受到OVA刺激,影响了正常免疫功能;而MH组小鼠SI、TI较M组小鼠均极显著增加(P<0.01),说明低敏宠物核心料可以提高肠道过敏小鼠胸腺和脾内淋巴细胞的正常分化成熟,确保其正常的免疫功能。
2.6 低敏宠物核心料对抗氧化能力的影响
由图8可见,与C组相比,M组小鼠GSH-PX、T-SOD水平极显著降低(P<0.01),MDA水平显著升高(P<0.05),而MH组小鼠血清GSH-PX和T-SOD较M组显著增加(P<0.05),MDA水平较M组显著下降(P<0.05),说明低敏宠物核心料可显著抑制由OVA导致的小鼠氧化应激的发生,并能增加机体的抗氧化能力。

a.脾指数;b.胸腺指数a. Spleen index; b. Thymus index图7 低敏宠物核心料对小鼠免疫器官指数的影响Fig.7 The effect of hypoallergenic core diet on the immune organ index of mice

a.血清SOD活性;b.血清GSH-PX水平;c.血清MDA水平a. Serum SOD activity; b. Serum GSH-PX level; c. Serum MDA level图8 低敏宠物核心料对小鼠抗氧化能力的影响Fig.8 Effect of hypoallergenic core diet on antioxidant capacity of mice
3 讨 论
过敏反应是机体在免疫异常情况下产生的一种对机体有害的病理过程。在宠物饲养中常见的过敏反应主要以FA为主,FA会引起皮肤瘙痒、红肿,还可产生呕吐、腹泻等胃肠症状[10]。FA是由IgE介导的I型速发型超敏反应[11]。OVA是蛋清中最常见的容易引起过敏和含量最多的蛋白质之一[12]。OVA添加铝佐剂是制备动物过敏模型中最常用的方法[13-15],有研究显示,OVA诱导的BALB/c小鼠的过敏模型比其他品系的鼠更接近IgE介导的FA模型。FA的发生机制复杂多样,可能与肠道菌群失衡和口服不耐受相关[16]。
根据过敏类型的不同,过敏反应能够引起机体产生不同的症状,严重的会引起休克,危及生命。本研究结果显示,各组小鼠日采食量没有显著变化;但M组小鼠的体重增长缓慢,平均日增重极显著降低,这与前人研究中OVA诱导的过敏小鼠日增重均降低一致[17-18]。这种变化可能与机体在不同免疫状态下对食物消化吸收的利用率不同有关。因为营养物质的吸收主要发生在小肠前段[19],过敏小鼠肠道屏障受到破坏,小肠对营养物质的转运和吸收能力下降[20],体重减轻。MH组小鼠平均日增重显著升高,基本恢复正常水平。说明添加低敏宠物核心料能够改善过敏小鼠体重降低的状况,这与前人研究结果相似。低敏宠物核心料中含有的低聚木糖、复合益生菌和DHA能增加机体免疫力并改善肠道屏障功能[18,21-22],可在不影响采食量的前提下,通过减轻肠道损伤,保护肠道屏障,进而提高机体对营养物质的吸收率,使过敏小鼠的ADG升高。作为评价小肠形态结构的特征性指标,小肠绒毛高度、隐窝深度以及V/C值能够直接显示小肠的结构和功能状态。很多研究发现,FA可破坏肠道组织结构,影响营养物质的吸收,这在本试验中也得到了同样的验证。而MH组小鼠较M组绒毛高度显著增加,结合体重和采食量的结果,说明该低敏宠物核心料能通过增加肠道绒毛高度,促进肠道营养物质的吸收,提高小鼠的体重,这可能是低敏宠物核心料中含有的DHA和益生菌所发挥的作用。
FA主要是由于IgE诱导的I型过敏反应,在食物摄入后的几分钟到几小时内会立即出现过敏的临床症状,通过观察OVA灌胃后1 h内各组小鼠的精神状态并对其进行过敏评分,检测直肠温度和腹泻率,能够直观地反映出每组小鼠的过敏反应状态。本试验中OVA诱导的过敏小鼠与正常组小鼠相比,体温降低,腹泻率增加,这与其他过敏原介导的过敏反应一致,在花生提取物(PE)诱导的过敏试验中,过敏组小鼠与正常小鼠相比过敏评分升高,直肠温度降低,IL-4水平升高[23]。而本试验添加低敏宠物核心料后小鼠的过敏症状有所改善。Diesner等[24]研究表明,益生菌可以调节宿主免疫系统或肠道微生物群的组成,有效缓解过敏症状。Ren等[25]发现短双歧杆菌(Bb)通过降低IL-4水平和激活Tregs对BALB/c小鼠产生免疫调节和抗过敏作用,这与本研究结果相似,说明该低敏宠物核心料能够改善动物的过敏症状,而且推测对其他过敏源诱导的过敏反应也可能具有潜在效果。
食物过敏原经树突细胞递呈后,Th2型细胞会大量释放IL-4、IL-5等细胞因子,激活B细胞,促进B细胞生成大量浆细胞,进而分泌IgE、IgG等抗体,这些抗体可与肥大细胞结合形成复合物并使机体处于致敏状态,当机体再次接触过敏源时,可使细胞发生脱颗粒,并释放组胺、IL-4、TNF-α等过敏介质和炎性因子,引起过敏反应及炎性反应[26]。在过敏反应机制中,Th1/Th2细胞的失衡及相应细胞因子的失衡也是过敏反应发生的机制之一,在Th1/Th2平衡的调控中,Treg会通过释放IL-10等发挥免疫调控的恢复作用,IL-10是一种具有免疫抑制功能的抗炎因子,其分泌水平在一定程度上与过敏反应程度呈反比。M组小鼠血清中HIS、IL-4、IgG和IgE水平显著高于C组,肥大细胞脱颗粒比例也明显升高。在花生和α-双加氧酶片段(ADF)诱导的食源性过敏试验中,过敏模型组IL-4、IgE极显著升高[27-28]。PE诱导的过敏组小鼠组胺水平显著升高[29],而本试验中MH组与M组相比,上述指标明显降低,说明低敏宠物核心料能够抑制食源性过敏所引起的促炎因子和组胺水平升高,降低肥大细胞脱颗粒比例,从而减轻机体的过敏反应。然而M组小鼠血清IL-10水平显著低于C组和H组,但与MH组相比无显著差异。DHA能够改善食物过敏引起的肠道菌群失调[30],通过调节肠道微生物的种类和数量,改善肠道屏障功能状态[31],并抑制肠道炎症、类风湿性关节炎等疾病的发展。除此之外,DHA还能调节免疫细胞因子的生成[32],降低促炎因子IL-4和免疫球蛋白IgG、IgE的表达水平,升高抗炎因子IL-10的表达水平[32-33]。这与本研究结果相似。说明低敏宠物核心料发挥其抗过敏反应的机制可能与低敏宠物核心料中含有的DHA、复合益生菌有关。并且低敏宠物核心料不仅能减轻OVA诱导的FA的过敏反应,还对花生等过敏原引起的食源性过敏反应具有潜在效果。
过敏反应不仅会引发机体产生一些过敏症状,也会使机体的免疫状态发生改变,当机体受到刺激引起免疫功能低下时,免疫器官中免疫细胞的正常分化、成熟则会减少,从而导致器官萎缩[34],质量下降。M组小鼠SI和TI均明显降低,说明OVA致敏后小鼠免疫器官萎缩,免疫功能有所下降,而MH组小鼠SI和TI明显升高,说明添加该低敏宠物核心料可促进动物免疫器官发育,增进动物免疫器官机能,提高机体免疫力。
SOD、GSH-PX、MDA作为动物机体抗氧化系统的重要成员,是反映机体抗氧化能力的特征性指标[35]。本研究结果显示,M组小鼠SOD和GSH-PX水平显著降低,MDA水平显著增加[34],而添加低敏宠物核心料后这3个指标均显著改善。研究显示,牛磺酸能下调MDA表达水平,具有抗氧化作用。且牛磺酸的抗氧化作用已经在很多试验中被证实[36-38]。说明添加该低敏宠物核心料能够改善因过敏引起的抗氧化能力的降低。
4 结 论
本试验采用OVA成功诱导了小鼠的过敏反应,低敏宠物核心料对健康小鼠无显著影响,但可抑制OVA诱导的小鼠肠道过敏反应的发生,减轻过敏反应症状,其机理一方面是通过抑制OVA诱导的Th2型细胞的激活,进而抑制B细胞释放IgE,减少肥大细胞脱颗粒及组胺的释放,减轻小鼠的过敏反应及其症状;另一方面可减轻过敏小鼠的氧化应激,增加其抗氧化机能,修复组织细胞的损伤,进而提高机体的抗过敏能力。
