P7C3-A20对创伤性脑损伤的PC12细胞凋亡和氧化的影响
2023-01-03杨芷清张浩权冼润浠李欣然
杨芷清,张浩权,冼润浠,李欣然,2*
(1.佛山科学技术学院生命科学与工程学院,佛山 528225; 2.佛山科学技术学院附属教学动物医院,佛山 528225)
创伤性脑损伤(traumatic brain injury, TBI)对动物的健康问题危害严重。TBI主要是由机械外力引起的,造成的主要原因:打架、撞击、坠落等。TBI所造成的原发性损伤往往不可逆转,会直接导致神经元的死亡,只能通过干预TBI造成的继发性损伤来治疗,但TBI的病理机制较为复杂,损伤过程包括线粒体损伤导致的细胞凋亡和氧化应激,细胞能量产生降低和弥漫性轴索损伤等[1-2]。TBI具有高致残率、高死亡率、高治疗费的特点,它的发生会降低患畜的生活质量,甚至会导致严重的残疾或死亡,且预后不良[3]。虽然人们已经意识到TBI的危害,但目前对治疗TBI的特效药物研究仍处于起步阶段,缺乏有效的治疗药物去治疗由TBI引起的各种损伤,如不及时治疗,会造成不可逆的损伤,是一项迫切需要解决的公共卫生和医疗问题。所以需要继续探索对TBI有修复作用的药物,以进一步改善TBI的预后。3, 6-二溴-beta-氟-N-(3-甲氧基苯基)-9H-咔唑-9-丙胺(P7C3-A20)是一种稳定细胞能量水平的化合物,可以通过血脑屏障,具有治疗TBI的潜力[4-5]。研究发现,P7C3-A20能对中风大鼠的脑细胞提供保护作用,在抑制成熟神经细胞死亡的同时,也可以增加烟酰胺腺嘌呤二核苷酸(NAD)的通量,并且接受P7C3-A20治疗的大鼠肢体性能和认知功能得到了改善[6-7]。即使大鼠在中风后延迟6 h腹腔注射P7C3-A20,依然具有减轻神经变性和促进慢性功能恢复的治疗效果[8]。研究也证实P7C3-A20的治疗可以恢复正常的血脑屏障内皮细胞长度,增加脑毛细血管周细胞密度,增加血脑屏障紧密连接蛋白的表达,减少脑内免疫球蛋白的浸润,阻止慢性神经变性和恢复认知[4]。虽然P7C3-A20已被证实在缺血性中风和神经退行性疾病等各种疾病中发挥神经保护作用,但是在大鼠肾上腺髓质嗜铬瘤分化细胞株(PC12细胞)TBI模型中,P7C3-A20与神经元凋亡和氧化应激的关系尚不清楚。本研究旨在通过CCK8试剂盒测定细胞活力,荧光显微镜观察细胞凋亡、活性氧含量,荧光定量PCR检测mRNA等方法探明P7C3-A20在PC12细胞TBI模型中所起的作用,为临床合理用药提供试验依据。
1 材料与方法
1.1 试验材料
3,6-二溴-beta-氟-N-(3-甲氧基苯基)-9H-咔唑-9-丙胺(P7C3-A20),分子式为C22H19Br2FN2O,购自上海源叶生物科技有限公司;CCK-8试剂盒购自武汉赛维尔生物科技有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒、细胞活性氧(ROS)检测试剂盒购自上海贝博生物科技有限公司;TransZol Up Plus RNA Kit、TransScript Uni One-Step gDNA Removal and cDNA Synthesis SuperMix购自北京全式金生物技术股份有限公司;LightCycler 480 SYBR Green I Master购自Roche公司。
1.2 主要仪器
Biotek 800TS吸收光酶标仪(美国伯腾仪器有限公司);ECHO revolve FL正置倒置一体荧光显微镜(北京深蓝云生物科技有限公司);Roche LightCycler480 Ⅱ实时荧光定量PCR仪(罗氏诊断产品(上海)有限公司)。
1.3 试验细胞
大鼠肾上腺髓质嗜铬瘤分化细胞株(PC12细胞),由东北农业大学临床教研室高利教授课题组馈赠。
1.4 试验方法
1.4.1 试验设计 将PC12细胞分为6组,分别为对照组(A组)、模型组(B组)和造模加药物治疗组,其中药物浓度分为0.03、0.3、和3 μmol·L-13组(C~E组)和药物空白组(F组)。A组不造模,在添加含100 mL·L-1血清、10 mL·L-1双抗的高糖DMEM培养液中培养细胞,并把细胞放置于37 ℃,50 mL·L-1CO2的培养箱中。B~E组模型通过使用10 μL枪头划出横竖相间4 mm的直线来制备[9]。B组造模后,后续处理与对照组相同。C~E组造模后使用不同浓度的P7C3-A20药物溶液对细胞进行治疗。F组不造模,只在对照组的基础上添加3 μmol·L-1的P7C3-A20药物溶液。
1.4.2 酶标仪检测细胞活力 在96孔板中,每孔接种100 μL细胞悬液,细胞密度为1×105·mL-1,待细胞贴壁完全后处理细胞,各组培养24 h后加入CCK8液,在培养箱避光孵育1 h,然后使用酶标仪测定450 nm处的吸光度。采用说明书中“细胞活力(%)=[A(加药)-A(空白)]/[ A(0加药)-A(空白)] ×100”公式对细胞活力进行计算。
1.4.3 荧光显微镜观察细胞凋亡、活性氧情况 在24孔板中,每孔接种500 μL细胞悬液,细胞密度为2×105·mL-1,待细胞贴壁完全后处理细胞,然后按说明使用Annexin V-FITC/PI双染细胞凋亡检测试剂盒与细胞活性氧(ROS)检测试剂盒对细胞进行染色,最后使用荧光显微镜观察细胞凋亡与活性氧的情况。
1.4.4 荧光定量PCR检测Caspase-3、Bcl-2、HO-1、NQO1和GCLCmRNA相对表达量 应用SYBR Green荧光定量PCR检测半胱氨酸蛋白酶-3(Caspase-3)、B细胞淋巴瘤/白血病-2基因(Bcl-2)、血红素氧合酶1(HO-1)、NAD(P)H:醌氧化还原酶1(NQO1)和谷氨酸半胱氨酸连接酶催化亚基(GCLC)在PC12细胞中的mRNA相对表达量。引物由生工生物工程(上海)股份有限公司设计与合成,引物序列见表1。反应体系为LightCycler 480 SYBR Green I Master 10 μL、Double Distilled Water 8 μL、cDNA 1 μL、上下游引物各0.5 μL。反应程序为95 ℃ 5 min;95 ℃ 10 s,53 ℃ 20 s,72 ℃ 20 s,45个循环;95 ℃ 5 s;65 ℃ 1 min;每间隔5 s上升0.5 ℃至97 ℃。以β-actin为内参,采用2-ΔΔCt法计算Caspase-3、Bcl-2、HO-1、NQO1、GCLC的mRNA相对表达量。
1.5 统计分析


表1 荧光定量PCR引物
2 结 果
2.1 P7C3-A20对细胞活力的影响
PC12细胞活力结果如图1所示。数据显示模型组对比对照组,细胞活力极显著下降(P<0.01)。0.03 μmol·L-1药物治疗组对比模型组,细胞活力显著上升(P<0.05)。0.3 μmol·L-1药物治疗组对比模型组,细胞活力极显著上升(P<0.01)。

A. 对照组;B. 模型组;C. 0.03 μmol·L-1P7C3-A20药物治疗组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1 P7C3-A20药物治疗组。与A组比较,**.P<0.01;与B组比较,#.P<0.05,##.P<0.01A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group. Compared with group A, **. P<0.01. Compared with group B, #. P<0.05, ##.P<0.01图1 细胞活力Fig.1 Cell viability
2.2 P7C3-A20对PC12细胞凋亡的影响
PC12细胞凋亡情况如图2和图3所示,图3的结果为各试验组凋亡细胞比例与对照组凋亡细胞比例的比值。数据显示,相对于对照组,模型组早晚期凋亡细胞比例均极显著增加(P<0.01)。0.03 μmol·L-1药物治疗组对比模型组早期凋亡细胞比例显著减少(P<0.05),晚期凋亡细胞比例极显著减少(P<0.01)。0.3 μmol·L-1和3 μmol·L-1药物治疗组对比模型组早晚期凋亡细胞比例均极显著减少(P<0.01)。
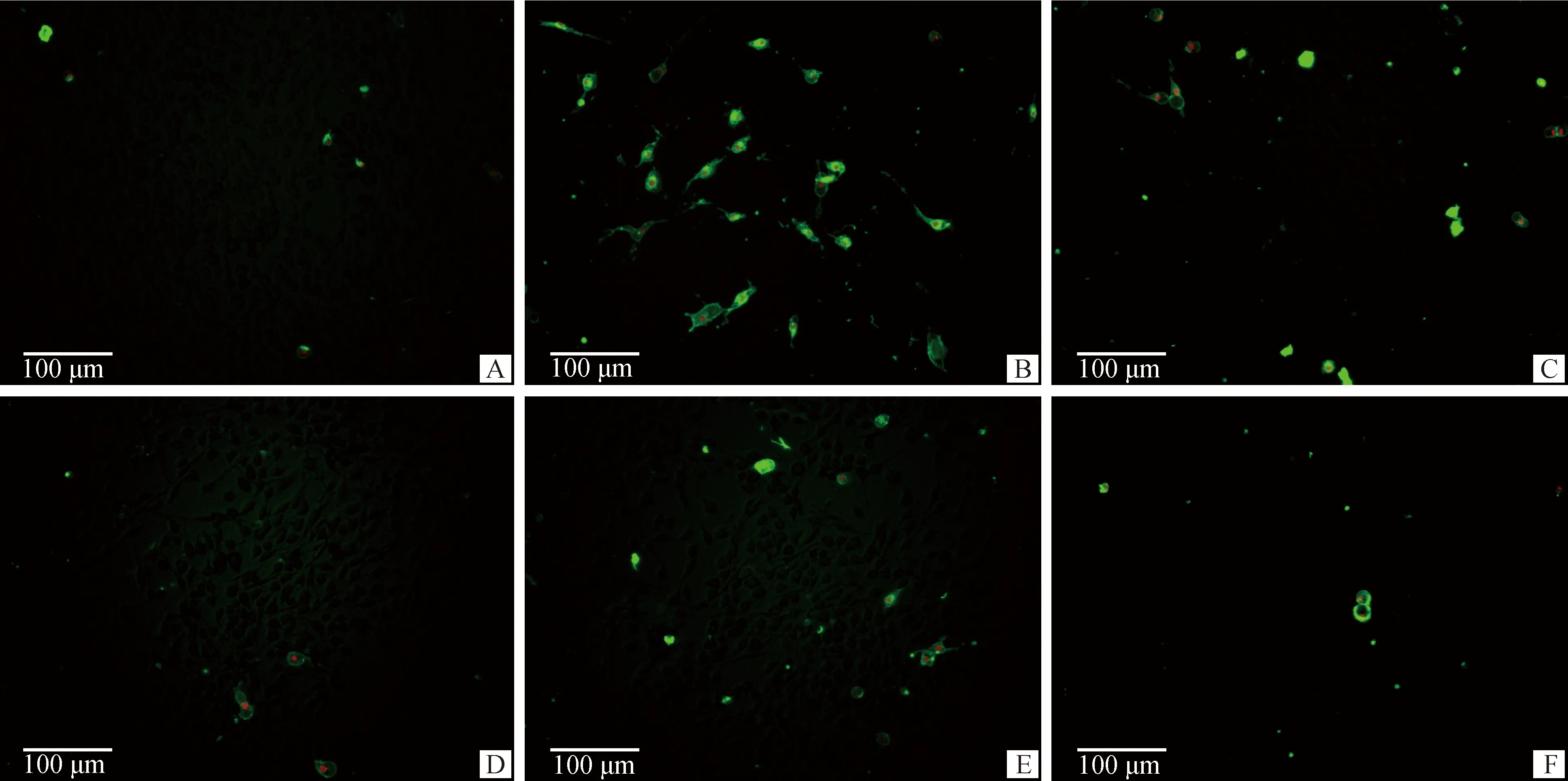
A.对照组;B.模型组;C.0.03 μmol·L-1P7C3-A20药物治疗组;D.0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group图2 PC12细胞凋亡检测(Annexin V-FITC/PI染色,标尺=100 μm)Fig.2 PC12 cell apoptosis detection (Annexin V-FITC/PI stain, Bar=100 μm)

A. 对照组;B. 模型组;C. 0.03 μmol·L-1P7C3-A20药物治疗组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1 P7C3-A20药物治疗组;F. 药物空白组。与A组比较,**.P<0.01;与B组比较,#.P<0.05,##.P<0.01A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, **. P<0.01. Compared with group B, #. P<0.05, ##.P<0.01图3 凋亡细胞比例Fig.3 Proportion of apoptotic cells
2.3 P7C3-A20对PC12细胞活性氧的影响
PC12细胞活性氧情况如图4和图5所示,图5的结果为各试验组活性氧细胞比例与对照组活性氧细胞比例的比值。数据显示,相对于对照组,模型组活性氧细胞比例极显著增加(P<0.01)。0.03 μmol·L-1和3 μmol·L-1药物治疗组对比模型组活性氧细胞比例均显著减少(P<0.05)。0.3 μmol·L-1药物治疗组对比模型组活性氧细胞比例极显著减少(P<0.01)。
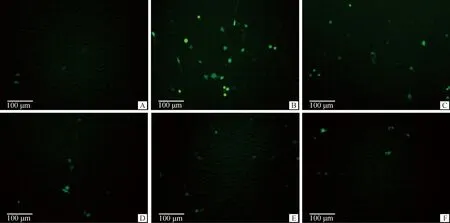
A.对照组;B.模型组;C.0.03 μmol·L-1P7C3-A20药物治疗组;D.0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group图4 PC12细胞活性氧检测(DCFHDA染色,标尺=100 μm)Fig.4 PC12 cell ROS detection (DCFHDA stain, Bar=100 μm)
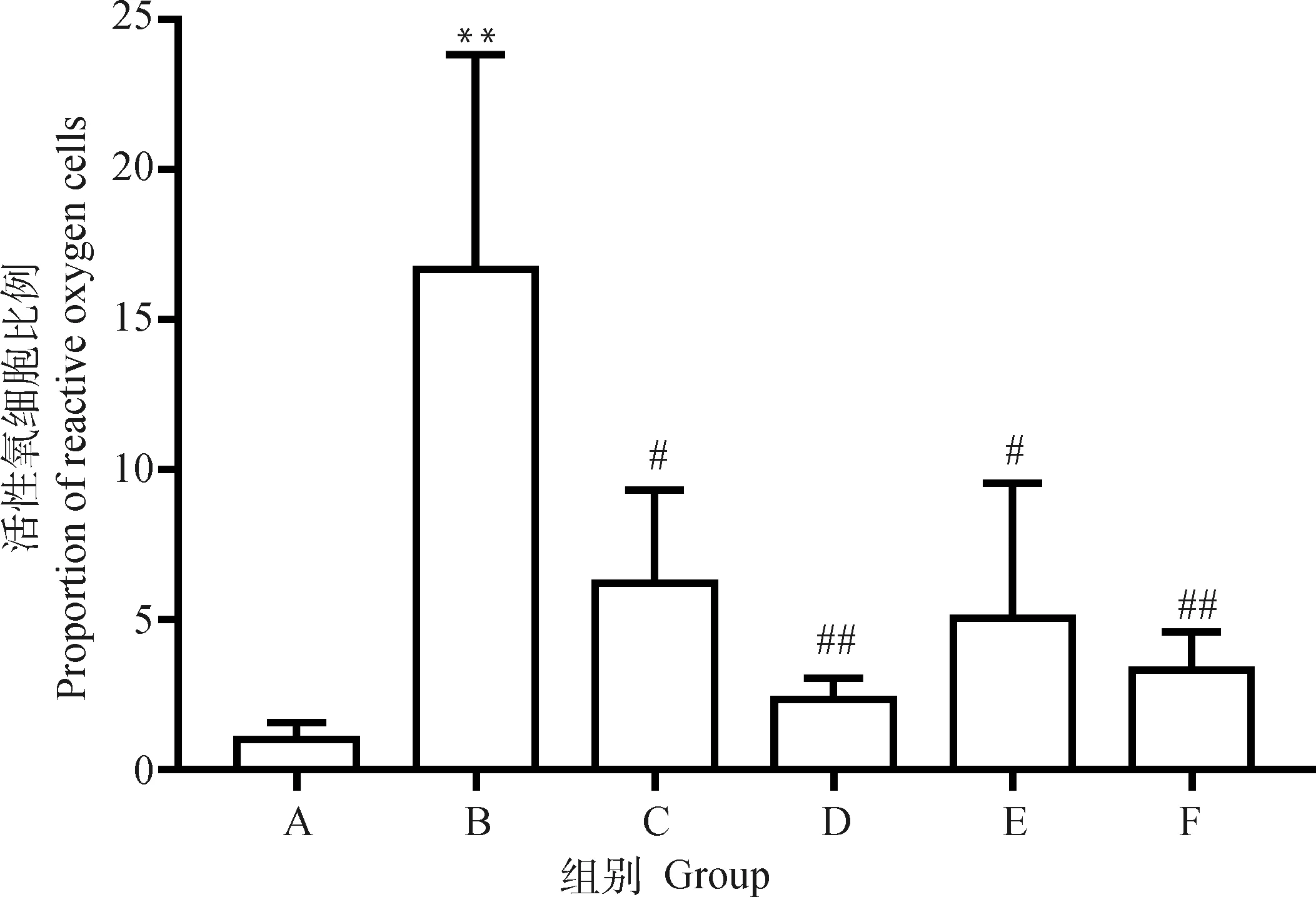
A. 对照组;B. 模型组;C. 0.03 μmol·L-1P7C3-A20药物治疗组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;E. 3 μmol·L-1 P7C3-A20药物治疗组;F. 药物空白组。与A组比较,**.P<0.01;与B组比较,#.P<0.05,##.P<0.01A. Control group; B. Model group; C. 0.03 μmol·L-1P7C3-A20 drug treatment group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; E. 3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, **. P<0.01. Compared with group B, #. P<0.05, ##.P<0.01图5 活性氧细胞比例Fig.5 Proportion of reactive oxygen cells
2.4 P7C3-A20对PC12细胞中Caspase-3、Bcl-2、HO-1、NQO1和GCLC mRNA表达的影响
Caspase-3和Bcl-2 mRNA荧光定量PCR检测结果如图6所示,0.3 μmol·L-1药物治疗组对比模型组Caspase-3 mRNA表达量极显著下降(P<0.01),Bcl-2 mRNA表达量显著上升(P<0.05)。HO-1、NQO1和GCLCmRNA荧光定量PCR检测结果如图7所示,0.3 μmol·L-1药物治疗组对比模型组NQO1、HO-1和GCLCmRNA表达量显著上升(P<0.05)。

A. 对照组;B. 模型组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组。与A组比较,**.P<0.01;与B组比较,#.P<0.05,##.P<0.01A. Control group; B. Model group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, **. P<0.01. Compared with group B, #. P<0.05, ##.P<0.01图6 PC12细胞中Caspase-3、Bcl-2 mRNA的表达量Fig.6 The relative expression of Caspase-3, Bcl-2 mRNA in PC12 cells

A. 对照组;B. 模型组;D. 0.3 μmol·L-1P7C3-A20药物治疗组;F. 药物空白组。与A组比较,*.P<0.05,**.P<0.01;与B组比较,#.P<0.05A. Control group; B. Model group; D. 0.3 μmol·L-1P7C3-A20 drug treatment group; F. Drug blank group. Compared with group A, *.P<0.05,**. P<0.01. Compared with group B, #. P<0.05图7 PC12细胞中HO-1、NQO1、GCLC mRNA的表达量Fig.7 The relative expression of HO-1, NQO1, GCLC mRNA in PC12 cells
3 讨 论
3.1 PC12细胞造模模拟TBI的可行性分析
TBI对动物危害严重,任何对头部的强烈撞击都可能导致TBI的发生,随后会导致运动、感觉和认知等功能障碍,另外还促进氧自由基增多和细胞凋亡等病理过程,且这种损害常常持续很久,甚至持续终生[10-11]。动物在体试验昂贵且费力,细胞体外模型具有易于构建,费时短,花费低,干扰因素少,试验条件可控性强等优点[12]。PC12细胞系是神经科学研究中最常用的细胞之一,源于大鼠嗜铬细胞瘤[13]。细胞体外TBI模型通过机械横断体外细胞,已被许多研究者认可并使用[9,12,14-15]。本试验通过使用10 μL移液枪头划断神经元神经突来制备细胞体外TBI模型,能够模拟神经元的轴索损伤,是一种操作简单,效果显著的体外模型,用于模拟体外TBI后的各种脑组织病变[9]。P7C3-A20能增强正常哺乳动物细胞中NAD补救途径的通量,阻止细胞死亡[6]。NAD在调节线粒体代谢的基本底物方面起重要作用,也是ATP产生的主要底物,对细胞生长、分化,能量代谢和细胞保护方面发挥重要作用。TBI模型中,对PC12细胞使用P7C3-A20能提高细胞活力。
3.2 P7C3-A20对创伤性脑损伤后的PC12细胞具有抗凋亡的作用
细胞凋亡指的是特定蛋白相互作用,程序化传递死亡诱导信号,从而进行细胞分解的过程[16]。凋亡细胞以核小体结构、脱落受体、抗炎代谢物或者包装在凋亡细胞外囊泡(ApoEVs)中的分子形式释放信使[17]。在此试验中,Annexin V-FITC能在Ca2+环境下与磷脂酰丝氨酸(PS)结合,早期凋亡细胞PS会从细胞膜内侧外翻,会被Annexin V-FITC染料染成绿色。PI不能透过完整细胞膜,但当细胞膜破损后,PI则能渗透进去,故晚期凋亡细胞会被Annexin V-FITC与PI同时染成绿色与红色。半胱氨酸蛋白酶(caspase)可以启动细胞凋亡,其家族成员Caspase-3是细胞凋亡级联反应关键的因子,细胞凋亡信号出现时,会导致Caspase-3裂解并被激活,而活化后的Caspase-3又会进一步放大蛋白酶级联切割效应,导致细胞最终走向死亡,Caspase-3一旦被激活,细胞凋亡则不可避免[10,18]。Caspase-3是重要的凋亡蛋白酶,其表达量可直接反映细胞凋亡的程度[18]。Bcl-2是典型的抗凋亡蛋白,可以通过形成异源二聚体来抑制凋亡,还可以通过抗氧化作用来提高细胞存活率[16]。TBI后使用P7C3-A20治疗,凋亡面积减少,Caspase-3 mRNA表达量下降,Bcl-2 mRNA表达量上升,表明P7C3-A20可以减少TBI后的神经元凋亡,具有抗凋亡的功能。
3.3 P7C3-A20对创伤性脑损伤后的PC12细胞具有抗氧化应激的作用
ROS诱导的脂质过氧化在细胞死亡中起重要作用,由于多不饱和脂肪酸含量较高,细胞膜和细胞器膜很容易受到ROS损伤,甚至会导致细胞凋亡[19]。ROS包括过氧化氢(H2O2)、一氧化氮(NO)、超氧阴离子(·O2-)、羟基自由基(·OH)、过氧化自由基(ROO·)、过氧羟自由基(HOO·)和单线态氧(1O2)等,它们会被DCFHDA荧光探针标记成绿色。ROS的过度产生会攻击生物膜,对细胞成分产生不利的影响,增强各种致病机制,引起氧化应激,而氧化应激会引起大脑神经损伤,诱导不同类型的细胞死亡。HO-1、NQO1和GCLC是Nrf2下游的抗氧化基因,上调HO-1、NQO1和GCLC基因的表达可以发挥抗氧化应激的作用[20-22]。HO-1在其启动子区域有一个抗氧化反应元件,HO-1直接影响机体的抗氧化平衡,并具有抗凋亡的作用[23]。NQO1能以NAD (P) H为受体,将醌类物质通过双电子还原反应转化为低毒性的氢醌类物质,从而避免细胞氧化损伤[24-25]。GCLC是抗氧化蛋白酶,能提高抗氧化应激的能力[20]。TBI后使用P7C3-A20治疗,活性氧面积减少,HO-1、NQO1和GCLCmRNA的表达量上升,说明PC12细胞在TBI后使用P7C3-A20会使氧化应激减少。
4 结 论
P7C3-A20对创伤性脑损伤后的PC12细胞有抗凋亡、减轻氧化应激的修复作用。
