罗沙司他联合重组人红细胞生成素治疗维持性血液透析肾性贫血临床观察*
2023-01-02王荣忠樊萍陈慧李恩琳王莉姚明娄璠余少斌
王荣忠,樊萍,陈慧,李恩琳,王莉,姚明,娄璠,余少斌
(1.四川大学华西医院临床药学部,四川 成都 610041;2.四川大学华西医院肾脏内科,四川 成都 610041)
维持性血液透析(MHD)是治疗终末期肾脏病常用的肾脏替代疗法,但长期MHD会加重贫血、心血管疾病的发生风险[1]。肾性贫血主要因红细胞生成素(EPO)生成不足导致[2],常用治疗方法是补充EPO。有研究显示,对MHD患者每周给予1次EPO可升高血红蛋白(Hb)水平[3]。然而,随着使用剂量的增加,患者常出现EPO抵抗,效果欠佳,甚至引发高血压。对于存在肺部感染的患者,EPO使用有局限性;还可能加重肿瘤患者的复发。罗沙司他为第二代低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),能稳定低氧诱导因子(HIF)水平,降低铁调素水平,升高EPO水平,避免了外源性补充EPO带来的相关并发症的发生。基于此,本研究中探讨了罗沙司他联合重组人红细胞生成素(rhEPO)治疗MHD肾性贫血患者的临床疗效。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《肾性贫血诊断与治疗中国专家共识(2018修订版)》[4]相关诊断标准;MHD治疗时间不短于3个月,每周至少2次;年龄≥18岁。研究经医院医学伦理委员会批准,患者及其家属签署知情同意书。
排除标准:再生障碍性贫血;合并癌症等恶性疾病;合并慢性失血性疾病;严重感染性疾病或免疫功能异常;严重营养不良;入组前1个月有铁剂使用史;认知功能障碍或精神状态欠佳;活动性出血;对本研究拟用药物过敏。
病例选择与分组:选取医院2020年7月至2021年9月收治行MHD的患者108例,按倾向评分匹配法分为观察组和对照组,各54例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组患者一般资料比较(n=54)Tab.1 Comparison of the patients'general data between the two groups(n=54)
1.2 方法
两组患者均予肾性贫血常规治疗,包括降压、调节水电解质平衡等治疗,并保证低蛋白饮食,进行规律血液透析;血液透析结束后予重组人红细胞生成素-β注射液(德国Roche Diagnostics GmbH,国药准字J20130094,规格为每支2 000 IU/0.3 mL)100~150 U/kg,分3次静脉注射,根据患者血常规指标调整剂量;并琥珀酸亚铁片(成都奥邦药业有限公司,国药准字H20083003,规格为每片0.1 g)0.1 g口服,每天3次,治疗3个月。观察组患者在血液透析结束后加服罗沙司他胶囊[珐博进(中国)医药技术开发有限公司,国药准字H20180024,规格为每粒50 mg],体质量40~60 kg者每次100 mg,>60 kg者每次120 mg,每周3次,根据患者血常规指标变化调整用量,持续治疗3个月。
1.3 观察指标
采集患者治疗前、治疗1个月后、治疗3个月后的静脉血,采用血细胞分析仪检测Hb浓度、红细胞计数(RBC)、平均红细胞血红蛋白(MCHC)浓度;取上述血液,离心,分离,得血清,采用全自动生化分析仪检测血清转铁蛋白饱和度(TS)、铁蛋白(FER)、血清白蛋白(Alb)、及白蛋白/球蛋白(A/G)、肌酐(Cr)、尿素氮(BUN)的水平;取上述血液,采用全自动化学发光免疫分析仪检测高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)的水平。观察治疗期间患者头晕、恶心、乏力、肠胃不适等不良反应发生情况。
1.4 统计学处理
采用SPSS 21.0统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验或Fisher精确概率检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表7。
表2 两组患者贫血指标比较(±s,n=54)Tab.2 Comparison of anemia indicators between the two groups(±s,n=54)
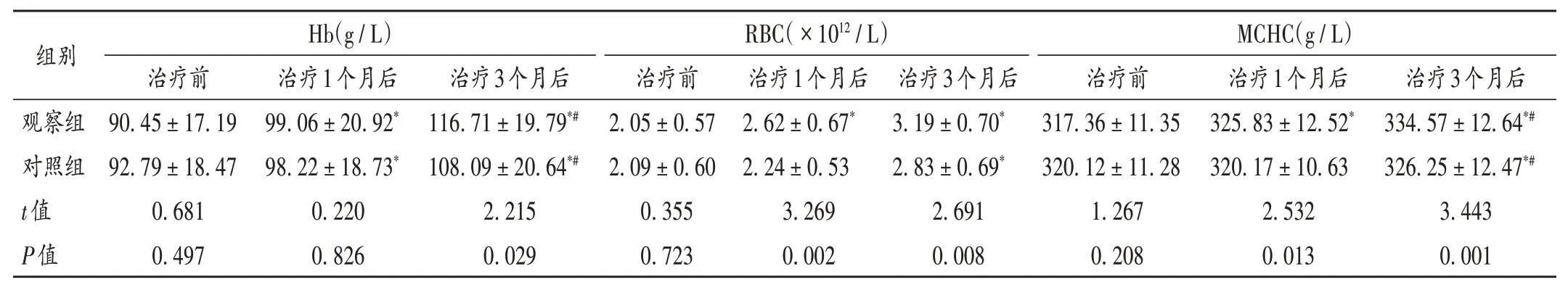
表2 两组患者贫血指标比较(±s,n=54)Tab.2 Comparison of anemia indicators between the two groups(±s,n=54)
注:与本组治疗前比较,*P<0.05;与本组治疗1个月后比较,#P<0.05。表3至表6同。Note:Compared with those before treatment,*P<0.05;Compared with those after one month of treatment,#P<0.05(for Tab.2-6).
组别观察组对照组t值P值Hb(g/L)治疗前90.45±17.19 92.79±18.47 0.681 0.497治疗1个月后99.06±20.92*98.22±18.73*0.220 0.826治疗3个月后116.71±19.79*#108.09±20.64*#2.215 0.029 RBC(×1012/L)治疗前2.05±0.57 2.09±0.60 0.355 0.723治疗1个月后2.62±0.67*2.24±0.53 3.269 0.002治疗3个月后3.19±0.70*2.83±0.69*2.691 0.008 MCHC(g/L)治疗前317.36±11.35 320.12±11.28 1.267 0.208治疗1个月后325.83±12.52*320.17±10.63 2.532 0.013治疗3个月后334.57±12.64*#326.25±12.47*#3.443 0.001

表7 两组患者不良反应发生情况比较[例(%),n=54]Tab.7 Comparison of the incidence of adverse drug reactions between the two groups[case(%),n=54]
3 讨论
治疗肾性贫血常见手段是补充铁剂或给予EPO[5],但对铁代谢无明显改善,且使用后头痛、血液高凝等药品不良反应的发生率相应提升[6]。罗沙司他是首个经我国审批上市的小分子HIF-PHI类药物,对于肾性贫血的治疗有一定意义[7-8]。
本研究中,观察组患者治疗3个月后的贫血指标相较于治疗前与治疗1个月后显著改善,且优于对照组,提示使用罗沙司他可降低肾性贫血风险。红细胞寿命短与氧感受机制异常是导致肾性贫血的主要原因,与HIF水平关系紧密[9],观察组患者血常规状态恢复较好,原因为罗沙司他可敏感地感应机体缺氧状态,通过敏感模拟底物,抑制脯氨酰羟化酶(PH)活性,从而调节HIF在机体中的平衡状态,促使EPO合成[10-11]。同时,MHD使体内红细胞无法正常存活造成铁代谢异常,使贫血状态反复[12]。本研究中,治疗1个月及3个月后,观察组患者的铁代谢指标优于对照组,可能与罗沙司他对铁利用与铁蛋白的全面有效调控有关。推测其调控途径,一是其中HIF-PHI可调控铁代谢,促进肝细胞分泌小分子激素铁调素,保证铁代谢的稳态;二是其有促进血红素氧合酶转录的作用,提高机体对铁的利用能力,增加内皮细胞、巨噬细胞等对铁的转运能力,提高肠内铁吸收效率,对机体铁循环状态有积极改善作用[13]。
表3 两组患者肾功能指标比较(±s,n=54)Tab.3 Comparison of renal function indicators between the two groups(±s,n=54)
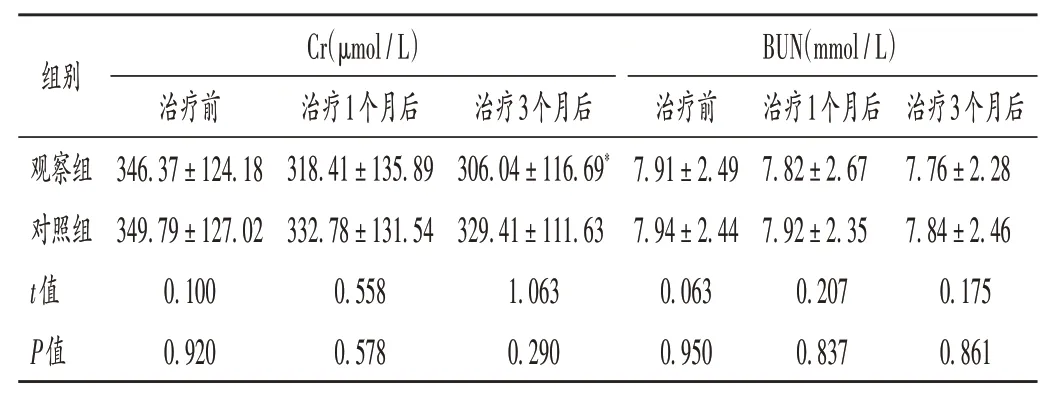
表3 两组患者肾功能指标比较(±s,n=54)Tab.3 Comparison of renal function indicators between the two groups(±s,n=54)
组别观察组对照组t值P值Cr(μmol/L)治疗前346.37±124.18 349.79±127.02 0.100 0.920治疗1个月后318.41±135.89 332.78±131.54 0.558 0.578治疗3个月后306.04±116.69*329.41±111.63 1.063 0.290 BUN(mmol/L)治疗前7.91±2.49 7.94±2.44 0.063 0.950治疗1个月后7.82±2.67 7.92±2.35 0.207 0.837治疗3个月后7.76±2.28 7.84±2.46 0.175 0.861
表4 两组患者营养指标比较(±s,n=54)Tab.4 Comparison of nutritional status between the two groups(±s,n=54)
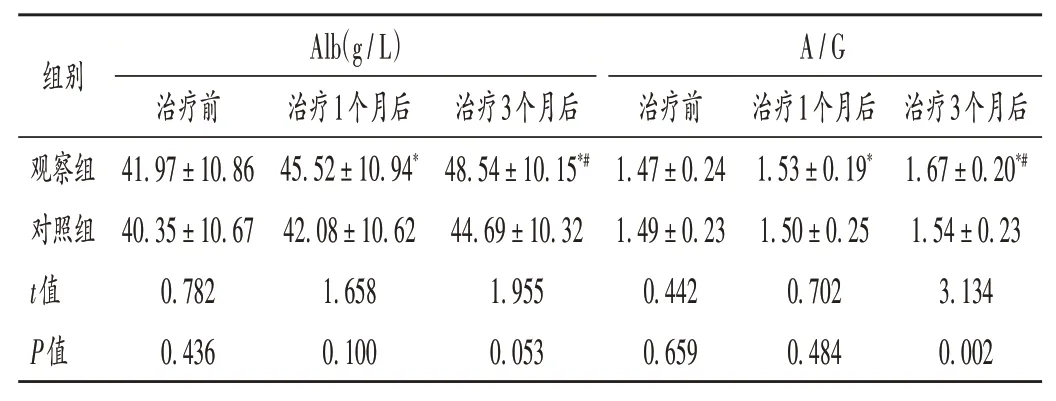
表4 两组患者营养指标比较(±s,n=54)Tab.4 Comparison of nutritional status between the two groups(±s,n=54)
组别观察组对照组t值P值Alb(g/L)治疗前41.97±10.86 40.35±10.67 0.782 0.436治疗1个月后45.52±10.94*42.08±10.62 1.658 0.100治疗3个月后48.54±10.15*#44.69±10.32 1.955 0.053 A/G治疗前1.47±0.24 1.49±0.23 0.442 0.659治疗1个月后1.53±0.19*1.50±0.25 0.702 0.484治疗3个月后1.67±0.20*#1.54±0.23 3.134 0.002
表5 两组患者脂代谢指标比较(±s,mmol/L,n=54)Tab.5 Comparison of lipid metabolism indicators between the two groups(±s,mmol/L,n=54)

表5 两组患者脂代谢指标比较(±s,mmol/L,n=54)Tab.5 Comparison of lipid metabolism indicators between the two groups(±s,mmol/L,n=54)
组别观察组对照组t值P值HDL-C治疗前1.24±0.56 1.22±0.54 0.189 0.851治疗1个月后1.44±0.59*1.29±0.56 1.355 0.178治疗3个月后1.68±0.62*#1.32±0.69 2.852 0.005 LDL-C治疗前2.33±0.68 2.28±0.57 0.414 0.680治疗1个月后2.14±0.55*2.20±0.53 0.557 0.565治疗3个月后2.20±0.48 2.18±0.54 0.203 0.839 TG治疗前1.93±0.54 1.98±0.57 0.374 0.709治疗1个月后2.05±0.51 2.01±0.56 0.388 0.699治疗3个月后2.03±0.67 2.04±0.52 0.087 0.931
表6 两组患者铁代谢指标比较(±s,n=54)Tab.6 Comparison of iron metabolism indicators between the two groups(±s,n=54)

表6 两组患者铁代谢指标比较(±s,n=54)Tab.6 Comparison of iron metabolism indicators between the two groups(±s,n=54)
组别观察组对照组t值P值TS(%)治疗前34.16±6.31 33.85±6.37 0.254 0.800治疗1个月后34.38±6.34 33.79±6.28 0.486 0.628治疗3个月后38.94±6.57*#35.03±6.36 3.142 0.002 FER(ng/mL)治疗前247.55±12.36 243.68±12.47 1.620 0.108治疗1个月后219.05±15.41*227.55±16.58*2.759 0.007治疗3个月后194.73±19.69*#214.89±19.23*#5.383 0.000
多数血液透析患者由于反复穿刺存在临床症状不显著的慢性持续性机体炎症,不及时干预会导致严重的炎性反应[14-15],炎性水平过高还会对免疫细胞产生刺激,干扰红细胞生成与铁输出功能,加重肾性贫血程度[16],因此,微炎症是MHD患者亟待解决的首要问题。同时,炎性因子的过度积累持续损害MHD患者肾功能,影响肾脏对脂蛋白的清除能力,加速赖氨酸的丢失,故患者出现血脂异常和心脑血管疾病发生的风险相应提升[17-18]。本研究中,相较于对照组,观察组患者治疗3个月后营养状态、脂代谢指标均显著改善,提示罗沙司他可间接调节患者机体微炎性状态,降低营养不良、血栓形成的风险。HDL-C水平升高是心血管病患病风险降低的表现,但当前此调节机制尚未完全阐明,推测与罗沙司他中HIF可提高脂蛋白受体表达水平,从而提高相关脂质的摄取能力有关[19-20]。
行MHD的患者多处于肾病终末期,需利用多种降压药维持血压稳定,但仍有超90%的患者患有难治性高血压[21]。患者血压水平不稳定,使肾小球处于高压力状态,加重肾负担。故避免治疗期间血压过高也是稳定肾功能、提高用药安全性的保证。本研究中,观察组患者治疗3个月后的肾功能指标显著改善,且两组不良反应发生率无明显差异,提示罗沙司他安全性较好。观察组患者治疗3个月后的Cr水平低于对照组,说明罗沙司他可能存在间接调节肾性高血压的临床效果,与HIF-PHI具有降低血压、缓解血管阻力的功能相关性较高[22]。同时HIF1α与2α可控制血流灌注与机体动脉血压,调节交感神经系统,从而抑制肾性高血压的发展,有利于提高MHD患者自身血压的控制能力[23]。同时,由于罗沙司他于近几年上市,因此本研究存在观察时间过短的问题,还需对患者用药后的相关指标进行长期观察,以证罗沙司他在MHD患者治疗中的应用价值。
综上所述,罗沙司他联合rhEPO治疗MHD患者的肾性贫血,可有效改善贫血状态,提高机体对铁的利用能力。
