化肝煎对慢性胃炎和非酒精性脂肪性肝病异病同治作用机制的网络药理学研究*
2023-01-02盛丹丹杨帆郭宏举钱奇芳刘芳史宁
盛丹丹,杨帆,郭宏举,钱奇芳,刘芳,史宁△
(1.中国人民解放军战略支援部队特色医学中心,北京 100101;2.中国人民解放军陆军军医大学第一附属医院,重庆 400038)
慢性胃炎为临床常见疾病,主要表现为反酸、疼痛、腹胀等症状,因多种致病因素对胃黏膜上皮细胞的反复侵袭,导致持续性慢性炎症改变[1],如不及时、有效治疗,易发展为胃癌[2]。西药主要通过抑制胃酸分泌、保护胃黏膜、根除幽门螺杆菌(HP)、促进胃肠蠕动等措施进行治疗,但有细菌耐药、病情复发等缺点。慢性胃炎属中医“胃脘痛”“痞满”“吐酸”等范畴,其病位虽在胃,但其发生与肝、脾功能密切相关。疏肝法为慢性胃炎的中医常用疗法,常用方剂包括化肝煎、柴胡疏肝散、石斛养胃汤、半夏泻心汤等[3-5],可有效缓解患者不适,降低复发率,显著提升疗效[6]。非酒精性脂肪性肝病(NAFLD)为全球最常见的肝病,属代谢功能障碍相关性脂肪肝病[7],目前尚无批准疗法[8]。《非酒精性脂肪性肝病中医诊疗专家共识意见(2017)》指出,采用疏肝健脾方法治疗肝郁脾虚证[9]。化肝煎出自《景岳全书》,由陈皮、青皮、丹皮、栀子、白芍、泽泻、土贝母组方,具有疏肝泻热功效,化肝煎加减用于治疗慢性胃炎[10-12]和NAFLD[13-14]的疗效显著,但其异病同治的作用机制尚未阐明。本研究中基于网络药理学和分子对接技术,初步探讨了化肝煎对慢性胃炎和NAFLD异病同治的作用机制。现报道如下。
1 研究方法
1.1 筛选化肝煎活性成分及靶点
在中药系统网络药理学数据库和分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)中,以“陈皮”“青皮”“白芍”“丹皮”“栀子”“泽泻”“土贝母”为关键词搜索,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18%的化合物为化肝煎方中的有效活性成分,同时通过检索文献对未入选但有相关活性研究的成分进行补充,汇集全部有效活性成分及药物活性成分相关靶点。利用Uniprot数据库将靶点名称转变成标准基因名称,得到化肝煎靶点基因。
1.2 建立与慢性胃炎和NAFLD的靶点交集
在OMIM(https://omim.org/)、GeneCards(https://www.genecards.org/)、TTD(http://db.idrblab.net/ttd/)数据库中,以“chronic gastritis”“nonalcoholic fatty liver disease”为关键词,搜索2种疾病的作用靶点,合并并删除重复靶点,得到有效靶点。采用Venny 2.1软件(https://bioinfogp.cnb.csic.es/tools/venny/)处理慢性胃炎、NAFLD和化肝煎活性成分的靶点,得交集靶点,并绘制韦恩图。
1.3 构建药物-活性成分-靶点网络
利用获得的交集靶点基因反向筛查化肝煎中对应的药物活性成分,借助Cytoscape_v 3.8.0软件构建药物-活性成分-靶点网络。
1.4 构建药物与疾病蛋白相互作用(PPI)网络
采用String数据库(https://cn.string-db.org/)对1.2项下交集靶点进行PPI分析,物种限定为Homo Sapiens,中置信度(medium confidence)>0.4。通过Cytoscape_v 3.8.0软件进行可视化分析,运用CytoHubba插件筛选出PPI网络的核心靶点。
1.5 富集分析
使用R语言软件对交集靶点基因进行基因本体论(GO)生物功能富集分析及京都基因与基因组百科全书(KEGG)通路富集分析,并对分析结果绘制气泡图进行可视化处理(气泡大小代表富集基因数目;adjustedPvalue颜色从红色至紫色,表示值从大到小,富集程度越来越显著)。
1.6 分子对接
选取PPI网络中节点度值排名前3的靶蛋白(受体蛋白)和药物-活性成分-靶点网络中节点度值排名靠前的药物活性成分(配体分子)进行分子对接验证。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)下载药物活性成分的2D结构,从PDB数据库(https://www1.rcsb.org)下载受体蛋白的3D结构,利用PyMOL软件去掉受体蛋白配体,AutoDockTools软件对受体蛋白及其配体分子进行去水、加氢、加电荷操作,并进行分子对接。利用PyMOL软件将对接结果进行可视化处理。
2 结果与分析
2.1 活性成分及靶点获取
共得到药物化学成分57个[15],预测靶点243个。
2.2 疾病靶点获取
分别获得慢性胃炎和NAFLD疾病靶点2 756个和859个,与化肝煎活性成分的靶点取交集,得到三者的交集靶点36个,见图1。根据交集靶点反向筛选其对应药物活性成分,获得同时治疗2种疾病的潜在药物活性成分,详见表1。
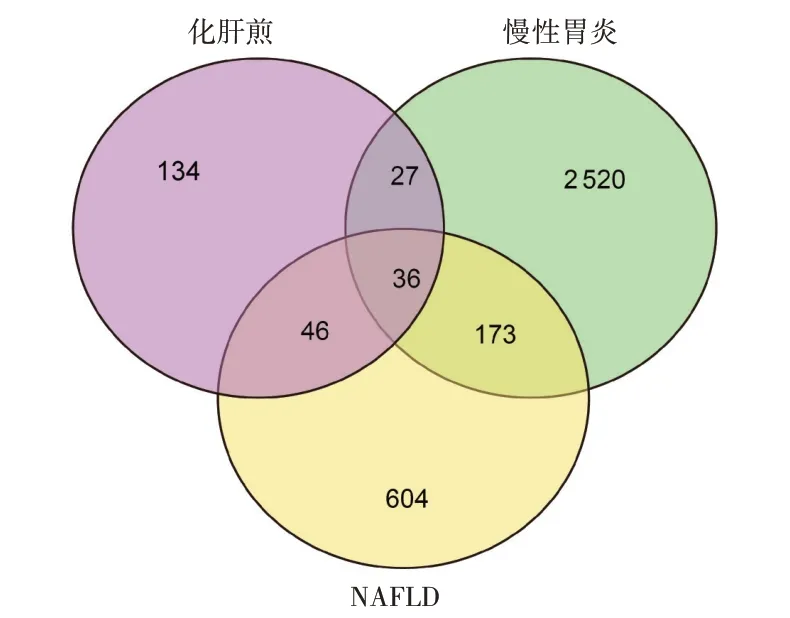
图1 化肝煎治疗慢性胃炎和NAFLD交集靶点韦恩图Fig.1 Venn diagram of the common targets of Huagan Decoction in the treatment of chronic gastritis and NAFLD
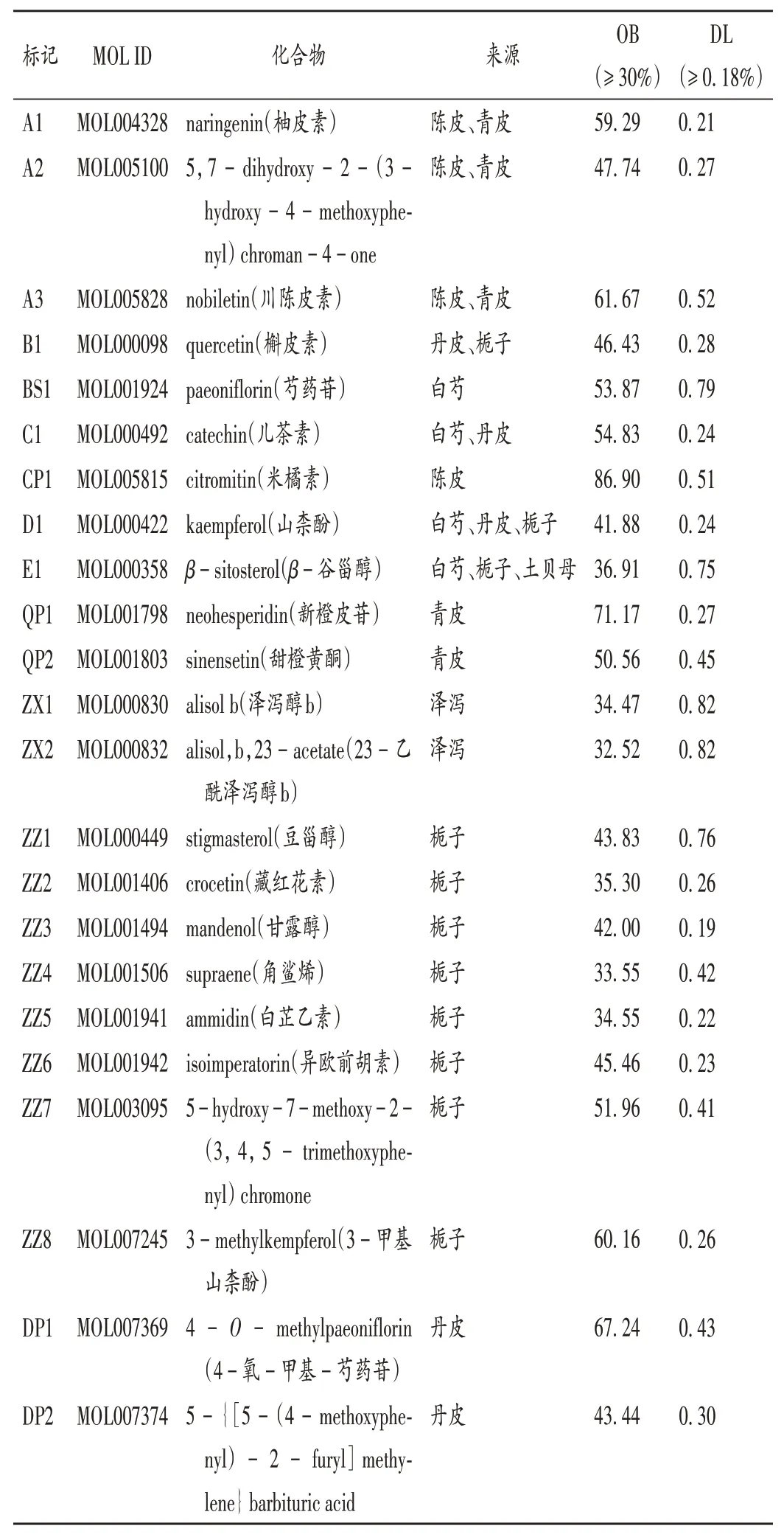
表1 化肝煎治疗慢性胃炎和NAFLD关键活性成分基本信息Tab.1 Basic information of key active components of Huagan Decoction in the treatment of chronic gastritis and NAFLD
2.3 药物-活性成分-靶点网络
共23个活性成分、66个节点和114条边,见图2(A1,A2,A3代表陈皮、青皮共有成分,B1代表丹皮、栀子共有成分,C1代表白芍、丹皮共有成分,D1代表白芍、丹皮、栀子共有成分,E1代表白芍、栀子、土贝母共有成分)。以节点度值设置节点面积大小,并按节点度值大小进行排列筛选。节点度值排前5的活性成分为MOL000098(quercetin/槲皮素)、MOL000422(kaempferol/山柰酚)、MOL005828(nobiletin/川陈皮素)、MOL004328(naringenin/柚皮素)、MOL003095[5-羟基-7-甲氧基-2-(3,4,5-三甲氧基苯基)色酮]。
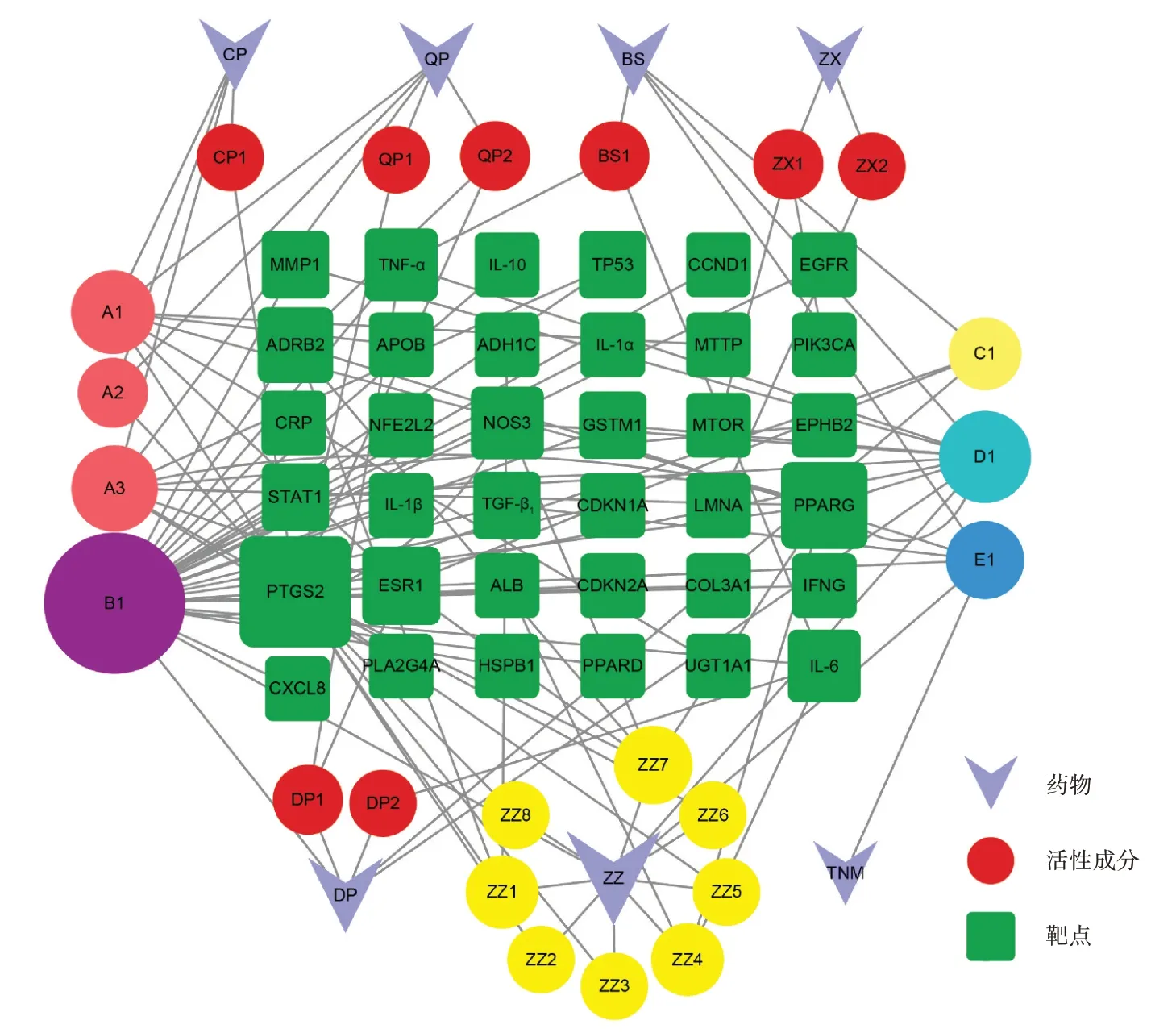
图2 化肝煎治疗慢性胃炎和NAFLD药物-活性成分-靶点网络Fig.2 Drugs-active components-targets network of Huagan Decoction in the treatment of chronic gastritis and NAFLD
2.4 PPI分析
PPI网络包含36个节点和307条边,平均度值为17.06,无游离节点,见图3(网络中各节点的大小、颜色与其度值成正比,节点面积越大、颜色越深,其度值就越高,在PPI网络中越关键)。PPI网络中排名前10的核心靶点(图4),包括白细胞介素1β(IL-1β)、表皮生长因子受体(EGFR)、细胞肿瘤抗原P53(TP53)、肿瘤坏死因子(TNF)、白细胞介素6(IL-6)、白蛋白(ALB)、细胞趋化因子8(CXCL8)、前列腺素内过氧化物合酶2(PTGS2)、转化生长因子β1(TGF-β1)和雷帕霉素靶蛋白(mTOR)。上述靶点在PPI网络中起关键作用,可能是化肝煎治疗慢性胃炎和NAFLD的关键靶点。
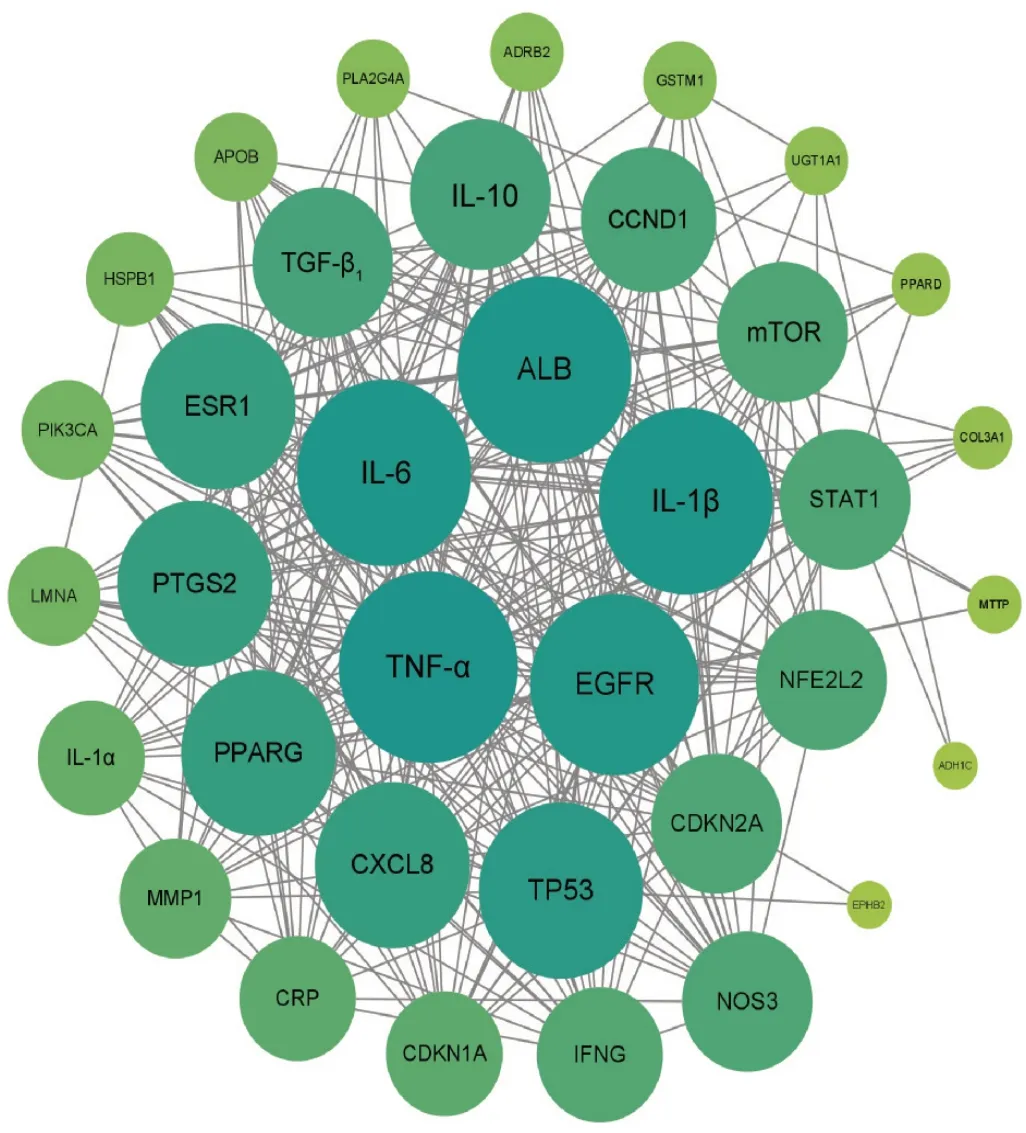
图3 化肝煎治疗慢性胃炎和NAFLD交集靶点的PPI网络Fig.3 PPI network of common targets of Huagan Decoction inthe treatment of chronic gastritis and NAFLD
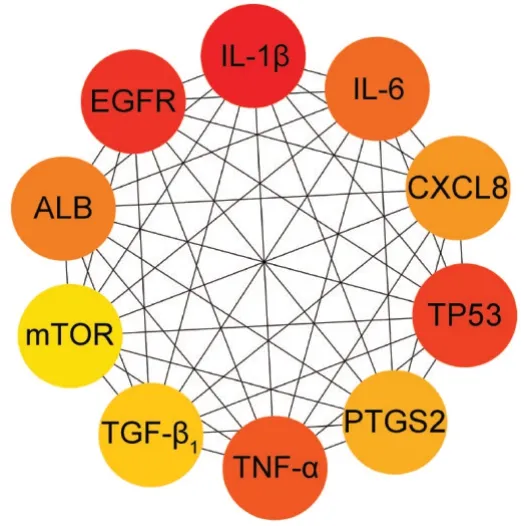
图4 核心靶点的PPI网络Fig.4 PPI network of core targets
2.5 富集分析
GO生物功能富集分析共获得1 445个生物过程(BP),13个细胞组分(CC),58个分子功能(MF)。基于P值大小,分别筛选BP,CC,MF排名前10的条目进行分析(图5),可见,化肝煎异病同治靶点参与的生物过程包括伤口愈合过程、平滑肌细胞增殖及调节增殖过程、营养应答过程、细菌源分子应答过程、脂多糖应答过程等,细胞组分主要影响核膜、内质网腔、内吞囊泡、囊泡腔等,分子功能主要涉及细胞因子受体结合、DNA转录因子受体结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合、受体配体活性、细胞因子活性等。KEGG通路富集分析获得125条信号通路,其中与化肝煎异病同治相关的有晚期糖基化产物-晚期糖基化终末产物受体(AGE-RAGE)信号通路、Janus酪氨酸蛋白激酶-信号转导及转录激活因子(JAK-STAT)信号通路、白细胞介素17(IL-17)等信号通路(图6)。
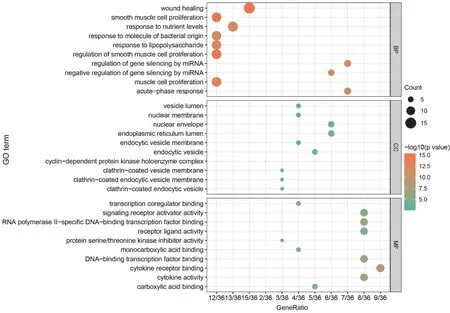
图5 化肝煎治疗慢性胃炎和NAFLD作用靶点GO生物富集分析气泡图Fig.5 Bubble diagram of targets of Huagan Decoction in the treatment of chronic gastritis and NAFLD based on the GO bio-concentration analysis
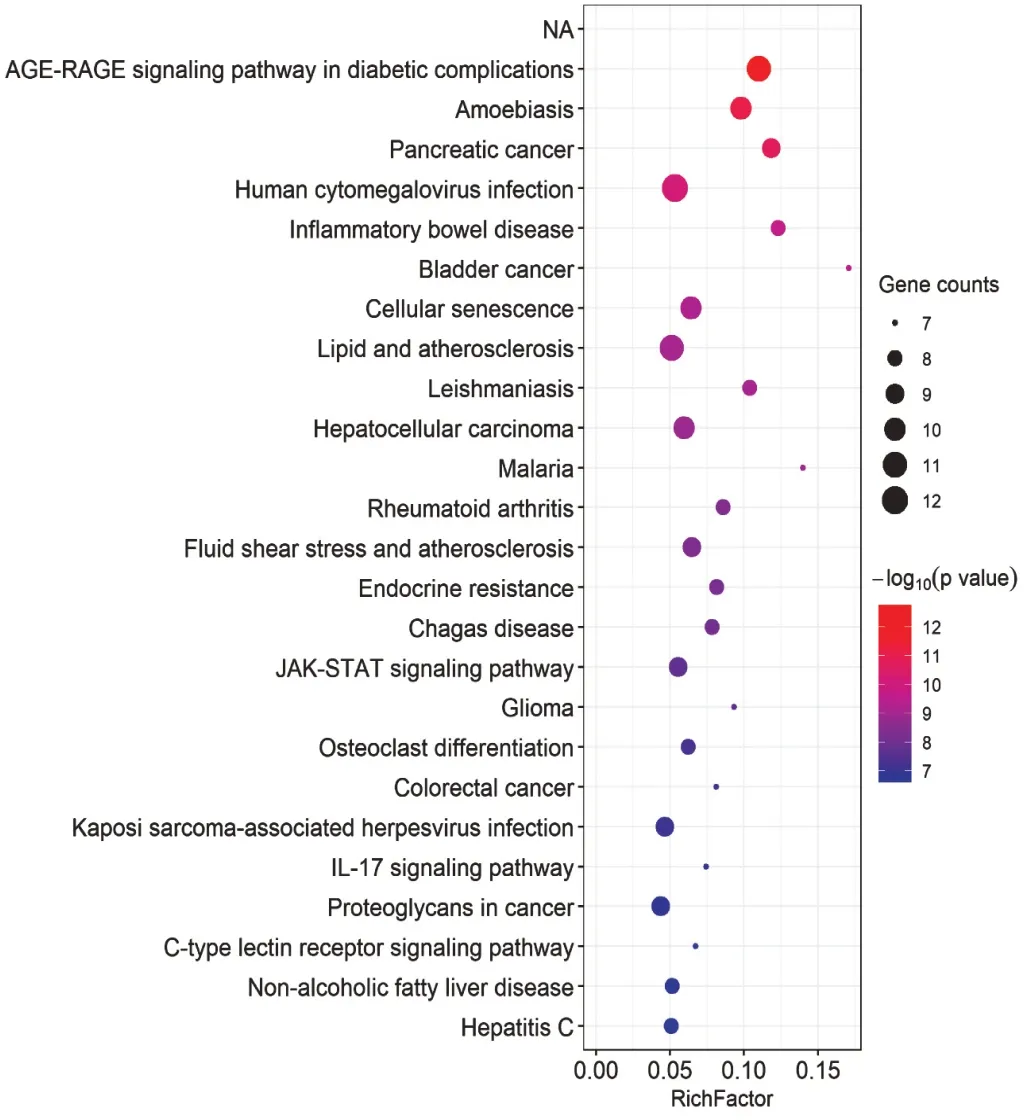
图6 化肝煎治疗慢性胃炎和NAFLD作用靶点KEGG通路富集分析气泡图Fig.6 Bubble diagram of targets of Huagan Decoction in the treatment of chronic gastritis and NAFLD based on the KEGG pathway enrichment analysis
2.6 分子对接验证
配体与受体结合能小于0,表示其能自发结合,且结合能越小,表示结合构象越稳定,一般认为,结合能≤-5 kcal/mol时配体与受体有良好的结合性。结果见表2,可知核心靶点与药物成分均具有较强的相互作用。将表2中对接模式进行可视化分析(图7)。分子对接结果显示,化肝煎主要活性成分与靶点蛋白能很好地结合,证实角鲨烯、槲皮素、芍药苷、山柰酚、4-氧-甲基-芍药苷治疗慢性胃炎和NAFLD的可能性。
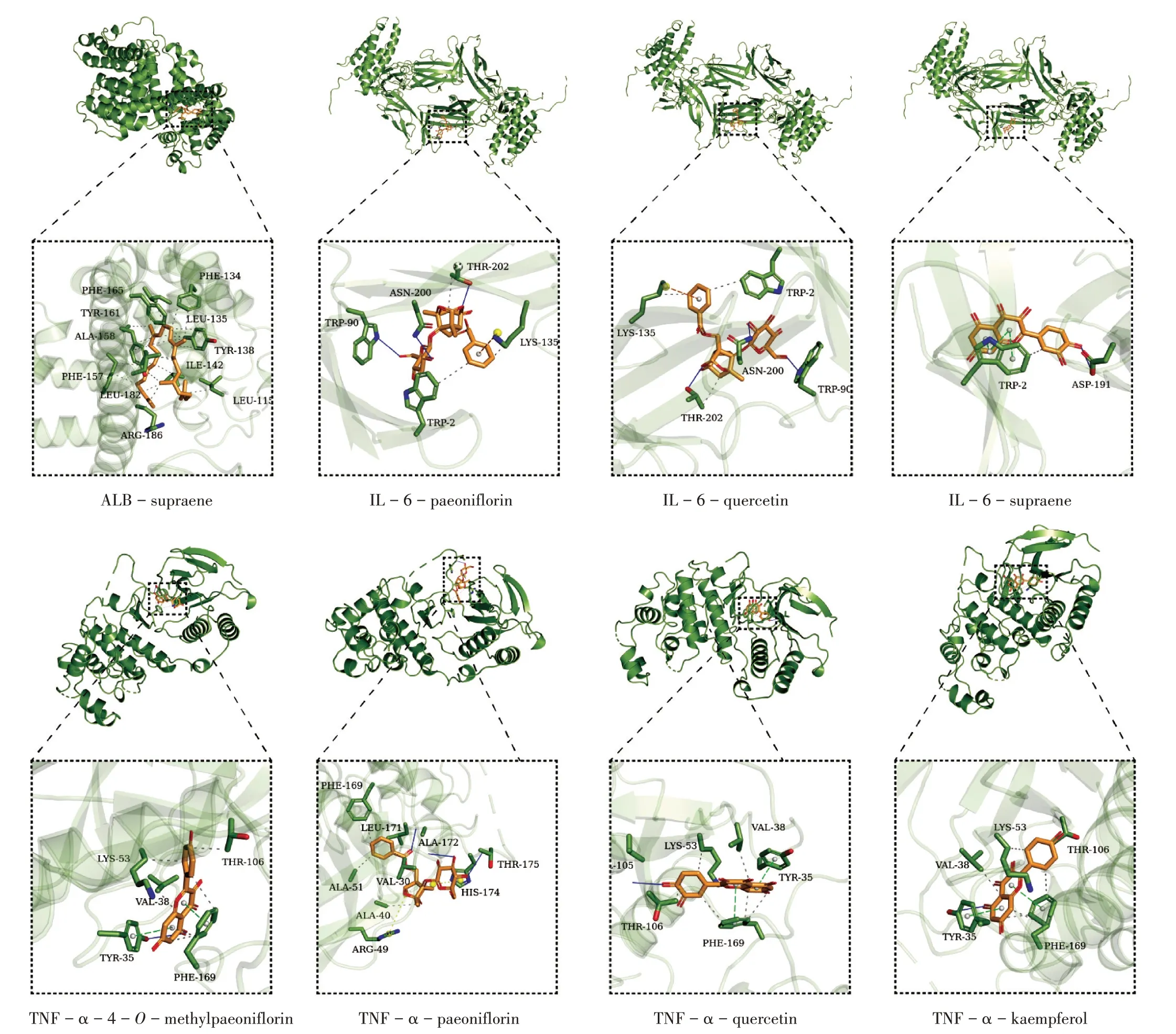
图7 化肝煎活性成分与关键靶点的分子对接图Fig.7 Molecular docking of active components of Huagan Decoction with key targets
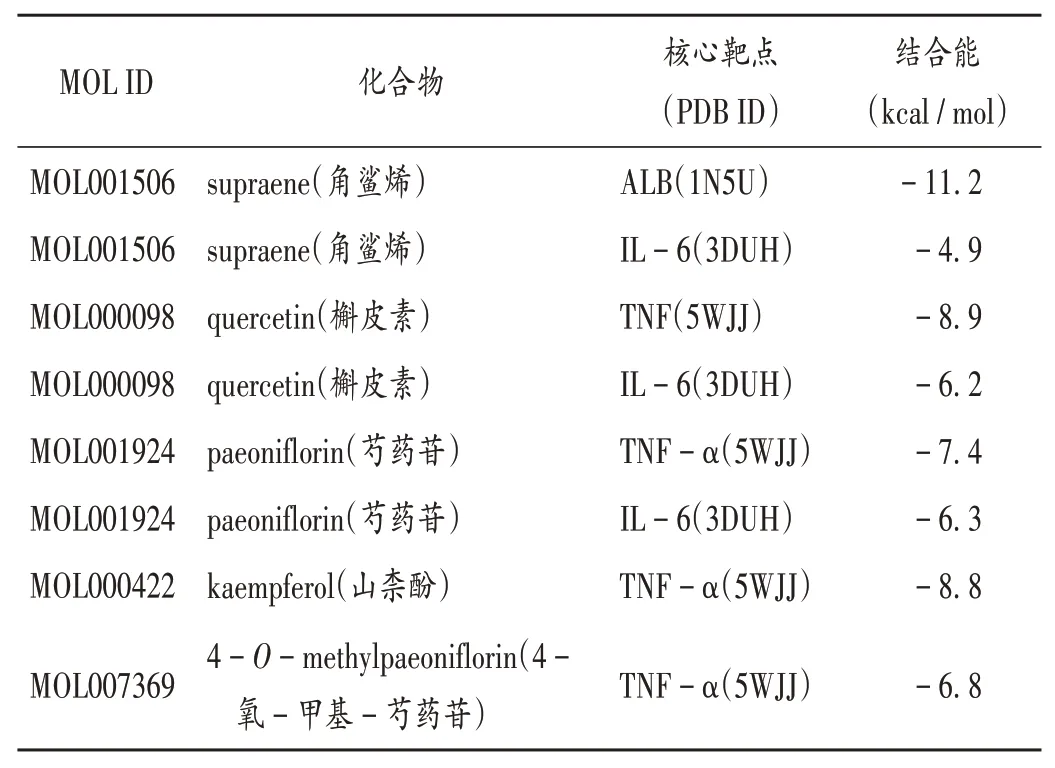
表2 化肝煎活性成分与关键靶点分子对接结果Tab.2 Molecular docking of active components of Huagan Decoction with key targets
3 讨论
慢性胃炎和NAFLD在发生和发展过程中具有关联性,如HP不仅是慢性胃炎的主要诱因,且是NAFLD发展的独立危险因素之一[16]。研究发现,在NAFLD患者和非酒精性脂肪性肝炎(NASH)患者的肝脏样本中存在HP的DNA/RNA[17-18],推测HP可能通过十二指肠和胆道由胃进入肝脏[19],诱导NAFLD发生。化肝煎在2种疾病中均有较好的临床疗效,但其异病同治的作用机制尚未阐明。故本研究中基于网络药理学探讨了化肝煎治疗慢性胃炎和NAFLD可能的作用机制,为化肝煎异病同治的临床应用和基础研究提供了思路。
本研究中对化肝煎方进行网络药理学分析和筛选知其有57个活性成分(OB≥30%且DL≥0.18%),其中同时治疗慢性胃炎和NAFLD的关键成分有23种,药物-活性成分-靶点网络节点度值排名前列的活性成分为槲皮素、山柰酚、川陈皮素、柚皮素、5-羟基-7-甲氧基-2-(3,4,5-三甲氧基苯基)色酮、β-谷甾醇、角鲨烯、豆甾醇、儿茶素。槲皮素、山柰酚、柚皮素均属黄酮类化合物。研究表明,槲皮素具有抗氧化、抗炎、抗疲劳、抗癌、抗微生物等多种生物学功能,可通过调节DNA修复系统、抑癌基因、紧密连接蛋白保持胃黏膜的完整性[20],可通过改善肝脏脂质累积、调节肠道微生物群代谢治疗NAFLD[21]。在慢性胃炎模型小鼠中,槲皮素可通过p38促分裂原活蛋白激酶(MAPK)通路维持胃黏膜上皮细胞增殖和凋亡平衡,阻止HP诱导胃炎的发生[22-23]。在高脂饮食诱导的NAFLD模型大鼠中,槲皮素通过抑制MAPK通路改善肝脏脂质沉积、炎症和纤维化[24],发挥治疗NAFLD作用。山柰酚可通过降低髓过氧物酶活性,下调TNF-α和IL-1β水平,上调一氧化氮水平以维持胃黏膜蛋白的表达,保护胃黏膜免受损伤[25]。在HepG2细胞中,山柰酚可通过抑制脂肪生成蛋白、脂滴蛋白、氧化应激相关蛋白的表达减弱油酸引起的脂质累积和氧化应激,可作为预防和治疗NAFLD的候选药物[26]。柚皮素能调节急性和慢性炎症,可有效控制多种炎症相关疾病(如脓毒症、急性肝病、纤维化和癌症)[27]。BAO等[28]的体外研究发现,柚皮素可通过抑制AKT通路降低基质金属蛋白酶9(MMP9)表达诱导胃癌细胞凋亡,尚未发现其在胃炎中的相关研究。临床试验结果显示,NAFLD患者摄入柚皮素后,血清中甘油三酯、总胆固醇、低密度脂蛋白水平降低,高密度脂蛋白水平升高,表明柚皮素可调节NAFLD患者的血脂[29]。川陈皮素是一种多甲氧基黄酮类化合物,通过减少细胞中活性氧产生、降低脂质过氧化物和谷胱甘肽的含量,抑制HP引起的炎症感染[30],长期低剂量补充川陈皮素可调节肝脏胆固醇合成、脂肪合成、脂肪酸氧化,减轻高脂饮食诱导的NAFLD[31]。β-谷甾醇是一种植物甾醇,在各种胃肠疾病中均有治疗作用[32],以及抗高脂血症和护肝作用,能改善由饮食诱导的NAFLD[33-34]。故化肝煎主要通过槲皮素、山柰酚、柚皮素、川陈皮素等活性成分发挥异病同治作用。
化肝煎与慢性胃炎和NAFLD的交集靶点有36个。PPI网络图中节点度值排名靠前的靶点有TNF,IL-6,ALB,IL-1β,EGFR,TP53,CXCL8等。慢性胃炎在组织学中表现为胃黏膜炎性细胞浸润。在炎症进展过程中,信号级联反应被激活,胃黏膜上皮细胞通过分泌一系列细胞因子和趋化因子(如IL-6和IL-1β)募集中性粒细胞和巨噬细胞,造成炎性浸润。树突状细胞、T淋巴细胞和B淋巴细胞也可造成浸润并分泌TNF-α、IL-12、人单核细胞趋化因子-1(MCP-1)等炎性因子[35]。TNF-α,IL-6,IL-1β均为促炎因子,是炎性反应中的重要免疫介质。TNF-α可促进胃黏膜细胞凋亡,而持续的细胞凋亡可能导致胃溃疡等广泛的胃黏膜损伤[36-37]。在IL-1β转基因模型小鼠中,IL-1β的高表达可导致严重的胃部炎症及癌变[38];在IL-1β缺失模型小鼠中,HP感染导致的中性粒细胞和巨噬细胞募集被显著抑制,炎性细胞浸润减弱[39]。IL-6持续高表达可引起Th17/Treg失衡,进一步导致自身免疫性疾病和慢性炎性疾病的发生和发展[40]。临床研究发现,HP阳性患者的IL-6水平显著高于未感染者,且与慢性胃炎分级相关[41]。TP53是肿瘤抑制蛋白,在检测DNA损伤中起关键作用,HP感染可能导致胃上皮细胞DNA错配修复不足,这可能增加胃黏膜细胞突变积累的风险和慢性胃癌的风险[42]。NAFLD病理谱广泛,范围从单纯性脂肪变性到非酒精性脂肪性肝炎(NASH)、肝细胞坏死和炎症,定义为代谢功能障碍相关性脂肪肝病[7]。TNF-α和IL-6可诱导肝脏脂肪生成和胰岛素抵抗,破坏胰岛素信号传导。在IL-6缺失模型小鼠中,若长期给药会加剧高脂饮食诱导的肝脏脂肪变性[43]。在肝细胞中,IL-1β能促进胆固醇和甘油三酯的累积[44],NAFLD患者血清中IL-1β水平显著升高[45];IL-1β还可增加肝脏中IL-17和TNF-α的表达,加剧肝损伤和肝纤维化[46];而在NAFLD模型小鼠中,IL-1β或IL-1R1缺失能减轻小鼠肝脏炎症和纤维化[47]。TP53在NAFLD的发病机制中也有重要作用,在HepG2和Huh7细胞系中,抑制TP53表达可减少棕榈酸酯诱导的脂质累积[48];在TP53缺失模型小鼠中,高脂饮食导致的肝脏脂质累积减少[49]。化肝煎主要通过靶向调控促炎因子改善胃黏膜的炎症,并通过调节其余靶基因保护胃黏膜免受其他损伤,从而治疗慢性胃炎;通过改善肝脏中脂质累积,减轻肝脏脂肪变性、纤维化、炎症,从而发挥抗NAFLD作用。
GO生物功能富集分析结果显示,化肝煎治疗慢性胃炎和NAFLD过程中参与多种生物过程,涉及的细胞组分、分子功能广泛,说明化肝煎治疗慢性胃炎和NAFLD是多靶点、多通路的过程。KEGG通路富集分析发现化肝煎发挥治疗作用排名前3的关键通路为AGERAGE信号通路、JAK-STAT信号通路、IL-17信号通路。慢性胃炎患者多伴随胃动力障碍症状,AGE可通过AGE/RAGE/核因子-κB(NF-κB)通路下调平滑肌收缩蛋白和心肌素的表达,诱发胃动力障碍[50]。AGERAGE信号通路也参与NAFLD的进展。AGE引起的炎症和氧化应激可致NAFLD从简单的脂肪变性发展为NASH和纤维化[51],而氧化应激和炎症也会诱导AGE的产生[52]。AGE与RAGE结合后激活AGE-RAGE信号通路,进一步诱导氧化应激和炎症[53]。AGE-RAGE信号通路与氧化应激和炎症形成恶性循环。临床研究报道,因AGE和RAGE分泌过多,导致血糖水平升高患者的NAFLD更快进展成纤维化[54]。抑制AGE的产生和阻断AGE与RAGE的相互作用,有望成为治疗慢性胃炎和NAFLD的新手段。JAK-STAT通路介导免疫调节过程,在HP感染导致的胃部炎症和癌变过程中,细菌通过激活STAT1和上调程序性死亡配体1(PD-L1)表达抑制T淋巴细胞亚群CD8+的抗肿瘤免疫反应,促进胃癌进展[55]。豆甾醇、槲皮素可通过抑制JAK-STAT通路发挥抗肿瘤作用[56-57]。JAK-STAT通路在肝病发病机制中有多种关键作用[58],如在非酒精性肝炎模型小鼠中,肝脏中的自然杀伤细胞通过分泌大量的促炎因子如IL-1β,γ干扰素(IFN-γ),IL-12,趋化因子配体4(CCL4),CCL5,粒细胞-巨噬细胞集落刺激因子(GM-CSF)激活肝脏中JAK-STAT 1/3和NF-κB信号传导并诱导肝细胞损伤[59]。山柰酚可通过抗氧化和抗凋亡作用保护肝细胞,对多种肝病发挥治疗作用[60]。Th17细胞分泌的促炎细胞因子在HP感染导致的胃部炎症中起主要作用[61]。临床研究结果显示,患者血清中IL-17水平与慢性胃炎严重程度呈正相关[62]。研究表明,IL-17/IL-21轴、IL-17/IL-23轴参与维持Th17扩增[63-64]。NAFLD的发病机制涉及多种免疫细胞介导的炎性过程及免疫功能失衡[65],IL-17在这种炎性反应中起核心作用。NAFLD模型大鼠的Th17/Treg失衡,Th17细胞比例明显增加导致IL-17大量分泌[66]。IL-17可作用于肝细胞、Kupffer细胞、肝星状细胞,诱导中性粒细胞募集、胶原沉积、促炎因子和趋化因子的产生[67]。IL-17过表达会促使肝细胞摄取脂质,导致肝细胞损伤/死亡和疾病进展[68]。IL-17通过激活Kupffer细胞,分泌大量的IL-6和TNF-α,加剧肝纤维化[69]。芍药苷可通过调节Th17/Treg平衡,改善结肠炎[70]。槲皮素可通过Tim-3和TLR4-MyD88-NF-κB信号通路维持Th17/Treg平衡,抑制雷公藤内酯素诱导的肝损伤[71]。上述研究结果表明,AGE-RAGE,JAK-STAT,IL-17信号通路与慢性胃炎和NAFLD的发生与发展密切相关,化肝煎活性成分有可能通过作用于多条信号通路发挥异病同治作用。
综上所述,基于网络药理学方法和分子对接技术对化肝煎治疗慢性胃炎和NAFLD的活性成分、潜在作用靶点和分子机制进行了初步探讨,阐述了化肝煎通过多成分、多靶点、多通路的协同作用,影响炎症进展、脂质累积、氧化应激而发挥疗效。但基于网络药理学方法预测活性成分和潜在机制也存在局限性,筛选出的活性成分可能与患者血液中实际吸收的成分不一致,且未能区分活性成分对潜在靶点的抑制作用和激活作用。未来研究中需对潜在有效成分进行进一步的实验验证。
