生物活性肽对肠道菌群调节作用研究进展
2022-12-31侯梦凡
侯梦凡,胡 晓
(中国水产科学研究院南海水产研究所 农业农村部水产品加工重点实验室 广州 510300)
生物活性肽是一类对生物体生理健康有特殊益处的肽类化合物,是从蛋白质中分离得到的特定的小的片段[1],通常由2~20 个氨基酸组成,且分子质量大多小于6 ku[2]。按照获取方式的不同,可将其分为外源性和内源性生物活性肽。外源性生物活性肽是从食物蛋白中摄取,经体内酶消化而获得;内源性生物活性肽是由动植物体内所分泌的激素类肽[3]。生物活性肽的活性依据其氨基酸的组成、序列、化学结构不同而有所差异,按照生物活性的不同,可将其分为抗氧化肽、抗菌肽、抗肿瘤肽、降血压肽、降胆固醇肽、神经活性肽、免疫活性肽、肠道调节肽和金属螯合活性肽等[4-5]。目前已鉴别出来的生物活性肽高达数千种。与蛋白质相比,由于生物活性肽分子质量较小,可以被肠道完全吸收,因此它们既可直接在消化道产生局部作用,也可以完整的形式进入循环系统,使其发挥相应的生理作用[6]。此外,生物活性肽一般具有较显著的效力,较高的组织亲和力,并且毒性小,稳定性高[7],在食品医药领域具有广泛的发展前景。
肠道菌群被认为是“第二基因组”,与人类健康密切相关。人体肠道中存在着数以万计的微生物,这些微生物在长期的竞争和进化过程中与宿主相互依存。研究发现,有超过1 000 种的微生物在人体肠道定植,其数量约等于人体的细胞数目[8]。在哺乳动物中,肠道的优势菌群为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),其分别为革兰氏阳性菌和阴性菌的代表,约占肠道总细菌数的90%[9]。越来越多的证据表明,肠道微生物对宿主的健康、营养、疾病发展、代谢特性和免疫稳态等起着关键作用[10]。肠道微生物丰富度、多样性、稳定性以及代谢活动的改变可能会对宿主健康产生一定影响,因而调节或维持肠道菌群的稳态也逐渐成为疾病预防的一个方向。
糖类、肽类、酚类物质、短链脂肪酸、益生菌等活性物质都对肠道菌群有一定的调节作用,而生物活性肽广泛存在于动物体内,是先天免疫系统的重要组成部分,具有广谱抗菌活性和多种免疫调节功能,且稳定性强、水溶性好、安全性高。近年来,生物活性肽对肠道菌群的调节作用越来越受到人们的关注[11]。研究发现,含氮化合物可改变肠道菌群的组成、代谢活动与代谢产物的生成以及肠黏膜基因表达等,与肠道环境有着密切的关系[12]。本文从菌群结构、作用机制、潜在应用方面论述生物活性肽对肠道菌群的调节作用。
1 生物活性肽调节肠道菌群的结构
1.1 内源性生物活性肽
激素肽、神经肽是广泛存在于动植物体内的内源性生物活性肽,在体内主要起着调节代谢、传递信号的功能,对维持生物体正常生命活动有着重要意义。近年来研究发现,部分激素肽、神经肽同时还具有一定的抗菌能力,在调节肠道菌群、维持肠道健康方面可能存在潜在的意义。
1.1.1 激素肽 激素肽是指由内分泌腺或内分泌细胞分泌的,在体内作为信使传递信息,对机体代谢、生长、发育等生命活动具有调节作用的肽类物质。研究发现瘦素、饥饿素、胰高血糖样素肽等对肠道菌群具有一定的调节作用[13]。Queipo-Ortunño等[14]研究发现大鼠血清瘦素水平与双歧杆菌(Bifidobacterium)、乳酸菌(Lactobacillus)数量呈显著正相关,与梭菌(Clostridium)、拟杆菌、普氏杆菌(Prevotella)数量呈负相关;血清饥饿素水平与双歧杆菌、乳杆菌和圆球真杆菌(B.coccoides-Eubacterium)的数量呈负相关,与拟杆菌和普氏菌数量呈正相关,这表明瘦素和饥饿素与肠道菌群具有相关性,可能存在着一定的调控作用。此外,Chorny 等[15]也证明了胃饥饿素对大肠杆菌有较强的杀菌作用,这进一步体现了二者之间的关系。Wu 等[16]发现胰高血糖素样肽2 虽对大鼠肠道菌群的多样性没有显著影响,但可以改变肠道菌群的结构,且对幼年小鼠和老年小鼠的调节作用具有差异性,这说明某些激素肽确实对肠道菌群具有一定的调节作用,但作用效果不强。
1.1.2 神经肽 神经肽是肽类的神经递质,在神经源性炎症中发挥着重要作用。一些具有神经或神经内分泌信号功能的神经肽,由于其在大小、电荷、等电点和氨基酸组成方面与抗菌肽相似,因此神经肽也有直接抗菌作用。神经系统可能以释放具有抗菌作用的神经肽来发挥对口腔或其它神经广泛支配部位的抗菌作用[17]。利拉鲁肽、血管活性肠多肽(Vasoactive intestinal polypeptide,VIP)等都为体内广泛存在的神经肽。利拉鲁肽是一种胰高血糖素样肽1(Glucagon-like peptide-1,GLP-1)受体激动剂,它可以通过增加GLP-1 的活性水平来增加胰岛素分泌、减少胰高血糖素的分泌[18]。Zhao 等[18]发现利拉鲁肽可导致微生物群落丰富度和多样性下降,且对肠道菌群的结构有着明显地调节作用。在门水平上,利拉鲁肽能明显提高大鼠拟杆菌门的含量,降低厚壁菌门的丰度;在纲水平上,利拉鲁肽能逆转高脂饮食导致的大鼠拟杆菌纲(Bacteroidia)含量降低以及梭状芽孢杆菌纲(Clostridia)含量升高,该研究结果与帕力万[19]研究报道相似。VIP 在中枢神经系统以及周围组织中广泛表达,且对革兰氏阳性和革兰氏阴性细菌均具有直接的抗菌活性[20]。El Karim 等[17]通过径向扩散试验发现VIP 对大肠杆菌、变异链球菌(Streptococcus mutans)、粪肠球菌(Enterococcus faecalis)、铜绿假单胞菌(Pseudomonas aeruginosa)、白色念珠菌(Candida albicans),嗜酸乳杆菌(Lactobacillus acidophilus)具有一定的抑制作用。垂体腺苷酸环化酶激活多肽是VIP 家族的一员,经验证它对革兰氏阴性大肠杆菌、铜绿假单胞菌、革兰氏阳性金黄色葡萄球菌(Staphylococcus aureus)也具有一定的抗菌活性[21]。神经肽对肠道菌群的调节作用主要源于其抗菌活性,通过对有害菌群的消杀作用达到消炎、维持机体健康的目的。
1.2 外源性生物活性肽
外源性生物活性肽是指由特定的方式从外界获取,通过摄入体内来发挥抗氧化等生理调节功能的肽类物质。目前已从动植物体内提取了多种生物活性肽,大多数是通过蛋白酶水解获得的,属于混合肽,与激素、神经类信号肽相比,它们在调节代谢等方面发挥了更好的组合效应,部分原因是由于肽组成的多样性以及不同肽之间潜在的协同作用[22]。同样,这些生物活性肽对肠道菌群也存在一定的调节作用。
1.2.1 抗菌肽 国内外对生物活性肽调节肠道菌群的研究主要集中在抗菌肽(Antimicrobial peptides,AMPs),AMPs 是一种小的基因编码阳离子肽,通常为带正电荷的寡肽,对革兰氏阴性和革兰氏阳性细菌、真菌和分枝杆菌具有广谱抗菌活性[23],这可能与其对肠道菌群的调节具有一定的相关性。姚远等[24]发现中、高剂量的天蚕素抗菌肽可显著降低鸡肠道中大肠杆菌数量,中剂量可显著降低沙门氏菌(Salmonella)数量,提高乳酸菌数量。铁鲲源[25]研究发现从鲎血液中提取的鲎素可显著增加产短链脂肪酸菌属-丁香球菌属(Butyricicoccus)和布劳蒂亚菌属(Blautia)的相对丰度,其可能通过提高产短链脂肪酸菌属相对丰度来增强机体机能。于曦[26]研究发现鲎素抗菌肽能提高感染雏鸡肠道微生物的多样性,减缓毛螺菌科(Lachnospiraceae)与梭菌属(Clostridiale)丰度水平的下降趋势以及瘤胃球菌属(Ruminococcus)、粪芽孢菌属(Coprobacillus)与肠杆菌科(Enterobacteriaceae)丰度水平的增加趋势。还有研究发现,从对虾中提取的对虾素类抗菌肽能够显著增加罗非鱼肠道中乳酸菌的的数量,并显著降低大肠杆菌的数量,可对肠道组织具有一定的保护作用[27]。由此可见,抗菌肽可以通过抑制大肠杆菌等有害菌的繁殖,促进肠道中乳酸杆菌、双歧杆菌等有益菌的增长,来调节肠道菌群的结构,从而维持肠道环境的稳态。
1.2.2 抗氧化肽 人体在正常的生理代谢过程中会产生少量的活性氧(Reactive oxygen species,ROS),而活性氧的大量聚集可严重危害细胞结构,引起机体的氧化应激反应,诱发炎症,进而引发多种疾病[28]。众多生物活性肽中抗氧化肽研究的最为广泛,抗氧化肽可以作为电子或氢自由基的贡献者发挥清除自由基的作用,减少疾病损害、缓解疾病症状,并调节肠道菌群的平衡,维持肠道健康。Ni 等[29]从鹿茸中提取的抗氧化肽可减轻由缺氧、缺血(Hypoxic-ischemic,HI)诱导的脑损伤,减少组织炎症和氧化应激反应,这些作用可能与其显著降低HI 组中厚壁菌门、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)的相对丰度,并增加拟杆菌门和变形菌门(Proteobacteria)的相对丰度有关。Han 等[30]从金枪鱼鱼卵中筛选出抗氧化肽LCGEC,其可显著降低拟杆菌门和变形菌门的丰富度,增加厚壁菌门以及厚壁菌门和拟杆菌门的比例,并改变小鼠肠道的优势菌种。除鱼卵外,金枪鱼鱼肉酶解物中存在的抗氧化肽对肠道菌群的调节具有性别差异,可降低雄性小鼠拟杆菌门的相对丰度,增加厚壁菌门的相对丰度,然而,其对雌性小鼠的调节效果却相反[31]。
1.2.3 降尿酸肽 降尿酸肽可通过抑制黄嘌呤氧化酶的活性进而影响嘌呤代谢,缓解高尿酸血症。海洋生物尤其是洄游性鱼类和棘皮动物体内含有的降尿酸肽也可调节肠道菌群。Han 等[22]从金枪鱼肉蛋白酶解物中获取的降尿酸肽可恢复高尿酸血症小鼠肠道菌群的丰富度和多样性,并降低厚壁菌门和变形菌门丰度,增加拟杆菌门和放线菌门的丰度。Wan 等[32]发现日本刺参和白刺海参酶解物具有抗高尿酸的作用,同时可以逆转高尿酸血症小鼠肠道菌群的功能障碍,提高肠道菌群的丰度及多样性,增加有益菌群如乳酸菌和梭菌目等产短链脂肪酸菌群的丰度,减少条件致病菌如卟啉单胞菌科(Porphyromonadacea)和拟杆菌属的丰度。
1.2.4 记忆增强肽 神经递质、神经肽对学习和记忆具有重要的影响,许多食源性生物活性肽可有效改善记忆力,其功效的发挥可能与其对肠道菌群的调节有关,然而,这方面的研究还相对缺乏。王敏[33]从核桃中提取了具有改善学习记忆能力的生物活性肽PPKNW(PW5),其能够调节D-半乳糖诱导的学习记忆损伤小鼠模型肠道菌群的平衡。在门水平上,PW5 肽可增加厚壁菌门相对丰度,降低变形菌门和疣微菌门相对丰度。在属水平上,PW5 肽干预后小鼠肠道菌群中有11 种微生物菌属发生明显变化。此外,口服PW5 肽比腹腔注射具有更好的改善记忆认知障碍的功效,由于肽是否与肠道微生物群接触是口服和注射给药之间的唯一明显区别,因此推测其生物活性是通过影响肠道菌群来发挥的。
1.3 其它生物活性肽
胶原蛋白肽作为胶原蛋白的水解产物,具有促进伤口愈合、改善骨骼健康、缓解皮肤老化等多种有益效果,同时对肠道菌群也有一定的调节作用。刘春雨等[34]发现牦牛骨胶原蛋白肽可促进放线菌门生长,抑制拟杆菌门和疣微菌门的生长。Mei 等[35]对比发现罗非鱼皮胶原蛋白肽可显著改变厚壁菌门、拟杆菌门和变形菌门的丰度,而鲑鱼鱼皮胶原蛋白肽的作用效果不显著,这可能与胶原蛋白肽本身的组成和特性有关。此外,分子质量小于1 ku 的乳清蛋白肽也可调节肠道菌群的变化[36],其可显著提高正常大鼠肠道中拟杆菌、双歧杆菌和乳酸菌的相对丰度,而不能逆转由肥胖大鼠肠道中的厚壁菌门与拟杆菌门的比例下降以及放线菌门和厚壁菌门的相对丰度的变化。
1.4 肽衍生物
肽链上的氨基酸残基可以与糖类、脂质等物质结合形成肽衍生物,或发生某些生化反应生成肽衍生物,这些物质由于具有一些特殊的结构,也会对肠道菌群起到一定的调节作用。
1.4.1 与糖类的结合物 糖肽(Glycopeptides)是指糖蛋白和蛋白聚糖中,糖与氨基酸或肽链以共价键相连而形成的特殊结构[37],酪蛋白糖巨肽(Casein glycomacropeptide,CGMP)是一种含有唾液酸的可溶性亲水多糖肽,对维持肠道健康具有重要作用。适当剂量的CGMP 可以明显促进肠道内乳酸杆菌、双歧杆菌的增殖,抑制肠杆菌、肠球菌(Enterococcus)和致病菌的增殖[38]。明珠等[39]研究发现,乳源CGMP 可促进溃疡性结肠炎小鼠肠道内拟杆菌门细菌的生长,可能有益于布劳蒂亚菌属和链球菌属(Streptococcus)的增殖,逆转溃疡性结肠炎导致的菌群多样性降低以及优势菌群比例下降,调节肠道菌群的平衡。Lü 等[40]发现灵芝中也存在可以调节肠道菌群的糖肽结合物,可以使拟杆菌属、拟普雷沃氏菌属(Alloprevotella)、副拟杆菌属(Parabacteroides)、巴氏杆菌(Barnesiella)、另枝菌属(Alistipes)的比例显著增加,使布劳蒂亚菌属、肠杆菌属(Enterorhabdus)和罗氏菌属(Roseburia)的相对丰度显著降低,显著逆转了高脂肪饮食所引起肠道菌群在组织结构上的变化,对改善脂质代谢紊乱具有重要的意义。
此外,糖类与肽段之间还存在一定的生化反应,美拉德反应产物是还原糖与氨基化合物反应生成的黑色大分子物质,具有一定的抗氧化活性。He 等[41]研究发现1~3 ku 大豆肽美拉德反应产物可显著降低衰老小鼠肠道拟杆菌门和厚壁菌门的丰度比,增加乳杆菌门的丰度,显著降低紫单胞菌科(Porphyromonadaceae)等潜在致病菌的丰度。Zheng 等[42]研究发现乳酸链球菌肽与壳寡糖的糖基化产物对肥胖有明显改善作用,并能促进双歧杆菌和乳酸杆菌增殖,抑制拟杆菌、普氏杆菌、梭状芽孢杆菌和溶组织梭菌(Clostridium histolyticum)增殖。
1.4.2 与脂类的结合物 脂肽(Lipopeptide)是由亲水的肽链和亲油的脂肪烃链两部分组成,具有良好的表面活性,大多数脂肽具有抗微生物作用,可作为抗生素的替代品。Surfactin 是一类环状脂肽化合物,苏保元[43]研究发现Surfactin 本身及发酵物可显著提高肠道总菌数和乳酸菌数,显著降低肠道弧菌数。Prathiviraj 等[44]发现由海洋细菌产生的脂肽MSA31 可提高被致病性副溶血弧菌SF14(Vibrio parahaemolyticus SF14)污染的南美白对虾其抗病性,改善其肠道微生物群,提高黏杆菌属(Adhaeribacter)、嗜酸菌属(Acidothermus)、短芽孢杆菌属(Brevibacillus)、念珠菌属(Candidatus)、分枝杆菌属(Mycobacterium)、棒状杆菌属(Rodopila)和链霉菌属(Streptomyces)的丰度,降低条件致病菌如链球菌属(Streptococcus)、埃希氏杆菌属(Escherichia)、克雷伯氏菌属(Klebsiella)、奈瑟氏球菌属(Neisseria)、根瘤菌属(Rhizobium)和沙门氏菌属的丰度。
此外,生物活性肽还可以与糖类[45-46]、脂类[47]、益生菌[48-49]等物质发挥协同调节肠道菌群的作用。
综上所述,生物活性肽对肥胖等代谢综合征肠道菌群具有明显的调控作用,集中表现在对哺乳动物两种优势菌门相对丰度变化的调节。具体来说,肥胖、衰老个体中厚壁菌门的比例较大,拟杆菌门的丰度相对较低[16,50]。部分生物活性肽可降低厚壁菌门的丰度,提高拟杆菌门的丰度,且降低二者的比值,使其肠道菌群组成与正常个体相似。肠道细菌可以依据对宿主的利害关系分为有益菌与有害菌两类。有益菌主要包括乳杆菌和双歧杆菌,它们在营养和疾病预防中起着重要作用;而有害的肠道细菌,如梭状芽孢杆菌、韦荣球菌(Veillonella)、葡萄球菌(Staphylococcus)、肠球菌和埃希氏菌等,可能会对宿主产生潜在的有害物质[51]。大多数生物活性肽可促进有益菌群的生长,抑制有害菌群的繁殖,从而调节肠道菌群的结构异常,维持肠道健康。
2 生物活性肽调节肠道菌群的作用机制
2.1 破坏有害菌体的结构
肽类物质对肠道菌群的调节主要表现在抗菌作用上,许多抗菌活性肽已作为抗生素的代替品应用于禽畜、水产养殖方面,用于调节肠道菌并维持肠道健康。传统抗生素的抗菌机制是与病原体特定部位的受体结合,以破坏其正常结构或阻碍其生物合成,从而达到抑菌或杀菌的作用。因此当其作用的靶点发生改变时,抗生素就会失去抗菌作用[52]。大多数抗菌肽与常规抗生素的不同之处在于它们主要作用于微生物细胞质膜,决定抗菌肽与微生物膜特定相互作用的基本理化性质是它们的两亲性、静电作用、结构灵活性和氢键能力[53-54]。抗菌肽的阳离子残基主要负责触发与带负电荷的细菌膜表面的初始结合[55],吸附后再发挥其作用。
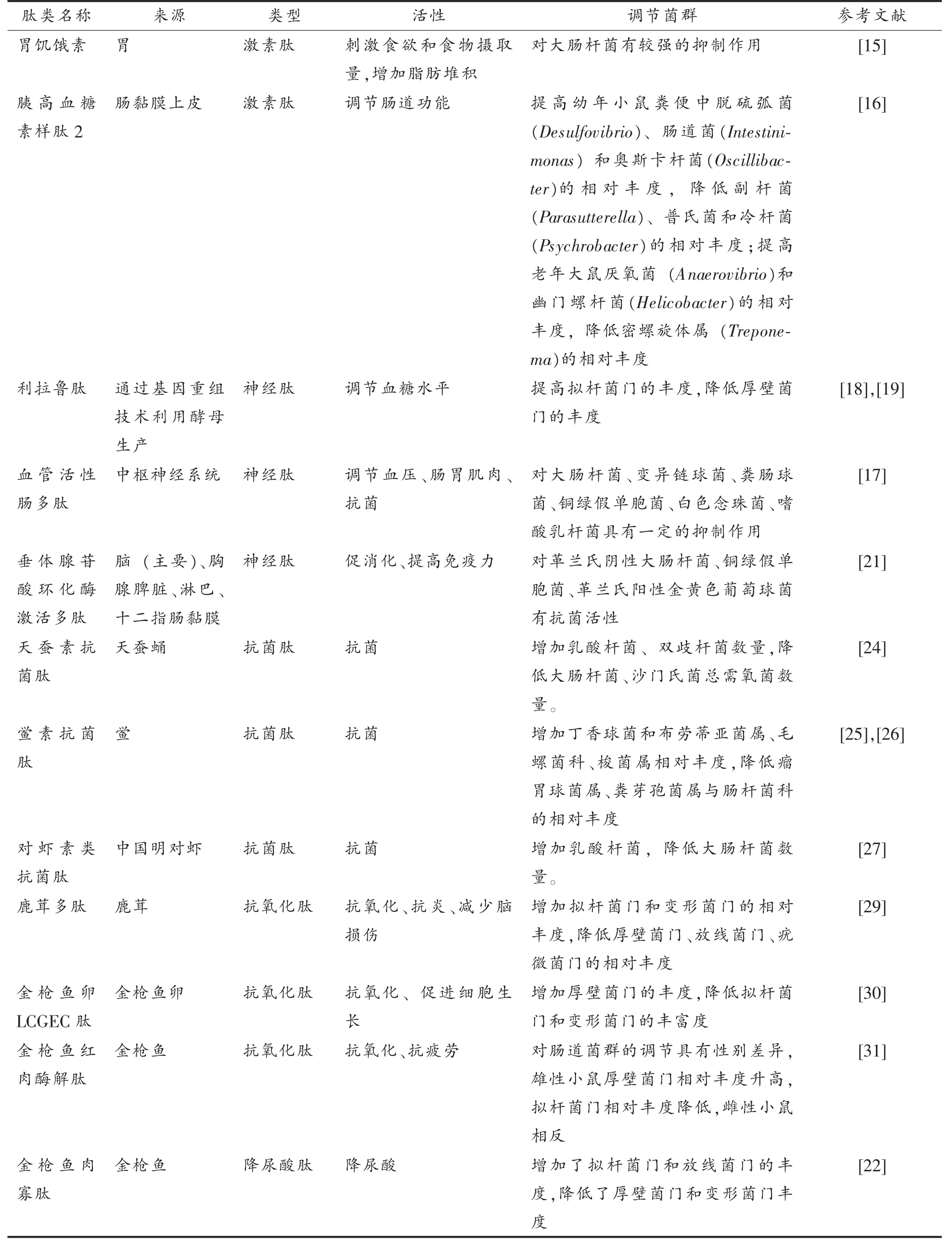
表1 生物活性肽对肠道群的调节作用Table 1 Regulatory effects of bioactive peptides on gut microbiota
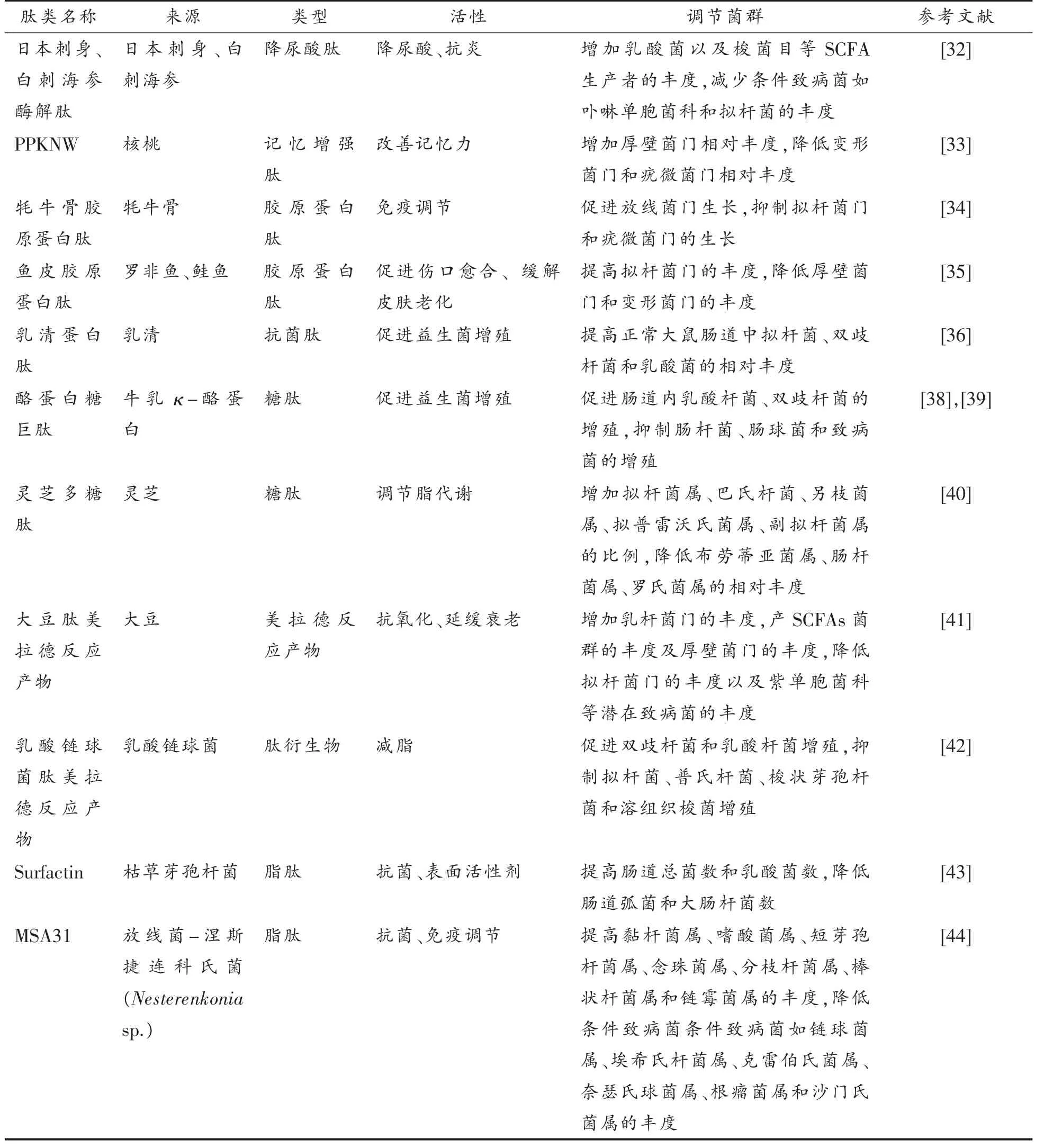
(续表1)
抗菌肽发挥作用的机制主要有细胞膜损伤机制和细胞内损伤机制两种。尽管导致细胞死亡的机制不同,脂质膜始终是抗菌肽与细菌相互作用的第一靶点。细胞膜损伤机制认为,抗菌肽可以通过与膜的疏水相互作用、静电作用,使膜变薄或无序,诱导其形成胶束类似结构,从而使膜结构其受损[56],内容物外泄,并最终导致病原菌死亡。脂肽可通过其中的氨基酸亲水基团和脂肪烃中的亲油基团分别与水相和细胞膜磷脂分子层融合,达到一定浓度时,将产生类似去垢剂的效应,使细胞膜产生裂缝并分离[43]。鲎素抗菌肽通过其与细胞膜的静电吸引和本身的分子势能来破坏菌体的细胞膜电位,导致细菌裂解死亡[26]。抗菌肽与脂质膜具体的作用模式包括“桶壁模型”“环孔模型”“地毯模型”“洗涤剂模型”和“静电聚类模型”。不同的肽可能通过不同的机制起作用,然而这些模型没有并很好地定义[56]。细胞内损伤观点则认为:抗菌肽并不直接作用于细胞膜,而是吸附并穿过细胞膜进入细胞内部,通过抑制DNA 的复制、转录、翻译、干扰蛋白质的合成等方式发挥其抑制作用[57]。此外,还可以通过静电吸引及疏水相互作用与相应的蛋白质结合形成复合物诱其失活、抑制细菌酶活来发挥抑菌作用[58],最终导致病菌死亡[52]。同时,致病菌数量的降低使得益生菌可以通过与其竞争营养物质、生存和繁殖空间,更好地定植,进一步抑制有害微生物生长,从而改善肠道微环境[59]。然而,抗菌肽对有益菌和有害菌的选择性作用机制这个问题并没有得到很好的解决,有研究表明,这可能与肠道菌本身的基因有关。Cullen 等[60]发现并定义了一种存在于拟杆菌中的磷酸酶编码基因LpxF,磷酸酶LpxF 可以去除脂多糖脂质中带负电荷的4′-磷酸基团,通过中和细胞的负电荷增加对炎症相关AMPs 的抵抗力,减少细菌表面与AMP的结合,从而减少AMP 导致的细胞膜破裂,以此来抵抗抗菌肽的破坏作用。其它的作用机制还需要进一步研究。
2.2 清除肠道活性氧以保护肠道菌群
肠道微生物种类的多样性与活性氧的产生存在相关性[61],由于各种代谢反应会使肠道内产生活性氧,而过量的活性氧产生会导致肠道微生物群受损[62]。脂质氧化、蛋白质氧化、DNA 损伤以及线粒体功能障碍是导致ROS 诱导细胞损伤的4个重要原因[63]。许多肽类具有抗氧化活性,可维持肠道中的氧化还原平衡,减少肠道中的活性氧。Zhang 等[64]研究发现,分子质量小于3 ku 的大豆蛋白水解肽可抑制细胞脂质过氧化并防止有害ROS 损伤细胞,并且还能够增强H2O2损伤的人肠Caco-2 细胞部分氧化还原酶的活性。在使用具有抗氧化活性的多肽治疗后,机体的氧化应激反应得到缓解,提高了肠道微生物群的丰富度和多样性[65]。此外,肽在调节肠道菌群丰度的同时也会在一定程度上影响其代谢产物含量,一些肠道菌的代谢产物具有一定的抗氧化活性,如吲哚丙酸、谷胱甘肽[66]、短链脂肪酸[30,67]等,其可以反过来保护肠道菌群免受ROS 的损伤。这种保护机制可能适用于多种肠道微生物群,不仅仅限制于有益菌群。
2.3 作为肠道菌群的底物被利用
小肠是蛋白质和多肽消化的有效器官,其消化率高达89%~95%[12]。某些蛋白质和多肽对肠胃道的消化具有一定的抵抗作用,在小肠中消化不够彻底,能够保持其结构和功能的相对完整性[68],因而可进入远端肠道。梭状芽胞杆菌、拟杆菌、乳杆菌等可以产出不同的蛋白酶,可将蛋白质降解为多肽而后再通过内肽酶降解成寡肽和氨基酸[69]。除多糖外,肠道微生物也可利用肽和氨基酸作为底物进行发酵,生成丙酸盐或丁酸盐,且肽的利用优于氨基酸。然而肠道pH 值和碳水化合物的存在限制了肽和氨基酸发酵,且利用氨基酸发酵细菌的数量较少,占比小于大肠菌群的1%[70]。因此,部分肠道菌群虽可以选择性利用生物活性肽促进其自身的生长繁殖,但作用效果有限。同时,哪些菌群可以利用生物活性肽进行增殖也需要进一步研究。
生物活性肽调节肠道菌群的结构也会相应地影响菌群代谢产物的含量,例如许多生物活性肽会促进双歧杆菌和乳酸杆菌等有益菌的增殖,双歧杆菌和乳酸杆菌在自身的代谢中也会产生乳酸等物质,这会使得肠道的pH 值降低;此外,产生的短链脂肪酸也会影响肠道环境,降低肠道pH值,使之呈现弱酸性,肠道的酸性环境具有较强的抑菌和杀菌作用,能够控制病原菌的生长和繁殖,从而调节肠道微生物群的组成[38]。
3 生物活性肽调节菌群与治疗疾病的相关性
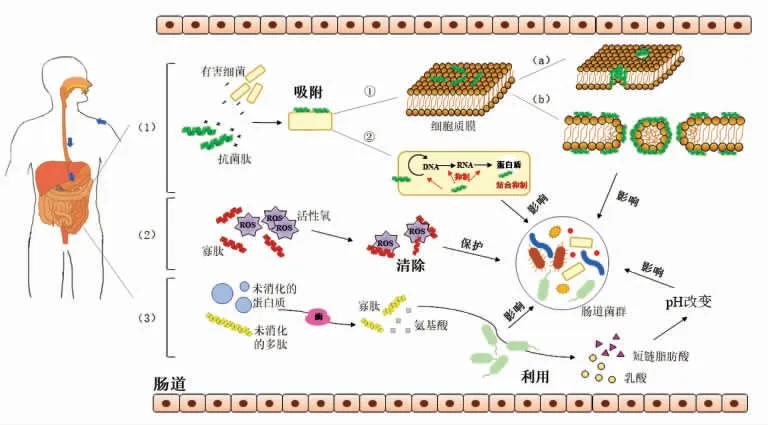
图1 生物活性肽调节肠道菌群的作用机制Fig.1 The mechanism of bioactive peptides regulating gut microbiota
近年来,在新一代高通量测序技术和大数据生物信息学相关发展的推动下,许多研究表明肠道微生物群与多种疾病之间有着密切的联系,甚至是因果关系[71]。越来越多的证据表明,肠道菌群紊乱可能与肥胖和糖尿病等疾病的发病机制有关[72]。研究发现,肥胖患者肠道中厚壁菌门和放线菌门的丰度增加,拟杆菌门的丰度减少,且厚壁菌门与拟杆菌门的比值与肥胖指数之间呈正相关关系,同时还发现拉克罗鳞菌属(Lachnoclostridium)、双歧杆菌属、细小杆菌属(Parvibacter)、鲁米诺洛鳞菌属(Ruminiclostridium)和布劳蒂亚菌属的相对丰度也有所增加[73]。糖尿病患者中厚壁菌门的相对丰度明显降低,而拟杆菌门和变形菌门的比例升高,特征菌群——普氏类杆菌(Bacteroides-Prevotella)、梭状芽孢杆菌和直肠类球菌(C.coccoides-E.rectale)的比例在糖尿病患者中也明显较高[74]。表2 归纳了几种疾病与肠道菌群变化趋势之间的联系,这充分说明了二者之间存在着密切的联系。因此,通过调节肠道菌群来达到治疗疾病的目的已经成为一个新的研究方向,而生物活性肽由于其显著的优越性已被广泛的用于调节肠道菌群的研究。

表2 部分疾病疾病与肠道菌群变化趋势之间的关系Table 2 The relationship between some diseases and trends of gut microbiota
许多研究表明,对疾病有直接治疗作用的可能是肠道菌群的代谢产物而不是其本身。王冉等[80]阐述了肠道菌群的代谢产物与糖尿病、高血脂心血管疾病等多种疾病的相关性和潜在的作用机制,这说明肠道菌群的代谢产物与多种疾病的发病及治疗密切的相关性。短链脂肪酸(Short chain fatty acids,SCFAs)是肠道微生物代谢的主要产物,在人体大肠中的总浓度通常可以达到50~200 mmol/L[81],乙酸、丙酸和丁酸盐是人体肠道内主要的SCFAs,在维持肠道健康[82]、平衡代谢[83]、调节免疫[84]等方面都具有重要作用,许多疾病可以通过摄入SCFAs 从而得到缓解。
生物活性肽调节肠道菌群代谢产物的主要观点是生物活性肽通过促进部分肠道菌的增殖,从而增加其代谢产物的量。例如,与对照组相比,经LCGEC 处理后,产SCFAs 的菌群的丰度增加,且SCFAs(乙酸、丙酸、丁酸和戊酸)的含量也相应增加,其中丁酸含量升高最为显著[30],其它方面的调节机制尚不明确。由此可见,肠道微生物群及其代谢产物在调节肠道健康和治疗疾病方面发挥着尤为重要的作用,因此,通过生物活性肽调控肠道菌群进而调节SCFAs 等代谢产物被认为是代谢综合征等疾病治疗的一个潜在靶点。
4 总结
生物活性肽对肠道菌群的调节作用是近年来的研究热点,在食品及医药领域具有广阔的应用前景。目前,国内外对于生物活性肽调节肠道菌群的作用主要集中于水产动物及禽畜养殖上,一方面可减少抗生素用量,用于抗菌或预防治疗某些动物疾病,增强其免疫能力,维护肠道健康;另一方面能够促进动物的生长、增加其产蛋、产奶能力,提高肉类的品质。然而,生物活性肽调节肠道菌群在功能性食品及医药领域的应用报道较少,缺乏进一步研究。
肠道菌群的变化与许多疾病息息相关,许多研究已证明生物活性肽可以调节肥胖、糖尿病等代谢疾病的特征菌群,经皮尔森相关性分析,发现肠道菌群与血清生化指标存在一定的关联性,这说明生物活性肽可能通过调节肠道菌群进而调节其代谢产物,从而达到治疗或缓解某些疾病的目的。然而,在目前的研究中,生物活性肽调节肠道菌群丰富度和多样性的具体机理还没有得到完整具体的阐述,对有益菌和有害菌的特异性选择机制仍需进一步研究,肠道菌群的改变是否能真的达到预防疾病的目的也有待考究。目前,部分研究已经采用无菌鼠进行粪便微生物移植来考究二者之间的关系,并取得了初步成效[22,85],这说明通过调节肠道菌群来治疗疾病是可行的,二者确实存在一定的因果关系,未来的研究仍需要采用菌群定植进行验证和探究,并寻求其潜在的作用机制。
