群体感应抑制剂对发酵乳杆菌生物膜生成的影响
2022-12-31郑砚学聂丽丽乔瑞芳贺银凤
郑砚学,张 悦,王 艳,聂丽丽,乔瑞芳,贺银凤
(内蒙古农业大学食品科学与工程学院 呼和浩特 010018)
乳酸菌是一类可发酵糖产生乳酸的革兰氏阳性菌,其作为公认的食品级益生菌,对人体有多种益生功能,在营养健康和食品保藏与发酵方面具有广泛的应用价值[1]。乳酸菌在一定的环境中通常以生物膜形式生存,生物膜是指细菌附着在一些物体表面后分泌胞外黏性聚合物,并在其中生长繁殖,最终形成的菌落聚集体[2-3]。有研究报道生物膜状态下的乳酸菌比浮游态的乳酸菌存活能力更强,具有更强大的耐环境胁迫能力和免疫调节能力[4-5]。加强对乳酸菌生物膜研究对阐明益生菌益生机理以及未来研究益生菌制剂具有重要意义。
现有研究表明,群体感应(Quorum sensing,QS)在细菌生物膜形成的过程中起重要作用,QS系统是指细菌通过向周围环境释放一种特殊的化学信号分子来感知环境变化,从而调控相关基因的表达,以激活特定的行为并进行信息交流[6]。在自然界中,大多数细菌都以生物膜形式生存,QS系统也普遍存在于不同细菌中,乳酸菌也不例外[7]。LuxS/AI-2 型QS 系统在乳酸菌种间信号交流中发挥着重要作用,在LuxS/AI-2 型QS 系统中,由luxS 基因介导的信号分子AI-2 在革兰氏阳性和阴性细菌中广泛存在,信号分子AI-2 也是乳酸菌形成生物膜的重要因素[8]。
群体感应抑制剂(Quorum sensing inhibitors,QSIs)是指通过抑制细菌群体感应中一些特定基因的表达来阻止细胞的通讯交流,而对细菌生长影响小的物质[9]。目前QSIs 可通过抑制信号分子合成、传递和接受等途径来抑制细菌的QS[10]。AI-2 系统是细菌最普遍存在的一种QS 系统,一般可通过抑制AI-2 合成过程中酶的活性,干扰信号分子AI-2 的接受或转导来抑制AI-2 系统[11]。现有研究表明,乳酸菌利用LuxS/AI-2 型QS 系统与周围环境中的其它细菌进行交流,利用AI-2 信号分子反馈的信号来调控相关基因的表达,如生物膜的形成[12]。目前对于AI-2 介导的QS 与生物膜的研究多集中于致病菌,对乳酸菌的QS 和生物膜研究还较少,在实际生产加工和进入肠道后,乳酸菌大多以生物膜形式存在[13-14],因此有必要加强对乳酸菌QS 系统对生物膜调控的研究。
乳酸菌作为人体肠道内的有益微生物,通常以生物膜形态来提高其对外界不良环境的抗性。现有研究表明,群体感应可以调控乳酸菌生物膜的形成,然而,AI-2 作为群体感应的信号分子是否参与乳酸菌生物膜形成的过程还有待研究。本试验以课题组前期筛选出的2 株高产信号分子AI-2 的发酵乳杆菌为研究对象,选择D-半乳糖、D-核糖和呋喃酮作为QSIs,通过添加不同种类以及不同浓度的QSIs,测定其对菌株AI-2 活性、生长量和生物膜形成量的影响。选择抑制信号分子AI-2 活性最好的抑制剂及最适浓度,测定其对菌体形态和生物膜形态的影响,探究乳酸菌生物膜的形成与信号分子AI-2 活性之间的关系,为进一步研究乳酸菌群体感应系统对生物膜的调控作用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种 试验菌株2-1 和211 均为发酵乳杆菌(Lactobacillus fermentum),分别分离自锡盟地区酸马奶和西藏地区牦牛乳制品中,现保存于内蒙古农业大学食品生物技术团队。
哈维氏弧菌(Vibrio harveyii)BB170,购买自美国菌种保藏中心(American Type Culture Collection,ATCC)。
1.1.2 培养基 试验所用到的AB 培养基参考燕彩铃[15]的方法配制。MRS 肉汤培养基,购自广东环凯微生物科技有限公司;D-半乳糖、D-核糖、呋喃酮,购自Aladdin 公司;结晶紫、氯化 钠、MgSO4·7H2O、乙酸,购自国药集团化学试剂有限公司;甲醇,购自天津永晟精细化工有限公司;酸水解酪蛋白,购自Coolaber 公司;无水乙醇,购自天津福晨化学试剂有限公司;叔丁醇,购自麦克林公司;试验中使用的水均为去离子水。
1.1.3 仪器与设备 HF-SAFE 1500 型生物安全柜、SMART-N 纯水机,力康生物医疗科技控股有限公司;SX-500 型全自动高压灭菌锅,日本TOMY 公司;PB 10 型酸度计,德国Sartorius 公司;5810R 型高速低温离心机,德国Eppendorf 公司;BioTek Epoch 全波长酶标仪,美国BioTek 公司;TM4000 形桌上显微镜,日本株式会社日立高新技术那珂事业所。
1.2 方法
1.2.1 供试菌液的制备 将2 株发酵乳杆菌以体积分数2.0%接种量接种于MRS 培养基中活化培养二代后,8 000 r/min 离心5 min,弃上清液后加入0.85%的生理盐水,吹打混匀后离心3 次以洗涤菌体,洗涤后加入0.85%的生理盐水调节菌液的吸光度OD595nm值在1.0 左右。此时细菌的细胞浓度为1×107CFU/mL,由此制得试验菌株的供试菌液[16]。
1.2.2 无细胞发酵上清液的制备 将试验菌株待测培养液于8 000 r/min 离心5 min(4 ℃),使用0.22 μm 水系滤膜对上清液过滤除菌,即得到试验菌株的无细胞发酵上清液(Cell-free fermentation supernatant,CFS)。将哈维氏弧菌BB170 培养3代至OD595nm为1.0 左右后,8 000 r/min 离心5 min(4 ℃),使用0.22 μm 水系滤膜对上清液过滤除菌,即得到阳性对照。AB 培养基过滤除菌即阴性对照,MRS 培养基过滤除菌即介质对照。无菌CFS或对照样品于-80°C 保存[17]。
1.2.3 信号分子AI-2 活性的测定 将哈维氏弧菌BB170 以2.0%接种量接种到AB 培养基中,30 ℃振荡培养3 代至OD595nm为1.0 左右后,按1∶5 000(体积比)将菌液和AB 培养基混合稀释,稀释后哈维氏弧菌BB170 菌液约为105CFU/mL。将试验菌株的CFS、阳性、阴性、介质对照与稀释后的哈维氏弧菌BB170 菌液以1∶100(体积比)混合后,30 ℃振荡培养。在0~6 h 内,每隔30 min 在化学发光模式下测定其荧光强度值。当阴性对照荧光强度值达到最低点时,测定待测样品的荧光强度,计算样品相对荧光强度用以代表菌株信号分子AI-2 的活性[18]。
1.2.4 QSIs 的筛选 在灭菌后的MRS 液体培养基中添加用0.22 μm 水系滤膜过滤的QSIs,使QSIs 终浓度分别为50,100,150,200,500,1 000,2 000,10 000,20 000 μmol/L,对照组为不添加QSIs(0 μmol/L)。将活化好的试验菌株接入已添加QSIs 的MRS 液体培养基中,静置培养到待测时间后用全波长多功能酶标仪检测菌体密度(OD595nm),同时8 000 r/min 离心5 min(4 ℃),收集上清液,对各上清液进行AI-2 活性检测。计算不同种类以及不同浓度的QSIs 对乳酸菌信号分子AI-2 的抑制率,计算公式如下:

根据对信号分子AI-2 活性的抑制率得出最佳QSIs 以及最佳浓度。
1.2.5 QSIs 对菌株生物膜形成量的影响 将活化好的试验菌株以体积分数2%的接种量接入到添加了不同浓度QSIs 的MRS 液体培养基中,96 孔酶标板中每孔加入200 μL 后37 ℃静置培养,培养到到待测时间后,用结晶紫染色法测定生物膜形成量(OD595nm)[19]。
1.2.6 QSIs 对乳酸菌菌体形态和生物膜形态的影响 将活化二代的试验菌株接入已添加不同浓度QSIs 的MRS 液体培养基中,制备浮游和被膜态菌株[20],培养到待测时间后,浮游态菌株8 000 r/min离心5 min,弃上清留菌泥,被膜态菌株弃培养液,分别使用终体积分数2.5%的戊二醛固定,置于4℃过夜后使用乙醇梯度脱水,使用叔丁醇梯度脱乙醇后干燥,使用扫描电镜观察菌体形态结构和生物膜结构。
1.3 数据分析
利用SPSS 23.0 和Origin 2018 进行数据分析及作图,测定结果以平均值±标准偏差表示。
2 结果与分析
2.1 发酵乳杆菌信号分子分泌规律以及生物膜形成规律的探究
2 株发酵乳杆菌在37 ℃下培养25 h,从4 h开始,每隔3 h 取样测定菌体生长量、生物膜形成量以及信号分子AI-2 的活性。
图1 为2 株发酵乳杆菌在不同培养时间下信号分子AI-2 的活性。由图可知,与阳性相对荧光强度相比,从7 h 开始,2 株发酵乳杆菌的信号分子活性均高于阳性相对荧光强度,说明2 株发酵乳杆菌具备分泌信号分子AI-2 的能力,同时发酵乳杆菌2-1 7 h 的AI-2 活性远高于其它时间的AI-2 活性,发酵乳杆菌211 13 h 的AI-2 活性高于其它时间的AI-2 活性,所以选择培养7 h 的发酵乳杆菌2-1 和培养13 h 的发酵乳杆菌211 用于后续筛选QSIs 及其对乳酸菌生物膜形成的影响。
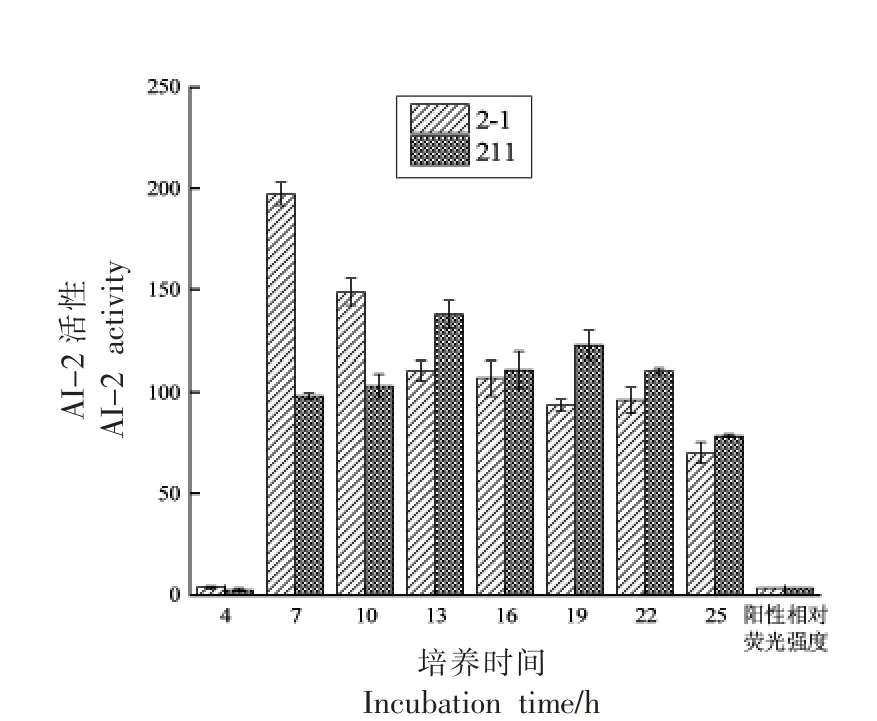
图1 发酵乳杆菌信号分子AI-2 的活性Fig.1 The active secretion of signal molecule AI-2 of L.fermentum
图2 为2 株发酵乳杆菌生长量与生物膜形成的关系图。由图可知,4~10 h 为2 株发酵乳杆菌生长的对数期,10 h 以后菌体生长达到稳定;2 株发酵乳杆菌在4~13 h 的生物膜形成量呈递增趋势,在13 h 生物膜形成量达到最大。发酵乳杆菌2-1的生物膜在13 h 后呈先下降再上升类似波浪的趋势,发酵乳杆菌211 生物膜的生成是一个先增长后降低再增长的过程。

图2 发酵乳杆菌生物膜的形成Fig.2 The biofilm formation of L.fermentum
2.2 QSIs 对发酵乳杆菌产信号分子AI-2 的影响
2.2.1 D-半乳糖对发酵乳杆菌产信号分子AI-2的影响 有研究报道,D-半乳糖的结合蛋白与信号分子AI-2 受体具有一定的结构相似性,D-半乳糖可能会与信号分子AI-2 竞争AI-2 受体,影响AI-2 与AI-2 受体的结合率,从而降低AI-2 发挥的作用[21-23]。
在MRS 培养基中添加不同浓度的D-半乳糖来评价其对2 株发酵乳杆菌生长量以及AI-2 活性的影响,对照组为不添加D-半乳糖(0 μmol/L)。如图3 所示,添加不同浓度的D-半乳糖对2 株发酵乳杆菌的生长量均无显著影响,说明D-半乳糖对菌株的生长不起能量来源的作用。
由图3a 可知,添加不同浓度的D-半乳糖对发酵乳杆菌2-1 的AI-2 活性有一定程度的抑制,终浓度为100 μmol/L 的D-半乳糖对AI-2 活性抑制效果最好,抑制率为14.68%。在100~2 000 μmol/L 范围内,随着D-半乳糖终浓度的增加,其对AI-2 活性的抑制作用降低,可能是当D-半乳糖结合蛋白和AI-2 受体浓度一定,而D-半乳糖浓度较高时,其更容易与D-半乳糖结合蛋白结合从而降低了其与信号分子AI-2 的竞争作用。
如图3b 所示,与对照组相比,随着D-半乳糖浓度的增加,其对发酵乳杆菌211 AI-2 活性的抑制作用增加,终浓度为200 μmol/L 的D-半乳糖对发酵乳杆菌211 的AI-2 活性影响最大,其抑制率为20.33%。随着D-半乳糖浓度的增加,对AI-2活性的抑制作用降低,甚至有一定的促进作用。
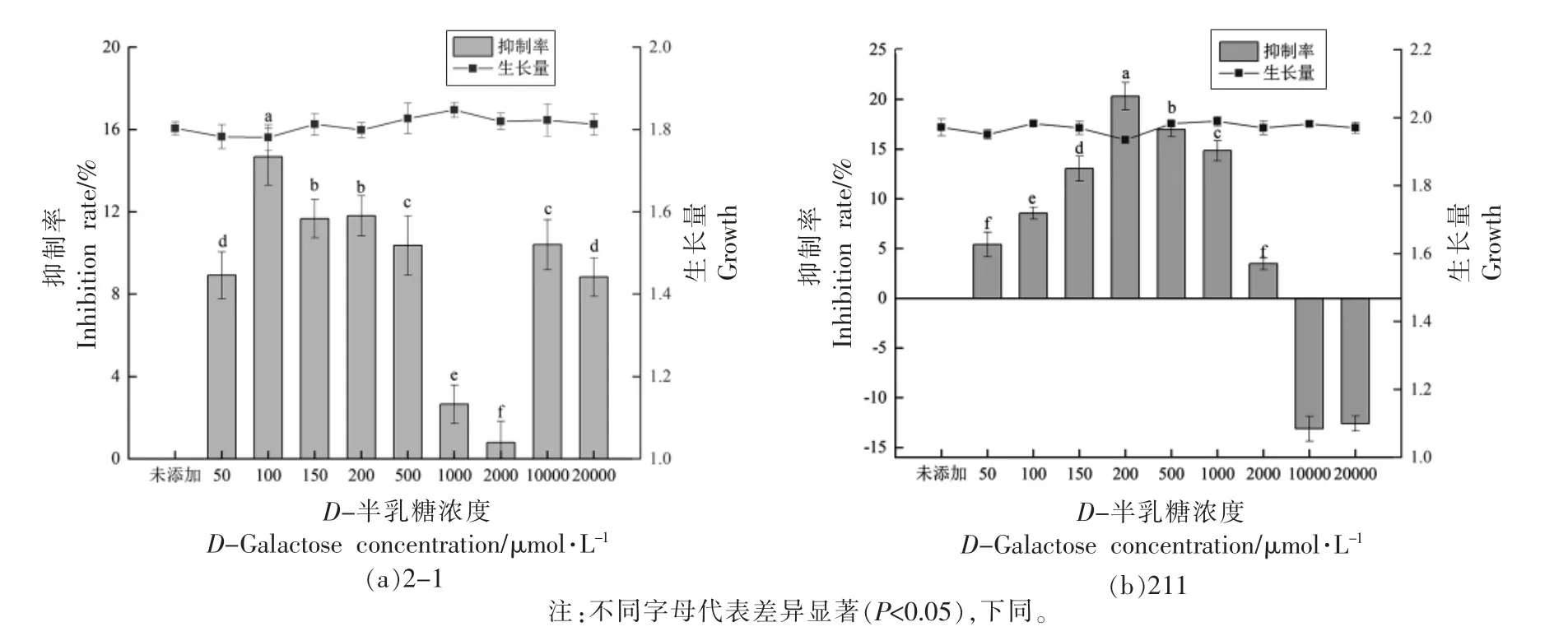
图3 D-半乳糖对发酵乳杆菌信号分子AI-2 活性的影响Fig.3 The effect of D-galactose on the activity of signal molecule AI-2 by L.fermentum
2.2.2 D-核糖对发酵乳杆菌产信号分子AI-2 的影响 有研究显示,D-核糖不会产生毒性作用且与AI-2 有一定的结构相似性,因此,D-核糖和AI-2 可以同时竞争AI-2 受体来降低AI-2 的作用[24]。目前,D-核糖可被用作QSIs 来抑制致病菌的生物膜形成。
本试验测定了在MRS 培养基中添加不同浓度的D-核糖对2 株发酵乳杆菌生长量及AI-2 活性的影响,对照组为不添加D-核糖(0 μmol/L)。如图4 所示,添加不同浓度的D-核糖不影响2 株发酵乳杆菌的生长。
由图4a 可知,200 μmol/L 的D-核糖对发酵乳杆菌2-1 AI-2 活性的抑制效果最好,抑制率为19.65%,而后随着D-核糖的浓度增加,其对AI-2活性的抑制作用降低且呈现出负作用,可能是D-核糖作为与AI-2 的结构相似物,一定浓度下可以与AI-2 共同竞争AI-2 受体从而起抑制作用。
如图4b 所示,与对照组相比,添加50 μmol/L的D-核糖对发酵乳杆菌211 的AI-2 的活性抑制效果最好,抑制率为28.57%,而后随着D-核糖浓度的增加,其对AI-2 的抑制效果整体呈降低趋势。

图4 D-核糖对发酵乳杆菌信号分子AI-2 活性的影响Fig.4 The effect of D-ribose on the signal molecule AI-2 produced by L.fermentum
2.2.3 呋喃酮对发酵乳杆菌产信号分子AI-2 的影响 有研究报道,呋喃酮类化合物与信号分子AI-2 结构有一定的相似性,作为AI-2 信号分子的同系物,其在控制致病菌感染和生物膜的形成方面具有良好的应用价值[25]。在MRS 培养基中添加不同浓度的呋喃酮来评价其对2 株发酵乳杆菌生长量及AI-2 活性的影响,对照组为不添加呋喃酮(0 μmol/L)。如图5 所示,添加一定浓度的呋喃酮对2 株发酵乳杆菌的生长量影响不明显。

图5 呋喃酮对发酵乳杆菌信号分子AI-2 活性的影响Fig.5 The effect of furanone on the signal molecule AI-2 produced by L.fermentum
与对照组相比,随着呋喃酮浓度的增加,其对发酵乳杆菌2-1 AI-2 活性的抑制作用逐渐增加,200 μmol/L 的呋喃酮与其它浓度相比抑制效果最好,抑制率为13.27%,后随着呋喃酮浓度的增加,AI-2 活性增强,可能是呋喃酮类化合物作为AI-2信号分子的结构相似物,在一定浓度下可以抑制AI-2 的活性,当超过抑制浓度的阈值时,呋喃酮类化合物则会对增强菌株产AI-2 的能力。
与对照组相比,50 μmol/L 的呋喃酮对发酵乳杆菌211 AI-2 活性的抑制最明显,抑制率为13.51%,而后随着添加呋喃酮浓度的增高,其对AI-2 活性的抑制作用不明显,甚至存在促进作用。
呋喃酮类化合物可与AI-2 竞争结合AI-2 受体蛋白从而抑制其QS[26],而在本试验中呋喃酮对2 株发酵乳杆菌的AI-2 活性抑制效果并不明显,可能是因为不同的菌株AI-2 受体的结构不同,所以对其QS 的抑制作用也不相同。吴雅茜等[27]研究了4-羟基-2,5-二甲基-3(2H)呋喃酮(DMHF)对单增李斯特菌(Listeria monocytogenes,L.monocytogenes)的生长与信号分子AI-2 活性的影响,结果表明DMHF 能延迟单增李斯特菌的生长,且能明显抑制单增李斯特菌AI-2 的活性,由此可认为DMHF 是AI-2 类QS 的抑制剂。
2.3 QSIs 对发酵乳杆菌生物膜形成量的影响
2.3.1 D-半乳糖对发酵乳杆菌生物膜形成量的影响 本试验测定了添加不同浓度的D-半乳糖对2株发酵乳杆菌生物膜形成量的影响。由图6 可知,与对照组(0 μmol/L)相比,添加不同浓度的D-半乳糖对2 株发酵乳杆菌生物膜形成量有不同程度的影响,其中添加50 μmol/L 的D-半乳糖对发酵乳杆菌2-1 的生物膜形成量抑制作用明显,添加2 000 μmol/L 的D-半乳糖对发酵乳杆菌211 的生物膜形成量的抑制作用最强,这与Ryu 等[28]研究的D-半乳糖对牙周致病菌生物膜的抑制作用结果相似,即一定浓度下的D-半乳糖可以抑制牙周致病菌的生物膜形成且不影响细菌生长,说明D-半乳糖可能与AI-2 竞争AI-2 受体,通过降低AI-2 活性来预防细菌生物膜的形成。

图6 D-半乳糖对发酵乳杆菌生物膜形成量的影响Fig.6 The effect of D-galactose on the formation of L.fermentum biofilm
2.3.2 D-核糖对发酵乳杆菌生物膜形成量的影响 本试验测定了添加不同浓度的D-核糖对2株发酵乳杆菌生物膜形成量的影响。由图7 可知,与对照组(0 μmol/L)相比,添加不同浓度的D-核糖对发酵乳杆菌2-1 的生物膜形成量都有一定的抑制作用,而对发酵乳杆菌211 的生物膜形成量抑制效果不明显。Liu 等[29]研究了D-核糖对类植物乳杆菌L-ZS9 AI-2 活性的抑制作用,与外源添加AI-2 相比,一定浓度的D-核糖虽可以抑制LZS9 的AI-2 活性和生物膜形成,但外源AI-2 和D-核糖对类植物乳杆菌L-ZS9 的生长没有影响,这与本试验研究结果相似。

图7 D-核糖对发酵乳杆菌生物膜形成量的影响Fig.7 The effect of D-ribose on the formation of L.fermentum biofilm
2.3.3 不同浓度的呋喃酮对发酵乳杆菌生物膜形成量的影响 本试验测定了添加不同浓度的呋喃酮对2 株发酵乳杆菌生物膜形成量的影响。如图8 所示,与对照组(0 μmol/L)相比,不同浓度的呋喃酮对发酵乳杆菌2-1 的生物膜形成量有显著的抑制作用,而发酵乳杆菌211 生物膜形成量的抑制作用并不明显。杨维等[30]研究了3,4-二溴-2(5H)-呋喃酮对单增李斯特菌生物膜形成的影响,发现呋喃酮对单增李斯特菌生物膜的形成有一定的抑制作用,随着呋喃酮浓度的增加,其对生物膜形成量的抑制效果更明显。

图8 呋喃酮对发酵乳杆菌生物膜形成量的影响Fig.8 The effect of furanone on the formation of L.fermentum biofilm
2.4 QSIs 对发酵乳杆菌菌体形态和生物膜形态的影响
根据前期试验最终选择200 μmol/L 和50 μmol/L 的D-核糖分别作为发酵乳杆菌2-1 和发酵乳杆菌211 的QSIs,并对添加了D-核糖的2 株发酵乳杆菌使用扫描电镜观察菌体形态结构,结果如图所示。
图9 为发酵乳杆菌2-1 培养24 h 细菌的生物膜状态下的菌体形态。由图9a 可以看出,未添加D-核糖的菌株整体形态完好,细胞表面平整光滑,多成聚集状态,说明生物膜状态下细菌的黏附性更高。由图9b 可以看出,添加200 μmol/L D-核糖的细菌整体形态以及表面光滑度虽未发生改变,但细菌聚集度下降,游离细菌增多,说明一定浓度的D-核糖可以降低菌体的黏附性。

图9 D-核糖对发酵乳杆菌2-1 菌体形态的影响Fig.9 The effect of D-ribose on the morphology of L.fermentum 2-1
图10 为发酵乳杆菌211 培养24 h 细菌的生物膜状态下的菌体形态。由图10a 可以看出,未添加D-核糖的菌整体形态完好,细胞整体聚集度较高,说明生物膜状态下细菌之间的黏附性更强。由图10b 可以看出,添加50 μmol/L D-核糖的细菌整体形态虽未发生改变,但游离细菌居多,细菌整体聚集能力下降,说明一定浓度的D-核糖可以降低菌株之间的黏附性,这与发酵乳杆菌2-1 结果相似。

图10 D-核糖对发酵乳杆菌211 菌体形态的影响Fig.10 The effect of D-ribose on the morphology L.fermentum 211
3 结论
3 种QSIs 虽对2 株发酵乳杆菌的信号分子AI-2 活性都有一定的抑制作用,但不同种类以及不同浓度的QSIs 对AI-2 活性的影响效果不同;不同种类以及不同浓度的QSIs 对菌株生长量的影响效果虽不显著,但在一定程度上都能抑制2株发酵乳杆菌生物膜的形成。最终根据3 种QSIs对2 株发酵乳杆菌AI-2 活性以及生物膜形成量筛选出200 μmol/L 的D-核糖作为发酵乳杆菌2-1 的QSIs;选择50 μmol/L 的D-核糖作为发酵乳杆菌211 的QSIs。对添加了D-核糖的2 株发酵乳杆菌使用扫描电镜观察菌体形态结构,结果发现D-核糖对2 株发酵乳杆菌的生物膜状态下的菌体形态虽无明显影响,但降低了被膜态菌株的黏附性,为后续研究乳酸菌群体感应系统与生物膜之间的关系提供了依据。
