脂肪间充质干细胞聚合物-细胞外基质复合物补片修复兔外耳道全层皮肤损伤的实验研究
2022-12-30马洪峰任庆郑末程万民廉梅
马洪峰,任庆,郑末,程万民,廉梅
天津市第五中心医院(北京大学滨海医院)1.耳鼻咽喉科,2.病理科,天津 300450
耳道皮肤缺损常发生于颞骨及其软骨组织的外科手术后,创面上皮自我修复缓慢,致使患耳溢液难以清除,需定期清理痂皮[1]。由于耳道结构以及耳腔的空间有限,加上饮食等因素影响,耳道皮肤缺损可能给患者带来不容忽视的听力障碍,影响患者的术后生活质量[2]。因此,国内外学者致力于寻找适合外耳道皮肤重建、乳突腔修复的生物学材料,不断加深对术腔上皮化机制的认知[3]。组织工程技术的日新月异推动支持颞骨上皮皮肤结构与功能恢复的生物材料的发展。来源广泛、具有较强分化和增殖潜能的脂肪间充质干细胞(adipose-derived stem cells,ADSCs)成为组织工程学、再生医学学科中最具前景的种子细胞之一。研究表明ADSCs 分泌的蛋白因子直接促进创面组织的再生和愈合;ADSCs 在异体组织移植中可降低异体宿主的免疫排斥反应,缩短治疗时间[4~6]。细胞外基质(extracellular matrix,ECM)支架因其具有稳定的机械张力,便于手术操作,降解过程的可控性,以及无毒性和免疫原性等优点[7],成为组织工程支架中广泛应用的材料。研究显示ECM 支架能够促进细胞分化、增殖,促进血管新生及创面愈合[8]。已经证实ECM 支架能模拟体内微环境,抑制细菌滋生,调节、引导宿主细胞长入,推动创面组织重构,缩短组织再生及皮肤缺损修复的时间[9]。本文探讨脂肪间充质干细胞聚合物(adipose-derived stem cell aggregates,ADSC aggregates)-细胞外基质(extracellular matrix,ECM)复合物补片(ADSC aggregates-ECM)在外耳道全层皮肤损伤修复中的应用,期为临床治疗提供新的角度。
1 材料和方法
1.1 材料
1.1.1 实验动物 4~5 月龄SPF 级健康雄性新西兰大白兔30 只,体重2.25~2.35 kg,来源于天津裕达实验动物繁育有限公司[SCXK(津)2016-0001],饲养于天津国际生物医药联合研究院[SYXK(津)2017-0003],标准颗粒饲料、自由饮水适应性喂养1 周后用于实验。实验经本院实验动物管理伦理委员会批准(IACUC-2020-028),操作均参照本院动物管理委员会有关规定进行,在3R 原则的指导下给与动物人道的关怀。
1.1.2 主要试剂与仪器 ADSC aggregates-ECM(批号TJ-ARN004)、ECM 支架(批号TJ-TBF057)由天津再生医学与疾病生物治疗研究中心设计完成;免疫组化试剂盒(批号GTY-2018-UY763,美国Gibco 公司);兔抗大鼠GAPDH(批号VCS-2019-FA095,美国abcam 公司);HE 试剂盒(批号RX-2019-EV7D08,美国Sigma公司);Western blot 试剂盒(批号JS-2020-MR97,南京建成生物有限公司)。凝胶成像仪(UV-D6.0,岛津公司,日本);组织切片机(PVT-6.8,SHELLAB 公司,美国);荧光显微镜(LIOOS600T,尼康公司,日本);高速低温离心机(FUB-98A,北京六一仪器厂,中国)。
1.2 实验方法
1.2.1 外耳道内壁全层皮肤缺损模型构建[10]新西兰大白兔耳腹侧耳根处备皮,碘伏消毒,切开外耳道皮肤、肌肉以及弹性软骨,暴露外耳道内壁皮肤,Miltex活检打孔器钻开直径为2 cm 的创面缺损,每只动物构建1 个创面。
1.2.2 分组处理 将兔随机分为3 组,空白组、对照组、实验组,每组10 只,进行处理前,先在实验动物的创面正下方的外耳道垫以无菌明胶海绵,保持明胶海绵的边缘与创面边缘相平,对照组动物通过内植法将ECM 支架铺于明胶海绵与创面边缘之间,实验组则将ADSC aggregates-ECM 支架铺于明胶海绵与创面边缘之间,确保支架完全覆盖创面。空白组不做处理。以自由饮水,标准颗粒饲料单笼饲养各组实验动物。
1.2.3 创面愈合观察 术后14 d 使用数码相机拍照,裸眼观察各组创面组织的愈合情况:创面颜色、有无渗出、新生上皮覆盖等。图像分析软件HVviewing8.0统计各组的创面愈合率。创面愈合率[11]=[(造模创面面积-未愈合创面面积)/造模创面面积]×100%。
1.2.4 创面组织形态学改变 14 d 后从各组实验动物的创面组织中心取创面范围内的表层皮肤,常规方法采集创面组织,迅速转至-80℃深冷冰箱中独立保存待测。将创面组织用5%甲醛固定,常规制片,HE、Masson 染色,二甲苯处理,切片透明后,使用显微镜观察创面组织的形态学变化:胶原蛋白及上皮组织再生、炎症细胞浸润等情况。
1.2.5 创面组织细菌菌落阳性比例比较 取创面组织,解剖剪剪成微小颗粒,搅拌匀浆后,稀释至1 000倍,取1 mg 稀释液接种于Mueller-Hinton agar 培养基,37 ℃,5% CO2生化培养箱中培养48 h,室温静置24 h,显微镜下观察,统计培养基上的菌落数,并换算成每克样品中细菌菌落数(colony forming units/gram,cfu/g),cfu/g≥105为阳性结果,cfu/g<105为阴性结果[12]。
1.2.6 免疫组化检测创面组织中细胞核增殖抗原(proliferating cell nuclear antigen,Ki67)表达 创面组织用10%聚甲醛固定2 h,脱水,透明,浸蜡后切片,以枸橼酸钠缓冲液进行高温抗原修复后,双氧水封闭,PBS 冲洗后,加入一抗(1:500),4℃孵育过夜,次日加入二抗(1:2 000),二氨基联苯胺(DAB)染色,苏木素染核,清洗、脱水,二甲苯透明,中性树脂封片,显微镜下观察,目的蛋白在胞质中呈棕褐色[13]。
1.2.7 免疫印迹实验(Western blot)检测创面组织中炎性因子白细胞介素1β(IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达 取创面组织,常规裂解、匀浆、离心后,测定蛋白浓度,电泳分离,转模、封闭,滴加一抗(均为1:500),4℃孵育过夜,次日清洗后加入二抗(均为1:1 000),显色,凝胶成像仪下读取各条带灰度值,以GAPDH 为内参,计算目的蛋白相对表达水平。
1.3 统计学方法
本研究数据分析采用SPSS 16.0,作图工具采用Graphpad 5.01,以平均数±标准差()表示符合正态分布的计量资料,多组间比较采用单因素分析,两两比较采用t检验;计数资料以百分比(%)表示,组间比较采用χ2检验,P<0.05 表示具有统计学意义。
2 结果
2.1 创面愈合大体观察以及创面愈合率
如图1 所示,术后14 d 实验动物创面均有不同程度的愈合,但实验组创面愈合的程度明显好于对照组、空白组。与空白组相比,实验组、对照组动物的创面愈合率明显升高(P<0.05),与对照组相比,实验组动物的创面愈合率明显升高(P<0.05)。
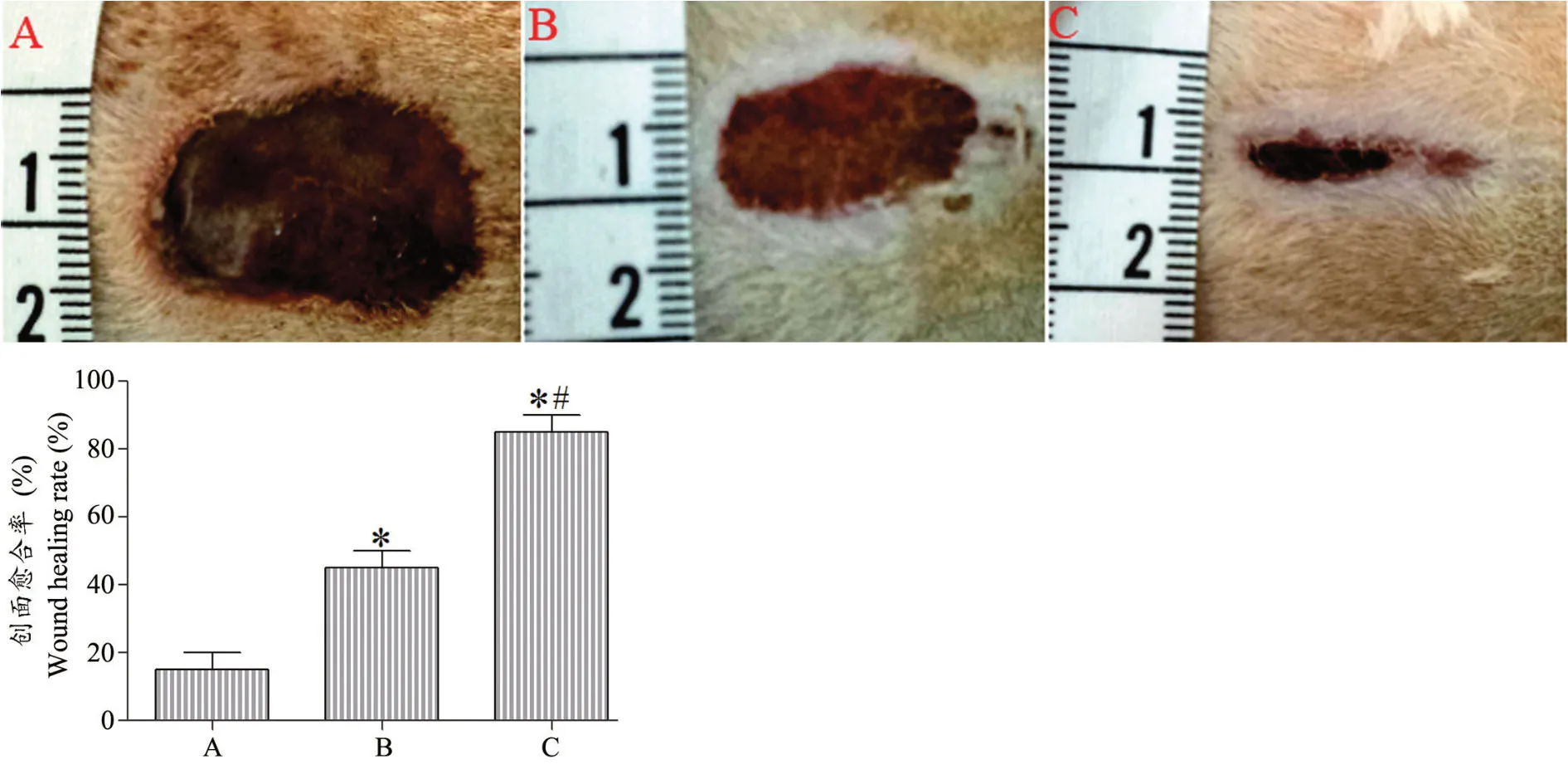
图1 兔外耳道内壁皮肤创面大体观察以及创面愈合率比较A:空白组B:对照组C:实验组* P<0.05,与空白组相比 #P<0.05,与对照组相比Fig.1 General observation of wounds in each group and the comparison of wound healing rate of external auditory canal in rabittsA: Blank group; B: Control group; C: Experimental groupCompared with the blank group,*P<0.05;Compared with the control group,#P<0.05
2.2 创面组织形态学改变
HE 染色结果显示,空白组创面的皮肤组织层次较为单一,虽有大量的血管新生,炎性细胞填充较多,但未见明显的复层结构;对照组创面新生血管的数量明显增多,皮肤的复层结构已开始出现,创面与正常组织间的交界分明,皮肤细胞的层数较少;实验组的创面组织与正常组织的交界模糊,两者相互延续,基底细胞的数量和形态比较正常,炎性细胞浸润程度明显好转,并可见较为明显的类似真皮层的结构,见图2。
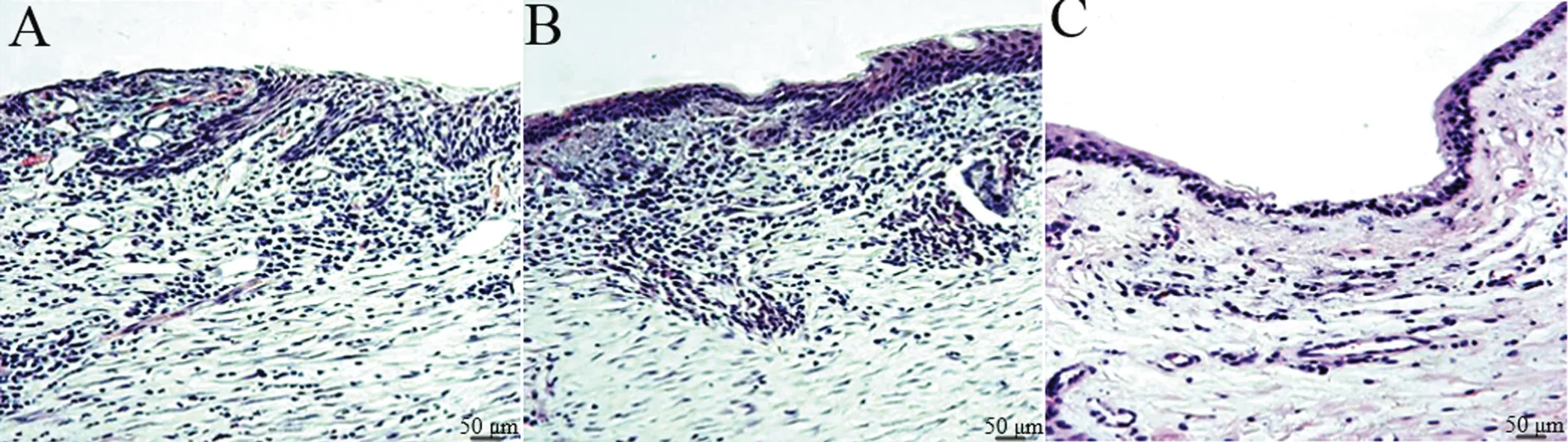
图2 创面皮肤HE 染色结果A:空白组 创面皮肤层次单一,炎性浸润丰富B:对照组 创面新生血管数量增多,皮肤出现复层结构C:实验组 创面炎性浸润明显减少,皮肤分层趋于正常Fig.2 Result of wounds HE stainingA: Blank group,the wounds had a single skin layer and abundant inflammatory infiltration; B: Control group,the number of new blood vessels on the wounds increased,and the skin appeared multi-layered structure; C: Experimental group the inflammatory infiltrations of the wounds were significantly reduced,and the skin layering tended to be normal
Masson 染色结果显示,空白组创面组织胶原沉积较少,胶原纤维排列松散;对照组创面组织胶原沉积明显增多,但胶原纤维存在较为明显的断裂,排列较为稀疏;实验组创面组织胶原沉积的量明显较前两组增多,且胶原纤维排列较为整齐,成簇状的胶原纤维质地较为紧密,部分创面已与正常组织交联融汇一起,见图3。
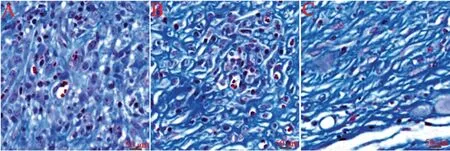
图3 创面皮肤Masson 染色结果A:空白组创面组织胶原纤维排列松散B:对照组创面组织胶原纤维断裂明显,排列较稀疏C:实验组创面组织胶原沉积的量明显较前两组增多,胶原纤维排列较整齐Fig.3 Result of wounds Masson stainingA: Blank group,the collagen fibers in the wound tissue were arranged loosely; B: Control group,the collagen fibers in the wound tissue were broken and arranged relatively sparsely; C: Experimental group,the amount of collagen deposition in the wound tissue was significantly higher than that of the first two groups,and the collagen fibers were arranged more neatly
2.3 各组创面组织细菌菌落阳性比例比较
与空白组相比,对照组、实验组创面的细菌菌落计数≥105cfu/g,检出率明显降低(P<0.05),与对照组相比,实验组创面的细菌菌落计数≥105cfu/g,检出率明显降低(P<0.05),见图4。
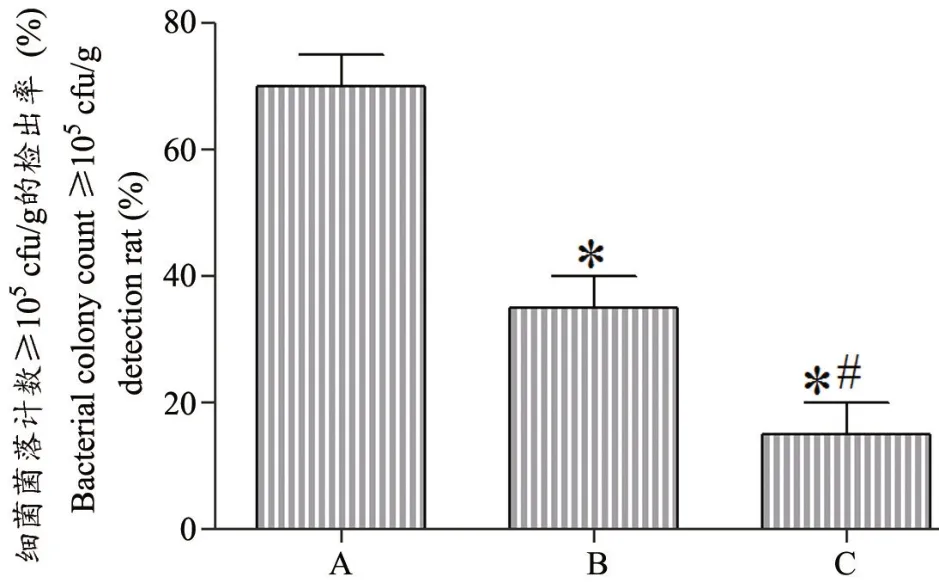
图4 各组创面组织细菌菌落阳性比例比较A:空白组 B:对照组 C:实验组 *P<0.05,与空白组相比 #P<0.05,与对照组相比Fig.4 Comparison of the positive ratio of bacterial colonies in wound tissuesA: Blank group; B: Control group; C: Experimental groupCompared with the blank group,*P<0.05;Compared with the control group,#P<0.05
2.4 创面组织中Ki67 表达
免疫组化结果显示,与空白组相比,对照组、实验组创面的Ki67 阳性细胞比例明显升高(P<0.05),与对照组相比,实验组Ki67 阳性细胞比例明显升高(P<0.05),见图5。
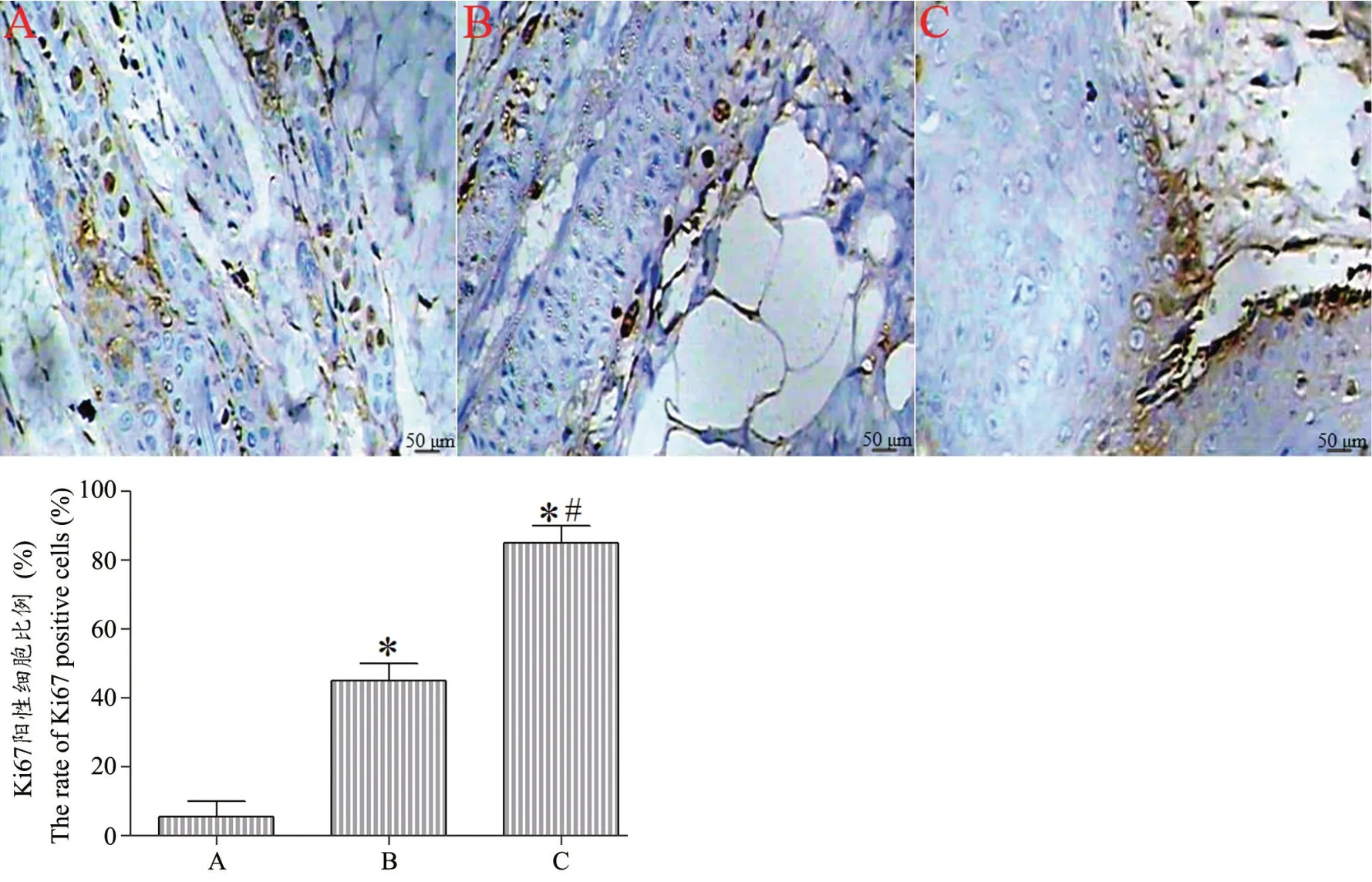
图5 创面皮肤免疫组化染色结果及统计图A:空白组B:对照组Ki67 阳性细胞比例明显高于空白组C:实验组Ki67 阳性细胞比例明显高于对照组*P<0.05,与空白组相比 #P<0.05,与对照组相比Fig.5 Result of wounds immunohistochemical staining and statistical diagram A: Blank group; B: Control group,the proportion of Ki67-positive cells in the wounds was significantly higher than that of the blank group; C: Experimental group,the proportion of Ki67-positive cells in the was significantly higher than that of the control group Compared with the blank group *P<0.05.Compared with the control group,#P<0.05.
2.5 各组创面组织中IL-1β、TNF-α 表达
Western blot 结果显示,与空白组相比,对照组、实验组创面组织中IL-1β、TNF-α 的表达明显下降(P<0.05);与对照组相比,实验组创面组织中IL-1β、TNFα 的表达明显下降(P<0.05),见图6。
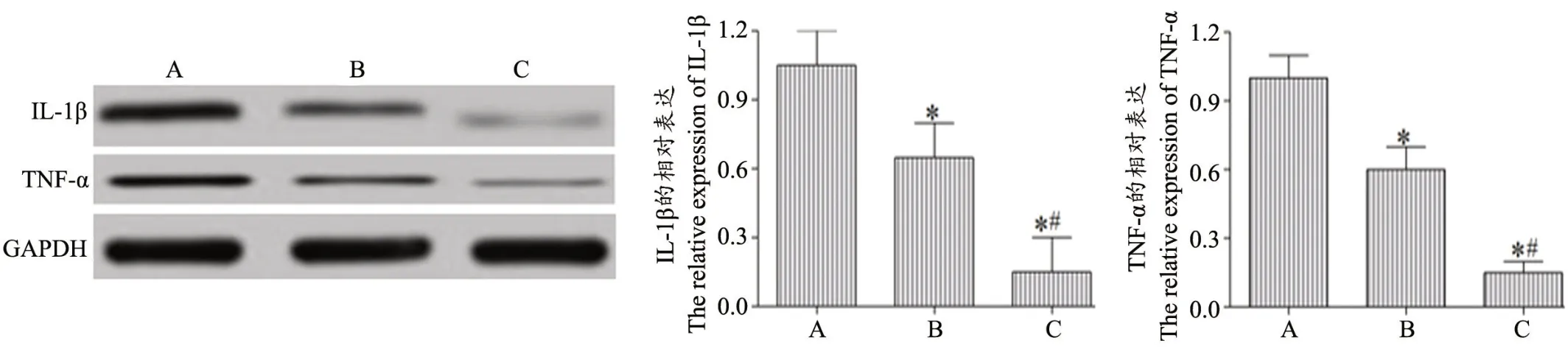
图6 各组创面组织中IL-1β、TNF-α 表达条带以及含量分析A:空白组B:对照组C:实验组*P<0.05,与空白组相比 #P<0.05,与对照组相比Fig.6 Expression band and content analysis of IL-1β and TNF-α in wound tissues of each group A: Blank group; B: Control group; C: Experimental groupCompared with the blank group,*P<0.05;Compared with the control group,#P<0.05
3 讨论
通常耳部手术触及颞骨或其软骨组织,容易导致外耳道、乳突等骨面暴露,形成颞骨上皮缺损,患者该部位创面的自行愈合程度取决于颞骨裸露创面的上皮化水平,研究显示耳道上皮的增殖及分化进程较慢,加之术腔气流量以及空气中细菌感染的影响,此类患者往往需要进行术腔重建,以加快创面愈合[14]。自体游离皮肤、生物陶瓷颗粒、自体骨质碎屑以及局部带蒂皮瓣等材料均被耳科学家用于临床术腔上皮修复和乳突腔重建;尽管使部分患者获得较好的恢复,但由于感染、排斥反应以及残渣堆积,或者创面未能获取足够的血供等,不适宜在临床推广应用[15]。组织工程是将工程学、细胞生物学、生命科学、材料学的原理与技术相结合,建立具有生物活性的细胞-生物-材料的三维复合体,在尽量降低免疫原性的条件下将此复合体用于修复或促进人体器官或组织损伤后功能和结构生物替代物的综合学科[16]。近年来组织工程技术被视为皮肤修复或再生的最有希望的途径。李剑等[17]研究证实较为成熟的组织工程皮肤表皮膜片用于治疗稳定期的白癜风,疗效显著,安全性较好,值得临床推广。关于外耳道皮肤修复的组织工程尚在实验室研究阶段[18]。鉴于耳道以及人体颞骨上皮的结构和功能的特殊性,组织工程学家曾将角质细胞膜片、口腔粘膜非角化细胞膜片以及脱细胞真皮基质等上皮细胞引入术腔上皮重建中,均显示了明显缩短上皮化时间,抗感染、干耳快、术后复发率低等优点,取得良好的临床疗效[19]。但由于上皮细胞来源有限、培养难度较高,且上皮膜片质地脆性偏高,致使转移操作困难,创面成功率难以控制,迫使该技术寻找理化性能稳定、促进颞骨上皮皮肤结构与功能恢复、便于细胞定植的上皮修复生物复合材料[20]。
选择合适的种子细胞以及生物支架是耳部皮肤组织工程亟待解决的问题[21]。脂肪间充质干细胞(ADSCs)可被诱导产生多向分化潜能,其来源丰富、体外扩增技术成熟、免疫原性低,还具有促进胶原蛋白分泌,促进表皮细胞再生,促进愈合等功能,使ADSCs 成为皮肤组织工程中最为优秀的种子细胞[22]。Li 等[23]研究表明ADSCs 在促进口腔皮肤创面愈合以及再生方面具有良好的疗效和安全性。作为细胞支架,细胞外基质(ECM)能够以细胞自身为内源性支架,在保留细胞与细胞间连接的同时,将细胞均匀分散于细胞三维空间,细胞稳定的结构免受机械损伤,更能保留细胞的生物学功能。同时作为天然、可降解的生物学材料,ECM 较强的可塑性,能够保障将创面完全覆盖,抑制炎性因子表达等多种优势。ECM 支架已在烧伤、器官重建以及整形美容中广泛应用[24]。但未见有将ADSCs 和ECM 用于耳部皮肤修复的研究报道。
本研究构建兔外耳道内壁全层皮肤缺损模型,实验组以ADSC aggregates-ECM 平铺创面进行修复,14 d 后,与空白组相比,实验组的创面愈合率明显较高,创面抗菌效果良好,创面组织病理良好,胶原蛋白成簇状分布;免疫组化结果显示实验组创面组织中Ki67 的表达明显增强,上皮细胞的增殖能力明显增强。Western blot 结果显示实验组创面组织中炎性因子的表达明显下调。
综上所述,脂肪间充质干细胞聚合物-细胞外基质复合物补片能明显促进兔外耳道内壁全层皮肤缺损的修复,但如何将这种组织工程技术应用于临床,尚需深入研究其治疗的稳定性、疗效的重复性。