山药多糖结构、生物活性及其机制研究进展
2022-12-30刘佩瑶何晓桐邹泽斌
梁 杉,王 琨,刘佩瑶,何晓桐,邹泽斌,黎 攀,杜 冰
(华南农业大学食品学院,广东 广州 510642)
山药(Dioscorea oppositaThunb.)又名薯蓣、土薯、山薯等,是薯蓣科(Dioscoreaceae)草本植物的地下块茎,主要分布于非洲、美洲和亚洲的热带和亚热带地区,山药在我国栽培历史悠久,其原产地是河南焦作,现在华北、华中、山东、江苏、福建、云南等地均有广泛分布[1]。山药是一种药食同源植物,含有蛋白质、脂肪、维生素等多种营养成分,同时还含有多糖、尿囊素、皂苷等多种活性成分[2],其中多糖是其主要的活性成分。
山药多糖因其复杂的组成和结构,具有多种功效作用,是近年来的研究热点。山药多糖主要由葡萄糖(glucose,Glu)、甘露糖(mannose,Man)、半乳糖(galactose,Gal)等单糖组成,具有抗氧化[3]、降血脂[4]、抗肿瘤[5]、抗衰老[6]、调节免疫活性[7]等多种生物学功效。山药多糖的生物活性与其结构特征息息相关,因此本文主要从山药多糖的结构、活性机制及结构与活性的关系进行综述,旨在为研究山药多糖的结构特征及生物活性提供理论依据。
1 山药多糖结构
1.1 单糖组成
山药多糖主要是由7种单糖和2种糖醛酸组成,其中单糖分别是Glu、Man、鼠李糖(rhamnose,Rha)、Gal、木糖(xylose,Xyl)、核糖(ribose,Rib)和阿拉伯糖(arabinose,Ara),在样品中含量较高的是Gal、Glu、Rha和Ara,糖醛酸只有半乳糖醛酸(galacturonic acid,GalA)和葡萄糖醛酸(glucuronic acid,GluA)两种(表1),山药多糖的单糖组成和含量受产地、品种、纯化方法、洗脱液、生长环境等多种因素的影响。
不同产地的山药,其单糖组成和含量存在差异。河南和广东产的山药中普遍Glu含量高,浙江和河北产的山药中单糖种类少[8-10];而同一产地的不同品种山药,其单糖含量有一定区别,如种植于河南的4种山药,怀山药和白玉山药中Glu含量较高,怀山药中Gal含量较高,铁棍山药中Man含量较高[11-14]。
不同纯化方法纯化出的多糖中单糖组成存在差异。目前用于分离纯化山药多糖的方法主要有DEAE纤维柱层析法、葡聚糖凝胶柱层析法及膜分离法3种,其中使用DEAE纤维柱层析法纯化得到的3个山药多糖组分(多糖I、多糖II、多糖III)中,多糖II糖醛酸含量高;超滤膜包法纯化得到的3个HSY组分(HSY-I、HSY-II、HSY-III)中,组分II中Glu含量较高,组分III中Gal含量较高,组分I中仅含有Gal和GluA;而高速逆流色谱法(high-speed countercurrent chromatography,HSCCC)和Sephadex凝胶柱层析法纯化后的山药多糖仅由Glu和Gal组成[15-16,19]。
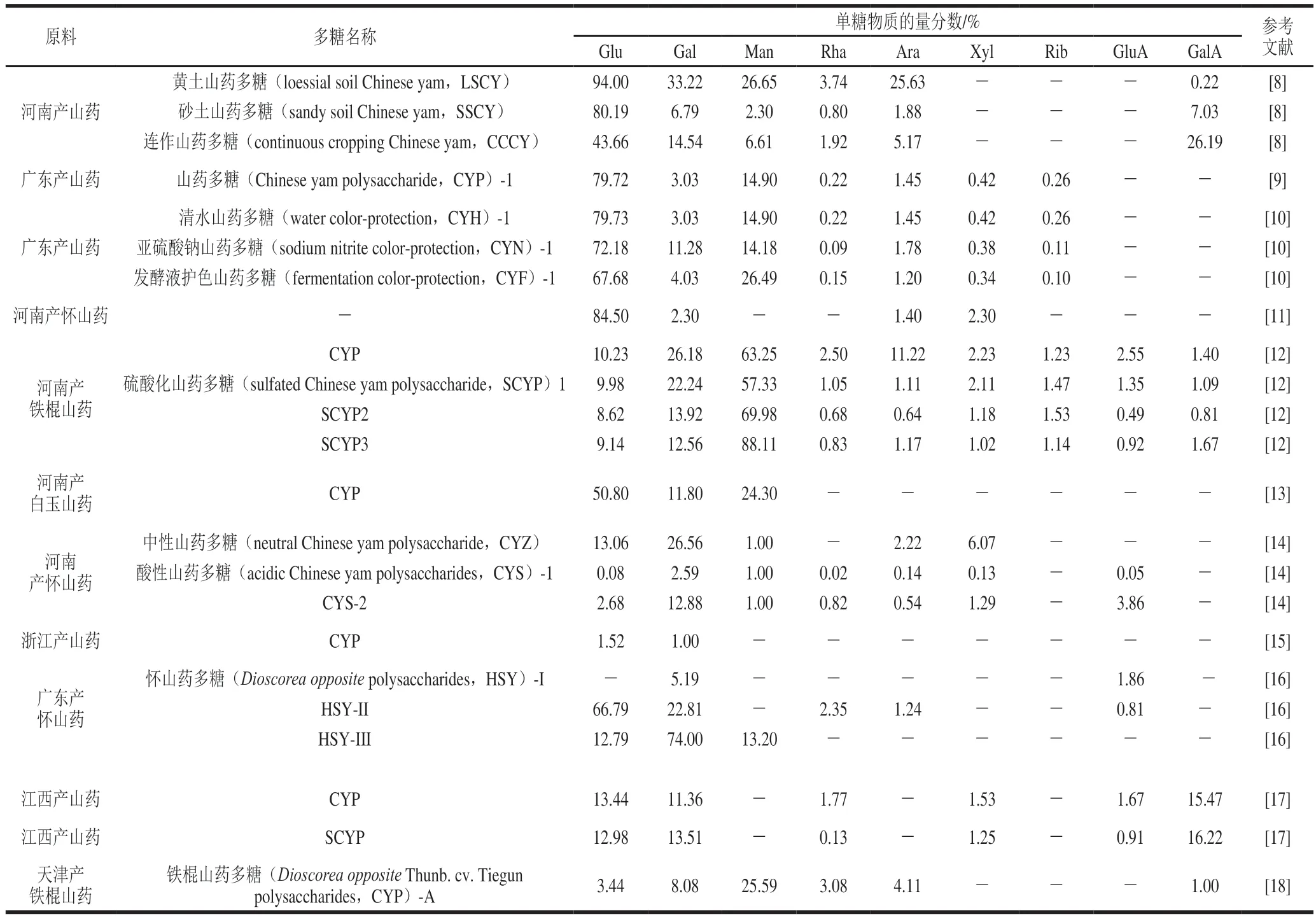
表1 山药多糖的单糖和糖醛酸组成Table 1 Monosaccharide and uronic acid compositions of yam polysaccharides
山药多糖中单糖组成会受到洗脱液的影响。山药多糖经过DEAE纤维柱层析时,蒸馏水洗脱出的为中性多糖,NaCl洗脱出的为酸性多糖[20]。目前山药多糖主要包括中性多糖和酸性多糖两种,其中中性多糖主要由Glu、Gal、Man、Ara、果糖(fructose,Fru)5种单糖组成,酸性多糖主要包括Glu、Man、Gal、Xyl、Ara、阿卓糖、GalA 7种单糖[21-24]。
不同生长环境的山药中单糖组成和含量受土壤类别、土壤pH值等因素的影响。如砂土栽培的山药中Glu含量较高且单糖含量最高的是Glu、GalA和Gal,而黄土栽培的山药中含量最高的是Gal、Man和Ara[8]。对于种植于砂土的山药,由于连作土壤中pH值降低,引起土壤养分元素发生变化,使得连作砂土种植的山药中Gal相对含量由7.03%升高至26.19%[8,25]。此外化学修饰也会影响山药多糖的单糖组成。硫酸化修饰后,多糖中Rha、岩藻糖、GluA的含量降低,而Gal和GalA的含量增加[12,26]。
1.2 分子质量
目前提取山药多糖的方法有热水提取法、酶法、超声波辅助提取法等。多糖类物质由于其分子中含有大量极性基团,因而对水分子具有较大的亲和力,一些分子质量较小、分支程度较低的多糖在水中有一定溶解度,并且温度越高,其溶解性能越好[27];传统的热水提取法成本低、操作简单,是提取植物多糖最常用的方法[28]。分子质量较大的多糖,疏水性强,溶解度差,就需要采用酸、碱、有机溶剂或酶法、超声波等辅助方法来将植物细胞壁降解成易溶于提取溶剂的小分子物质,或是机械性地破坏植物细胞壁,加快细胞质中成分的传递,从而加速植物细胞中有效成分的溶出[29-31],因此不同分子质量大小的山药多糖应选用不同的多糖提取方法[29,32]。Zhao Chengcheng等[33]分别采用热水、温水、冷水、超声辅助来提取山药多糖,其中热水提取出的多糖分子质量最低,其他3种方法提取的多糖分子质量相差不明显,可能是热水提取过程中随着温度的升高,多糖发生热降解,分子质量减小[34]。
目前用于测定山药多糖分子质量的方法主要是高效凝胶渗透色谱法(high-performance gel permeation chromatography,HPGPC)和高效液相色谱法(highperformance liquid chromatography,HPLC)(表2)。HPGPC是将分子质量大小不同的聚合物按其由大到小的顺序依次洗脱,当聚合物分子质量大于填料孔径时,不能被洗脱出,因此用于测定分子质量在一定范围内的聚合物,此外这种方法会因聚合物分子中某些阴离子基团与凝胶色谱柱表面残留的阴离子基团相互排斥而导致测出的分子质量偏大[37-38];HPLC是根据固定相对组分的吸附力大小不同而将不同的组分分离,适用于分子质量大、分子质量范围广的化合物分析[39]。从表2可看出,山药多糖的分子质量在1~370 ku范围内,其中HPGPC测得的分子质量为1~50 ku,HPLC测得的分子质量为9~370 ku,此外陈运中等[24]采用多角度激光光散射检测器和示差折光检测器与凝胶渗透色谱联用测出山药多糖的分子质量为34.78~65.09 ku。分子质量大小还与多糖种类有关,多糖提取方法和分子质量测定方法相同时,酸性多糖的分子质量大于中性多糖的分子质量[24,40]。
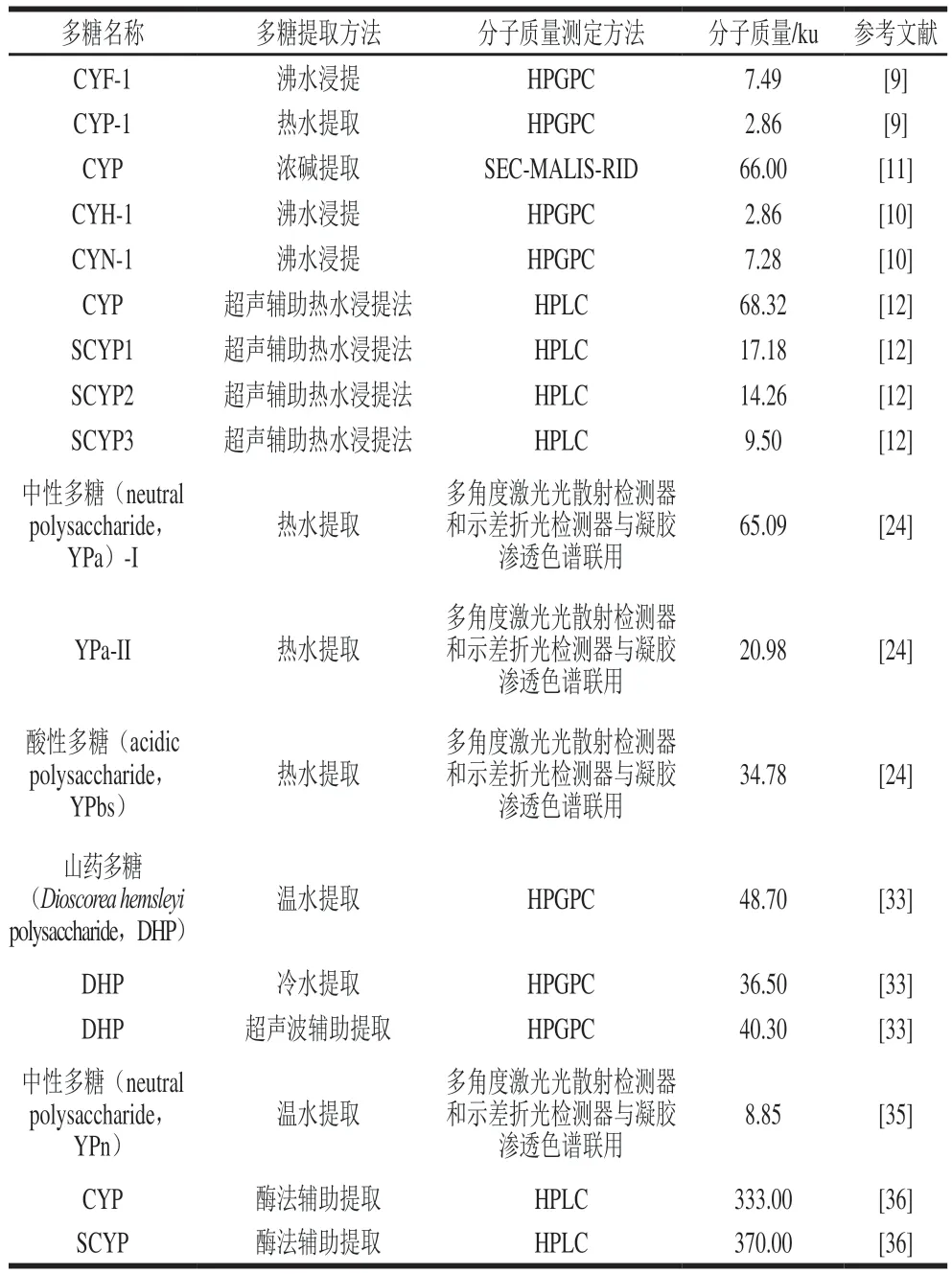
表2 提取和测定方法对山药多糖分子质量的影响Table 2 Effects of extraction and detection methods on molecular mass of yam polysaccharides
山药多糖分子质量还受化学修饰和分离纯化方法的影响。硫酸酯化修饰后,强烈的反应条件使山药多糖降解,从而使其硫酸化多糖衍生物的分子质量由原来的66.00~68.32 ku降低到9~18 ku[11-12]。不同的纯化方法可以有效分离分子质量片段不同的山药多糖,同时在分离纯化过程中,由于多糖降解,糖链断裂,导致大分子多糖变成小分子多糖而被透析除去,因此,采用梯度醇沉法分离的山药多糖,其分子质量随乙醇体积分数的增大而减小;同样柱层析法纯化的山药多糖,其分子质量随NaCl洗脱液浓度的升高也减小[16,20,24]。
1.3 糖链结构
山药多糖糖链的结构包括碳链构型、糖苷键类型、糖链有无分支、分支的位置等(表3),山药多糖的主链主要由Glc、Man、Gal组成,其中Glc最常见,Man和Gal常在支链末端,侧链通过O-2、O-3、O-6与主链连接,碳链有α和β两种构型。不同组分的山药多糖中,糖苷键的类型、糖苷构型有所差异,如怀山CYS中,组分1(CYS-1)的碳链有2种α构型和4种β构型,其中主链由1→2和1→4两种糖苷键连接,而组分2(CYS-2)的碳链有2种α构型和3种β构型,主链主要是由1→2、1→4和1→6 3种糖苷键连接[14]。
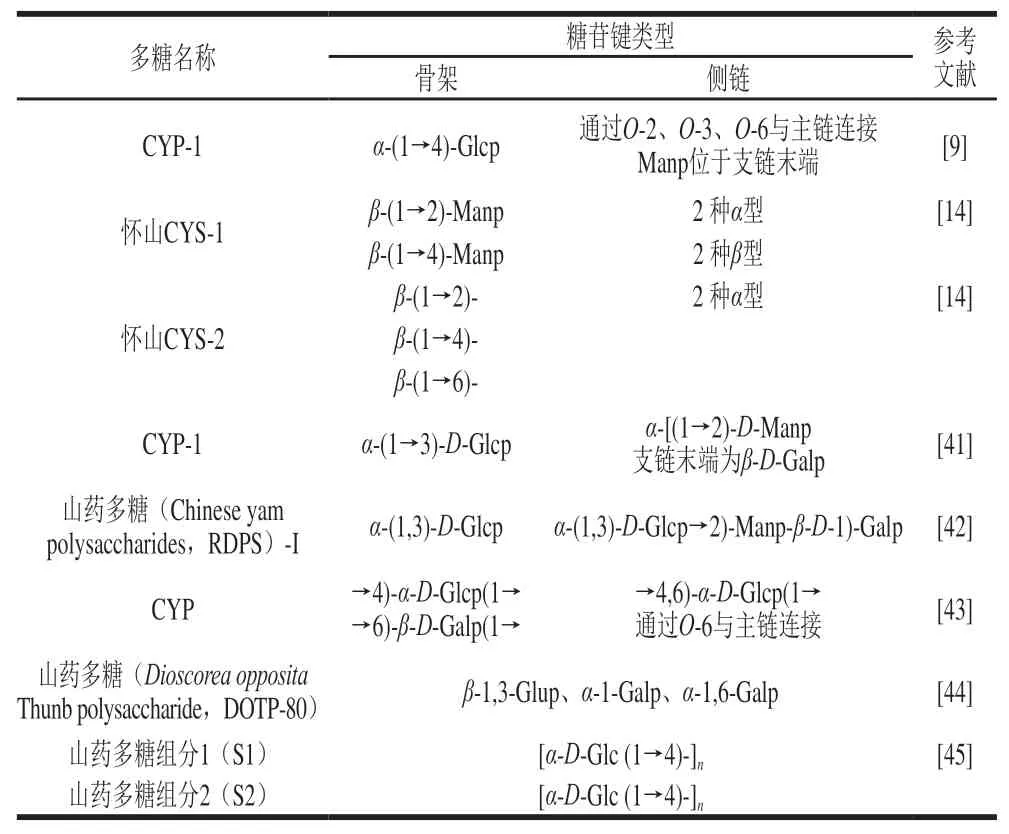
表3 山药多糖的糖苷及糖链Table 3 Glycosides and sugar chains of yam polysaccharides
2 山药多糖的活性及机制
山药多糖具有抗氧化[3]、降血脂[4]、抗肿瘤[5]、抗衰老[6]和免疫调节[7]等多种生物学活性,广泛应用于功能性食品、药品等行业。现阶段,有关山药多糖的体外评价和动物实验不断被报道,对其机制的研究也逐渐深入,明确其具体的活性机制对山药多糖的精深加工及应用具有指导意义。
2.1 抗氧化、抗衰老活性
氧化应激会导致机体内脂类、蛋白质、DNA、脂质膜的损坏,从而引起机体衰老。研究表明,山药多糖具有很强的还原力,具有抗氧化和抗衰老的功效[6]。山药多糖主要通过清除自由基来发挥其体外抗氧化的作用,同时又通过激活各种抗氧化酶、调控抗衰老基因klotho的表达、调控p53/p12信号通路而起到抗衰老的作用。
山药多糖通过清除羟自由基、超氧阴离子自由基、1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picrythydrazyl,DPPH)自由基来提高其体外抗氧化活性[30],且其清除能力可达到VC的清除水平[3]。其中清除自由基的机理可能是山药多糖中的羟基可以提供氢,与羟自由基结合,促进羟自由基的清除;另外多糖中可能存在亲电基团,如醛或酮,会释放出氢原子,清除超氧阴离子自由基;而对DPPH自由基的清除可能是与山药多糖中单糖组成、糖苷键及构型有关[46-49]。
山药多糖可通过上调相关抗氧化基因超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)的mRNA表达水平,使机体内各种氧化酶如SOD、CAT和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活力显著提高,脂质过氧化物如丙二醛(malondialdehyde,MDA)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)的水平显著降低,从而降低胞内自由基的数量,提高机体抗氧化应激的能力,减少氧化损伤,延缓衰老[50-52]。
山药多糖可上调肝和肾脏中抗衰老klotho基因的表达来延缓小鼠衰老[6],klotho蛋白通过与细胞膜表面特定受体结合而启动胞内的信号转导过程,该信号传递可以抑制特定的靶酶磷酸肌醇-3激酶/蛋白激酶B(phosphatidyinositol 3-kinase/protein kinase B,PI3K/Akt)的磷酸化过程,而导致Akt的去磷酸化,去磷酸化后的Akt抑制了叉头转录因子FOXO家族(FOXO1、FOXO3a、FOXO4等)的磷酸化,进而直接调控并促进锰超氧化物歧化酶(MnSOD)的表达,从而清除细胞内活性氧类物质,减轻氧化应激,延缓机体衰老[6,52]。
p53/p12信号通路在氧化应激引发细胞衰老的调节中发挥着重要作用,其中p53蛋白和p12蛋白是细胞衰老调控通路中的关键蛋白,当氧化应激发生时,p53蛋白活化,表达水平升高,进而激活p21蛋白,使其表达量显著上升,引起衰老的发生[53]。对D-半乳糖诱导的衰老大鼠灌胃山药多糖后,大鼠中衰老基因p16、p21的表达水平降低,免疫印迹检测结果表明,山药多糖可显著下调大鼠肝脑中p53、p21蛋白的表达,从而下调衰老基因的表达水平[54],因此推断山药多糖发挥抗氧化与抗衰老主要的机制如图1所示。
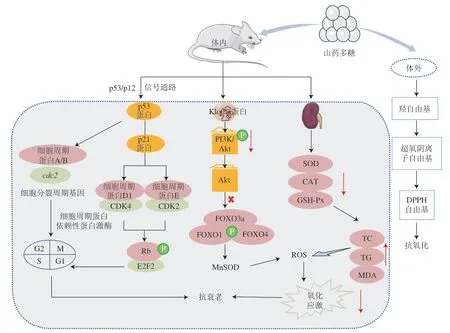
图1 山药多糖的抗氧化与抗衰老机制Fig. 1 Antioxidant and anti-aging mechanisms of yam polysaccharides
2.2 免疫调节活性
免疫调节活性被认为是改善老年人和癌症患者身体防御机制的重要能力[55]。大量研究表明,山药多糖具有免疫调节的功效[56-57]。Li Cheng等[43]研究得出,含有N-聚糖的山药糖蛋白(30CYGP)和去糖基化的山药糖蛋白(De-30CYGP)都具有免疫调节作用,其中两种糖蛋白发挥免疫作用的机制可能是山药糖蛋白激活了巨噬细胞,促进了一氧化氮(NO)的释放而发挥其免疫调节作用,这与Chen Weixia等[58]的研究结果相似;而Huang Rong等[17]研究发现,山药非淀粉多糖(CYP)及多糖硫酸化衍生物(SCYP)均能减轻环磷酰胺诱导的免疫抑制小鼠的免疫损伤,而SCYP在一定程度上表现出更为明显的作用,其机制可能是CYP和SCYP通过刺激脾淋巴细胞增殖,触发T细胞表面标志物(CD3+、CD4+、CD8+)的表达,同时使免疫损伤小鼠中CD4+/CD8+恢复,从而活化T细胞,释放大量肿瘤坏死因子(tumor necrosis factor,TNF)α和白细胞介素(interleukin,IL)1β,并刺激了血清中抗体免疫球蛋白(immunoglobulin,Ig)G和IgM的产生,激活免疫系统,增强免疫调节功能。
此外山药多糖还可调控核因子κB(nuclear factor κB,NF-κB)信号通路激活其免疫调节活性,NF-κB是一种转录因子,调节与免疫和炎症反应相关的各种基因。在未受刺激细胞的胞质中,NF-κB与NF-κB抑制蛋白(inhibitory protein of NF-κB,IκB)结合,成为一种非活性复合物形式。当细胞受到刺激时,IκB激酶(IκB kinase,IKK)复合物被激活。IKK家族催化IκB-α磷酸化并与NF-κB解离,IκB-α降解并诱导NF-κB的核异位,将NF-κB转化为活化形式[59]。Li Min等[23]研究表明,山药非淀粉多糖可通过激活NF-κB信号通路,从而激活RAW264.7巨噬细胞,释放大量NO,促进IL-6和TNF-α的表达,最终发挥其免疫调节功效。山药多糖发挥免疫调节作用主要的机制如图2所示。
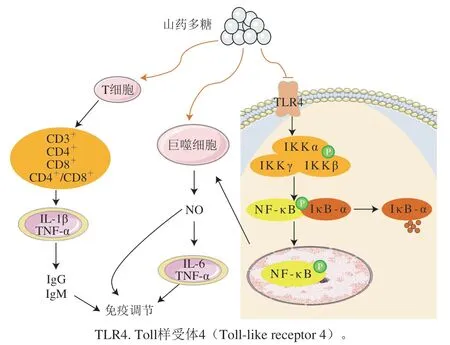
图2 山药多糖的免疫调节机制Fig. 2 Immunoregulatory mechanism of yam polysaccharides
2.3 降血糖、降血脂活性
山药多糖具有降血糖、降血脂、治疗糖尿病的功效[60]。山药多糖可降低2型糖尿病大鼠体内与糖代谢相关酶活力,如己糖激酶(hexokinase,HK)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)及苹果酸脱氢酶(malate dehydrogenase,MDH)、α-葡萄糖苷酶的活力,来降低其血糖水平[18,61];此外山药多糖也能够通过降低大鼠体内的TC、TG和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)的含量,改善胰岛素抵抗降低糖尿病小鼠的血糖、血脂水平[62-67],杜妍妍等[68]研究发现,低、中、高剂量的山药多糖均能显著降低小鼠的空腹血糖浓度和血清胰岛素指标水平,并能在一定程度上改善胰岛素抵抗指数,较好地发挥其降糖、降脂功效;王淑静[61]的研究也得出类似的结论。山药多糖改善胰岛素抵抗的机制复杂,Lee等[69]在研究CYP是否会对胰岛素抵抗有影响时发现,CYP在抑制由TNF-α或活性氧诱导的胰岛素抵抗中发挥了重要作用,推测可能的潜在机制是山药多糖抑制了胰岛素受体底物蛋白的酪氨酸磷酸化,使胰岛素受体(insulin receptor,IR)和磷酸化Akt(phospho-Akt,p-Akt)水平增加,从而增大了胰岛素信号通路中Akt的活性,抑制了小鼠体内Glu浓度的升高,并降低血脂水平;而Cheng Zhenyong等[67]研究又表明,山药多糖可通过降低LDL-C和TC的水平,抑制游离脂肪酸(free fatty acids,FFAs)的产生,随后降低血清中瘦素和IL-1β的水平并下调内脏脂肪组织中基质金属蛋白酶-3(matrix metalloproteinase-3,MMP-3)的表达,减少了炎症蛋白产物,同时MMP-3活力降低又抑制了TNF-α的产生,从而改善了胰岛素抵抗,起到降血脂的功效,因此推测山药多糖改善胰岛素抵抗的主要机制如图3所示。
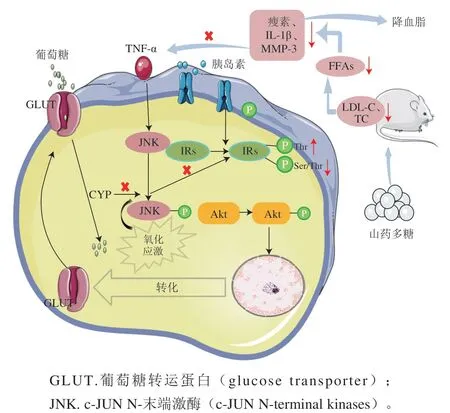
图3 山药多糖改善胰岛素抵抗的机制Fig. 3 Mechanism by which yam polysaccharides improve insulin resistance
2.4 保肝护肝活性
研究表明,山药多糖具有预防肝损伤的作用[70]。对急性酒精中毒的小鼠灌胃山药多糖溶液,可协调小鼠肝器官,调节血糖水平,降低乙醇和乙醛的质量浓度,延长醉酒耐受时间,减轻小鼠肝损伤;对D-半乳糖诱导的衰老小鼠灌胃HSY后发现,HSY能明显改善衰老小鼠肝、肾组织器官的病理状态,修复肝、肾的储备能力;对环磷酰胺所致免疫低下小鼠分别灌胃中剂量和高剂量的山药多糖后发现,小鼠脾脏指数和白细胞计数明显改善,肝组织病理学损伤明显减轻,山药多糖对肝脾损伤小鼠起到良好的保护作用;对肝损伤的小鼠灌胃山药多糖溶液后,小鼠体内血清谷丙转氨酶和天冬氨酸转氨酶的活力降低,MDA、NO含量及肝脏指数降低,而GSH-Px和SOD活力增大,小鼠的体质量、脾脏指数和白细胞数量得到改善,小鼠肝损伤修复[71-74]。
2.5 抗肿瘤活性
目前治疗癌症的方法大多数依赖于化学药物,但长期使用化学药物治疗会导致机体免疫力下降,因此,寻找高效、低毒、低副作用的天然抗肿瘤药物具有重要意义。研究表明,植物多糖多无毒且具有抗肿瘤活性[75-76]。赵国华等[77]研究表明,山药多糖可促进T淋巴细胞和自然杀伤细胞的增殖分化,提高肿瘤小鼠的脾淋巴细胞和巨噬细胞中IL-2和TNF-α含量,抑制肿瘤细胞生长,诱导肿瘤细胞凋亡,发挥抗肿瘤功效,且山药多糖的给药剂量越高,荷瘤鼠肿瘤质量越小,对肿瘤抑制率越高。
2.6 其他活性作用
Li Pan等[9]发现CYP及从中分离纯化出的水溶性多糖(CYP-1)均能降低葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎小鼠中厚壁菌门数量,增加拟杆菌门数量,从而使厚壁菌门与拟杆菌门的比例降低,缓解了肠道菌群失调,且与DSS诱导的结肠炎小鼠相比,CYP-1降低了幽门螺杆菌和未知肠杆菌科的水平,而CYP增加了鼠杆菌、玫瑰杆菌和杜氏杆菌的水平,CYP-1和CYP均改善了DSS诱导结肠炎小鼠的肠道微生物群失调,缓解了结肠炎小鼠的炎症。
3 山药多糖结构与活性的关系
3.1 糖醛酸与活性的关系
在多糖中单糖作为基本组成单元会以特定的方式形成特殊的空间构象,这个空间构象一般都是多糖发挥活性的中心,如糖醛酸能明显影响多糖的活性[78-79]。在山药多糖中,糖醛酸能够清除DPPH自由基、羟自由基和超氧阴离子自由基,且清除能力随着糖醛酸浓度的增加而提高[15,27];此外严静等[10]分别用清水、亚硫酸钠及乳酸芽孢杆菌发酵液对山药多糖进行3种不同的护色处理,并探究其对巨噬细胞分泌IL-6水平的影响中发现,乳酸芽孢杆菌发酵液护色的山药多糖中糖醛酸含量显著升高,免疫活性明显增强。
3.2 分子质量与活性的关系
多糖的活性与其分子质量大小密切相关[80],分子质量过小,很难形成活性空间结构,分子质量越大,多糖分子的体积越大,越不利于多糖跨越细胞膜被吸收进入生物体内发挥生物学活性,分子质量分布在一个比较合理的区间由于多糖发挥其生物活性[78]。超声波辅助提取法、冷水提取法、温水提取法和热水提取法提取的4种山药多糖中,超声波辅助提取法和冷水提取法制得的山药多糖分子质量相对较低,表现出的抗氧化活性较强[33];同样对于分子质量分别为132、94、36 kDa和9 kDa的4种山药多糖(DP、LP1、LP2和LP3)中,LP3分子质量最小,但其抗氧化能力明显高于其他组分[81],因此,分子质量相对较小的山药多糖其抗氧化活性强。此外从同一种山药中分离纯化出的两个多糖组分中,分子质量较大的其免疫活性相对较强[78]。
3.3 硫酸化修饰与活性的关系
硫酸酯化修饰的原理是多糖大分子链上单糖分子中的羟基被硫酸基团取代,硫酸酯化对多糖的活性有提高作用[79]。如采用氯磺酸吡啶法对怀山药碱溶性多糖(alkali polysaccharides ofDioscorea fordiiPrain et Burkill,DFPA)-I进行硫酸化修饰后,其清除超氧阴离子自由基的能力是DFPA-I的4 倍;采用浓硫酸法修饰后的山药多糖同样增大了对自由基的清除率[12,82]。
硫酸化修饰后的多糖SCYP可通过提高肠道中消化酶活力,促进SCYP的消化与吸收,修复环磷酰胺诱导小鼠体内的短链脂肪酸水平,高剂量的SCYP还可促进肠道有益菌乳酸杆菌、拟杆菌和阿克曼菌的产生,抑制变形菌与疣状菌等有害菌的产生,改善肠道菌群的结构和组成,激活免疫活性[1]。此外取代度不同的硫酸酯化修饰对山药多糖活性的影响也存在差异,Huang Lixin等[26]在研究山药多糖中发现,硫酸化修饰后,山药多糖的取代度为0.5,其免疫活性高于原山药多糖CYP,Wang Xiaohua等[83]解释了这一结论,由于取代度小于1的SCYP中三螺旋结构没有被破坏,而取代度大于1的SCYP中三螺旋结构被破坏,因此取代度小于1的山药多糖SCYP的免疫活性大于取代度大于1的SCYP或原CYP,这也说明硫酸化修饰处理后山药多糖的生物活性与多糖中的三螺旋结构有密切关系。
3.4 糖链与活性的关系
糖链对多糖的活性起着重要作用。山药多糖主链中的β-(1→3)-糖苷键与免疫调节作用有关,而支链末端连接的α-或β-连接的Manp残基可启动先天免疫,从而发挥免疫调节、抗炎、抗肿瘤等功效[84-85]。
李倩[16]分离纯化出的3种山药多糖组分(HSY-I、HSY-II、HSY-III)中,组分II和组分III都含有1→3类糖苷键,HSY-II具有一定的降糖作用,而HSY-III却无降血糖的功效,说明仅具备1→3活性功能键的一级结构单元对其活性的影响不大,而多糖中的高级结构如双螺旋、三螺旋结构对其活性具有重要影响,因此研究山药多糖的高级结构对其活性具有重要意义[16]。
4 结 语
由于山药多糖无毒性,单糖组成复杂、结构独特且具有免疫调节、抗衰老、抗氧化、降血糖、降血脂等多种生物活性,使其在保健食品、化妆品和制药等领域具有广阔的应用前景。目前对山药多糖中单糖组成及分子质量、一级结构的研究较多,而对高级结构的研究甚少,尽管山药多糖在结构与生物活性及作用机制的研究中取得了一定的进展,但因多糖结构的复杂性、不规律性及分子质量的分散性,极大增加了山药多糖高级结构鉴定的难度,使得山药多糖分子结构与其生物活性之间的关系仍不明确。此外,因山药多糖发挥其生物活性的作用机制是多途径、多靶点、多效应的,目前虽已有大量文献报道了山药多糖的生物活性及作用机制,但报道的主要是抗氧化、免疫调节、降血糖的作用机制,其他活性机制还有待深入研究。
为了更加有效地开发利用山药多糖,今后可在传统技术的基础上创新、完善分析方法,明确山药多糖的高级结构,深入探究其与生物活性间的关系。对于化学修饰方面,可深入探究硫酸化修饰过程中,硫酸基团的取代位置、取代数量及与生物活性间的关系,同时在硫酸化修饰的基础上衍生出其他化学修饰方法并探究其与硫酸化修饰的异同及对山药多糖生物活性的影响。另外也可从分子结构及作用机制上寻找山药多糖与其生物活性之间的作用规律,探究山药多糖的新型活性,从而为开发相关功能产品提供理论基础。
