益生菌在改善阿尔茨海默病中的研究进展
2022-12-30贾龙刚王远望耿伟涛王艳萍
贾龙刚,王远望,方 伟,耿伟涛,王艳萍
(天津科技大学食品科学与工程学院,天津 300457)
近年来,随着人类寿命的延长,人口老龄化问题日益严峻,多种疾病对中老年人的生存、生活质量产生了严重影响,其中神经系统疾病是最普遍的老年性疾病之一,包括阿尔茨海默病、帕金森综合征等[1-2]。阿尔茨海默病(Alzheimer’s disease,AD)又称老年痴呆症,是目前世界上影响范围广、患病人数多的一种神经退行性疾病[3]。据国际失智症协会报道,目前全球范围内约有超过5 500万人患有痴呆症,预计2050年总患病人数将达到1.52亿,平均每3 s就有一人患病[4]。据统计,我国已有1 000多万AD患者,总量居世界第一,且是患病人数增长最快的国家之一[5]。由此可见,我国的AD形势尤为严峻,探究AD的发病机制,并基于此开发防治AD的药品或功能性食品及相应治疗方案,是解决该困境的有效途径。
AD的发病机制十分复杂,目前仍未完全解析,存在多种致病假说,例如淀粉样蛋白级联假说、神经炎症假说、线粒体损伤假说等[6-8]。近年来,随着“微生物-肠-脑轴”概念的提出,大量研究表明肠道菌群是调节肠-脑功能的关键之一[9]。自主神经系统的交感神经和副交感神经分支可影响肠神经系统回路,导致肠道运动性改变,从而影响抗性淀粉、膳食纤维等益生元或其他肠道关键微生物的营养物质进入小肠和结肠,进而影响肠道微生态的平衡[10]。另外,下丘脑-垂体-肾上腺(hypothalamicpituitary-adrenal,HPA)轴可通过刺激分泌肾上腺皮质激素,影响肠道菌群的定植和组成[11-12]。反之,肠道微生物及其代谢产物可通过调节小胶质细胞和星形胶质细胞的成熟和功能,介导神经生理过程,包括神经发育、神经传递、中枢神经系统的免疫激活、血脑屏障的完整性等[13]。同时,肠道菌群及其代谢产物,如短链脂肪酸(short chain fatty acids,SCFAs)、γ-氨基丁酸(gammaaminobutyric acid,GABA)、脑源性神经营养因子(brain-derived neutrophic factor,BDNF)等,通过调节外周免疫反应对神经炎症、神经损伤和大脑行为产生重要影响[14-15]。因此,调节和干预肠道微生物的组成和功能,是改善神经系统疾病及开发相应预防和治疗方法的新途径。
益生菌是一大类对人体有益的、活的微生物,包括乳酸菌、双歧杆菌等,能够通过调节肠道微生态的平衡来发挥益生作用。多项研究表明,摄入某些特定益生菌可通过肠-脑轴有效预防和改善AD,潜在的作用机制包括调节肠道微生态,调节色氨酸等关键物质代谢,促进神经递质及其他有益代谢产物的释放,降低肠道通透性和机体炎症等(图1)[16-18]。另外,益生菌发酵食品、发酵中药,或益生菌联合其他药物共同用于治疗AD也逐渐受到越来越多的关注。由益生菌衍生出来的益生元、后生元、合生元等同样在食品、医学、生物工程等领域广泛应用。本文对近5 年来单种益生菌、多种益生菌复配菌剂、益生菌发酵食品或益生菌联合其他药物用于改善AD的研究进展进行了综述,概述了相关实验方法、作用效果及潜在的分子机制,并提出了益生菌及其产品在预防和治疗AD中的发展前景、存在的问题与挑战。

图1 益生菌通过肠-脑轴改善AD的潜在作用机制示意图Fig. 1 Schematic diagram of the potential mechanism by which probiotics alleviate AD through the gut-brain axis
1 单种益生菌用于改善AD
作为一种活的功能性微生物,益生菌对于AD的功效逐渐被开发,包括体外指标检测、动物模型分析和临床试验等[19]。表1整理了近年来单种益生菌在防治AD中的应用,其中,植物乳杆菌和双歧杆菌是研究和应用最广泛的单种菌株。Song Xinping等[20]通过D-半乳糖和AlCl3联合处理构建AD小鼠模型,经灌胃植物乳杆菌DP189干预10 周后,AD小鼠的认知紊乱得到明显改善,显著增加了血清中5-HT、多巴胺(dopamine,DA)、GABA的含量,降低了脑内神经元损伤、Aβ沉积和微管相关蛋白tau蛋白病理损伤,同时通过调节磷脂酰肌醇3-激酶/蛋白激酶B/糖原合成酶激酶-3β(phosphoinositide 3-kinase/protein kinase B/glycogen synthase kinase 3β,PI3K/Akt/GSK-3β)信号通路降低tau蛋白的过度磷酸化,从而发挥改善AD的作用。植物乳杆菌MTCC1325同样具有缓解AD模型大鼠的行为学损伤,减少脑内Aβ沉积和乙酰胆碱含量的功能[21]。该研究的局限性在于仅讨论了AD相关的动物形态学、行为学、胆碱能和组织学方面,其他参数包括各种生化指标和关键基因表达的变化还需进一步研究。在另一项研究中,研究者分别分析了3种不同的益生菌,植物乳杆菌DR7、发酵乳杆菌DR9和干酪乳杆菌对转基因AD果蝇的神经保护作用,其中植物乳杆菌DR7改善AD果蝇眼睛粗糙表型的效果最明显,通过16S rRNA测序发现植物乳杆菌DR7能够显著降低AD果蝇肠道菌群中Wolbachia的丰度,提高Stenotrophomonas和Acetobacter的丰度,因此作者推测Stenotrophomonas和Acetobacter丰度与AD患病率呈负相关,而Wolbachia可能是AD、帕金森病等神经退行性疾病的潜在靶标[22]。该研究首次将Wolbachia菌与神经性疾病相联系,有助于人们从抑制肠道有害菌来预防和治疗神经性疾病。Cogliati等[23]探究了枯草芽孢杆菌NCIB3610对转基因AD线虫的神经和行为学保护作用,研究发现该菌株能显著缓解线虫与AD相关的麻痹表型,恢复线虫的寿命水平。在群体感应肽合成和肠道相关生物膜形成方面的能力,可能是枯草芽孢杆菌发挥抗AD益生作用的关键。
短双歧杆菌A1也能显著逆转AD模型小鼠的认知障碍,小鼠肠道内容物转录组测序结果显示,双歧杆菌A1抑制了AD小鼠海马中免疫应激过程中相关基因的表达,而对野生型小鼠无明显影响。16S rRNA测序分析发现补充双歧杆菌A1不影响AD小鼠肠道菌群组成,但显著提高了血浆中SCFAs含量,如醋酸。同时,研究者进一步分别检测了灭活短双歧杆菌A1和醋酸盐对AD小鼠认知障碍的作用,发现其都具有一定的缓解效果,因此推测短双歧杆菌A1的抗AD功效可能主要依赖于其菌体成分和代谢产物醋酸盐的作用[24]。该研究局限性是所用的模型未能完全体现AD病症常规的生理指标,例如Aβ沉积等,作者主要集中在动物行为学分析和炎症检测,未探讨短双歧杆菌A1能否抑制Aβ的积累,这可能是该研究后期需进一步解决的问题。基于短双歧杆菌A1的抗AD功能,多位研究者开展了一系列随机、双盲临床试验,证明补充该菌的神经保护作用,尤其是改善老年人记忆损伤患者的瞬时记忆,提高简易精神状态测验总分[25-27]。除短双歧杆菌外,Lee等[28]从人类肠道中分离出一株长双歧杆菌NK46,经口服NK46 2个月后,转基因5×FAD-Tg小鼠的认知障碍明显得到改善,肠道菌群中变形菌门的丰度显著降低,血液和粪便中的脂多糖(lipopolysaccharide,LPS)含量降低。免疫反应研究结果显示,长双歧杆菌NK46能有效抑制核因子κB(nuclear factor κB,NF-κB)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子的表达,从而达到抑制神经炎症的作用。同时,也进一步证明了诱发神经精神障碍的应激源可通过调节HPA轴导致肠道菌群失调,肠道菌群紊乱及产生过量的内毒素可能导致内毒素血症和系统性炎症,进而通过肠-脑轴引起神经性疾病。
丁酸梭菌是一种高产丁酸及丁酸盐的益生菌,可通过调节肠道微生态,增加丁酸盐等有益代谢产物的产量,有效改善淀粉样前体蛋白/早老蛋白1(amyloid-β protein precursor/presenilin 1,APP/PS1)转基因AD小鼠的认知障碍,减少脑内Aβ沉积、抑制小胶质细胞激活,并降低TNF-α、白细胞介素(interleukin,IL)-1β等炎症因子的释放,从而发挥改善AD的功能。体外Aβ寡聚体诱导的小胶质细胞模型实验结果显示,丁酸盐能降低分化簇分子11b(cluster of differentiation 11b,CD11b)和环氧化酶-2(cyclooxygenase 2,COX-2)表达,通过抑制NF-κB信号通路来降低炎症[29],另外,相较于AD模型小鼠,补充丁酸梭菌小鼠的肠道菌群丰度略微降低,说明更多的微生物数量并非健康肠道的绝对标准,肠道菌群丰度增加可能是由于各种有害细菌或古生菌的过度生长造成的。在另一项研究中,作者利用LPS诱导的认知障碍模型和APP/PS1转基因AD小鼠模型,首次分析了一株来源于人的产丁酸无杆菌的功能,明确指出该菌可通过抑制Akt/GSK-3β和胰岛素样生长因子(insulin-like growthfactor,IGF)-1信号通路来抑制炎症,进而发挥改善AD的功能[30]。以上研究体现了SCFAs及相关盐类,尤其是丁酸、丁酸盐分子在改善AD方面的巨大潜力。嗜黏蛋白阿克曼菌在肠道内的丰富程度与人体健康密切相关,是近年来益生菌研究的热点,包括抗癌、降脂、抗糖尿病等。Ou Zihao等[31]发现嗜黏蛋白阿克曼菌GP01具有保护肠道屏障、延缓脑内病理变化、改善空间学习和记忆的功能。本课题组前期也挖掘、鉴定了多个具有抗AD潜力的益生菌,包括植物乳杆菌MA2、马乳酒样乳杆菌ZW3等,从抗炎抗氧化、调节脂质代谢、改善抑郁症、调节肠道微生态等方面对各菌株进行了系统的分析,为新型益生菌通过肠-脑轴防治神经性疾病的研究提供借鉴[32-33]。

表1 单种益生菌用于改善ADTable 1 Single-strain probiotics for improving AD
通过基因工程、遗传工程构建的基因工程益生菌也逐渐应用于改善AD的研究中,例如基因工程乳酸乳球菌MG1363-pMG36e-GLP-1能高产胰高血糖素样肽-1,补充MG1363-pMG36e-GLP-1能有效改善由LPS引起的空间学习和记忆障碍,减少模型小鼠脑内Aβ沉积,并能通过下调Toll受体4(toll like receptor 4,TLR4)/NF-κB信号通路和上调Akt/GSK-3β信号通路降低炎症。16S rRNA测序结果显示,补充基因工程益生菌后减少了小鼠肠道内肠球菌和变形菌的丰度,增加了嗜黏蛋白阿克曼菌的丰度[34]。Cecarini等[35]构建了一株基因工程乳酸乳球菌P62,经口服该基因工程菌,转基因AD小鼠的空间记忆损伤得到明显改善,脑内淀粉样蛋白沉积显著减少,同时降低了TNF-α、IL-1β等炎症因子的表达。然而由于其改善AD的作用较复杂,具体的炎症信号通路还未明确指出。
2 多种益生菌复配用于改善AD
多种益生菌复配制成联合菌剂应用于食品工业中较为常见,同样也广泛应用于防治AD的动物或临床研究中(表2)。据一项汇总分析研究报道,16 项研究直接对比了单菌种和多菌种对健康的促进作用,其中12 项研究表明多菌种的效果更好[36]。有学者利用宏基因组测序法分别评价了3 株植物乳杆菌(Lp-6、P-8和P9),以及由这3 株益生菌复配组成的联合菌剂对健康大鼠肠道菌群的调节作用,结果表明,与单菌株相比,补充多菌株菌剂对大鼠肠道菌群的重塑作用效果更加明显,尤其是提高了肠道微生物群落及其群落结构的多样性[37]。而肠道微生物之间错综复杂的相互联系,使得相对于单菌株,补充多菌株菌剂更能影响其他微生物之间的相互作用。而且相较于单菌株,多菌株益生菌还可能在其他几个方面发挥功能:1)增强关键物质的代谢过程;2)更有效地限制某些潜在促炎菌株的生长,抗炎能力更强;3)促进更多肠道有害成分的降解。乳杆菌和双歧杆菌复配是最常见的用于改善AD研究的复配菌剂。例如植物乳杆菌和两歧双歧杆菌组成的复配菌剂,通过8 周的灌胃处理,并配合中等强度间歇训练,AD模型大鼠的短时记忆损伤得到显著改善,胆碱乙酰转移酶(choline acetyltransferase,ChAT)、BDNFmRNA的转录水平明显升高,进而发挥神经保护作用[38]。这项研究的独特之处在于设计了一种益生菌与运动训练相结合的治疗方案,并起到了显著的效果,但并未明确指出联合疗法对小鼠肠道菌群的影响及炎症反应的作用。针对调节炎症反应,Mohammadi等[39]利用LPS诱导的AD大鼠模型,灌胃2 周瑞士乳杆菌R0052和长双歧杆菌R175组成的联合菌剂后,AD大鼠的记忆损伤得到显著缓解,并提高了BDNF的表达,降低了血清中TNF-α、IL-1β等炎症因子的含量。除乳杆菌和双歧杆菌的组合外,Guilherme等[40]分析了由嗜酸乳杆菌和鼠李糖乳杆菌组成的复配菌剂对5×FAD(B6SJL)转基因AD小鼠的神经保护作用,结果显示,虽然复配菌剂未明显改善AD小鼠的筑巢行为,但重塑了肠道菌群组成,减少了海马中Aβ沉积,一定程度缓解了AD病症。而在该研究中,作者并未明确阐明补充复合菌剂后,肠道菌群和特定代谢产物的变化情况,以及肠道微生态的变化与AD之间的关系,这可能是该工作将来需要进一步讨论的方向。在最新的一项利用两种益生菌进行的双盲临床试验中,两歧双歧杆菌BGN4和长双歧杆菌BORI组成的联合菌剂能显著改善受试者的认知障碍,提高受试者血清中BDNF的含量,同时发现受试者肠道菌群发生了明显变化,尤其是真杆菌属和梭杆菌,其丰度与BDNF的含量呈负相关[41]。
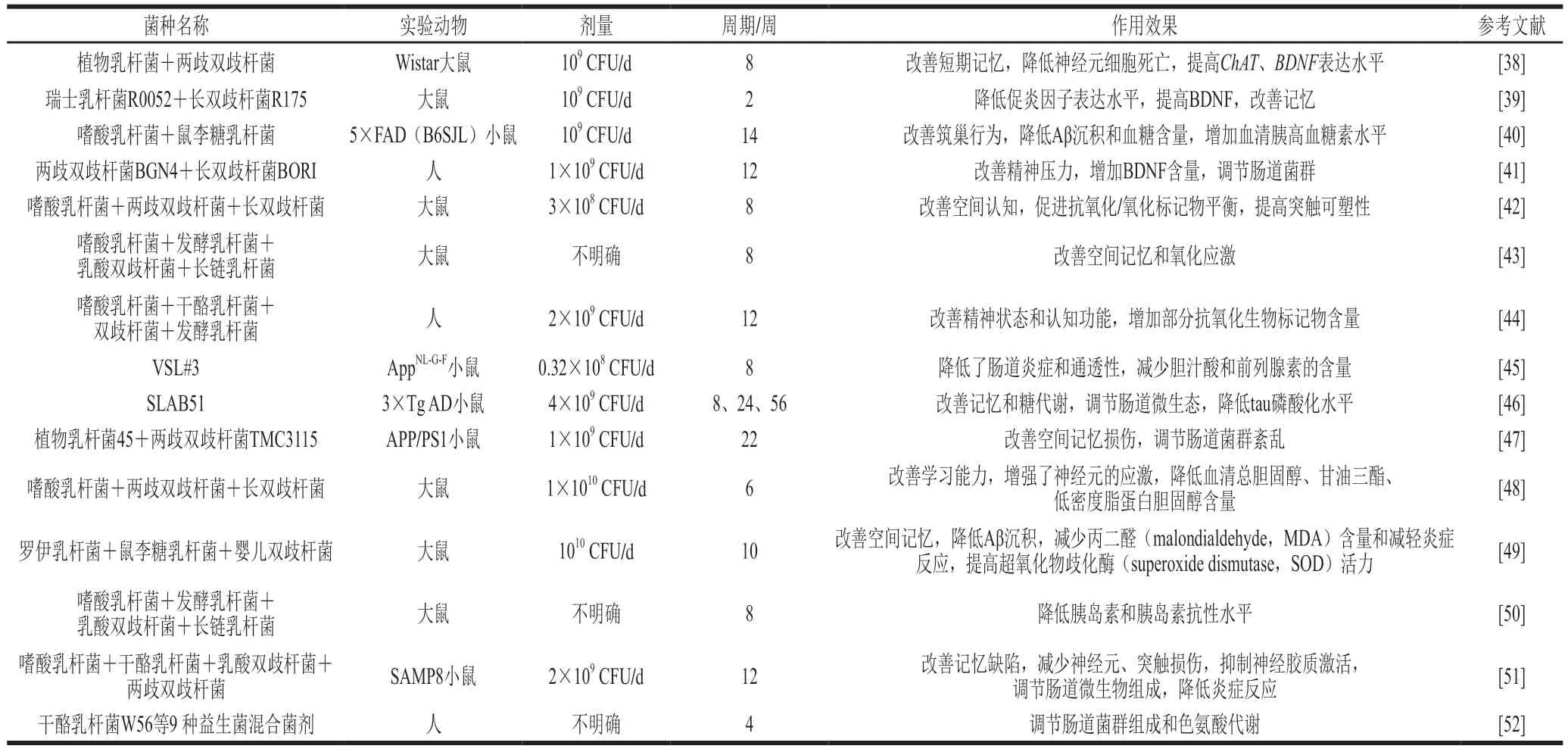
表2 多种益生菌复配用于改善ADTable 2 Multi-stain probiotics to improve AD
相对于由两种益生菌组成的复配菌剂,由3种及以上益生菌组成的菌剂更为常见。Rezaei等[42]发现由嗜酸乳杆菌、两歧双歧杆菌和长双歧杆菌3种益生菌组成的复配菌剂能有效改善AD模型大鼠的空间记忆和认知障碍,显著减少脑内Aβ沉积,调节抗氧化剂与氧化剂的平衡。该研究首次利用区域兴奋性突触后电位检测法,发现复合菌剂能有效恢复突触的可塑性,这也为分析其他功能性分子或治疗手段对AD的改善效果提供了新的思路。由嗜酸乳杆菌、发酵乳杆菌、乳双歧杆菌和长链乳杆菌4种益生菌组成的复配菌剂能显著改善AD模型大鼠的空间记忆损伤,减少了海马组织内淀粉样斑块的沉积,同时也有效降低了氧化应激标记物MDA含量,提高了SOD表达水平[43],虽然作者利用菌落计数法检测了小鼠肠道内容物中乳杆菌和双歧杆菌的变化,但并未结合现代基因测序和组学分析手段系统解析补充联合菌剂对AD小鼠肠道微生态的影响,也未分析除乳杆菌和双歧杆菌外其他微生物的变化。也有将4种益生菌制成联合菌剂用于临床试验的研究,通过饮用添加了嗜酸乳杆菌、干酪乳杆菌、双歧杆菌和发酵乳杆菌复配菌剂的牛奶12 周后,AD患者的精神状态得到明显改善,对胰岛素、甘油三酯代谢具有良好的调节作用,而对氧化应激、炎症反应、血糖及其他指标并无显著作用[44]。该项临床试验也有一些局限性,例如采集受试者补充益生菌前后的粪便有一定的困难,仅根据简易精神状态检测法判定受试者的认知功能还不够精确。因此,结合更多的判定标准,可能有助于研究者建立益生菌与改善认知功能的联系。目前有一些由多种益生菌组成的联合菌剂已经上市,例如商业益生菌剂VSL#3由8种益生菌组成,同样具有抗AD的潜力,主要作用在于VSL#3能够改善小鼠肠道菌群失调导致的肠道炎症和黏膜损伤,增加血液和脑内的多种胆汁酸和类花生酸的含量,然而对脑内的淀粉样蛋白沉积、细胞因子水平或胶质细胞激活并无显著影响[45]。而另一种商业复合益生菌剂SLAB51的抗AD作用主要体现在抗炎症方面,可通过单磷酸腺苷依赖的蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)、IGF-I和胰岛素信号通路调节转基因AD小鼠的炎症反应和代谢紊乱,缓解认知障碍和记忆损伤[46]。
3 益生菌发酵食品或益生菌与其他药物联合用于改善AD
除益生菌自身用于改善AD外,益生菌发酵食品或益生菌与其他药物联合治疗也成为当今益生菌改善AD研究的热点(表3)。开菲尔是一种由乳酸菌、酵母菌发酵牛乳或羊乳酿制而成的传统发酵乳饮料。研究者通过颅内注射链脲霉素构建AD小鼠模型,灌胃不同剂量开菲尔发酵产物后,AD小鼠认知障碍得到明显改善,海马组织内乙酰胆碱含量、Aβ沉积、磷酸化哺乳动物雷帕霉素靶蛋白(phospho-mammalian target of rapamycin,p-mTOR)及tau蛋白的表达量显著降低,而胰岛素受体、胰岛素降解酶(insulin-degrading enzyme,IDE)、p-PI3K、p-Akt、p-GSK-3β的表达量明显提高,并且有效降低了链脲霉素引起的氧化应激。由此可见,开菲尔发酵产物主要通过改善胰岛素信号通路、激活PI3K/Akt、降低GSK-3β/mTOR信号通路降低tau蛋白的过度磷酸化,从而发挥抗AD效果[53],虽然该研究讨论了肠道菌群变化在抗AD过程中可能发挥了重要作用,但并未明确阐明补充开菲尔发酵产物后肠道菌群的变化情况,另外,该研究中开菲尔发酵产物的关键活性成分及其量效关系也是未来需要进一步解决的问题。而在另一项研究中,作者利用转基因AD果蝇模型,分析了开菲尔及其不同提取组分的对AD的神经保护作用,发现开菲尔的正丁醇提取物表现出最佳抗AD效果,16S rRNA测序结果表明开菲尔中丰度最高的益生菌为马乳酒样乳杆菌[54],作者不仅详细分析了开菲尔不同极性成分的抗AD效果,且根据溶剂的差异,预测了最可能的活性分子,为挖掘和解析混合物中抗AD关键分子提供了思路。除此之外,发酵乳杆菌或干酪乳杆菌发酵牛奶[55]、植物乳杆菌发酵大豆[56]都表现出抗AD的潜力,且在抗氧化、降低神经炎症方面具有重要的调节作用。

表3 益生菌发酵食品或益生菌与其他药物联合用于改善ADTable 3 Probiotics fermented foods or probiotics in combination with other drugs to improve AD
为增强已知抗AD药物或功能性分子的疗效,研究者们探索了益生菌与抗AD分子联合作用的效果。美金刚是一种治疗中、重度AD病症的已批准上市的药物,Wang Qiujun等[57]发现,分别补充植物乳杆菌ATCC8014、美金刚以及ATCC8014与美金刚的联合制剂后,APP/PS1转基因AD小鼠的短期认知障碍均得到一定程度的改善,海马组织中的Aβ沉积显著减少,神经元的完整性和可塑性得到有效保护。同时,联合制剂通过重塑肠道菌群组成,降低了三甲胺和氧化三甲胺的分泌和含量,发挥了缓解AD病理恶化的作用。而相较于益生菌和美金刚药物本身的作用,益生菌与美金刚的联合制剂对改善AD小鼠短期物体识别能力、空间学习记忆和主动回避反应的效果更好,由此可见,益生菌具有增强抗AD药物药效的潜力。鼠李糖乳杆菌增强姜黄素抗AD效果的研究进一步证明了上述观点,研究者利用东莨菪碱诱导AD小鼠模型,分别测试了姜黄素与鼠李糖乳杆菌UBLR-58联合制剂对AD小鼠的神经保护作用,结果显示鼠李糖乳杆菌UBLR-58不仅能增强姜黄素改善AD小鼠认知障碍和学习记忆效果,还能显著提高小鼠的抗氧化能力[58]。造成以上现象的原因可能是益生菌能合成和分泌多种特异性酶,例如葡萄糖醛酸酶、糖基化酶、羟基化酶等,这些酶可通过生物催化反应,将功能性分子转化成其他活性更高的分子,或转化成更易吸收的结构形式,从而增强其抗AD的效果。也有研究者将益生菌与其他食品功能因子共同作用,分析其抗AD功能。FRAMELIM®是一种由长双歧杆菌、嗜酸乳杆菌、鱼油和多种维生素组成的混合制剂,研究者利用APP/PS1转基因小鼠模型,分析了补充FRAMELIM®配合运动对AD病症的改善作用,结果显示单独使用FRAMELIM®或运动对AD小鼠的神经损伤无明显作用,而两者结合的疗法能有效缓解AD小鼠的记忆损伤,减少脑内Aβ沉积、小胶质细胞的激活和碱基切除修复酶的表达,并能调节肠道菌群组成,增加了高产SCFAs有益菌(如约氏乳杆菌等)的丰度,从而首次证明运动辅助益生菌产品能通过调节肠道微生态来干预AD的进展[59]。然而,为更全面探究该联合疗法的作用机制,具体的炎症因子和生化指标需进一步分析。硒是人体必需的微量营养元素,缺乏硒是导致克山病的重要原因。Tamtaji等[60]利用3种益生菌与硒联合用于临床治疗AD的研究,联合用药12 周后患者的认知障碍和代谢紊乱得到明显改善。综上所述,益生菌确实具有增强药物或功能因子活性的潜力,这种联合疗法可能会成为将来防治AD的有效途径。
4 益生菌在防治AD中存在的问题与挑战
虽然已报道了多项益生菌改善AD等神经性疾病方面的研究,然而目前该领域仍处于初级研究阶段,我国还未有任何关于益生菌可用于治疗疾病的官方声明。也有一些报道将益生菌的使用与某些病理症状联系起来,包括过敏、腹泻、抗生素耐药性等,这些风险可能导致老年人、重症AD患者或免疫缺陷患者在使用益生菌时引起其他并发症。由于肠道微生态的复杂性和研究方法的困难性,目前真正进行到临床阶段的研究还较少[62]。而在临床试验过程中,由于受试者的性别、个人身体状况、自身其他疾病等方面存在个体差异,益生菌用于防治AD的量效关系仍需进一步的研究,并且采取益生菌治疗AD时需考虑患者的严重程度,因其并未药物,所以并不适用于重病AD患者[63]。同时,对于人类体内微生物种群的鉴定仍处于初级阶段,微生物群落与机体代谢、基因之间复杂的相互作用机制还未完全解析,阻碍了以益生菌-肠-脑轴为靶点治疗AD的研究进展。另外,目前已知可用于预防和治疗AD的益生菌菌种较少,来源匮乏,这些都是目前益生菌在防治AD中存在的问题和挑战。
总的来说,目前大量的动物、临床研究表明,益生菌本身及其代谢产物可通过调节免疫反应、肠道微生态平衡、抗氧化等途径改善AD等神经退行性疾病。同时,益生菌可作为佐剂,提高其他药物的抗AD疗效。益生菌作为缓解AD的潜在选择,需要精心设计和进行大量临床研究,以确保其安全、高效、特异性地发挥防治作用。利用现代食品、生物工程学技术,挖掘和拓展新一代益生菌及配套的研究方法,阐明其调节肠道微生态和改善AD的内在分子机制,并以此为理论基础,开发新型药物和治疗方法是未来防治AD的重要方向。
