野生葛根与栽培葛根对慢性酒精中毒小鼠的护肝作用比较
2022-12-30盖永强陈铁军朴美子
姚 媛,盖永强,陈铁军,王 喆,朴美子,2,*
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.青岛海军食品与营养创新研究院(青岛特种食品研究院),山东 青岛 266109)
酒精性肝损伤定义为长期或过量摄入酒精引起的肝脏损伤[1-2]。通常是由于长期饮酒,使肝脏持续处于被酒精刺激的状态,导致肝脏功能逐渐下降,出现肝硬化、酒精肝等疾病,进而会导致脂质代谢紊乱、免疫功能下降,最终多器官、系统出现疾病,甚至危及生命[3]。世界上各个国家肝硬化患者中有近一半是由于大量饮酒导致[4],长期大量饮酒对人体的损伤不容忽视。
葛根(Pueraria lobataOhwi)为豆科植物野葛或粉葛干燥后的根[5],是药食同源植物,最早记载于《神农本草经》,具有较高的药用价值[6]。野生葛根和栽培葛根中均含有一定量的葛根素和异黄酮等功能性成分[7],具有良好的抗氧化、解酒护肝和降血糖等功效[8-9],能够缓解大量饮酒时酒精对肝脏的损伤。研究表明葛根素对小鼠急性酒精中毒有一定功效,能有效降低血液中乙醇含量,缩短小鼠醒酒时间[10-11]。
目前,大多数研究是针对同一葛根的不同部位(葛根、葛花)或单一葛根进行解酒护肝活性研究,而对比野生葛根和栽培葛根在缓解酒精性肝损伤方面差异的研究较少。鉴于此,本实验以野生葛根和栽培葛根为研究对象,对野生葛根和栽培葛根中基本成分进行分析,建立小鼠慢性酒精性肝损伤模型,对比不同剂量的野生葛根和栽培葛根对小鼠肝组织和血液中转氨酶、脱氢酶、抗氧化指标和炎症信号指标影响的差异,以期为后续基于野生葛根和栽培葛根开发解酒护肝产品提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
昆明种SPF雄性小鼠,8 周龄,体质量(25±2)g,购自青岛大任富城畜牧有限公司,生产许可证号:SCXK(鲁)2019-0003。
野生葛根粉和栽培葛根粉均购自连云港市葛花葛藤粉食品有限公司,产地为江苏省连云港市,生长年限为2~3 年;乙醇体积分数56%红星二锅头 北京红星股份有限公司。
葛根素标准品 北京索莱宝科技有限公司;复方鳖甲软肝片 内蒙古福鸡医疗科技股份有限公司;石蜡、苏木精、伊红 上海吉至生化科技有限公司;乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)检测试剂盒 南京建成生物工程研究所;一氧化氮(NO)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)和IL-10酶联免疫吸附测试试剂盒 上海通蔚实业有限公司。
1.2 仪器与设备
U3000型高效液相色谱(high performance liquid chromatography,HPLC)仪 美国赛默飞世尔科技公司;ELx808酶标仪 美国BioTek公司;TGL-16M型高速冷冻离心机 湘潭湘仪仪器有限公司;索氏提取器连云港光威石英制品有限公司;切片机 天美(中国)科学仪器有限公司;BX53型正置荧光显微镜 奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 野生葛根和栽培葛根中成分含量的测定
参考GB/T 22251—2008《保健食品中葛根素的测定》,采用HPLC法测定葛根素质量分数;参考DB32/T 1277—2008《葛根中异黄酮含量的测定》,采用紫外分光光度法测定异黄酮质量分数;参考GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》,采用直接滴定法测定还原糖质量分数;参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》,采用灼烧法测定灰分质量分数;参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》,采用索氏抽提法测定脂肪质量分数。参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,采用分光光度法测定蛋白质量分数;参考GB 5009.9—2016《食品安全国家标准 食品中淀粉的测定》,采用酶水解法测定淀粉质量分数。
1.3.2 野生葛根和栽培葛根溶液的制备
购买的野生葛根粉与栽培葛根粉每日建议食用量为25 g,根据基于体表面积折算法的动物与人类等效剂量换算,成人体质量以70 kg计,可换算出小鼠每天摄入量为3.25 g/kgmb,以此剂量为基准[12],设计野生葛根和栽培葛根低、中、高剂量分别为3.3、10、30 g/(kgmb·d)。取适量葛根粉,加入不同量85 ℃的水配制成低、中、高剂量的葛根粉溶液,备用。
1.3.3 小鼠的分组及饲喂
将SPF级小鼠随机分成9 组,分别为空白组(CK)、阳性组(PC)、模型组(MC)及野生葛根低(WP-L)、中(WP-M)、高剂量组(WP-H),栽培葛根低(CP-L)、中(CP-M)、高剂量组(CP-H)。每组12 只,适应性饲养7 d。
空白组和模型组灌胃与给药组等体积的生理盐水,阳性组灌胃复方鳖甲软肝片(0.78 g/(kgmb·d)),野生葛根低、中、高剂量组给药量分别为3.3、10、30 g/(kgmb·d),30 min后,除空白组,其余组均灌胃乙醇体积分数56%白酒,灌胃剂量均为10 mL/(kgmb·d)。栽培葛根低、中、高剂量组灌胃方式同野生葛根组。实验期间,小鼠每7 d称量1 次体质量,并按体质量调整给酒及给药体积,灌胃11 周。
1.3.4 血清指标测定
小鼠末次灌胃后,禁食12 h,眼球取血于离心管内,4 ℃、3 000 r/min离心15 min,取上层血清,分装后4 ℃冷藏备用。使用相应试剂盒检测血清中ALT、AST、ALDH和ADH活力,其中ALT、AST结果以蛋白质量计。
1.3.5 肝脏指标测定
小鼠断颈处死并解剖,取肝脏,一半肝组织放入10%福尔马林固定液中保存,备用。剩余肝组织利用研磨器加生理盐水制备质量分数10%的肝组织匀浆。离心取上清分装后,按照试剂盒说明书的方法测定肝脏组织中ALT、AST、CAT、GSH-Px、NO、TNF-α、IL-1β和IL-10水平。ALT、AST、CAT、GSH-Px活力及NO含量以蛋白质量计。
1.3.6 小鼠肝组织切片观察
将固定好的小鼠肝脏取出,选择结构完整的部分切取约0.5 cm厚薄片,于流水下冲洗24 h,在45 ℃恒温箱中用梯度体积分数乙醇溶液脱水。脱水完成后用二甲苯透明处理,并进行石蜡切片制作,完成后进行苏木精-伊红(hematoxylin eosin,HE)染色并观察[13-14]。
1.4 数据处理与分析
采用SPSS Statistics 24.0软件进行数据统计分析,结果以表示;采用Duncan法进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 野生葛根和栽培葛根中成分含量测定
由表1可知,野生葛根中的葛根素、异黄酮、脂肪和蛋白质量分数均显著高于栽培葛根(P<0.05),分别高出26.31%、25.63%、41.31%、25.00%;野生葛根中灰分和淀粉的含量显著低于栽培葛根(P<0.05)。野生葛根中还原糖质量分数为6.57%,与栽培葛根相差较小,无显著差异(P>0.05)。

表1 野生葛根与栽培葛根中基本成分比较Table 1 Analysis of basic components in wild and cultivated kudzu root
野生葛根与栽培葛根在主要成分含量上有一定差异,这与两种葛根生长环境、栽培方式的不同有关,属于正常现象。后续实验进一步验证主要成分含量是否会影响其功能特性。
2.2 野生葛根和栽培葛根对小鼠血清和肝脏中转氨酶活力的影响
由表2可知,与空白组相比,模型组小鼠长期受酒精的刺激,血清中AST、ALT水平显著升高(P<0.05)。与模型组相比,野生葛根组和栽培葛根各剂量组小鼠血清中AST和ALT水平均显著降低(P<0.05),表明野生葛根和栽培葛根对于受长期酒精刺激的小鼠血清中AST、ALT活力具有一定的稳定作用,使其在受刺激时保持稳定状态。综合比较,中剂量野生葛根组和栽培葛根效果更佳,且野生葛根的保护效果优于栽培葛根。
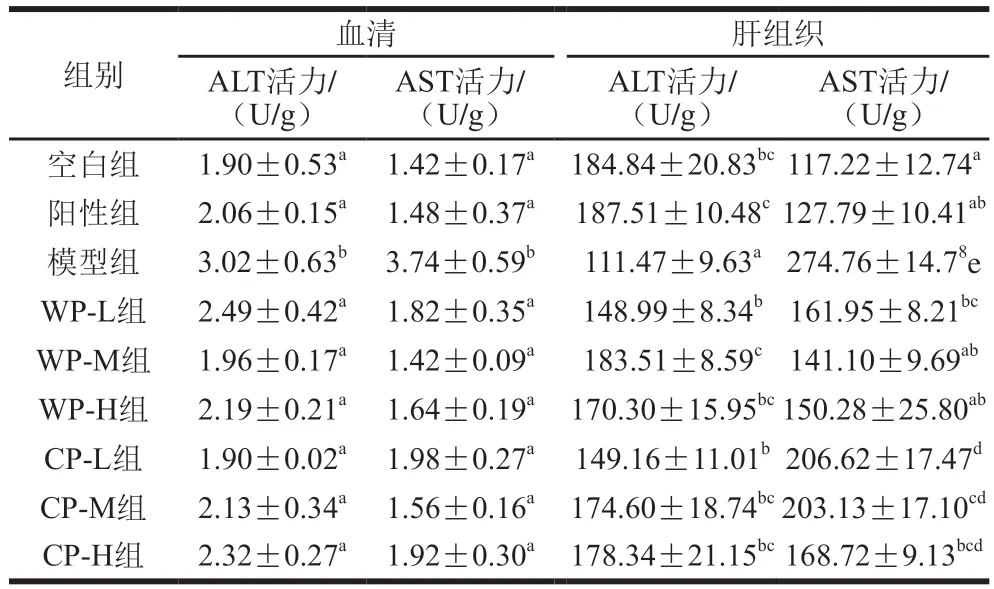
表2 葛根对小鼠血清和肝组织中转氨酶活力的影响Table 2 Effect of kudzu root on the activity of transaminase in serum and liver of mice
模型组小鼠肝组织中ALT活力较正常组显著降低(P<0.05),AST活力显著增加(P<0.05),中剂量的野生葛根能够有效减轻酒精对肝组织的损害,使肝脏AST和ALT活力保持在正常水平。
2.3 野生葛根和栽培葛根对小鼠血清中脱氢酶活力的影响
人体内对酒精起分解作用的关键酶是ADH和ALDH[15-16]。如表3所示,在长期酒精刺激下,阳性组、WP-M、WP-H组小鼠ADH活力仍具有较高水平,与空白组相当(P>0.05),说明阳性药物和中、高剂量的野生葛根对肝脏起到了良好的保护作用,能够稳定ADH活力,且中、高剂量野生葛根的功效能达到阳性药物水平;CP-M、CP-H组小鼠ADH活力与模型组相比显著提升(P<0.05),说明中、高剂量的栽培葛根同样具有良好的稳定ADH活力的作用,但效果不及野生葛根组。模型组小鼠血清中ALDH活力显著低于其他各组(P<0.05)。这是由于模型组小鼠长期受到酒精刺激,且无药物辅助治疗,肝组织损伤严重、功能下降,出现病症,导致血清ALDH活力显著降低;在同样受到酒精刺激的情况下,小鼠在阳性药物及一定剂量葛根作用下,ALDH活力能够恢复至正常水平,与空白组无显著差异(P>0.05)。综合来看,中等剂量野生葛根的保护效果最佳。
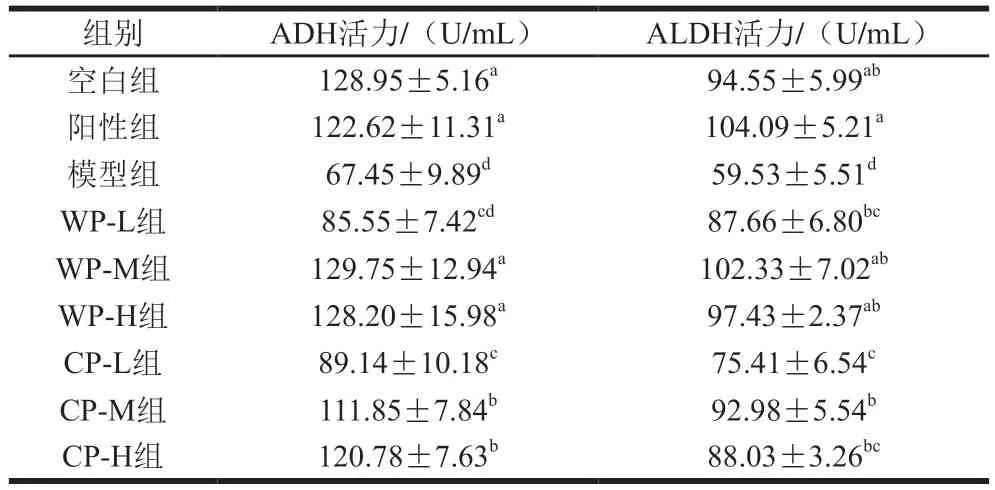
表3 葛根对小鼠血清中ADH和ALDH活力的影响Table 3 Effect of kudzu root on the activity of alcohol dehydrogenase and acetaldehyde dehydrogenase in serum of mice
2.4 野生葛根和栽培葛根对小鼠肝组织中抗氧化酶活力的影响
如表4所示,模型组小鼠肝组织中CAT活力显著低于空白组和其他实验组(P<0.05);与模型组相比,野生葛根和栽培葛根各剂量组CAT活力均显著升高(P<0.05);WP-M、CP-L组CAT活力与正常组无显著差异(P>0.05)。模型组小鼠肝组织匀浆中GSH-Px活力与空白组相比均显著降低(P<0.05);与模型组相比,WP-M、WP-H、CP-L、CP-M和阳性组GSH-Px活力均显著提高(P<0.05),与正常组无显著差异(P>0.05)。说明葛根对慢性酒精损伤小鼠肝组织中GSH-Px活力有一定的提升作用,在一定程度上能减轻酒精对肝脏的损伤作用。

表4 葛根对小鼠肝组织中CAT和GSH-Px活力的影响Table 4 Effect of kudzu root on catalase and glutathione peroxidase in liver of mice
2.5 野生葛根和栽培葛根对小鼠肝组织中炎症信号传导的影响
如表5所示,模型组小鼠肝组织中NO含量为4.65 mmol/g,显著高于空白组及其他实验组(P<0.05);进一步验证模型建立成功。实验组小鼠虽长期受到酒精刺激,但在阳性药物和相应剂量葛根的保护作用下,肝脏未出现功能受损的情况,NO含量均较模型组显著降低;低、中剂量的野生葛根和栽培葛根对NO含量有稳定作用,但效果不明显,与空白组相比差异显著(P<0.05);高剂量野生葛根和栽培葛根组小鼠肝组织中NO含量与空白组差异不显著(P>0.05)。
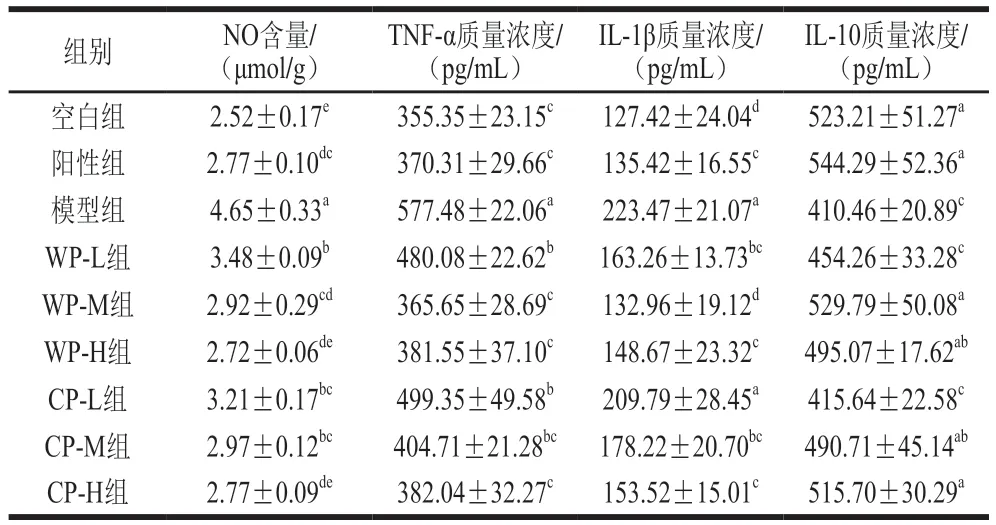
表5 葛根对小鼠肝组织中NO、TNF-α、IL-1β和IL-10水平的影响Table 5 Effect of kudzu root on NO, TNF-α, IL-1β and IL-10 levels in liver of mice
模型组小鼠肝组织中TNF-α质量浓度与空白组相比显著升高(P<0.05);WP-M、WP-H、CP-H组小鼠受到长期酒精刺激后,通过一定剂量葛根的干预,肝组织TNF-α质量浓度与模型组相比分别降低了37.63%、34.92%、34.83%,且接近正常组(P>0.05)。
模型组小鼠长期灌胃酒精且不采取任何治疗,导致肝功能受损,其肝组织中TNF-α质量浓度升高,引发炎症,导致IL-1β质量浓度显著升高(P<0.05);与模型组相比,WP-L、WP-M、WP-H、CP-M和CP-H组IL-1β质量浓度显著降低(P<0.05),且WP-M组恢复至正常水平。
与空白组比较,模型组小鼠肝组织中IL-10质量浓度显著降低(P<0.05);与模型组相比,WP-M、WP-H、CP-M和CP-H组IL-10质量浓度均显著升高至接近正常水平(P<0.05)。
2.6 小鼠肝组织切片染色结果
由图1可以看出,各组小鼠肝组织HE染色后呈现出不同的结构特征。空白组小鼠肝组织细胞排列规则整齐,细胞间空隙均匀,胞质丰富,细胞核圆润、位于细胞中央,无病症现象。模型组小鼠肝组织出现严重病理改变,细胞形态不规则,排列杂乱,细胞间隙不均匀,出现挤压,细胞核仁增大,挤压堆叠,细胞边缘不规则,甚至出现细胞破碎现象。这是由于长期酒精刺激加重了肝脏的负担,使模型组小鼠肝脏出现病变。阳性组、WP-M、WP-H和CP-H组小鼠肝组织切片与空白组较为接近,细胞边缘平滑,核仁大多位于细胞中央,细胞无肿大及破损现象,说明一定剂量的葛根对于慢性酒精刺激下的肝脏有保护功效。WP-L、CP-L、CP-M组呈现出轻微病变,肝细胞轻度肿胀,部分细胞胞浆溢出,细胞边缘不规则。
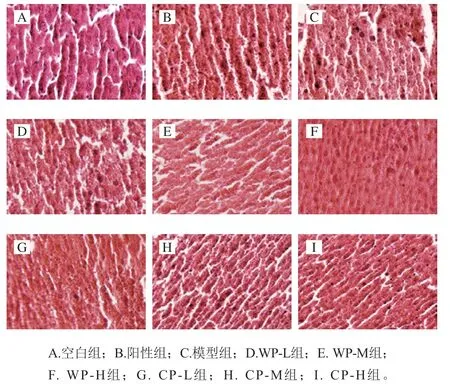
图1 小鼠肝组织切片HE染色结果(×400)Fig. 1 Results of HE staining of liver tissue in mice (× 400)
3 讨 论
野生葛根和栽培葛根对慢性酒精肝损伤小鼠血清及肝组织中转氨酶水平具有稳定作用。ALT和AST是临床上常用的肝功能评价指标,也是酒精所致肝损伤的最敏感指标[17]。因此,转氨酶活力可以一定程度反映生物体内肝细胞的损伤程度。肝组织在大量酒精的刺激下,功能受损,出现急性肝炎,ALT和AST大量释放,使血液中ALT和AST水平显著提升[18]。本实验证明一定剂量的葛根可以减轻过量酒精对肝组织的损伤,维持肝功能正常,从而降低血清中AST和ALT水平。
乙醇在人体内大部分氧化反应过程都有ALDH参与[19],肝脏在受到长期酒精刺激下,其功能受损,影响血清中ADH和ALDH活力[20]。若ALDH活性降低,导致血液中乙醛积累,其与黄嘌呤形成超氧化物,导致脂质过氧化,损坏细胞膜脂质,进而导致肝损伤[21]。阳性药物和中、高剂量的野生葛根对肝脏具有良好的保护作用,能够稳定ADH活力,且功效能达到阳性药物水平。中、高剂量的栽培葛根同样具有良好的稳定ADH活力的作用,但效果不及野生葛根。
抗氧化剂可以清除肝脏中堆积的过氧化物以降低氧化应激造成的肝损伤,保证机体细胞内稳态,对肝脏结构与功能的稳定发挥重要作用[22-23]。大量酒精被人体摄入,加重了肝脏负担,同时会降低机体的抗氧化活性,抑制肝组织中GSH-Px活力,使乙醇的代谢分解速率低于吸收速率,进而引起代谢紊乱,机体免疫防御功能衰减[24]。野生葛根和栽培葛根具有增强小鼠肝组织抗氧化活性的功效。与空白组小鼠相比,模型组小鼠肝脏抗氧化能力显著降低(P<0.05);相比于模型组小鼠,WP-M、CP-L和CP-M组小鼠CAT活力显著提升接近正常水平,WP-M、WP-H、CP-L和CP-M组小鼠GSH-Px活力显著提高至接近正常水平(P<0.05),表明野生葛根和栽培葛根在一定剂量下可以有效维持肝组织的抗氧化体系平衡状态,减轻酒精引发的肝组织氧化损伤。
NO、TNF-α、IL-1β和IL-10是酒精性肝损伤的重要炎症因子,能诱发肝脏细胞进一步坏死、凋亡、加重炎症反应[25]。NO作为新型传导因子,如果个体NO含量过高,将会导致多种器官出现病症甚至衰竭[26]。TNF-α是一种促炎因子,其过表达可能会导致炎症性肠病、免疫失调等病症[27]。IL-1β是一种重要的炎症介质,机体内IL-1β水平提高易加重炎症反应[28]。IL-10是人体免疫反应中关键的抗炎因子,能抑制炎症的产生[29]。本实验中,慢性酒精肝损伤模型小鼠肝组织中炎症明显,灌胃一定剂量的野生葛根和栽培葛根能够不同程度减轻小鼠体内炎症,实验结果与柏琳等[30]研究结果较为接近。证明一定剂量的野生葛根和栽培葛根均具有抑制NO、TNF-α、IL-1β的产生、提升IL-10水平以抑制炎症的功效。
由小鼠肝组织切片HE染色结果可知,模型组小鼠肝组织出现细胞形态不规则、排列杂乱,细胞间隙不均匀、出现挤压,细胞核仁增大、挤压堆叠,细胞边缘不规则,甚至出现细胞破碎等病理特征,表明肝脏出现明显的炎症性病理学改变,进一步证实小鼠酒精性肝脏损伤模型建立成功。野生葛根和栽培葛根干预组小鼠肝脏受保护明显,仅出现轻微病变,但与正常小鼠仍有一定差异,表明一定剂量的野生葛根和栽培葛根对慢性酒精肝损伤实验小鼠的肝组织均具有良好的保护功效,这与王书庆等[31]研究结果一致。
4 结 论
模型组小鼠长期受酒精的影响且无药物治疗,肝功能严重受损。一定剂量的野生葛根和栽培葛根可通过提升脱氢酶活力、稳定转氨酶水平、提升肝脏抗氧化活性和抑制炎症产生等途径发挥良好的解酒护肝功效,有进一步研究开发的价值。野生葛根和栽培葛根均具有良好的解酒护肝功效,但综合比较下野生葛根的保护功效优于栽培葛根,这可能与所含葛根素、异黄酮等主要功能成分含量差异有关。本研究不同剂量野生葛根和栽培葛根对各效应指标的影响未呈现一致的剂量效应关系,低剂量效果不佳。因此,有关葛根对小鼠慢性酒精性肝损伤干预的最佳有效剂量和确切机理还有待进一步研究。
