低压静电场辅助冷冻对竹笋品质的影响
2022-12-30郭家刚童光祥伍玉菡杜京京潘九红
郭家刚,杨 松,童光祥,伍玉菡,朱 倩,杜京京,潘九红,江 舰,*
(1.安徽省农业科学院农产品加工研究所,安徽 合肥 230031;2.安徽省食品微生物发酵与功能应用工程实验室,安徽 合肥 230031;3.广德惊石农业科技发展有限公司,安徽 宣城 242200)
竹笋滋味鲜美、质脆爽口,富含膳食纤维、蛋白质与氨基酸、维生素和人体所必需的矿物质等营养成分,且胆固醇、脂肪含量低,享有“菜中珍品”美誉,是深受广大消费者喜爱的纯天然健康食品[1-3]。同时,竹笋含有酚类、多糖、类黄酮等多种活性物质,具有抗氧化[4]、抑菌[5]、调节血糖[6-7]、改善肠道环境[8]等生理功能,药用价值较高[9]。我国竹笋资源丰富,可食品种繁多,主要分布于东部沿海地区、四川和广西等地[10]。新鲜竹笋水分质量分数高达90%,采后生理代谢旺盛,极易出现褐变、木质化、营养物质损失等问题,导致其食用品质和商品性降低[11]。目前常用的竹笋贮藏加工方式有干制、腌渍和低温贮藏等[12-13]。然而低温冷藏易引起鲜竹笋失水,且只具备短时间保鲜效果;干制处理难以保持竹笋特有的形态、色泽和风味,营养成分也会受到不同程度的影响;腌渍竹笋含盐量高,通常还需脱盐处理,难以满足消费者日益增长的低盐、健康营养饮食需求[14]。因此,探究高品质果蔬加工技术对果蔬产业的发展具有重要意义。
冷冻作为果蔬重要的贮藏加工方式,在80多年前已有应用[15],可以显著延长果蔬贮藏时间、减少损耗[16],能够较好地保持食品的色泽、风味和营养成分[17]。然而传统冷冻方法的降温速率比较低,冷冻过程中形成的粗大、不规则的冰晶体会对冻藏竹笋等果蔬产品品质产生较大影响,导致产品质构损伤、解冻后蛋白质等营养流失以及适口性不佳等问题,影响冷冻竹笋品质和风味[18-19]。微冻藏(-3 ℃)是介于冷藏和冷冻贮藏之间的一种低温保鲜方式,能够改善竹笋汁液流失情况,但贮藏期较短[20]。因此,控制冰晶尺寸及分布依然是当前果蔬冷冻贮藏技术研究的热点[21]。近年来,随着食品冷冻技术研究的深入和物理场应用技术的兴起,静电场作为一种新型非热处理手段,具有成本低、效率高、操作简单等优点,在食品贮藏与加工领域引起广泛关注[22]。低压静电场辅助冷冻技术是通过外加低压静电场作用于物料冻结过程的一种新型技术,根据物料冻结特性,选择适当场强的低压静电场辅助冷冻有助于提高肉品的冻结品质[23-24]。然而,目前关于低压静电场辅助冷冻对果蔬冻结过程及其品质影响的研究鲜有报道,且低压静电场辅助冷冻作用机理尚不明确,需进一步探究。
本实验以竹笋为研究对象,将低压静电场应用于竹笋冷冻过程,以非施加低压静电场的冷冻竹笋作为对照,探究低压静电场辅助冷冻对竹笋冻结效率、冰晶分布、微观形态及汁液流失等冻结特性的影响,为低压静电场辅助冷冻果蔬加工技术提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
实验所用竹笋为当季新鲜冬笋,采收于安徽省广德惊石农业科技发展有限公司基地。
无水乙醇、二甲苯、中性树胶、乙酸异戊酯 国药集团化学试剂有限公司;番红固绿(植物)染液、FAA固定液(甲醛-冰醋酸-乙醇-水溶液,体积比为5∶5∶45∶45)、电子显微镜固定液(含质量分数2.5%戊二醛的磷酸缓冲液,pH 7.0~7.5)、磷酸盐缓冲液(phosphate buffered saline,PBS,0.1 mol/L、pH 7.4)武汉赛维尔生物科技有限公司。
1.2 仪器与设备
ME204电子显示天平 梅特勒-托利多(上海)仪器有限公司;TA.XT Plus型质构分析仪 英国Stable Micro Systems公司;JK-8U多路温度测试仪 常州金艾联电子科技有限公司;DW-40低温试验冰箱(-35 ℃,90 L)沧州科成仪器设备有限公司;NMI20-015V-I低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)成像分析仪 上海纽迈电子科技有限公司;JB-P5包埋机武汉俊杰电子有限公司;RM2016切片机 上海徕卡仪器有限公司;ECLIPSE E100正置光学显微镜日本Nikon公司;K850临界点干燥仪 英国Quorum公司;MC1000离子溅射仪、SU8100扫描电子显微镜日本Hitachi公司;DENBA+鲜度保持电场装置(173 mm×247 mm×100 mm) 日本AGUA商事株式会社;低压静电场装置为实验室自制,由静电场发生装置(交流电压220V,50/60 Hz)和放电板(430 mm×230 mm)组成,静电场发生装置输出电压为2 500 V,电流为0.2 mA,放电板在低温试验冰箱内产生低压静电场,形成负离子环境,如图1所示。

图1 低压静电场冷冻实验装置Fig. 1 Schematic diagram of the LVEF-assisted freezing apparatus
1.3 方法
1.3.1 样品处理及分组
鲜笋采收后挑选无破损、无病虫害、色泽较好、笋龄和质量相近的新鲜竹笋置于4 ℃冷库中冷藏备用,实验时从冷库随机取出竹笋,清洗表面泥沙,放入沸水中烫漂30 min,常温流水冷却,剥去笋壳,切除底部老蔸,剩余部分切成笋块(2 cm×5 cm×5 cm),得到鲜竹笋样品。选取50 块鲜竹笋样品随机分为5 组,每组10 块竹笋。以非静电场下冷冻(-35 ℃)的竹笋作为对照组(标记为CK),具体操作为直接将竹笋放入DW-40低温试验冰箱(-35 ℃,90 L)中进行冻结。以低压静电场环境下冷冻(-35 ℃)的竹笋作为处理组。设置竹笋与低压静电场发生板之间的距离分别为10、20、30、40 cm,所得样品分别标记为LVEF-10、LVEF-20、LVEF-30、LVEF-40。
1.3.2 冻结曲线的测定
采用JK-8U多路温度测试仪测定竹笋样品冻结过程中的温度变化,将温度传感器探头插入竹笋样品中心,每隔3 s记录一次温度,绘制冻结曲线。待竹笋样品中心温度降至-18 ℃时停止测定,冷冻过程结束。然后将冻结样品转移到4 ℃冰箱进行解冻,待竹笋样品解冻后进行指标测定。
1.3.3 冰晶形态观察
取不同冷冻处理组竹笋样品及冷冻处理前的鲜竹笋样品置于FAA固定液中固定24 h以上,取出后用手术刀将目的部位组织修平,放入脱水盒内,然后放进脱水机依次进行梯度乙醇溶液脱水,浸蜡、包埋后于-20 ℃冻台冷却,再将冷却的蜡块置于切片机切片,切片厚度4 μm。将石蜡切片脱蜡至水化,经番红固绿染色,中性树胶封片后,采用正置光学显微镜观察分析。
1.3.4 水分损失率的测定
取不同冷冻处理组竹笋样品,称质量后立即放入4 ℃冰箱中解冻24 h,然后用吸水纸拭去竹笋表面汁液,并称质量,按下式计算竹笋样品解冻后的水分损失率[25]。
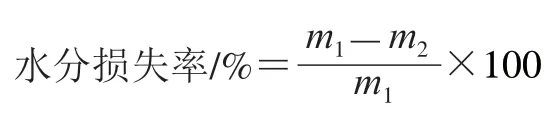
式中:m1为竹笋样品解冻前质量/g;m2为竹笋样品解冻后质量/g。
1.3.5 硬度测定
采用TA.XT Plus质构仪测定鲜竹笋和不同冷冻处理组解冻后竹笋样品的硬度。探头型号P/2,压缩量30%;测前速率3.00 mm/s,测试速率1.00 mm/s,测后速率5.00 mm/s,触发力5 g。每个样品重复测定6 次。
1.3.6 水分分布的测定
取鲜竹笋和不同冷冻处理组竹笋样品,切片(0.8 cm×0.8 cm×1.5 cm)并称样品质量,然后置于直径为1.2 cm的核磁共振管底部,采用NMI20-015V-I磁体探头,采用CPMG(Carr-Purcell-Meiboom-Gill)序列测定样品横向弛豫时间T2,每个处理组样品重复测定3 次。主要参数设置:采样频率100 kHz,90°脉宽15 μs,180°脉宽29 μs,射频延时0.08 ms,重复采样等待时间3 500 ms,累加采样次数为4,回波时间3 ms,回波个数为2 000。主要成像参数为:重复时间500 ms,回波时间20 ms,平均次数为3,FOV Read为80 mm,FOV Phase为80 mm,竹笋样品成像厚度为2 mm,同一样品进行4 层成像。成像方式为纵切片,图像文件保存为fid格式然后采用V1. 0软件进行伪彩处理。
1.3.7 竹笋纤维微观结构观察
取不同冷冻处理组竹笋样品及冷冻处理前的鲜竹笋样品浸入电子显微镜固定液中室温固定2 h,然后转移至4 ℃保存。固定好的样品经PBS漂洗3 次,每次15 min。用PBS配制1%锇酸溶液室温避光固定1~2 h。然后用PBS漂洗3 次,每次15 min。把组织样品依次浸入不同体积分数(30%、50%、70%、80%、90%、95%、100%、100%)的乙醇和乙酸异戊酯进行脱水处理,脱水后的样品放入临界点干燥仪内干燥。将样本紧贴于导电碳膜双面胶上,然后放入离子溅射仪样品台上喷金30 s左右,在扫描电子显微镜下观察并拍照。
1.4 数据处理与分析
每组实验重复3 次,结果以平均值±标准差表示。采用SPSS Statistics 22.0软件进行数据统计分析,采用最小显著性差异(least significance difference,LSD)法进行显著性分析,P<0.05表示差异显著,采用Origin 2017软件和GraphPad Prism 6软件作图。
2 结果与分析
2.1 低压静电场辅助冷冻对冻结速率的影响
在冷冻过程中,冻结速率对冷冻果蔬品质起着至关重要的作用[26-27]。如图2所示,对照组与处理组样品的冻结曲线变化趋势大体相同,可分为:预冷阶段(I),即竹笋温度从初始温度迅速降至冰点温度;相变阶段(II),即竹笋中的水转变成冰晶的过程,该阶段竹笋样品中的水大部分冻结成冰,并释放出相变热量,因此温度下降比较缓慢;深度冻结阶段(III),该阶段竹笋温度快速下降到冷冻终点温度[28]。整个冻结过程,样品中心温度从5 ℃开始下降,达到-18 ℃结束,低压静电场处理组LVEF-10、LVEF-20、LVEF-30、LVEF-40所需冻结时间分别为214.6、208.3、205.9、212.9 min,均明显短于非施加低压静电场对照组所需冻结时间(225.8 min),不同静电场处理组冻结时间差异不明显。由此可见,在低压静电场辅助下,各处理组竹笋通过最大冰晶生成带的时间有不同程度的缩短,样品冻结速率得到提高,其中处理组LVEF-30的冻结速率最快,相较对照组冻结时间缩短近20 min。研究发现,静电场对水分子的极化作用能降低水分子成核自由能,进而促进冰核的产生,提高冻结效率[29],但该结论仍待进一步验证。
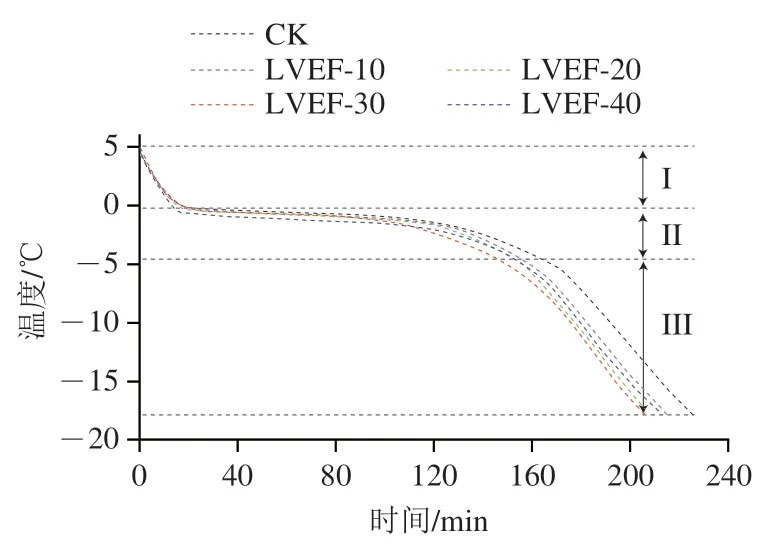
图2 低压静电场辅助冷冻对竹笋冻结曲线的影响Fig. 2 Freezing curves of bamboo shoot samples treated by different freezing methods
2.2 低压静电场辅助冷冻对竹笋组织中冰晶形态的影响
果蔬在冷冻过程中会形成针状等不规则的冰晶,对组织造成机械损伤、导致细胞结构破裂[30]。如图3所示,新鲜竹笋组织结构分布均匀、相对致密,细胞之间缝隙较小。竹笋在冷冻过程中,组织细胞间隙中的水不断形成冰晶,体积逐渐增大,冰晶的生长导致竹笋组织及周围细胞结构永久性破坏,在竹笋组织中产生不规则孔洞。对照组竹笋组织中形成的冰晶体积较大,分布无序,细胞破损比较严重。而低压静电场冷冻处理组竹笋组织形成的冰晶体积相对较小、分布较为均匀,细胞破坏程度较轻,竹笋组织结构保持较好,各处理组均显著优于对照组,与新鲜竹笋组织形态相近;这可能是由于在低压静电场作用下,竹笋样品冻结速率提高,促进了冰核的形成,并抑制了冰晶的过快生长,使得形成的冰晶体积小、分布均匀,与对照组竹笋相比,产生了较小的水位移和更少的组织损伤。
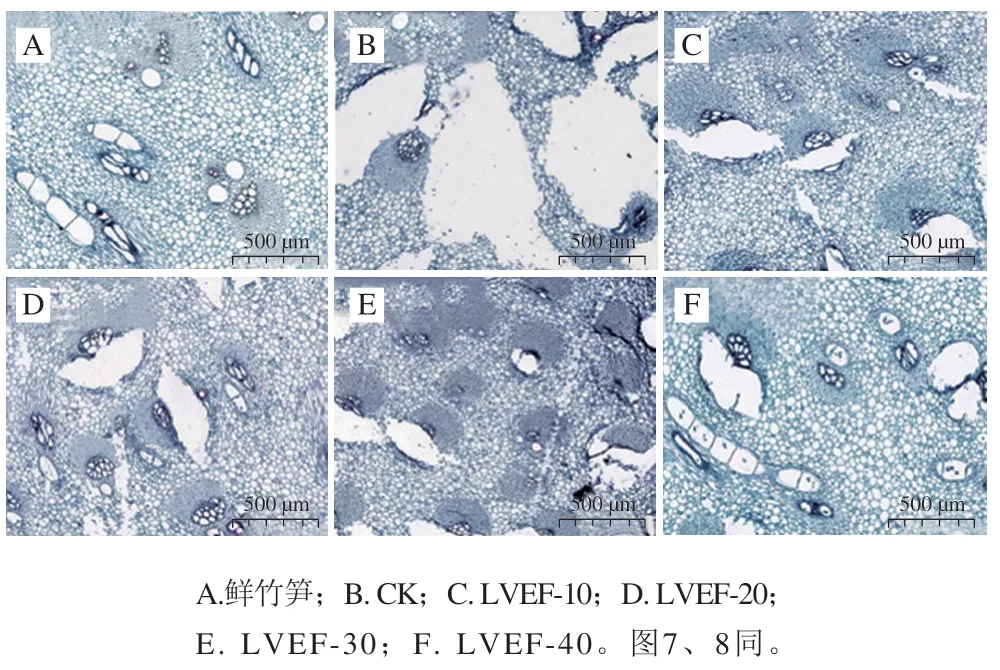
图3 低压静电场辅助冷冻对竹笋冰晶形态的影响(35×)Fig. 3 Effects of different freezing treatments on ice crystal morphology in bamboo shoot samples (35 ×)
2.3 低压静电场辅助冷冻对竹笋水分损失率的影响
竹笋样品冷冻过程中,水分结晶后体积增大会导致组织损伤及细胞破裂,解冻后易出现营养物质流失等现象。水分损失率反映了竹笋解冻后汁液流失的情况,其受到冰晶的形成、细胞含水率及组织持水性等多种因素的影响[31]。如图4所示,与对照组相比,低压静电场处理组LVEF-10、LVEF-20、LVEF-30、LVEF-40的竹笋解冻水分流失率分别为14.16%、12.58%、9.73%、10.44%,显著低于对照组(21.01%)(P<0.05)。低压静电场辅助冻结显著降低了竹笋在解冻后的水分损失率,有效改善了竹笋的保水性及营养流失情况,其中LVEF-30组竹笋汁液流失最少。这可能是因为低压静电场辅助冷冻减小了冰晶的形成和大小,导致冰晶对竹笋微观组织结构的损伤程度有所降低,所以解冻后竹笋水分损失率有不同程度的降低,该结果与冻结速率分析结果相一致。
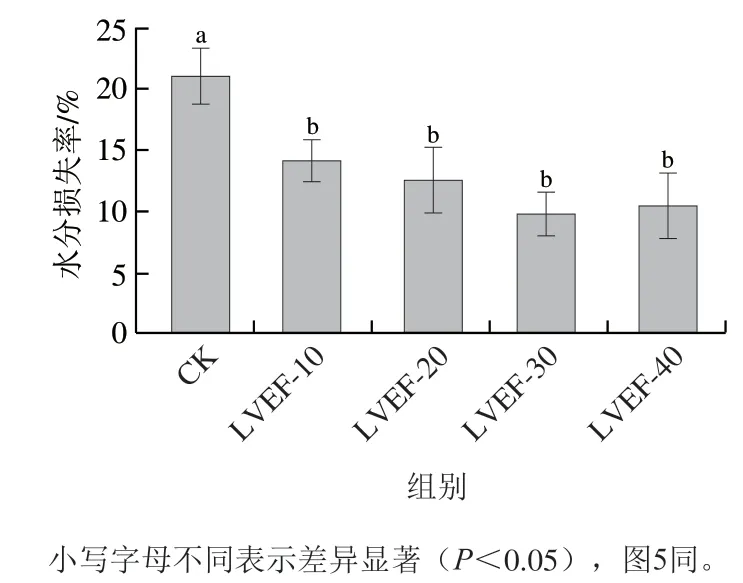
图4 低压静电场辅助冷冻对竹笋样品水分损失率的影响Fig. 4 Effects of different freezing treatments on drip loss of bamboo shoot samples
2.4 低压静电场辅助冷冻对竹笋硬度的影响
质构性质是评价果蔬质地的重要参数,直接决定了果蔬产品的商业价值[32]。通过测定解冻后竹笋样品的硬度评价低压静电场辅助冷冻对竹笋品质的影响。如图5所示,新鲜未冻结竹笋硬度为633.22 g,经低压静电场辅助冷冻处理后,各组竹笋硬度均不同程度下降。与对照组相比,施加低压静电场处理的LVEF-10、LVEF-20、LVEF-30和LVEF-40竹笋硬度分别为461.19、507.48、496.65、455.31 g,均显著大于对照组(350.70 g)(P<0.05),其原因与冷冻过程中冰晶的形成有关。冰晶使竹笋组织结构受到破坏,从而导致竹笋硬度降低,而低压静电场辅助冷冻使竹笋冻结过程中形成的冰晶较小且分布均匀,减少了冰晶对竹笋组织结构造成的损伤,因此低压静电场辅助冷冻显著改善了竹笋质构品质,与未冻结鲜竹笋样品硬度更接近。

图5 低压静电场辅助冷冻对竹笋样品硬度的影响Fig. 5 Effects of different freezing treatments on hardness of bamboo shoot samples
2.5 低压静电场辅助冷冻对竹笋组织中水分分布的影响
LF-NMR能够快速、无损检测食品中水分的状态信息,利用低场核磁多脉冲回波序列测得的横向弛豫时间T2可以反映水分在食品内部的存在状态及分布[33]。T2越小,表示水分与组织结合越紧密,水分流动性越小,反之T2值越大表明水分与组织结合越疏松,水分的流动性越大;用弛豫时间对应的峰面积反映水分含量[34]。如图6所示,各组T2反演谱曲线上均有2个波峰,即T21(4~25 ms)表示竹笋细胞中不易流动水,以及T22(100~750 ms)表示自由水(如液泡中的水),其流动性较大[35]。如表1所示,与对照组竹笋相比,经低压静电场辅助冷冻处理的竹笋横向弛豫时间T21无显著性差异(P>0.05),而T22变化显著(P<0.05),其原因可能是普通冷冻冻结速率慢,形成的冰晶粗大,对竹笋细胞的破坏程度大,导致大分子物质与水的结合发生变化,从而使其持水性下降。与对照组相比,低压静电场处理组的水分含量均发生显著性变化(P<0.05),低压静电场辅助冷冻处理组的峰面积均大于对照组峰面积,这可能是因为冻结过程中冰晶的形成对竹笋组织结构造成了一定的机械损伤,从而使得一部分水分从竹笋组织中渗出,产生了水分损失,而低压静电场辅助冷冻竹笋组织机械损伤相对较小,汁液流失少,因此水分含量相对较高[36]。

图6 低压静电场辅助冷冻对竹笋中水分横向弛豫时间T2的影响Fig. 6 Effects of different freezing treatments on transverse relaxation time (T2) of bamboo shoot samples

表1 低压静电场辅助冷冻对竹笋水分分布的影响Table 1 Effects of different freezing treatments on water distribution of bamboo shoots
通过样品反射的LF-NMR信号强度获得高分辨率氢质子密度图像,检测竹笋样品中的水分分布情况,红色越深表示水分含量越高,蓝色越深表示水分含量越低[37]。如图7所示,新鲜竹笋水分含量较高,样品图像呈黄红色,色泽分布比较均匀。冻融后的竹笋样品呈现不同程度的蓝绿色,表明冻融后样品水分含量有所降低,对照组竹笋样品图像仅呈现较深的蓝色,表明对照组水分流失较多,与对照组相比,LVEF-10、LVEF-20、LVEF-30、LVEF-40组图像多呈红色和黄色,说明低压静电场辅助冷冻处理的竹笋水分含量高于对照组,其中LVEF-30图像黄绿色区域最少,且分布均匀,与新鲜竹笋样品图像基本接近,表明LVEF-30处理可以较好地保持竹笋水分。

图7 不同处理条件竹笋组织氢质子密度加权伪彩图Fig. 7 Weighted pseudo color images of hydrogen proton density of bamboo shoots under different treatment conditions
2.6 低压静电场辅助冷冻对竹笋组织微观结构的影响
对新鲜竹笋及低压静电场辅助冷冻竹笋组织的横截面进行扫描电子显微镜观察,分析竹笋微观结构的完整性及损伤情况。如图8所示,新鲜竹笋纤维呈现疏松多孔的蜂窝状结构,细胞结构完整,排列紧密、细胞间隙小[10],而对照组竹笋组织结构损伤程度较大,细胞严重变形、破损。与对照组相比,低压静电场辅助冷冻处理组的竹笋微观结构保持较好,细胞排列较为紧密且间隙较小、细胞壁受到损伤的程度也较轻。结果表明,低压静电场辅助冷冻改善了竹笋组织微观结构的损伤程度,与竹笋水分损失率低和硬度维持较好的结果相互印证。

图8 不同处理后竹笋的微观结构(200×)Fig. 8 Microstructure of bamboo shoots subjected to different freezing treatments (200 ×)
3 结 论
本研究将低压静电场辅助冷冻技术应用于竹笋冷冻加工,探究了低压静电场辅助冷冻对竹笋冻结特性及品质的影响。在竹笋样品与静电板10~40 cm间距条件下,低压静电场辅助冷冻缩短了冻结时间,改善了竹笋冻融后的硬度及汁液流失情况,其潜在机理可能是由于静电场降低了水分子成核自由能,改变了晶体生长模式,从而缩短了竹笋冻结时间,提高了冷冻速率,有效抑制了冰晶生长,形成的冰晶小且分布均匀,减轻了冰晶生长对竹笋组织微观结构的机械损伤程度,较好地保持了竹笋的硬度,解冻后竹笋样品的持水性得到改善,水分损失率降低。综上所述,低压静电场辅助冷冻技术可以提高竹笋冷冻速率,改善冷冻后的竹笋品质。
