浓香型白酒酿造过程中不同形态氰化物的含量分布规律
2022-12-29朱晓春陈双徐岩
朱晓春,陈双,2*,徐岩,2
1(酿造微生物与应用酶学实验室, 工业生物技术教育部重点实验室,江南大学 生物工程学院, 江苏 无锡, 214122) 2(国家市场监管重点实验室(白酒监管技术),四川 泸州,646000)
白酒是具有我国民族特色的酒精饮料,其采用粮谷为原料,经多种微生物发酵、蒸馏、贮存勾兑而成[1]。白酒酿造过程中粮谷原料在多种微生物及其酶系的共同作用下代谢形成了白酒复杂的风味组分,但同时发酵过程中也生成了一些内源性的食品安全潜在风险物质,如氰化物、氨基甲酸乙酯(ethyl carbamate, EC)等[2-3]。近年来,随着人们对白酒质量安全的重视,对于白酒中内源性风险物质如氰化物与EC的监测与减控研究受到了极大的关注。我国GB 2757—2012《食品安全国家标准 蒸馏酒及其配制酒》对白酒中的氰化物含量作出了限量规定,限量值为8.0 mg/L。对于白酒中的EC含量虽然目前国家还未制定限量标准,但国外对蒸馏酒中EC含量的设定限量值为150 μg/L,参照国外的限量标准,对EC和氰化物的控制成为我国白酒品质安全控制的研究重点[3]。
氰化物是指带氰基的一类有毒化合物,常以氰苷的形态广泛地存在于粮谷中[4]。白酒酿酒原料中的氰苷,在发酵过程中会发生酶解和热分解生成非糖苷形态的氰化物(图1)[4-5],其在不同香型的发酵酒醅中氰化物含量范围为1.5~8.0 mg/kg[5-6];酒醅中的氰化物会经蒸馏进入白酒中,白酒中氰化物的检出含量为32~2 293 μg/L[5, 7-8],虽然低于我国国家标准规定的限量值,但由于氰化物在发酵、蒸馏和贮存过程中易与乙醇反应生成EC,所以它是白酒中潜在致癌物质EC形成最重要的前体[5, 9]。在之前研究中,人们对原料中的氰苷以及白酒产品中游离的CN-研究较多[5, 7-8],而对酿造过程中存在的不同形态氰化物(氰苷、非糖苷和游离形态)的研究较少,特别是易释放出CN-的非糖苷形态氰化物。这些氰化物的含量影响着最终白酒产品的质量,但目前对不同形态氰化物在酿造过程中的含量变化和分布规律尚不清楚。
浓香型白酒是我国产销量最大的白酒,占白酒总产量的60%~70%[10]。前期对于浓香型白酒中EC和氰化物监测发现,浓香型白酒原酒中氰化物与EC的含量分别为5.59~2 017.41 μg/L、27.12~547.8 μg/L,在不同香型白酒中处于较高的水平[5],因此对浓香型白酒酿造过程中氰化物的控制对于减控浓香型白酒中内源性风险物氰化物和EC具有重要意义。本研究针对浓香型白酒酿造过程不同形态氰化物分布规律不清的问题,采用不同的QuEChERS前处理结合气相色谱-质谱联用(gas chromatograph-mass spectrometer,GC/MS)法分别测定了酒醅中的非糖苷和游离形态氰化物,并对蒸得的原酒中的游离氰化物与EC也采用GC/MS法进行了定量。对酿造过程中不同形态氰化物及其原酒中游离氰化物和EC的含量变化及分布规律进行了分析,以期为白酒生产过程中降氰与调控EC的研究提供基础数据参考。
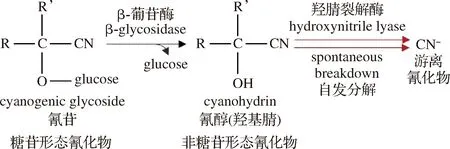
图1 氰苷的降解[4-5]Fig.1 Degradation of cyanogenic glycoside[4-5]
1 材料与方法
1.1 材料与仪器
1.1.1 样品
选择四川地区浓香型白酒厂A厂(多粮发酵工艺)与江苏地区浓香型白酒厂B厂(单粮发酵工艺),对酿造生产入窖、出窖、蒸酒前、蒸酒后几个关键的工艺时间点,按窖池深度取上、中、下层的酒醅样品,每份3次平行,于-20 ℃冷冻保存至分析。并取上、中、下层酒醅蒸馏所得的原酒样品,密封保存至分析。

表1 样品信息Table 1 Sample details
1.1.2 试剂
磷酸二氢钾、磷酸氢二钠、无水硫酸镁、氯化钠、氯胺T、乙酸锌、酒石酸、氢氧化钠、磷酸、无水硫酸钠、乙腈(色谱纯)、乙酸乙酯(色谱纯),上海国药集团;十八烷基硅烷键合硅胶(C18)、氨丙基键合硅胶(NH2)、石墨化炭黑(GCB)、GBW(E)080115水中氰成分分析标准物质(50 μg/mL),上海安谱实验科技公司;氨基甲酸乙酯标准物质(纯度 99.0%)、d5-氨基甲酸乙酯(纯度 98.0%),美国 Sigma-Aldrich 公司。
1.1.3 仪器与设备
GC 7890-MSD 5975气相色谱-质谱联用仪,美国Agilent公司;Milli-Q超纯水装置,美国Millipore 公司;电子天平(感量为0.000 1 g),梅特勒托利多科技有限公司;SB-25-12D超声波清洗机,宁波新芝生物科技股份有限公司;旋涡混合仪,上海沪西分析仪器有限公司;N-EVAP111型氮吹仪,美国Organomation公司。
1.2 实验方法
1.2.1 GC-MS法定量氰化物
1.2.1.1 样品前处理
酒醅样品:
(1)总氰化物含量测定前处理:参考GB 5009.36—2016《食品安全国家标准 食品中氰化物的测定》中粮食原料的蒸馏操作处理酒醅样品。
(2)非糖苷形态氰化物含量测定前处理:参考文献[11-12]的QuEChERS前处理方法,准确称取均质酒醅3 g于50 mL塑料离心管中,加入7.5 mL磷酸盐缓冲液(PBS,pH=9.0)浸泡15 min,加入10 mL乙腈,超声8 min,放入1颗陶瓷均质子,加入4.0 g MgSO4、1.0 g NaCl,立即摇动涡旋1 min,然后5 000 r/min离心5 min,吸取6 mL上清液到内含750 mg MgSO4、120 mg C18、120 mg NH2、20 mg GCB的15 mL塑料离心管中,涡旋1 min,5 000 r/min离心5 min,吸取1 mL 上清液,氮吹至近干,以1 mL 1 g/L氢氧化钠溶液溶解。
(3)游离形态氰化物含量测定前处理:准确称取均质酒醅3 g于50 mL塑料离心管中,采用7.5 mL超纯水涡旋混匀,后续操作同非糖苷形态氰化物含量测定的QuEChERS前处理。
以上总氰化物、非糖苷和游离形态氰化物前处理后的样品液,准确移取100 μL于顶空瓶中,加入150 μL 1 g/L氢氧化钠溶液,静置5 min,加入蒸馏水4.75 mL,加入100 μL磷酸溶液(1∶5, 体积比),100 μL 氯胺T溶液(10 g/L),立即加盖密封,涡旋,待GC-MS检测[8]。
原酒样品:准确移取100 μL酒样于顶空瓶中,加入150 μL 1 g/L氢氧化钠溶液,静置5 min,加入蒸馏水4.75 mL,加入100 μL磷酸溶液(1∶5, 体积比),然后加入100 μL氯胺T溶液(10 g/L),立即加盖密封,涡旋,待GC-MS检测[8]。
1.2.1.2 仪器条件
顶空条件:顶空平衡温度为60 ℃;取样针温度为65 ℃;顶空加热时间为10 min,进样间隔为16 min;进样体积为0.5 mL。
色谱条件:色谱柱为DB-FFAP毛细管柱(60 m×0.25 mm×0.25 μm);色谱柱流量为1.4 mL/min;色谱柱温度为40.0 ℃。柱温箱升温程序为40 ℃保持2 min,以20 ℃/min 速率升到60 ℃,保持2 min;再以50 ℃/min的速率升到200 ℃,保持2 min。进样模式为分流(10∶1);进样口温度为200 ℃。载气为He;吹扫流量为3.0 mL/min。
质谱条件:离子源温度为230 ℃;接口温度为220 ℃;溶剂延迟时间为3 min;扫描离子m/z:61、63、35、26;定量离子m/z:61。
1.2.1.3 标准曲线
标准曲线工作液:用1 g/L氢氧化钠溶液将GBW(E)080115水中氰成分分析标准物质(50 μg/mL)稀释到1 μg/mL,再用水进行梯度稀释,配制成一系列浓度的标准溶液。进行GC/MS分析后,以CN-峰面积为横坐标,质量浓度为纵坐标,绘制标准曲线。
1.2.2 GC/MS法定量EC
1.2.2.1 样品前处理
参考文献[13]的方法,准确移取2.0 mL酒样于离心管中,然后移取50 μL 5 μg/mL的氨基甲酸乙酯内标(EC-d5),加入0.5 g NaCl,涡旋振荡混匀后,准确加入2.0 mL乙酸乙酯,振荡提取5 min,静置分层后,吸取上层清液,经无水硫酸钠脱水,0.22 μm有机滤头过滤后,待GC-MS分析。
1.2.2.2 仪器条件
色谱条件:色谱柱为DB-FFAP毛细管柱(60 m×0.25 mm×0.25 μm);进样口温度为220 ℃;载气为He,纯度≥99.999%;流速为1.4 mL/min;进样方式为不分流进样,进样体积为1 μL。柱温箱升温程序为50 ℃保持2 min,以5 ℃/min的速率升至170 ℃,再以10 ℃/min的速率升至230 ℃。
质谱条件:离子源电压为70 eV,离子源温度,230 ℃;扫描范围m/z:35~350;采用选择离子监测(selective ion monitoring, SIM)模式。EC扫描离子m/z:44、62和89,定量离子m/z:62;EC-d5扫描离子m/z:64、44和89,定量离子m/z:64。
1.2.2.3 标准曲线
标准曲线工作液:用色谱甲醇将EC和EC-d5标准品稀释为质量浓度为1.0 mg/mL,再用60%vol乙醇水溶液进行梯度稀释,配制成一系列浓度的标准溶液,按照与酒样相同的处理方法进行GC-MS分析。以EC与内标EC-d5峰面积之比为横坐标,质量浓度之比为纵坐标,绘制标准曲线。
2 结果与分析
2.1 QuEChERS结合GC/MS定量酒醅中不同形态氰化物的方法建立
氰化物常以氰苷的形态广泛地存在于粮谷中,白酒酿造常用的高粱、小麦等原料中的氰苷[4],在酿造过程中会发生酶解和热分解,使得酒醅基质中含有不同形态氰化物(氰苷,非糖苷和游离形态)。前期检测原料中的氰苷以及白酒产品中游离CN-的研究较多[5,7-8],而酒醅基质有酸度大、水分含量较高、颜色深、微生物代谢产物复杂的特点,检测其不同形态的氰化物含量的前处理难度大,检测干扰严重。QuEChERS前处理是一种常用于复杂样品基质提取和净化的前处理方法[11, 14],适合用于处理酒醅基质。因此,我们参考木薯淀粉生产过程中测定不同形态氰化物的前处理条件[15-17],参考文献[11-12, 18]的QuEChERS前处理方法,结合GC-MS首次建立了酒醅中非糖苷和游离形态氰化物的定量分析方法。
采用1.2.1.1中不同的QuEChERS前处理结合GC-MS法检测酒醅中的非糖苷和游离形态氰化物的质量浓度(n=6),再往酒醅样品中添加1∶1平均质量浓度水平的水中氰成分分析标准物质,通过重复性实验(n=3)计算样品的加标回收率(P)及相对标准偏差(relative standard deviation,RSD)来考察方法的准确度和精密度。测试结果如表2所示,该测定方法较为稳定,准确度(P,80%~110%)和精密度(RSD,3%~7%)达到实验室要求。标准曲线线性方程为Y=302 606X-545.66,R2=0.999 1。

表2 酒醅中氰化物定量方法的线性、检测限、回收率及相对标准偏差(n=3)Table 2 Linearity,LOD,recovery,and RSDs of the quantification of cyanide in fermented grains (n=3)
2.2 浓香型白酒酿造酒醅中不同形态的氰化物含量分析

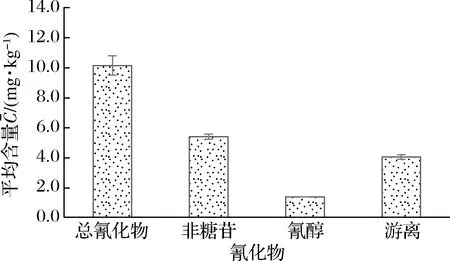
图2 酒醅中不同形态的氰化物Fig.2 Different forms of cyanide in fermented grains
2.3 不同工艺浓香型白酒酒醅中的非糖苷形态氰化物分析
浓香型白酒常使用高粱原料,在多粮混合型的浓香型白酒生产中,高粱的使用量也占原料之首[1]。四川地区的浓香型白酒A厂就采用了高粱、大米、糯米、小麦和玉米多种粮混合为原料,江苏地区B厂采用糯高粱作为单一的原料。这些粮谷原料中的氰苷本身并没有毒性,在白酒发酵过程中会在β-葡萄糖苷酶的作用下酶解生成非糖苷形态的氰化物[4]。我们针对A、B两厂入窖、出窖、蒸酒前和蒸酒后几个关键工艺时间点,对酒醅中的非糖苷形态氰化物进行了检测,结果如图3所示。比较A、B两厂的非糖苷形态氰化物含量可知,B厂酒醅中非糖苷形态氰化物含量水平高于A厂,酿造原料的用量配比造成氰化物引入的初始含量不同可能是原因之一。A厂采用多粮浓香发酵工艺(高粱占比约为32%)[1],B厂为单粮浓香酿造工艺,主要采用高粱为原料发酵。而研究发现我国白酒酿造使用的粮谷原料中,高粱原料富含氰苷。蜀黍氰苷是高粱里主要的氰苷,不同品种的高粱中蜀黍氰苷的含量差异较大,含量范围为4.52~547.71 mg/kg[5, 19-20]。而不同的大米原料中总氰化物含量在45 μg/kg以下,小麦中总氰化物含量范围为63.02~168.95 μg/kg[21]。因此,高粱原料可能是白酒酿造过程中氰化物最主要的来源。这使得单粮与多粮的不同工艺条件下,高粱原料的品种及用量可能是影响酒醅中氰化物含量的一个重要因素。因此,优选低氰苷含量的酿酒原料对有效控制酿造过程中氰化物的产生及EC的形成具有重要意义。
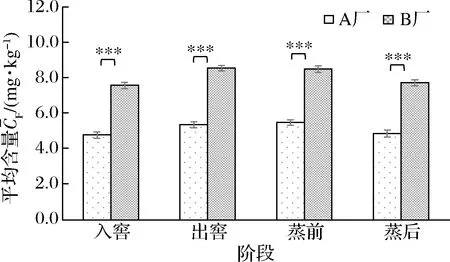
图3 两厂酒醅中非糖苷形态氰化物的含量Fig.3 The contents of non-glycosides cyanide in the fermented grains of the two distilleries注:**表示P<0.05;***表示P<0.01(下同)
2.4 浓香型白酒酿造酒醅中不同形态氰化物的含量分布分析
浓香型白酒采用独特的固态泥窖发酵,四川地区的浓香型白酒工艺上采用跑窖法或原窖法,发酵周期60~90 d;江苏地区常采用混烧老五甑工艺,发酵周期45~60 d[1]。复杂的微生物发酵和较长的窖池发酵时间,会造成窖池中不同形态氰化物的分布有所不同,为探究浓香型白酒酿造过程不同形态氰化物含量变化和分布规律,对A、B两厂几个关键工艺时间点的不同发酵层(上、中、下)酒醅中的非糖苷和游离形态氰化物进行了分析,结果如图4所示。
在窖池发酵阶段,出窖酒醅中非糖苷与游离形态氰化物的含量有所增加,这表明原料中的氰苷在发酵过程中发生了酶解反应。不同酒厂非糖苷与游离形态氰化物的含量上有明显差异,A厂发酵酒醅中非糖苷形态氰化物的平均含量为4.51~5.76 mg/kg,游离形态氰化物为3.47~4.62 mg/kg(图4-a);B厂发酵酒醅中非糖苷形态氰化物的平均含量为7.26~9.47 mg/kg,游离形态氰化物为4.82~7.99 mg/kg(图4-b)。二者之间的差值可体现氰醇的含量,氰醇的含量在窖池发酵前后变化不大,推测可能是由于部分氰醇在窖池发酵酒醅酸性(pH 3.2~3.8)的条件下不易完全分解。
在蒸馏取酒阶段,蒸酒后酒醅中的非糖苷形态氰化物含量均有下降,A厂蒸酒前后酒醅中的非糖苷形态氰化物的平均含量分别为5.43~5.62 mg/kg和4.76~5.06 mg/kg(图4-a),B厂为8.14~9.13 mg/kg和7.29~8.17 mg/kg(图4-b)。而游离形态氰化物含量变化不大,推测固态甑桶蒸馏操作的高温条件下,使得非糖苷氰化物发生进一步的分解反应,产生的氰化物经蒸馏操作释放到原酒中[4, 22]。
由图4可知,两厂在发酵前后及蒸馏前后的氰化物含量分布趋势呈现上层<中层<下层。这可能是由于浓香型白酒独特的泥窖发酵方式,发酵时间长,发酵过程中下层酒醅较为丰富的微生物代谢产生的降解酶等酶解反应有关[23]。因此,可在白酒发酵及蒸馏过程中对下层酒醅层区进行氰化物的监测,采取针对性的降氰措施,如筛选氰化物的降解菌株应用于发酵过程[22]等。
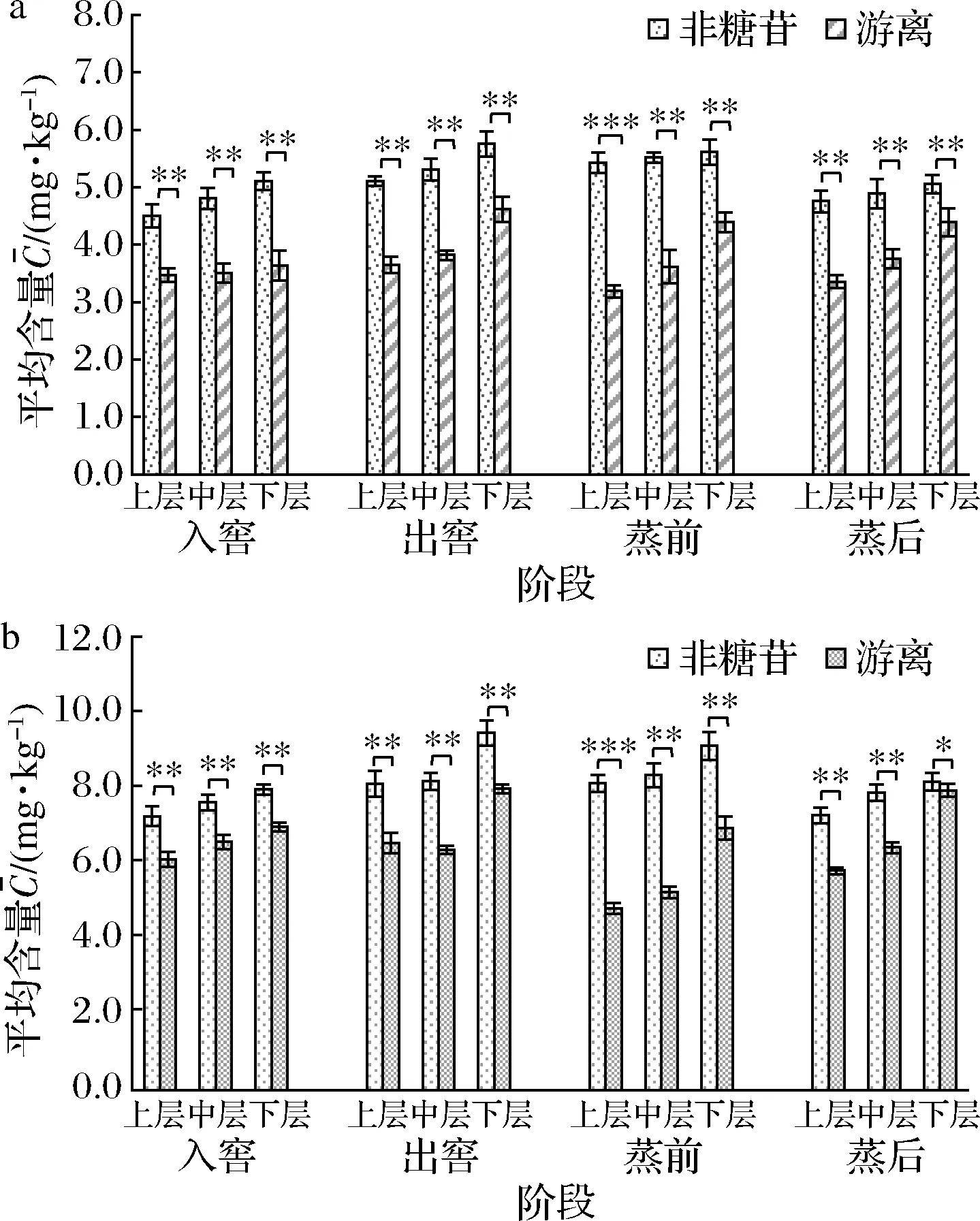
a-A厂发酵和蒸馏前后;b-B厂发酵和蒸馏前后图4 发酵与蒸馏过程不同形态氰化物的含量变化Fig.4 Concentration changes of different forms of cyanide during fermentation and distillation
2.5 浓香型原酒中游离氰化物与EC含量的分布规律
采用GC/MS的方法对不同酒醅层蒸得的浓香型原酒中游离氰化物和EC含量进行了测定。结果如表3和表4所示,原酒中游离氰化物平均含量为946.86~1 608.26 μg/L;EC的平均含量为30.18~105.15 μg/L。与张顺荣[5]检测的多种浓香型原酒中氰化物(536.56 μg/L)和EC(952.04 μg/L)平均含量相比,本研究测定的EC含量结果较低,推测可能与原酒样品经蒸馏后直至检测分析的时间长短有关,有研究发现刚刚蒸馏出来的原酒其EC含量通常较低,含量在40~70 μg/L,经过贮存后含量会有明显的上升[5, 24-25]。比较表3和表4可发现,A厂原酒中的游离氰化物和EC的含量均明显低于B厂,且氰化物含量较高的原酒中EC含量也较高,这可能与B厂发酵及蒸馏过程中较高氰化物含量水平的酒醅有关,发酵酒醅中的氰化物经固态甑桶蒸馏进入到原酒中与乙醇反应产生EC[4, 24]。白酒蒸馏过程中EC含量与氰化物含量可能具有一定的相关性,这与张顺荣等[5, 24]对白酒中的氰化物和EC含量的研究结论相符合。对于不同酒醅层(上、中、下)蒸得的原酒,游离氰化物及EC的含量分布趋势也呈现上层<中层<下层,这与酒醅中的氰含量分布趋势一致,已有研究推测氰化物可能是白酒酒醅蒸馏期间EC形成的主要前体,由于EC的高沸点和氰化物的易挥发性,约80%的EC是在蒸馏过程产生的[5]。因此,可针对下层酒醅蒸馏取酒的过程,通过提高回流二次蒸馏等措施来降低原酒中的EC含量[25]。

表3 浓香型原酒中游离氰化物(CN-)含量(n=3) 单位:μg/L
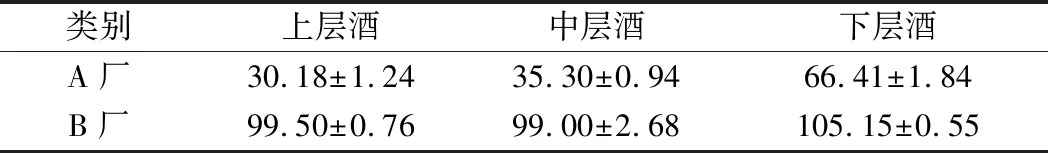
表4 浓香型原酒中EC含量(n=3) 单位:μg/L
3 结论
本研究首次建立了QuEChERS前处理联合GC/MS技术测定白酒酿造过程酒醅中不同形态的氰化物的方法,并对不同工艺浓香型白酒发酵过程中不同形态氰化物的变化规律进行了分析。结果显示,酿造过程酒醅中存在着不同形态的氰化物,包括氰苷、非糖苷和游离形态。不同工艺对原料特别是高粱原料的品种选择及用量配比,影响着氰化物的初始引入量。在发酵及蒸馏阶段,非糖苷形态与游离形态的氰化物含量有明显差异,窖池发酵酒醅中可能存在着部分氰醇形态的氰化物;蒸馏过程非糖苷形态氰化物存在进一步的分解释放,酒醅中不同形态氰化物含量分布趋势均呈上层<中层<下层。蒸得的原酒中游离氰化物与EC的含量分布趋势与酒醅的分布趋势一致,呈现上层<中层<下层的规律。本研究发现可以通过筛选低氰苷含量的酿酒原料,在白酒发酵及蒸馏过程中对高氰含量的下层酒醅层区进行氰化物监测和采取针对性的降氰措施,降低白酒酿造过程中氰化物及EC的生成,以控制成品酒的质量安全。
