一清颗粒联合环磷酰胺对三阴性乳腺癌荷瘤小鼠移植瘤的影响*
2022-12-29邱剑飞张知音吴小森李艳梅
邱剑飞,张知音,赵 鹏,李 珂,吴小森,李 静,杨 珏**,李艳梅**
(1.省部共建药用植物功效与利用国家重点实验室 贵阳 550014;2.贵州省中国科学院天然产物化学重点实验室贵阳 550014;3.贵州医科大学基础医学院现代病原生物学特色重点实验室 贵阳 550025;4.贵航贵阳医院 贵阳 553009;5.湖南省湘西自治州烟草公司永顺县分公司 湘西自治州 416000)
根据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据,2020年,新发女性乳腺癌病例(226万例)首次超过肺癌(221万例),成为全球第一大癌症。中国是乳腺癌大国,2020年新发乳腺癌患者约42万例,导致近12万人死亡[1]。临床上根据患者雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受 体-2(human epidermal growth factor receptor-2,HER-2)表达情况的不同把乳腺癌分为3种类型,包括激素受体阳性乳腺癌、表皮生长因子受体-2阳性乳腺癌和三阴性乳腺癌(triple-negative breast cancer,TNBC)[2]。激素受体阳性乳腺癌是指患者ER或PR表达为阳性,HER-2表达为阴性。表皮生长因子受体-2阳性乳腺癌是指患者的HER-2表达为阳性,同时ER和PR表达均为阴性。三阴性乳腺癌是指患者ER、PR及HER-2表达均为阴性,也是乳腺癌中具有高度转移特性的一种亚型。
手术治疗是三阴性乳腺癌治疗的首选方案[3]。对于全身情况较差,年老体弱不能耐受手术的乳腺癌患者,需要制定相应的化疗及放疗方案进行治疗[4]。无论是化疗还是放疗,都存在作用靶点单一、治疗效果有限的弊端,同时会带来一些副作用,患者会出现一定程度的身体损伤,比如临床上治疗过程中因患者个人体质不同可能会出现恶心、呕吐、头晕、头痛等不良反应。环磷酰胺是乳腺癌治疗中的一种常见的烷化剂类化疗药物,与DNA发生烷化,形成交叉联结,可直接破坏DNA的结构,诱导肿瘤细胞发生凋亡和抑制肿瘤细胞增殖,但其对机体正常细胞也会产生毒副作用,如骨髓抑制和免疫抑制等[5]。所以,目前在三阴性乳腺癌的治疗方面可以选择的方案有限。因此,开发有效治疗三阴性乳腺癌的创新药物或新的治疗策略迫在眉睫。
近年来,基础和临床研究结果显示部分中药及其活性成分与环磷酰胺联用具有良好的增效减毒作用,并且能够延长患者生存期[6-8],可见中医药在现代肿瘤防治中扮演着重要角色。一清颗粒源自张仲景《金匮要略》之三黄泻心汤,由大黄、黄芩、黄连三味药组成,具有清热泻火解毒、化瘀凉血止血之效[9],临床用于火毒血热所致的身热烦躁、目赤口疮、咽喉牙龈肿痛和咽炎等。另有研究表明,一清颗粒中的大黄、黄芩和黄连三味药均能表现出一定的抗三阴性乳腺癌的作用[10-12],而三味药联合用药是否能够发挥协同作用、抑制三阴性乳腺癌,目前尚未见报道。以4T1乳腺癌荷瘤小鼠为模型对三阴性乳腺癌进行研究已有较多报道[12-13]。为此本实验利用小鼠三阴性乳腺癌细胞4T1制备BALB/c乳腺癌荷瘤小鼠模型,以研究一清颗粒单用及与环磷酰胺联用时对三阴性乳腺癌荷瘤小鼠移植瘤的影响,为临床抗乳腺癌联合药物方案的选择提供实验依据,为复方中药的二次开发提供新的思路。
1 材料与方法
1.1 细胞
小鼠三阴性乳腺癌4T1细胞系,贵州省中国科学院天然产物化学重点实验室常规保存。
1.2 实验动物
雌性BALB/c小鼠,鼠龄4-6周龄,体重18-20 g,购自北京斯贝福生物技术有限公司。动物生产许可证号:SCXK(京)2019-0010。
1.3 药品与试剂
一清颗粒,规格:每袋7.5 g,批准文号:国药准字Z20055404,批号:20190605,购自贵州百灵企业集团正鑫药业有限公司;环磷酰胺注射液,规格:每支3 mg,注册证号:H20160467,批号:8D229A,自德国Baxter Oncology GmbH公 司。TRIzol购 自 美 国Invitrogen公 司,货 号:15596-018,逆 转 录 试 剂 盒PrimeScript™RT reagent Kit with gDNA Eraser购 自 日本TaKaRa公司,货号:RRO47Q,荧光定量试剂盒FastStart Universal SYBY Green Master(ROX)购自瑞士罗氏公司,货号:4913850001。DMEM培养基、胎牛血清、胰酶,均购自美国Gibco公司。
1.4 主要仪器
细胞培养箱(Thermo scientific)生物安全柜(Thermo scientific),倒置显微镜(ZEISS公司),台式离心机(BECKMAN),电子天平(METTLER TOLEDO公司)。NanoDrop 2000超微量分光光度计(Thermo scientific),StepOne PLUS荧光定量PCR仪(ABI)。
1.5 模型构建
取对数生长期4T1小鼠三阴性乳腺癌细胞,用0.25%胰酶和0.02%乙二胺四乙酸(EDTA)消化处理,收集细胞,用DMEM培养基重悬,制备单细胞悬液,调整细胞密度为1×106cell·mL-1,每只小鼠右侧第二乳头脂肪垫皮下注射50µL细胞悬液。
1.6 分组与给药方案
将成功建立的乳腺癌荷瘤小鼠随机分为阴性对照组、阳性对照组(环磷酰胺)、实验组(一清颗粒)和联合组(一清颗粒+环磷酰胺),每组8只。按照人与动物体表面积换算给药剂量给与小鼠药物,阳性对照组每日腹腔注射30 mg·kg-1环磷酰胺,实验组每日灌胃20 g·kg-1一清颗粒,联合组每日腹腔注射30 mg·kg-1环磷酰胺+每日灌胃20 g·kg-1一清颗粒。阴性对照组每日灌胃等体积0.9%NaCl+每日腹腔注射等体积0.9%NaCl。
1.7 观察肿瘤生长体积
从给药后第1天开始,每隔1天,用游标卡尺测量测量瘤体的长径(A)和短径(B),瘤块体积=0.5×长径(A)×短径(B)2。
1.8 测定各组抑瘤率、胸腺指数
采血后,颈椎脱臼法处死各组小鼠,解剖并摘取小鼠的移植瘤块组织、脾脏和胸腺,精密称重后计算各组抑瘤率、脾指数和胸腺指数,抑瘤率(%)=[1-阳性对照组(实验组或联合组)平均瘤重/阴性对照组平均瘤重]×100%;脾(胸腺)指数=脾(胸腺)重(mg)/体重(g)。
1.9 测定各组中性粒细胞、外周血淋巴细胞和单核细胞的比例
末次给药结束后,眼眶采血测定血常规,测定各组中性粒细胞、外周血淋巴细胞和单核细胞的比例。
1.10 测定各组荷瘤小鼠肿瘤组织中CD4+T和CD8+T细胞比例
将各组小鼠肿瘤组织在含有1 mg·mL-1I型胶原酶的RPMI-1640培养基中用剪刀剪成2 mm×2 mm的小块,置于37℃,消化1 h。将组织过2次70 µm的细胞筛,使用红细胞裂解液进行裂解,PBS清洗2遍,3000 rpm离心5 min,PBS重悬后得到肿瘤组织单细胞混悬液。按照使用说明书,使用Ficoll淋巴细胞分离液,分离得到淋巴细胞。用CytoFLEX流式细胞仪检测肿瘤淋巴细胞比例,操作如下:将得到的淋巴细胞用2% BSA于4℃封闭30 min,之后取1.0×106细胞(100 µL体积)加入荧光标记的抗小鼠CD4和CD8抗体,离心,PBS重悬后,上机检测CD4+T细胞和CD8+T细胞的比例。
1.11 RT-PCR技术测定各组瘤组织中IL-6和TNFα mRNA的表达水平
取各组小鼠的肿瘤组织适量,加入1 mL的TRIzol试剂,冰上研磨制成组织匀浆,裂解5 min,加200µL三氯甲烷,上下颠倒2 min,室温静置3 min;4℃12000 rpm离心15 min;将上层无色水相转移到新的EP管中;加等体积异丙醇,混匀,-20℃静置40 min;4℃12000 rpm离心10 min;弃去上清,用预冷的75%乙醇1.0 mL洗涤沉淀物;4℃7500 rpm离心5min;弃上清;风干5-10 min,用DEPC水溶解沉淀物;取适量溶解后的总RNA,用NanoDrop 2000超微量分光光度计测定RNA浓度。使用TaKaRa逆转录试剂盒进行逆转录合成cDNA。利用Roche荧光定量试剂盒FastStart Universal SYBY Green Master(ROX),按照该试剂盒说明书配制反应体系,最后通过StepOne PLUS荧光定量PCR仪扩增检测各组瘤组织中IL-6和TNF-α mRNA的表达水平,IL-6和TNF-α基因的引物序列设计如下:IL-6上游引物:5’-AGTTGCCTTCTTGGGACTGA-3’,下游引物:5’-TCCACGATTTCCCAGAGAAC-3’;TNF-α上游引物:5’-TATGGCTCAGGGTCCAACTC-3’,下游引物:5’-CTCCCTTTGCAGAACTCAGG-3’。
1.12 测定各组体质量增加率
称量给药前和给药结束后小鼠体质量,计算各组体质量增加率,体质量增加率=(实验结束后体质量-实验前体质量)/实验前体质量×100%。
1.13 统计学处理
使用SPSS 21.0软件进行统计分析。计量资料用均值±标准差(±s)表示,两组间比较使用t检验,多组间均数比较用单因素多样本方差分析,计数资料采用卡方检验。
2 结果
2.1 对小鼠移植瘤肿瘤体积变化的影响
与阴性对照组相比,阳性对照组和联合组肿瘤生长速度缓慢,而实验组效果不明显,并且联合组肿瘤生长速度低于阳性对照组。给药7天后,阳性对照组和联合组的移植瘤体积与阴性对照组相比均有显著差异(P<0.01)。且给药11天后,联合组的移植瘤体积与阳性对照组比较,差异具有统计学意义(P<0.05,P<0.01),说明一清颗粒与环磷酰胺联用可以显著增强环磷酰胺对荷瘤小鼠瘤体积生长的抑制作用。结果见图1。
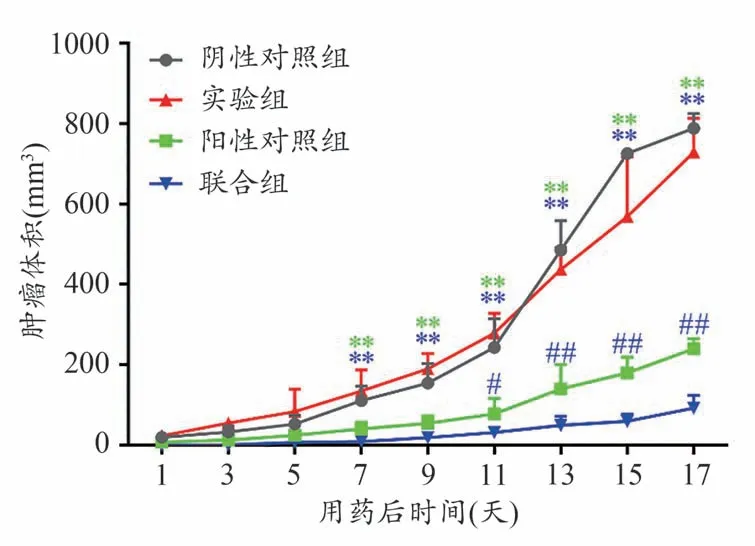
图1 各组荷瘤小鼠瘤体体积变化情况(±s,n=8)
2.2 对各组荷瘤小鼠存活时间的影响
体内实验结果显示阴性对照组、阳性对照组、实验组和联合组的生存比例分别为37.5%、50%、37.5%和87.5%,并且联合组与阴性对照组和实验组相比,差异均具有统计学意义(P=0.03)(P=0.047)。该结果表明一清颗粒和环磷酰胺联用可以提高荷瘤小鼠的存活率,延长小鼠存活时间(图2)。

图2 各组荷瘤小鼠存活时间(n=8)
2.3 对小鼠移植瘤重量和抑瘤率的影响
实验结果显示阳性对照组、实验组和联合组的抑瘤率分别为60.34%、24.77%和76.46%。与阴性对照组相比,阳性对照组和联合组的肿瘤重量均显著降低(P<0.01),与阳性对照组相比,联合组的肿瘤重量显著下降(P<0.01)且抑瘤率增加。说明一清颗粒与环磷酰胺联用可增强环磷酰胺的抑瘤效果,见表1和图3。
表1 各组荷瘤小鼠肿瘤重量及抑瘤率(±s,n=3)

表1 各组荷瘤小鼠肿瘤重量及抑瘤率(±s,n=3)
注:各组间肿瘤重量采用t检验,与阴性对照组比,*P<0.05,**P<0.01,与阳性对照组比,#P<0.05,##P<0.01;抑瘤率采用卡方检验,与阳性对照组比,*P<0.05。
?
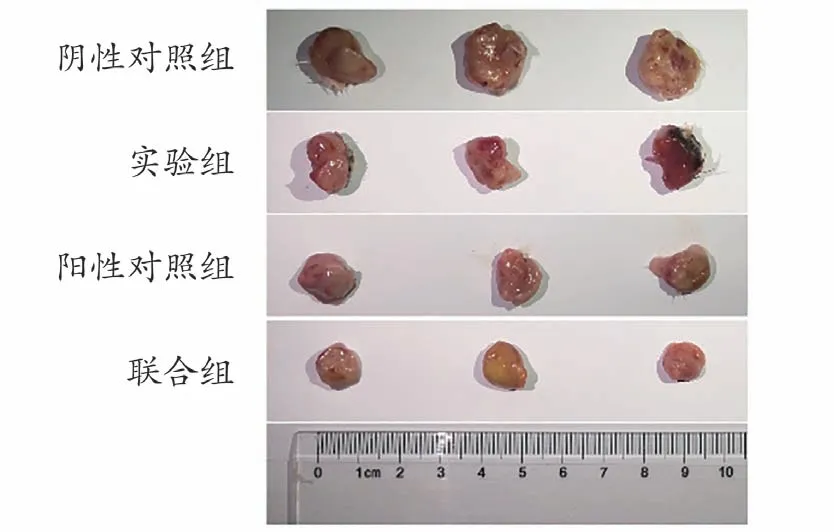
图3 各组小鼠瘤体
2.4 对荷瘤小鼠脾指数和胸腺指数的影响
与阴性对照组相比,阳性对照组小鼠的胸腺指数受到明显抑制(P<0.05),而脾指数无明显影响;实验组和联合组小鼠胸腺指数和脾指数也均无明显影响。与阳性对照相比,联合组小鼠胸腺指数显著增加(P<0.01),脾指数无显著性差异,说明一清颗粒和环磷酰胺联用可以改善环磷酰胺单独使用时所抑制的胸腺指数。见表2。
表2 各组荷瘤小鼠脾指数和胸腺指数(±s,n=3)

表2 各组荷瘤小鼠脾指数和胸腺指数(±s,n=3)
注:与阴性对照组比,*P<0.05,**P<0.01,与阳性对照组比,#P<0.05,##P<0.01。
?
2.5 对各组荷瘤小鼠中性粒细胞、外周血淋巴细胞和单核细胞比例的影响
与阴性对照组比较,阳性对照组的小鼠外周血淋巴细胞比例明显下降(P<0.05),实验组和联用组无显著性差异。与阴性对照组比较,阳性对照组、实验组和联合组的小鼠中性粒细胞比例和单核细胞比例无明显差异。与阳性对照组比,联用组可以显著提高淋巴细胞的比例(P<0.05),说明一清颗粒可显著改善环磷酰胺单独使用时对淋巴细胞比例的抑制作用,见表3。
表3 各组荷瘤小鼠血常规指数(±s,n=3)

表3 各组荷瘤小鼠血常规指数(±s,n=3)
注:与阴性对照组比,*P<0.05,**P<0.01,与阳性对照组比,#P<0.05。
?
2.6 对各组荷瘤小鼠肿瘤组织中CD4+T和CD8+T细胞比例的影响
与阴性对照组比较,实验组和联合组的肿瘤组织中CD4+T和CD8+T细胞比例明显增加(P<0.05,P<0.01),而阳性对照组无显著性差异。与阳性对照组比,联用组可以显著提高肿瘤组织中的CD4+T和CD8+T细胞比例(P<0.01),见表4和图4。
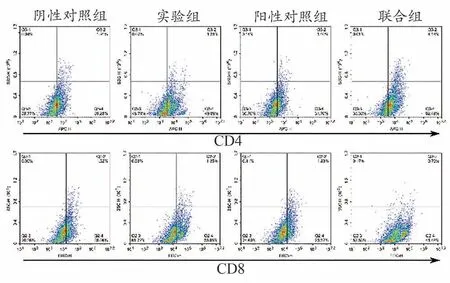
图4 各组荷瘤小鼠肿瘤组织中CD4+T和CD8+T细胞比例
表4 各组荷瘤小鼠肿瘤组织中CD4+T和CD8+T细胞比例(±s,n=3)
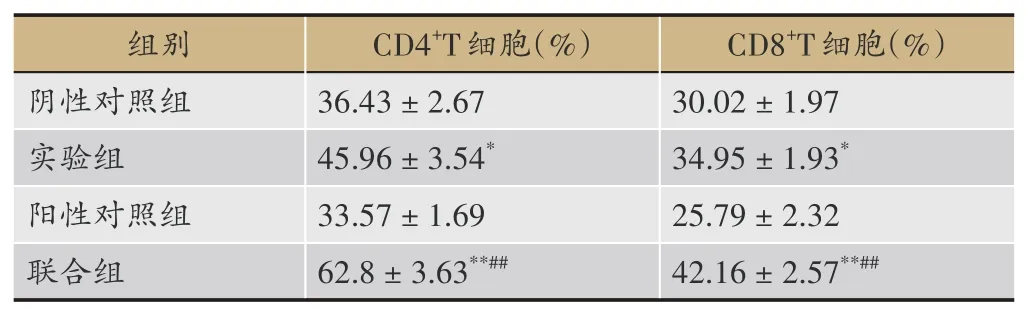
表4 各组荷瘤小鼠肿瘤组织中CD4+T和CD8+T细胞比例(±s,n=3)
注:与阴性对照组比,*P<0.05,**P<0.01,与阳性对照组比,#P<0.05,##P<0.01。
?
2.7 对各组荷瘤小鼠肿瘤组织中IL-6和TNF-α mRNA表达水平的影响
与阴性对照组比较,实验组、阳性对照组和联合组的肿瘤组织中IL-6和TNF-α mRNA表达水平显著降低(P<0.05,P<0.01)。并且与阳性对照组比,联用组的肿瘤组织中IL-6表达水平较低(P<0.05),而TNF-α没有显著性差异,见表5。
表5 各组荷瘤小鼠肿瘤组织中IL-6和TNF-α mRNA表达水平(±s,n=3)

表5 各组荷瘤小鼠肿瘤组织中IL-6和TNF-α mRNA表达水平(±s,n=3)
注:与阴性对照组比,*P<0.05,**P<0.01,与阳性对照组比,#P<0.05。
?
2.8 对各组荷瘤小鼠体质量增加率的影响
与阴性对照组相比,阳性对照组、实验组和联用组的体质量增加率均显著降低(P<0.05,P<0.01)。与阳性对照组相比,实验组和联用组的体质量增加率明显提高(P<0.05),说明一清颗粒与环磷酰胺联用可以降低环磷酰胺对小鼠体重的影响,见表6。
表6 各组荷瘤小鼠体质量增加百分率的比较(±s,n=3)
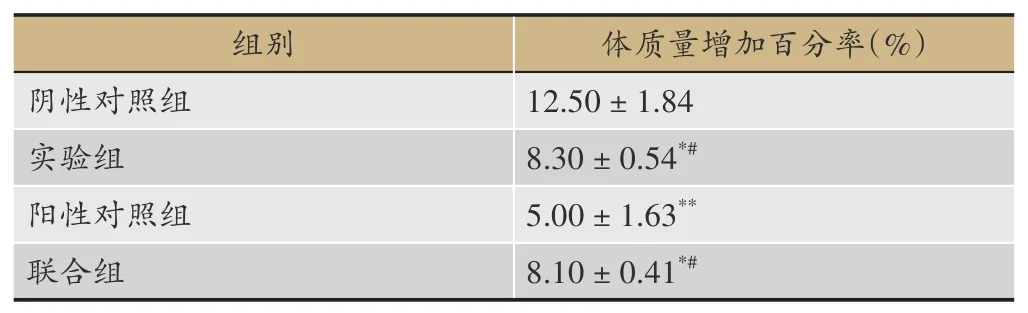
表6 各组荷瘤小鼠体质量增加百分率的比较(±s,n=3)
注:与阴性对照组比,*P<0.05,**P<0.01,与阳性对照组比,#P<0.05
?
3 讨论
据统计约15%的患者为三阴性乳腺癌,由于缺失3种关键的治疗靶点:雌激素受体(ER)、孕激素受体(PR)和人类表皮生长因子受体2(HER-2),导致内分泌治疗或抗HER-2靶向治疗的方案对之疗效甚微[14-15]。目前,化疗是三阴性乳腺癌的主要治疗方式,但是5年内患者复发转移的风险高达20%[16]。另一方面,长期使用化疗药物会产生副作用和药物抗性,也成为三阴性乳腺癌治疗的难点[17]。
与大多数其他恶性肿瘤不同,乳腺癌最初被认为是免疫原性较低的癌症类型。然而,多项研究表明,具有高水平淋巴细胞浸润的早期和晚期三阴性或HER-2阳性乳腺癌患者预后较好,表明三阴性乳腺癌患者也可以从免疫检查点抑制剂中获益[18-20]。虽然肿瘤免疫检查点抑制疗法(如PD-1和PD-L1抗体)已被批准用于局部晚期或转移的三阴性乳腺癌的临床治疗,但是由于肿瘤异质性、免疫逃逸和肿瘤微环境的复杂性,免疫检查点抑制疗法仍然存在一定的障碍和挑战。数据显示只有10-20%的三阴性乳腺癌患者对免疫治疗有好的响应[21]。因此,开发有效治疗三阴性乳腺癌的创新药物迫在眉睫,但是如何发现这类新型药物是亟需探究和解决的科学问题。
多年的临床实践表明,清热类中药的药理作用广泛,具有解热、抗炎、抗肿瘤和提高机体免疫能力等功能,且疗效确切。目前,传统清热类中药在三阴性乳腺癌的治疗上也取得许多新进展。例如,在中药提取物方面,蒲公英的提取物能够通过内质网应激相关信号通路诱导三阴性乳腺癌MDA-MB-231细胞发生凋亡,抑制细胞增殖[22]。在中药复方制剂方面,复方半边莲口服液能够显著提高CD4+T和CD8+T细胞比例,降低调节性T细胞比例,提高了荷瘤小鼠的抗肿瘤免疫能力[23]。由此可见,清热类中药可通过多种途径发挥抗三阴性乳腺癌的作用,这为治疗三阴性乳腺癌的新型药物开发提供了潜在的活性物质基础。
目前化疗常作为三阴乳腺癌根治性手术后的一线治疗手段,临床上常见副作用较多,对患者的生理功能损害较大,而使用一些清热类药物辅助化疗治疗在临床上具有一定增效减毒的作用。如施晓丽等[24]采用清热解毒法与新辅助化疗相结合的方法治疗乳腺癌,发现能明显改善患者免疫功能,使白细胞及中性粒细胞减少的发生率得以减少。戴玉娜等[25]复方苦参注射液联合乳腺癌新辅助化疗的疗效观察结果显示,联合组能提高治疗效果,减轻血小板减少、肝功能异常和胃肠道反应等毒副作用。可见清热类中药不仅自身具有抗三阴性乳腺癌的潜能,也可以作为辅助化疗治疗三阴性乳腺癌,可起到增加疗效、减轻毒副反应和改善患者生存质量的作用。因此发现与化疗药物联用具有增效减毒的清热类药物,对于解决化疗药物的毒副作用及耐药现象具有一定的临床意义。
中医学认为乳腺癌属于气血失调和痰凝毒滞等所致的杂症,机体正气受损,而化疗又进一步耗损气血和热毒损伤,因此治宜清热解毒以及养阴益气。一清颗粒是由黄连、大黄、黄芩三味药组成的清热剂,方中黄连和黄芩分别重于清心胃之火和肺胃之火,并可凉血止血。大黄清热解毒,攻积泄热,三味药联合具有清热泻火解毒、化瘀凉血止血之效。为了考察一清颗粒是否具有抗三阴性乳腺癌的作用,本研究利用小鼠三阴性乳腺癌细胞株4T1建立乳腺癌荷瘤小鼠模型,分为阴性对照组、一清颗粒、阳性药环磷酰胺和一清颗粒与环磷酰胺联用组,以在体内评价一清颗粒单用和联用时对三阴性乳腺癌的作用。结果显示一清颗粒单用时对三阴性乳腺癌荷瘤小鼠的效果不佳,但是与环磷酰胺联用可增强环磷酰胺对荷瘤小鼠体积生长的抑制作用,提高环磷酰胺的抑瘤率,并且能够延长荷瘤小鼠的存活时间,能够发挥协同增效的作用,为一清颗粒这种清热解毒药物能够用于三阴性乳腺癌的辅助治疗提供实验依据。由于化疗药物长期使用可能使肿瘤细胞对其的敏感性降低,一清颗粒作为复方中药具有多成分,多靶点的作用特征,是否可能通过改善肿瘤微环境而发挥增效作用,仍需要进一步探究。
环磷酰胺有显著的抗肿瘤效应,但是同时也具有免疫抑制的作用,长期使用会导致一些副作用,比如胃肠道反应、对血液系统有一定的损伤和骨髓抑制等。本研究中结果显示阳性对照组的小鼠外周血淋巴细胞比例、胸腺指数以及体质量增加率都显著低于阴性对照组。淋巴细胞是介导机体特异性免疫应答的主力,而胸腺是T细胞发育、分化的主要场所,是身体免疫系统重要的器官,其器官指数可反映免疫功能[26-28]。免疫功能对肿瘤的发生、发展有着重要的调控作用,肿瘤浸润淋巴细胞(tumor infiltrates lymphocytes,TILs)是最早被发现的免疫细胞,其中的CD4+T和CD8+T细胞具有一定的抗肿瘤免疫作用[29-30]。一清颗粒与环磷酰胺联用组可以明显拮抗环磷酰胺单独使用时对胸腺指数和淋巴细胞比例的抑制作用。同时一清颗粒与环磷酰胺联用组肿瘤组织中的CD4+T和CD8+T细胞比例也显著增加,提高了机体抗肿瘤免疫应答。肿瘤微环境的炎症因子如IL-6、IL8和TNF-α等在包括乳腺癌在内的多种肿瘤中扮演着重要的角色,最近有研究表明乳腺癌肿瘤微环境中IL-6过度表达,并且能激活下游信号通路介导乳腺癌的增殖、转移和耐药等[31-32]。有研究人员发现下调血清中TNF-α的表达可以促进长期抗肿瘤免疫[33]。本研究的结果发现一清颗粒、环磷酰胺及两者联用均能下调乳腺癌瘤组织中IL-6和TNF-α的表达,表明一清颗粒与环磷酰胺对肿瘤炎症因子有一定的影响。体质量增加率可一定程度上反应小鼠生存质量[34-35]。阳性对照组的结果提示环磷酰胺可造成小鼠免疫抑制并且体重下降。一清颗粒与环磷酰胺联用组可以降低环磷酰胺对小鼠体重的影响,改善小鼠的生存质量,因此一清颗粒能够减轻因环磷酰胺引起的毒性反应,发挥减毒作用。
综上所述,一清颗粒联合环磷酰胺不仅可以有效抑制三阴性乳腺癌荷瘤小鼠移植瘤的生长,同时可以在一定程度上改善环磷酰胺所造成的骨髓、免疫器官等损害,从而起到增效减毒的作用。该研究不仅为一清颗粒这种清热药物在临床肿瘤化疗中的辅助应用提供了实验依据和理论基础,同时也对一清颗粒的二次开发提供新的思路,但是其具体的分子机制及化学物质基础仍需进一步深入研究。
参考文献2
1 Sung H,Ferlay J,Siegel R L,et al.Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries.CA Cancer J Clin,2021,71(3):209-249.
2 Feng F,Zhang D J,Han F K,et al.Downregulation ofGATSgene inhibits proliferation,clonogenicity and migration in triple negative breast cancer cells MDA-MB-231 by cell autophagy.Cancer Biomark,2019,26(3):261-269.
3 Cont N T,Maggiorotto F,Martincich L,et al.Primary tumor location predicts the site of local relapse after nipple-areola complex(NAC)sparing mastectomy.Breast Cancer Res Treat,2017,165(1):85-95.、
4刘晓宇,李静蔚,刘晓菲,等.中药联合新辅助化疗治疗乳腺癌的研究进展.环球中医药,2021,14(2):357-362.
5 Zong S,Li J L,Yang L,et al.Synergistic antitumor effect of polysaccharide fromLachnumsp.in combination with cyclophosphamide in hepatocellular carcinoma.Carbohydr Polym,2018,196:33-46.
6代春美,陈香,胡相卡,等.芪胶升白胶囊联合环磷酰胺对S180荷瘤小鼠增效减毒作用研究.天然产物研究与开发,2016,28(7):1029-1034.
7赵妙惠,周佳妮,漆勇.桑黄多糖调控PI3K/AKT/mTOR通路抑制肝癌腹水荷瘤小鼠及对化疗的减毒增效作用.中国临床药理学与治疗学,2020,25(4):401-407.
8刘丹,谢枫枫,陈莹.香砂六君子汤对乳腺癌化疗患者的减毒及增效作用观察.湖南中医药大学学报,2018,38(4):455-458.
9陈哲杰,李文,林美斯,等.三黄泻心汤研究现状及其关键技术与核心问题分析.中草药,2016,47(22):4111-4117.
10张淑群,高晓燕,薛兴欢,等.黄芩素对人乳腺癌MDA-MB-231细胞株SATB1表达的影响.中国肿瘤临床,2014,41(6):355-358.
11孙玮.芦荟大黄素与顺铂对乳腺癌MDA-MB-231细胞Bcl-2及Bcl-xL表达水平的影响.中国实用医刊,2018,45(21):112-115.
12王斌,许诗雨,刘嘉欣,等.黄连总生物碱联合运动通过阻滞细胞周期G1/S转换抑制原位移植4T1乳腺癌小鼠荷瘤生长的研究.中国中药杂志,2019,44(8):1635-1641.
13陆慧敏,孙文熙,霍晨星,等.基于MEKK1/SEK1/JNK1/AP-1通路探讨三七总皂苷对4T1乳腺癌荷瘤小鼠肿瘤模型的影响.中国实验方剂学杂志,2020,26(24):75-81.
14 Waks A G,Winer E P.Breast cancer treatment.JAMA,2019,321(3):316.
15 Denkert C,Liedtke C,Tutt A,et al.Molecular alterations in triplenegative breast cancer—The road to new treatment strategies.Lancet,2017,389(10087):2430-2442.
16 Li J J,Yu K D,Pang D,et al.Adjuvant capecitabine with docetaxel and cyclophosphamide plus epirubicin for triple-negative breast cancer(CBCSG010):An open-label,randomized,multicenter,phase III trial.J Clin Oncol,2020,38(16):1774-1784.
17 NedeljkovićM,DamjanovićA.Mechanisms of chemotherapy resistance in triple-negative breast cancer-how we can rise to the challenge.Cells,2019,8(9):957.
18 Loi S,Drubay D,Adams S,et al.Tumor-infiltrating lymphocytes and prognosis:A pooled individual patient analysis of early-stage triplenegative breast cancers.J Clin Oncol,2019,37(7):559-569.
19 Park J H,Jonas S F,Bataillon G,et al.Prognostic value of tumorinfiltrating lymphocytes in patients with early-stage triple-negative breast cancers(TNBC)who did not receive adjuvant chemotherapy.Ann Oncol,2019,30(12):1941-1949.
20 Wein L,Luen S J,Savas P,et al.Checkpoint blockade in the treatment of breast cancer:current status and future directions.Br J Cancer,2018,119(1):4-11.
21 Keenan T E,Tolaney S M.Role of Role of immunotherapy in triplenegative breast cancer.J Natl Compr Canc Netw,2020,18(4):479-489.
22 Li X H,He X R,Zhou Y Y,et al.Taraxacum mongolicumextract induced endoplasmic reticulum stress associated-apoptosis in triplenegative breast cancer cells.J Ethnopharmacol,2017,206:55-64.
23夏雪竹,董永强,刘翠红,等.复方半边莲口服液对乳腺癌荷瘤小鼠抗肿瘤免疫的影响.川北医学院学报,2020,35(2):203-206.
24施晓丽,谢俊.清热解毒法联合新辅助化疗治疗乳腺癌的疗效及对免疫功能和生活质量的影响.现代中西医结合杂志,2019,28(12):1288-1291.
25戴玉娜,韩建军,李菊梅,等.复方苦参注射液应用于乳腺癌新辅助化疗的疗效观察.辽宁中医杂志,2019,46(10):2121-2123.
26 Zhou Y L,Chen X Y,Yi R K,et al.Immunomodulatory effect ofTremellapolysaccharides against cyclophosphamide-induced immunosuppression in mice.Molecules,2018,23(2):239.
27吴仪,龙承星.痛泻要方对泄泻肝气乘脾证小鼠血常规及脏器的影响.湖北中医药大学学报,2020,22(4):18-21.
28张林超.白花蛇舌草多糖对肾癌荷瘤小鼠肿瘤生长及免疫调节作用的影响.中成药,2021,43(3):765-769.
29 Désage A L,Karpathiou G,Peoc'h M,et al.The immune microenvironment of malignant pleural mesothelioma:A literature review.Cancers,2021,13(13):3205.
30 Nelson M A,Ngamcherdtrakul W,Luoh S W,et al.Prognostic and therapeutic role of tumor-infiltrating lymphocyte subtypes in breast cancer.Cancer Metastasis Rev,2021,40(2):519-536.
31 Masjedi A,Hashemi V,Hojjat-Farsangi M,et al.The significant role of interleukin-6 and its signaling pathway in the immunopathogenesis and treatment of breast cancer.Biomed Pharmacother,2018,108:1415-1424.
32 Siersbæk R,Scabia V,Nagarajan S,et al.IL6/STAT3 signaling hijacks estrogen receptor α enhancers to drive breast cancer metastasis.Cancer Cell,2020,38(3):412-423.e9.
33 Lou Y,Wang J J,Peng P,et al.Downregulated TNF-α levels after cryo-thermal therapy drive tregs fragility to promote long-term antitumor immunity.Int J Mol Sci,2021,22(18):9951.
34侯超,胡志希,曾柏荣,等.抗癌防移片对4T1小鼠乳腺癌影响的研究.湖南中医药大学学报,2014,34(4):6-9.
35彭莉,苏泽琦,赵保胜,等.滋阴安神方对实验性更年期模型大鼠的影响.中国实验方剂学杂志,2018,24(15):137-142.
