实时动态超声造影在多囊肝射频消融术治疗中的有效性及安全性分析
2022-12-29方崟又陈志丞
方崟又 陈志丞 宗 方
义乌市中心医院超声科,浙江义乌 322000
多囊肝又称多发性肝囊肿,是一种常染色体显性基因遗传病,患者早期无明显症状,随着囊肿逐渐增大,出现腹部隆起、疼痛、恶心、呕吐、食欲下降等症状[1,2]。多囊肝临床尚无标准治疗方案,囊肿抽液、开窗去顶等外科手术均存在术后并发症发生率高、复发率高等情况,治疗效果均不理想[3,4]。射频消融术(radiofrequency ablation,RFA)是一种微创疗法,其根据肿瘤细胞耐热性差的特点,通过超声引导射频消融针至病灶位置,利用高频电流使肿瘤内部组织高热而被杀死[5]。与常规超声相比,超声造影可提供肿瘤的实时动态影像,对提高术前诊断的敏感性、降低漏诊率及术后评价病灶残留等具有显著的临床意义[6]。本研究旨在探讨实时动态超声造影在多囊肝RFA 治疗中的有效性及安全性,为临床治疗提供参考。
1 资料与方法
1.1 一般资料
选取2018 年5 月至2019 年6 月于义乌市中心医院行RFA 的98 例多囊肝患者为研究对象,根据随机数字表法将其分为造影组(n=49)和常规组(n=49)。纳入标准:①术前经肝脏增强CT 确诊为多囊肝;②肝脏储备功能分级为A 级。排除标准:①合并凝血功能障碍;②合并全身性感染;③对超声造影剂过敏者。两组患者的一般资料比较差异均无统计学意义(P>0.05),见表1。所有患者均签署知情同意书,本研究已获得义乌市中心医院伦理委员会批准(批件号:K2022-IRB-033)。

表1 两组患者的一般资料比较
1.2 方法
入组患者术前均行CT 及磁共振成像检查,根据影像结果制订进针路径及治疗方案。术前两组患者均禁食、禁水8h,入室后行静脉镇静,监测患者的血压、心率、呼吸频率、心电图等生命体征。常规组患者行常规超声(飞利浦CX50)检查后确定消融范围,全身麻醉后在超声引导下将消融电极经皮置入囊肿内,以起始功率120W 行RFA 治疗,每次治疗时间12min。当囊肿直径≥2cm 或相邻囊肿直径>5cm 时,先将消融电极置入囊内,抽净囊液,囊壁回缩至附着电极再行消融,囊壁被强回声覆盖后结束消融;当囊肿直径<2cm 时,消融电极置入囊内后无需抽液直接启动消融,囊肿及囊壁被强回声覆盖后结束消融。消融后超声检查肝周围出血情况。造影组患者超声造影检查:超声诊断仪(Acuson Sequia-512)频率调至2.5~4.0MHz,先行常规扫描,观察多囊肝病灶形态大小、数量、位置等情况,后切换为实时动态造影模式,选用SonoVue(意大利Bracco 生产)冻干粉注入生理盐水5ml 并震荡至微泡混悬液状态,抽取混悬液1.3ml 以团注法经肘静脉注入后,立即注入5ml 生理盐水冲洗管道,观察感兴趣区域的血流灌注情况,记录病灶强化特点。随后迅速扫描全肝筛查可疑病灶,待确定消融范围后行RFA 治疗,方法同常规组。
采集两组患者的术前及术后1 周空腹外周静脉血3ml 检测肝功能,包括丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和总胆红素(total bilirubin,TBIL)。两组患者分别于术前、术后6 个月行上腹部CT 扫描,以门静脉期的容积测量肝内囊肿总体积,比较其肝内囊肿总体积并计算肝囊肿总体积缩小率,肝囊肿总体积缩小率=(术前囊肿总体积-术后6 个月囊肿总体积)/术前囊肿总体积×100%,记录术后完全灭活数、术后局部残存数及不良反应发生情况。
1.3 统计学方法
采用SPSS 21.0 软件进行数据处理与分析。计数资料以例数(百分率)[n(%)]表示,比较采用χ2检验;计量资料以均数±标准差()表示,比较采用t检验。检验水准α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者的术后疗效比较
两组患者的术前肝囊肿体积比较差异无统计学意义(P>0.05),术后6 个月两组患者的肝囊肿体积均显著缩小,造影组患者的肝囊肿体积显著小于常规组(P<0.05);造影组患者的术后肝囊肿总体积缩小率显著大于常规组(P<0.05);造影组患者的术后完全灭活率显著高于常规组(P<0.05),见表2。
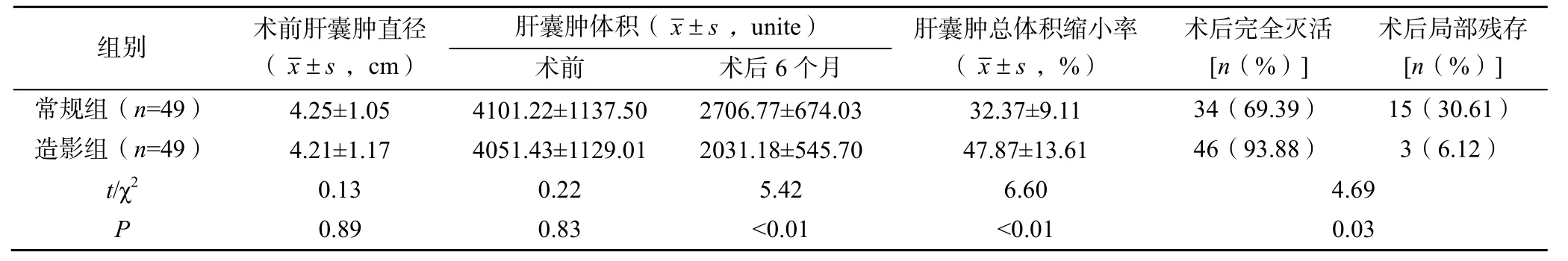
表2 两组患者的术后疗效比较
2.2 两组患者的肝功能比较
术前和术后1 周,两组患者的ALT、AST、TBIL比较差异均无统计学意义(P>0.05),见表3。
表3 两组患者的肝功能比较( )
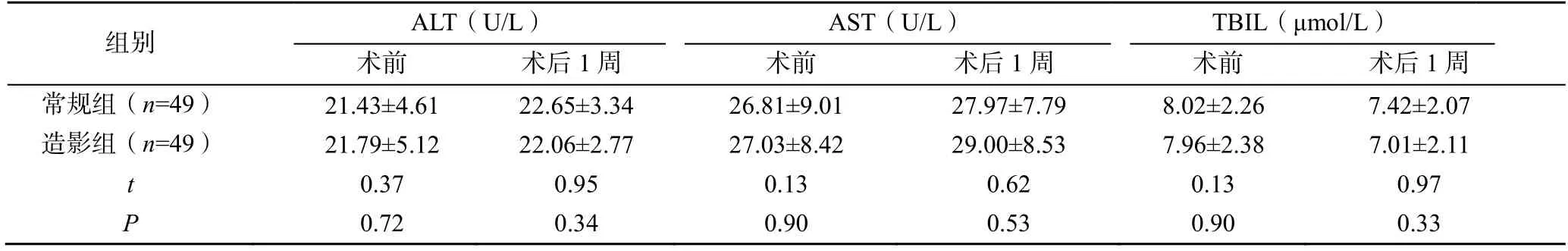
表3 两组患者的肝功能比较( )
2.3 两组患者的术后不良反应比较
两组患者的术后不良反应发生率比较,差异无统计学意义(P>0.05),见表4。

表4 两组患者的术后不良反应比较[n(%)]
3 讨论
多囊肝是可对肝脏造成弥散性损伤的良性肿瘤,90%以上的患者合并多囊肾,影像学检查可见肝脏体积增大,囊肿大小不一,囊与囊之间无肝实质,且边缘光滑清晰,囊内部密度均匀[7,8]。多囊肝患者早期无临床症状,囊肿增大到一定程度后压迫肺部造成呼吸困难,压迫肠胃造成食欲不振、恶心、食管反流,压迫肝门静脉导致门静脉高压[9];若囊肿破裂或出血可发生失血性休克等急症[10]。多囊肝的临床治疗尚无标准方案,常规超声引导囊肿穿刺抽液及硬化术、肝囊肿开窗术及肝移植等均在一定程度上存在缺陷[11]。研究表明,囊肿穿刺引流复发率高,且其与硬化治疗术均存在乙醇中毒风险,囊壁破损也增加复发概率,多次引流硬化亦可造成肝组织纤维化,严重影响患者术后的生活质量[12-14]。因此,探索有效治疗多囊肝并降低肝损伤、减少术后复发的治疗手段具有重要意义。
RFA 在对房颤、心律失常及<3cm 的肝癌病灶的临床治疗中均展现出有效率高、微创、并发症少、复发率低等优势[15-17]。RFA 可通过发射高频交变电流,引导并快速转变细胞内导电离子或极化分子的运动方向,使之在组织内部相互摩擦并生热,造成细胞内蛋白质不可逆性的凝固、坏死,从而消除病灶而达到治疗的目的[18]。采用RFA 治疗多囊肝即是利用消融产生的热效应使囊肿的囊壁细胞发生不可逆性凝固、坏死,彻底破坏其分泌能力,消除囊肿复发的基础,防止其术后复发。张珊珊等[19]发现,RFA 术后即刻,患者腹胀等不适症状较术前明显好转,术后1 周治愈率92.31%,且无不良反应发生,说明RFA 在多囊肝临床治疗中确实安全有效。张瑶等[20]发现,90 例经常规超声引导的肝癌患者RFA 术后1 个月CT 复查病灶残留率为13.33%;而采用超声造影引导下的104 例肝癌患者残留率仅为3.85%。由此可知,RFA 的治疗效果与影像学存在关联。多囊肝的囊肿大小不同,囊肿间分隔不排除存在受压血管,传统二维超声及多普勒血流显像对细小血管分支的成像能力有限,不能引导术中穿刺避开血管;超声造影可在常规超声基础上,利用造影剂中气泡在声场中产生强烈背向散射,并以此散射的对比获取增强图像,观察并判断病灶组织局部的血流灌注信息,尤其可增加微细血管的成像,显著提高诊疗水平。因此,超声造影不仅可应用于术前诊断,还可为术中指导手术范围、术后评价疗效、改进治疗方案等提供可视化依据。本研究结果显示,造影组患者术后完全灭活率达93.75%,显著高于常规组的69.39%;术后肝囊肿总体积缩小率显著高于常规组。提示超声造影可提高RFA 在多囊肝治疗中的有效率,与上述研究基本吻合。同时本研究结果发现,两组患者的术前、术后ALT、AST、TBIL 比较差异均无统计学意义,不良反应发生率亦无统计学意义,提示超声造影应用于多囊肝治疗不会造成更高的肝脏负荷,安全性良好。
综上所述,实时动态超声造影可有效提高多囊肝RFA 治疗效果,减少术后局部残留数,且未加重肝脏负荷,适宜临床推广。
