聚维酮碘对豚鼠耳毒性的实验观察
2022-12-29廖辉煌金雪玲夏云燕李朝霞陈静熊园平余蓉涂翔罗五根
廖辉煌金雪玲夏云燕李朝霞陈静熊园平余蓉涂翔罗五根
1南昌大学第一附属医院耳鼻咽喉头颈外科(南昌 330000)
2中山大学附属第七医院耳鼻咽喉头颈外科(深圳 518107)
慢性化脓性中耳炎是耳科学最常见疾病,其常见的症状是反复耳流脓与听力下降,影响患者的工作与生活,鼓室成形术是目前主要治疗方法。鼓室成形术术后患者有1%-11%的概率发生术区感染[1],其原因可能是与术前外耳和中耳未充分消毒及术中用生理盐水冲洗术腔有关。目前,尚未有报道术前可用于中耳黏膜的消毒液。酒精和碘酒对皮肤黏膜有较大的刺激性,如遇面神经裸露的患者,在中耳腔使用有致面瘫的风险。在更早的研究中,已经证明消毒剂氯己定,苄索氯铵和苯扎氯铵对豚鼠的内耳具有耳毒性[2-4]。
聚维酮碘(Povidone Iodine,PVP-I)溶液是一种高效广谱的杀菌消毒剂,目前已广泛应用外科手术中皮肤与黏膜的消毒。但有关聚维酮碘能否用于中耳腔黏膜消毒及进入中耳后对中耳黏膜及内耳毛细胞有无影响尚不清楚。目前,国内外有少量关于聚维酮碘对中耳腔和耳蜗毒性的研究,部分动物实验结果与临床实验结论并不完全一致。本实验通过鼓室内注入聚维酮碘溶液后从听力学、中-内耳解剖、免疫荧光染色及HE染色方面验证聚维酮碘是否会对内耳造成损害,探索聚维酮碘能否用于鼓室成形术中外耳道皮肤与中耳黏膜的消毒及中耳炎合并真菌感染的耳浴治疗。
1 材料和方法
1.1 实验动物
选取26只正常体重成年豚鼠,由湖南太平生物科技有限公司提供(许可证号:SCXK(湘)2020-0005),雌雄不限。入选条件:ABR反应阙<40dB nHL
1.2 实验方法
1.2.1 分组与给药
随机分成4组,一次生理盐水给药组(Once saline,OS)4只;一次聚维酮碘给药组(Once PVP-I,OP)9只;连续生理盐水给药组(Continuous saline,CS)4只;连续聚维酮碘给药组Continuous PVP-I,CP)9只。
1.2.2 动物造模
用电子分析天平称取聚维酮碘粉末5.0g置容量瓶中,加生理盐水定容至100ml,装入棕色瓶中避光保存。一次给药组:双耳经鼓室注射药液0.2ml生理盐水或聚维酮碘溶液,作用10min后吸出;连续给药组:双耳经鼓室注射药液0.2ml生理盐水或聚维酮碘溶液,作用10min后吸出,一天一次,连续7天(图1)。
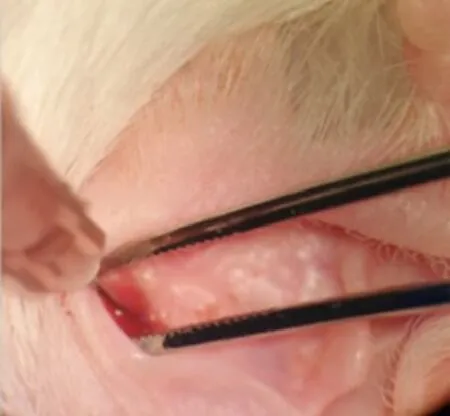
图1 中耳腔给药场景Fig.1 Scenario of drug delivery in the middle ear scene
1.2.3 听性脑干反应(ABR)测试
左下腹腔按40mg/kg体重注射,2%戊巴比妥钠溶液麻醉,记录电极置于耳后,参考电极置于颅顶,接地电极置于鼻尖,利用诱发电位系统检测记录ABR反应阈(图2)。以短声作为刺激声,以能分辨出可重复III波的最低刺激强度判断阈值。

图2 ABR检测场景Fig.2 ABR detection scene
1.2.4 中耳黏膜观察
动物在过量麻醉状态下,快速断头取两侧听泡。由2位研究人员在显微镜下通过评分系统[5](表1)对中耳腔充血、水肿,黏膜增厚和粘连程度进行评分。最后计算各项总平均分,最低4分,最高20分,分值越高,表示总体损伤越严重。

表1 中耳损伤严重程度的定义Table 1 Definitions for Severity of Middle Ear Damage
1.2.5 耳蜗基底膜免疫荧光染色
(1)剥离基底膜后用0.01M PBS洗三遍,每次10min;(2)PBST(0.25%Triton-PBS)浸泡 30 min;(3)5%BSA(PBST稀释)室温下封闭30min;(4)弃除BSA(5)滴加 PBST稀释的一抗(1:200)及鬼笔环肽(1:200),4℃过夜保存 16h;(6)PBS漂洗 3次,每次10min;(7)滴加Alexa488标记的羊抗兔二抗,37℃避光孵育1h;(8)PBS漂洗3次,每次5min;(9)荧光防淬灭剂封片,免疫荧光显微镜下观察,分别截取每组每个样本耳蜗各回同等部位三排外毛细胞,在视野下记录正常形态的细胞个数。
1.2.6 HE染色方法
取样本置载玻片上,经苏木素染色,盐酸乙醇分化,氨水反蓝,伊红染色,酒精脱水,二甲苯透明,封片后光镜下阅片。
1.3 数据统计与分析
应用SPSS25软件进行统计分析。计量资料以表示,结果用t检验和Dunnett检验进行统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 ABR检测结果
实验前,所有组豚鼠听力全部正常,均在15-20dB nHL范围(图3a)。实验后,OS和CS有1耳听力稍有下降,变化范围不超过10dB nHL(图3b,c),差异无统计学意义(P>0.05);OP组有2耳听力无下降,其余16耳有10-65dB nHL听力下降(图3d),差异有统计学意义(P<0.05);CP组有14耳全聋,90dB nHL未能引出III波(图3e),其余4耳亦有严重听力损失,差异有统计学意义(P<0.05)。同时我们计算出四组间实验后与实验前听力的差值发现,CP组听力差值最大,OP组听力差值次之,OS和CS组听力差值接近于0。对比四组间听力差值发现,除OS组与CS组听力差值间差异无统计学意义外(P>0.05),余各组间听力差值间差异有统计学意义(P<0.05),因此CP组听力下降最明显,OP组次之,OS和CS组听力改变最不明显。统计结果见表2。
表2 ABR 阈值(±s,n=56)(dB nHL)Table 2 ABR Thereshold(±s,n=56)(dB nHL)

表2 ABR 阈值(±s,n=56)(dB nHL)Table 2 ABR Thereshold(±s,n=56)(dB nHL)
Note:a,OS vs OP P<0.05;b,OS vs CP P<0.05;c,OP vs CS P<0.05;d,OP vs CP P<0.05;e,CS vs CP P<0.05
Group OS OP CS CP Ear 8 18 8 18 Before administration 18.12±2.58 16.94±2.50 15.62±1.76 17.22±2.55 After administration 18.75±3.53 45.55±25.08 16.25±2.31 76.94±21.36 Difference between before and after administration 0.63±1.77a,b 28.61±24.60c,d 0.63±1.77e 59.72±22.3 T 1.00 4.93 1.00 11.34 P*P>0.05*P<0.05*P>0.05*P<0.05
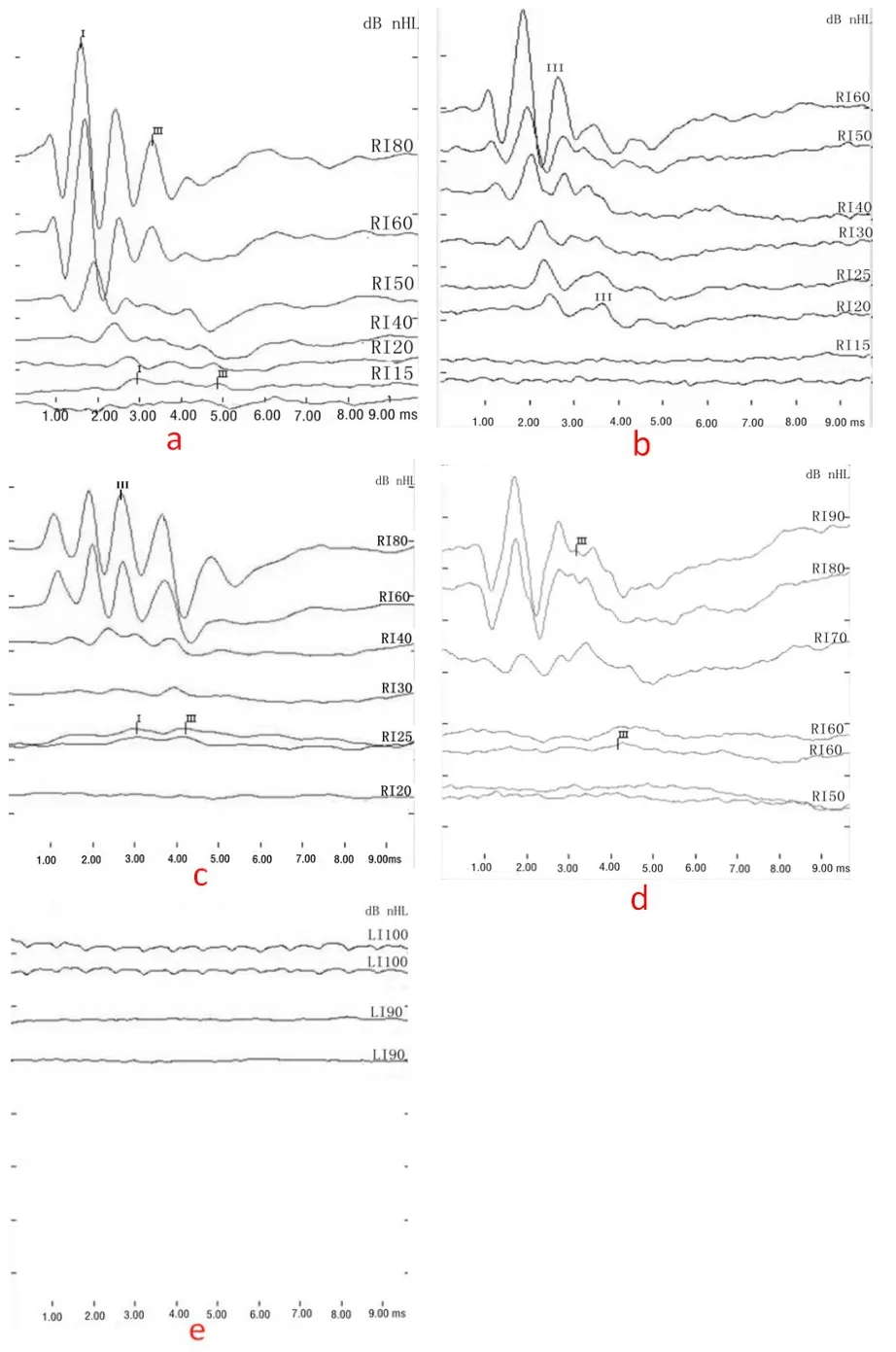
图3 a:正常豚鼠阈值在15-20dB nHL之间;b:OS组给药后有1耳阈值从15dB nHL上升到20dB nHL;c:CS组给药后有1耳阈值从20dB nHL上升到25 dB nHL;d:OP组给药后阈值从15dB nHL上升到60 dB nHL;e:CP组给药后阈值从15dBnHL上升到90dB nHL以上,未能引出有效的III波。Fig.3 a:The threshold of normal guinea pigs was between 15-20dB nHL;b:The threshold of 1 ear in the OS group increased from 15dB nHL to 20dB nHL after administration;c:The threshold of 1 ear in the CS group increased from 20dB nHL to 25 dB nHL after administration 2;d The threshold of OP group increased from 15dB nHL to 60 dB nHL after administration;e:The threshold of CP group increased from 15dB nHL to more than 90dB nHL after administration,and failed to elicit effective wave III after administration.
2.2 中耳、内耳解剖结果
OS组与正常解剖结构无明显差异,蜗壳表面覆有一层透明的黏膜,黏膜表面有1-2根微细血管,未出现黏膜充血、增厚、血肿、粘连现象(4a图);CS组偶见黏膜增厚和充血,无血肿和粘连形成;OP组以黏膜充血和血肿为主要变化,表现为蜗壳周围黏膜充血的血管增多,中耳腔周围出现不规则血肿,扩张的血管与之相连,无黏膜增厚和粘连现象(图4b);CP组损伤最严重,聚维碘酮渗入耳蜗后大多数整体呈褐色,蜗尖颜色最深,呈深褐色,整个中耳腔增厚的黏膜面积大于90%,血肿及充血面积大于50%,渗出物填满整个中耳腔(图4c),中耳腔、前庭池及骨螺旋板上有大量淡黄色絮状渗出物(图4d),其余组中耳腔及内耳未见絮状渗出物。中耳腔评分见表3。
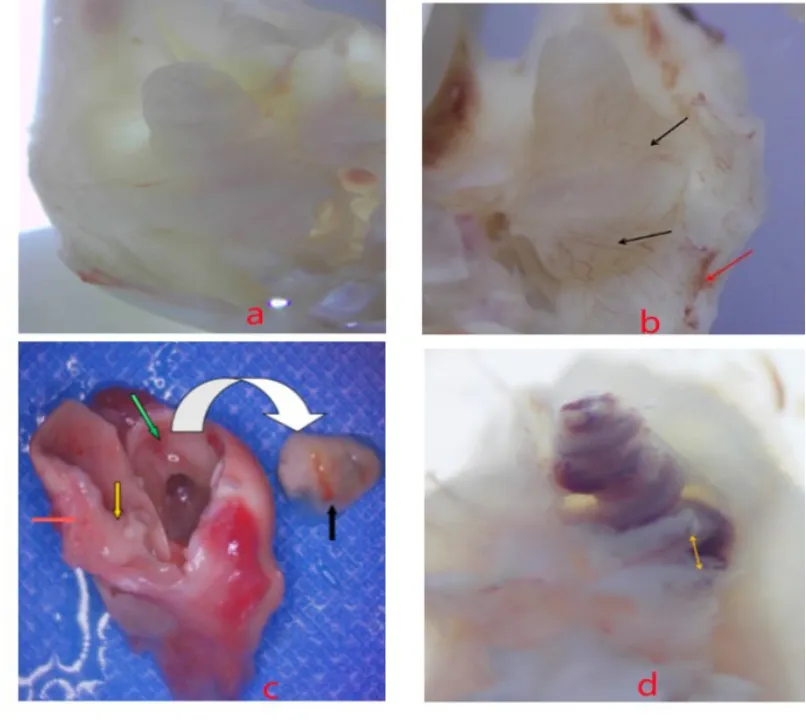
图4 a:OS组中耳腔黏膜无充血、增厚、血肿、粘连现象;b:OP组充血的血管(黑箭头)与血肿(红箭头)相连;c:CP组中耳腔黏膜增厚(黄箭头)、充血(红箭头),血肿(绿箭头),渗出物(黑箭头);d:CP组前庭池和骨螺旋板上大量黄色渗出物(黄色箭头)。Fig.4 a:OS group middle ear mucosa without hyperemia,thickening,hematoma,or adhesion;b:OP group congested blood vessels(black arrow)connected to hematoma(red arrow);c:CP group middle ear mucosa increased thick(yellow arrow),hyperemia(red arrow),hematoma(green arrow),exudate(black arrow);d:CP group a large amount of yellow exudate on the vestibular cistern and bone spiral plate(yellow arrow).

表3 中耳腔评分Table 3 Middle ear cavity score
2.3 HE染色结果
将CP组中耳腔及内耳渗出物在载玻片上涂片,经常规HE染色后可见大量炎症细胞渗出(图5)。
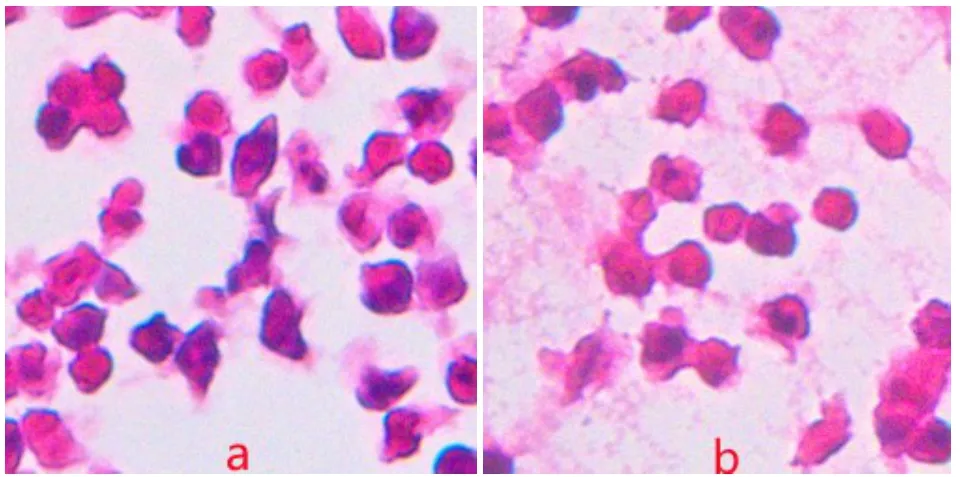
图5 a CP组中耳腔渗出物HE染色;b:CP组内耳渗出物HE染色(10×40)。Fig.5 a:HE staining of exudate from middle ear cavity in CP group 2;b:HE staining of exudate from inner ear in CP group(10×40).
2.4 耳蜗基底膜免疫荧光染色观察结果
OS组和CS组(图6、图7)和OP组(图8)耳蜗基底膜各回三排外毛细胞排列整齐,细胞形态清晰可辨认,细胞无肿胀,外毛细胞无丢失,三组间不存在明显差别;CP组(图9)各回外毛细胞均有不同程度丢失,以第一排丢失最常见,部分细胞肿大、结构模糊。所有组内毛细胞均未出现丢失。四组各回三排外毛细胞计数结果如表4所示,研究发现各回中CP组毛细胞计数显著低于其他三组(P<0.05),其他三组间毛细胞计数无显著差异(P>0.05)。

图6 OS组的三排外毛细胞排列整齐,细胞无肿胀、无缺失,纤毛呈V或W状排列;OHC:外毛细胞,IHC:内毛细胞;abcd依次为毛细胞第1、2、3、4回,×400Fig.6 In OS group,three rows of outer hair cells were arranged neatly,without swelling or deletion,and cilia were arranged in V or W shape;OHC:outer hair cells,IHC:inner hair cells;abcd is the first,second,third,and fourth circle of the basilar membrane,×400

图7 CS组与OS组细胞形态无差异,×400Fig.7 There was no difference in cell morphology between CS group and OS group,×400

图8 OP组基底膜毛细胞排列整齐均无丢失,形态正常,×400Fig.8 In OP group,basilar membrane hair cells were arranged neatly without loss,and their morphology was normal,×400

图9 CP组各回外毛细胞均有不同程度丢失(白圈),部分细胞肿大、结构模糊(黑圈),×400。Fig.9 CP group outer hair cells were lost to varying degrees in each round(white circles),and some cells were swollen and blurred in structure(black circles),×400.
表4 四组动物耳蜗各回三排外毛细胞统计比较(个/高倍镜,±s)Table 4 Statistical comparison of four rows of outer hair cells from cochlear each turn in three groups of animals(number/scope,±s)
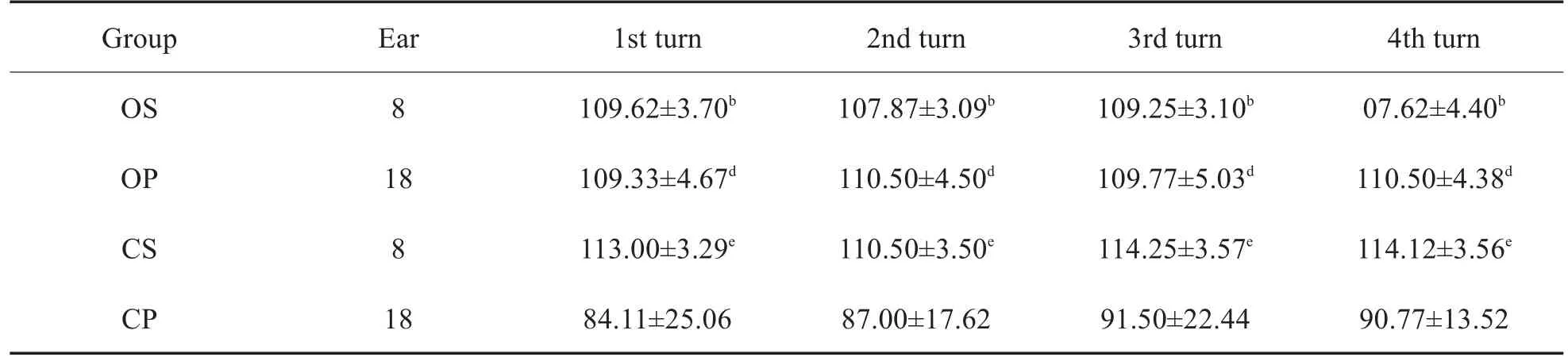
表4 四组动物耳蜗各回三排外毛细胞统计比较(个/高倍镜,±s)Table 4 Statistical comparison of four rows of outer hair cells from cochlear each turn in three groups of animals(number/scope,±s)
Note:b,OS vs CP P<0.05;d,OP vs CP P<0.05;e,CS vs CPP<0.05.
Group OS OP CS CP Ear 8 18 8 18 1st turn 109.62±3.70b 109.33±4.67d 113.00±3.29e 84.11±25.06 2nd turn 107.87±3.09b 110.50±4.50d 110.50±3.50e 87.00±17.62 3rd turn 109.25±3.10b 109.77±5.03d 114.25±3.57e 91.50±22.44 4th turn 07.62±4.40b 110.50±4.38d 114.12±3.56e 90.77±13.52
3 讨论
聚维酮碘是一种抗菌谱广、效率高、起效迅速、安全性高、理化性质稳定的常用消毒剂,按化学物质急性毒性分级标准属实际无毒性,使用后10-30秒便能达到满意效果,在临床上常用于手术区域消毒、换药、含漱、浸泡、术腔冲洗等方面。聚维酮碘系聚乙烯吡咯酮和碘的络合物,聚乙烯吡咯烷酮作为载体,有助于增强碘的溶解度,在接触到皮肤、黏膜后,缓慢释放出游离碘,游离碘可使微生物机体的蛋白质变性乃至凝固,导致死亡,而达到消毒杀菌的作用。目前市售碘伏有效碘含量为0.005g/ml,百分浓度为0.5%,多用于皮肤表面消毒;聚维酮碘溶液有效碘为0.05g/ml,百分浓度为5%。由此可见,后者的有效碘含量是前者的10倍,所以后者多用于手术创口的消毒[6-8]。
聚维酮碘对皮肤黏膜刺激小,可用于黏膜的消毒,但对中耳和内耳损害的研究,临床研究结论与部分动物实验结果与并不完全一致。周详、李永等人[7,9]使用5%聚维酮碘治疗中耳炎合并真菌感染后通过检测纯音听阈检查发现患者未出现听力下降。Jaya C等[10]给慢性化脓性中耳炎患者使用5%聚维酮碘滴耳液滴耳,研究结束时未见明显不良反应。Piromchai[11]报道了一位36岁的女性,她将大约三滴10%聚维酮碘滴入她的左耳道,她立即感到剧痛和眩晕,纯音听阈检测提示左耳重度感音神经性耳聋,磁共振成像显示左侧前庭轻度强化。因此,即使单次使用聚维酮碘也可能导致严重的听力损失和平衡失调。
在动物实验中研究聚维酮碘溶液研究对内耳是否有损害,不同实验者的研究结果不同。Yagiz R等[12]通以豚鼠为实验对象在鼓室内注入0.1ml的10%聚维酮碘溶液,之后在第10天和第30天进行TEOAE检测和耳镜检查。结果表现为TEOAE不能引出,6耳中发现2耳外耳道轻度水肿,4耳外耳道重度水肿。待外耳道皮肤消肿后行鼓室图检测仍然可以得到“A型”鼓室图;而所有生理盐水组耳的TEOAE反应、耳镜检查、鼓室图检测没有改变,实验结果表明聚维碘酮对豚鼠有耳蜗毒性作用;özkiriş等[13]应用畸变产物耳声发射研究不同浓度聚维酮碘溶液对大鼠中耳腔的耳毒性作用发现7.5%和10%聚维酮碘组在第1天和第10天表现出明显的耳毒性作用,而5%聚维酮碘组在第10天没有引起这种毒性作用,根据实验结果提出大鼠鼓膜局部给药可引起明显的耳毒性作用;Ichibangase T等[14]通过通过测定圆窗膜复合动作电位发现,使用10%浓度的溶液在24小时和7天时轻度听力损失,但使用5%的溶液在第7天时没有听力损失,并提出术中用生理盐水冲洗中耳腔可使该产品的耳毒性作用降至最低。Perez等[15]在耳内应用10%聚维酮碘溶液5天后检测前庭诱发电位和听性脑干反应发现两者实验前后没有明显的变化,因此认为在对鼓膜穿孔的耳朵进行消毒时,聚维酮碘可能比其他药物更好。以上实验仅观察了实验后的人或动物听力学及电生理的改变,并未从细胞形态学上进行研究。本实验通过实验研究观察耳蜗毛细胞的变化情况,从形态学方面提供了最直接的证据来验证聚维酮碘对内耳的毒性。
我们推测聚维酮碘溶液致聋可能有以下原因:1.骨迷路和膜迷路之间充满细胞外液样的外淋巴液,呈高钠低钾状态,局部使用的聚维酮碘经圆窗膜渗入到内耳后解离出来的I-扰乱了外淋巴液成分而致聋,且作用时间越久,致聋的可能性越大;2.聚维碘酮溶液进入中耳及内耳后产生炎症反应致聋,根据渗出物HE染色结果可以加以证实;3.I-在起消毒杀菌的作用时也对毛细胞产生了杀伤作用,我们通过免疫荧光染色可看出,CP组造成了外毛细胞丢失;而OP组可能由于作用时间短,来不及渗入到内耳而未造成损害;4.聚维酮碘溶液的浓度可能与听力损失的严重程度有关。另外有研究报道[16]聚维碘酮碘可能具有致突变作用,当碘作用于毛细胞中的某些蛋白质因子,如DNA或核糖体,然后这些因子可通过遗传密码中的碱基替换突变而被杀死。
OP组虽无毛细胞丢失,但此时内耳微环境可能发生了改变,毛细胞处于部分死亡而未溶解状态,功能已经受到影响,因为ABR阈值提高但仍有残余听力。CP组均是造成外毛细胞的丢失,这可能是由于内毛细胞对毒性的抵抗力较外毛细胞强,而不同排的外毛细胞受到的损伤程度相同[17]。此时内耳微环境发生明显改变,产生了大量炎症渗出物,大量毛细胞死亡,部分毛细胞溶解,在基底膜上出现缺失,而此时的ABR处于高阈值状态。
从解剖学上讲,与啮齿类动物相比,人类的圆窗很少暴露于中耳腔,并且圆窗膜的厚度明显更大且具有更多的胶原纤维。另外,临床上使用的滴耳液通常是在局部炎症的环境中进行的,而动物实验研究通常是在健康的耳朵中进行的,急性炎症可增加圆窗膜的通透性,而慢性炎症由于组织纤维化而显示出相反的效果[18],这可能是不同实验结果不一致的原因之一。
实验从听力学、中-内耳解剖、免疫荧光染色及HE染色方面验证了5%聚维酮碘溶液是具有耳毒性的。本实验属于动物实验,下一步实验将设置不同的药物浓度梯度,探索最佳的药浓度,即可有效消毒杀菌又不对听力产生损害。同时,需大量临床试验和更有力度的检测方法研究聚维酮碘的耳毒性,但基于目前的动物实验结果,我们建议在耳科手术术前消毒时应当避免聚维酮碘溶液进入中耳以免产生损害。在手术消毒时我们可以用稍挤干的聚维酮碘棉片对外耳道及中耳黏膜进行填塞或擦洗,可降低聚维酮碘溶液经圆窗膜渗入到内耳的可能性。如不慎流入中耳腔应立即用生理盐水冲洗干净。另外,在中耳炎鼓膜穿孔合并外耳道真菌感染时也不建议使用聚维酮碘溶液进行耳浴治疗,可局部填塞聚维酮碘纱条。
