意大利蜜蜂工蜂幼虫肠道中ame-miR-bantam对靶基因USP和P300的表达调控
2022-12-28张文德王思懿张凯遥任中民蔺哲广赵红霞陈大福
胡 颖, 张文德, 王思懿, 张凯遥, 任中民, 吉 挺, 蔺哲广, 赵红霞, 陈大福,2,*, 郭 睿,2,*
(1. 福建农林大学动物科学学院(蜂学学院), 福州 350002; 2. 福建省蜂疗研究所, 福州 350002; 3. 扬州大学动物科学与技术学院, 江苏扬州 225000; 4. 广东省科学院动物研究所, 广州 510260)
微小RNA(microRNA, miRNA)是一类小非编码RNA(non-coding RNA, ncRNA),在转录后水平上负调控基因表达(Bartel, 2004)。 在秀丽隐杆线虫Caenorhabditiselegans中,首次发现的miRNA(lin-4)和稍后鉴定到的let-7均被证实参与调节秀丽隐杆线虫的发育进程(Leeetal., 1993; Roush and Slack, 2008)。前人对西方蜜蜂Apismellifera的miRNA进行过较多研究,主要涉及极型分化(Guoetal., 2013; Ashbyetal., 2016)和蜂王产卵行为等生物学过程(Chenetal., 2017)。但对西方蜜蜂幼虫的miRNA研究较为滞后,相关功能研究更为匮乏。蜜蜂肠道是消化食物、吸收营养和免疫防御的关键部位(梁勤和陈大福, 2009)。前人关于蜜蜂肠道的研究主要集中在成年蜜蜂的肠道微生物方面(Engeletal., 2013; Ellegaardetal., 2015)。
意大利蜜蜂Apismelliferaligustica(简称“意蜂”)是西方蜜蜂的优良亚种,也是我国养蜂生产使用的主要蜂种,具有群势大、产量高及繁殖力强等优点。前期研究中,笔者团队全面解析了意大利蜜蜂工蜂幼虫肠道发育过程的差异基因表达谱(郭睿等, 2018),系统鉴定了幼虫肠道中的miRNA(熊翠玲等, 2018),并揭示了差异miRNA在肠道发育中的潜在调控作用(郭睿等, 2018)。miR-bantam在冈比亚按蚊Anophelesgambiae、小菜蛾Plutellaxylostella和黑腹果蝇Drosophilamelanogaster等昆虫中的研究已见诸报道(Liangetal., 2013; Biryukovaetal., 2014; Wuetal., 2017)。Nolo等(2006)曾对果蝇的miR-bantam进行过表达,发现Yorkie突变细胞的生长缺陷发生改变,同时因Hippo过度活化而诱导的细胞死亡受到抑制。此外,miR-bantam还能调节表皮生长因子及MAPK和Hippo信号通路进而调控果蝇生长发育(Herranzetal., 2012)。此前,人们对意大利蜜蜂和中华蜜蜂Apisceranacerana的miR-bantam进行过研究,发现其丰度在不同蜂种、不同日龄幼虫的王浆中均有显著差异(Shietal., 2012; Guoetal., 2013),其表达量在西方蜜蜂蜂王、工蜂和雄蜂幼虫中也具有明显差异(Ashbyetal., 2016),表明miR-bantam潜在参与调控西方蜜蜂幼虫的生长发育。
变态发育是昆虫适应生态环境和气候变化的主要生存策略之一,超气门蛋白(ultraspiracle protein, USP)作为蜕皮激素作用的受体,与昆虫发育密切相关(柳鹏飞等, 2021)。家蚕Bombyxmori和斜纹夜蛾Prodenialitura中USP在幼虫-蛹变态过程中高量表达(黄明霞等, 2014)。Chavoshi等(2010)研究表明USP在果蝇的胚胎发育及变态发育中起到重要作用。在梨小食心虫Grapholithamolesta中,USP表达水平降低可导致变态过程中化蛹时间延长、蛹死亡率升高(Caoetal., 2015)。Wnt信号通路在生物体的进化过程中高度保守,参与调控胚胎的生长和形态发育,能量代谢平衡,组织的稳定性及干细胞维持等诸多生物学过程,本研究中,P300可注释到Wnt信号通路。
笔者所在团队前期已通过small RNA-seq(sRNA-seq)对意大利蜜蜂4-6日龄工蜂幼虫肠道进行测序,共鉴定到515个保守miRNA和45个新miRNA(熊翠玲等, 2018),解析了miRNA的差异表达谱(郭睿等, 2018),验证了ame-miR-bantam的表达和序列真实性,并检测了ame-miR-bantam在蛹期发育过程的表达谱(祝智威等, 2022)。目前,意大利蜜蜂工蜂幼虫肠道组织中ame-miR-bantam与USP和P300之间是否存在靶向关系,以及ame-miR-bantam如何调控USP和P300表达尚不清楚。本研究通过饲喂法对前期鉴定到的ame-miR-bantam进行过表达及敲减,预测和分析其靶基因,进而检测靶基因USP和P300的表达量动态变化,以期明确ame-miR-bantam与USP和P300间的调控关系。研究结果可为探究ame-miR-bantam通过调控USP和P300表达影响意大利蜜蜂工蜂幼虫肠道发育的分子机理提供依据。
1 材料与方法
1.1 供试昆虫
意大利蜜蜂工蜂幼虫取自福建省福州市仓山区上下店路15号福建农林大学动物科学学院(蜂学学院)教学蜂场的饲养蜂群。
1.2 工蜂幼虫肠道中ame-miR-bantam的过表达和敲减
根据祝智威等(2022)的方法,委托北京擎科生物科技有限公司设计合成ame-miR-bantam的模拟物mimic-ame-miR-bantam和抑制物inhibitor-ame-miR-bantam, 及其对应的阴性对照mimic-NC-ame-miR-bantam和inhibitor-NC-ame-miR-bantam,序列信息见表1。参照笔者团队前期建立的技术流程(Chenetal., 2017)进行意大利蜜蜂工蜂幼虫的人工饲养与肠道样品制备:(1)挑选群势较强且无白垩病症状的意大利蜜蜂蜂群,限王产卵后用移虫针将脾上2日龄工蜂幼虫移至预置50 μL饲料(蜂王浆50%,葡萄糖6%,果糖6%,酵母粉1%,无菌水37%)的48孔细胞培养板中,放入温度35±0.5℃和相对湿度(RH)90%的恒温恒湿箱,每组准备24头幼虫供后续实验;(2)分别配制含mimic-ame-miR-bantam, inhibitor-ame-miR-bantam, mimic-NC-ame-miR-bantam和inhibitor-NC-ame-miR-bantam的饲料,终浓度均为25 pmol/g,用于饲喂3日龄幼虫,每24 h补加50 μL饲料;(3)在超净工作台中分别剖取4-6日龄工蜂幼虫肠道,每3只肠道样品置于一个RNA-Free EP管为1个生物学重复,经液氮速冻后立即转移到-80℃超低温冰箱保存备用,每组设3个生物学重复。

表1 ame-miR-bantam的模拟物和抑制物及其对应的阴性对照序列Table 1 Sequences of the mimic and inhibitor and their corresponding negative controls of ame-miR-bantam
1.3 ame-miR-bantam的过表达和敲减效果检测
根据ame-miR-bantam的核酸序列设计特异性的Loop引物和上下游引物(表2)。 通过RT-qPCR检测1.2节饲喂含mimic-ame-miR-bantam, inhibitor-ame-miR-bantam, mimic-NC-ame-miR-bantam和inhibitor-NC-ame-miR-bantam饲料后工蜂幼虫肠道组织中ame-miR-bantam的相对表达量: (1)使用RNA提取试剂盒(诺唯赞,南京)分别提取mimic-ame-miR-bantam组、inhibitor-ame-miR-bantam组、mimic-NC-ame-miR-bantam组和inhibitor-NC-ame-miR-bantam组4-6日龄工蜂幼虫肠道样品的总RNA;(2)利用反转录试剂盒(Yeasen,上海)和Loop引物反转录得到ame-miR-bantam的cDNA,另使用olig(dT)与随机引物反转录得到内参U6的cDNA;(3)使用ABI QuantStudio 3荧光定量PCR系统(ABI公司,美国)进行RT-qPCR反应。PCR反应体系(20 μL): SYBR Green Dye 10 μL, 上下游引物(2.5 pmol/μL)各1 μL, cDNA模板1 μL, DEPC水7 μL。反应程序: 95℃ 5 min; 95℃ 30 s, 59℃ 45 s, 72℃ 20 s, 40个循环。引物信息见表2。每个生物学重复进行3次技术重复。

表2 RT-qPCR引物信息Table 2 Primer information for RT-qPCR
1.4 ame-miR-bantam的靶基因预测及分析
联用TargetScan(Version: 7.0), Miranda(v3.3a)和RNAhybrid(v2.1.2)+svm_light(v6.01)3种软件预测ame-miR-bantam的靶mRNA,将预测结果的交集作为可信度高的靶mRNA集合,再根据靶mRNA的Nr数据库(ftp:∥ftp.ncbi.nih.gov/blast/db)注释得到靶基因集合。进一步利用Blast工具将上述靶基因比对到GO(http:∥www.geneontology.org/)和KEGG(http:∥www.genome.jp/kegg/pathway.html)数据库以获得相应的注释信息。
1.5 ame-miR-bantam靶基因的相对表达量检测
根据1.4节预测到的靶基因的Nr和KEGG数据库注释信息,同时参考其他昆虫物种的相关研究报道(Koles and Budnik, 2012; Swarup and Verheyen, 2012; Browningetal., 2021),挑选与生长发育密切相关的靶基因P300和USP进行进一步研究。利用Adobe Illustrate软件(Adobe公司,美国)分别绘制ame-miR-bantam与靶基因P300和USPmRNA的结合关系示意图。通过RT-qPCR检测靶基因P300和USP在过表达和敲减ame-miR-bantam后4-6日龄工蜂幼虫肠道中的相对表达量,以肌动蛋白基因actin(GenBank登录号: AB023025.1)作为内参基因,引物信息见表2。RT-qPCR同1.3节。
1.6 数据分析
通过GraphPad Prism 8软件绘制miRNA和靶mRNA表达趋势图。使用Student氏t检验对实验数据进行差异显著性分析,以P<0.05为差异显著性阈值。
2 结果
2.1 意大利蜜蜂工蜂幼虫肠道中ame-miR-bantam的敲减和过表达效果
RT-qPCR检测结果显示(图1),相较于饲喂inhibitor-NC-ame-miR-bantam的阴性对照组,inhibitor-ame-miR-bantam饲喂组4日龄工蜂幼虫肠道中ame-miR-bantam的表达量显著下调(P<0.01),5和6日龄工蜂幼虫肠道中ame-miR-bantam下调表达(P>0.05)。相较于饲喂mimic-NC-ame-miR-bantam的阴性对照组,mimic-ame-miR-bantam饲喂组4-6日龄工蜂幼虫肠道中ame-miR-bantam的表达量皆显著上调(P<0.05)。
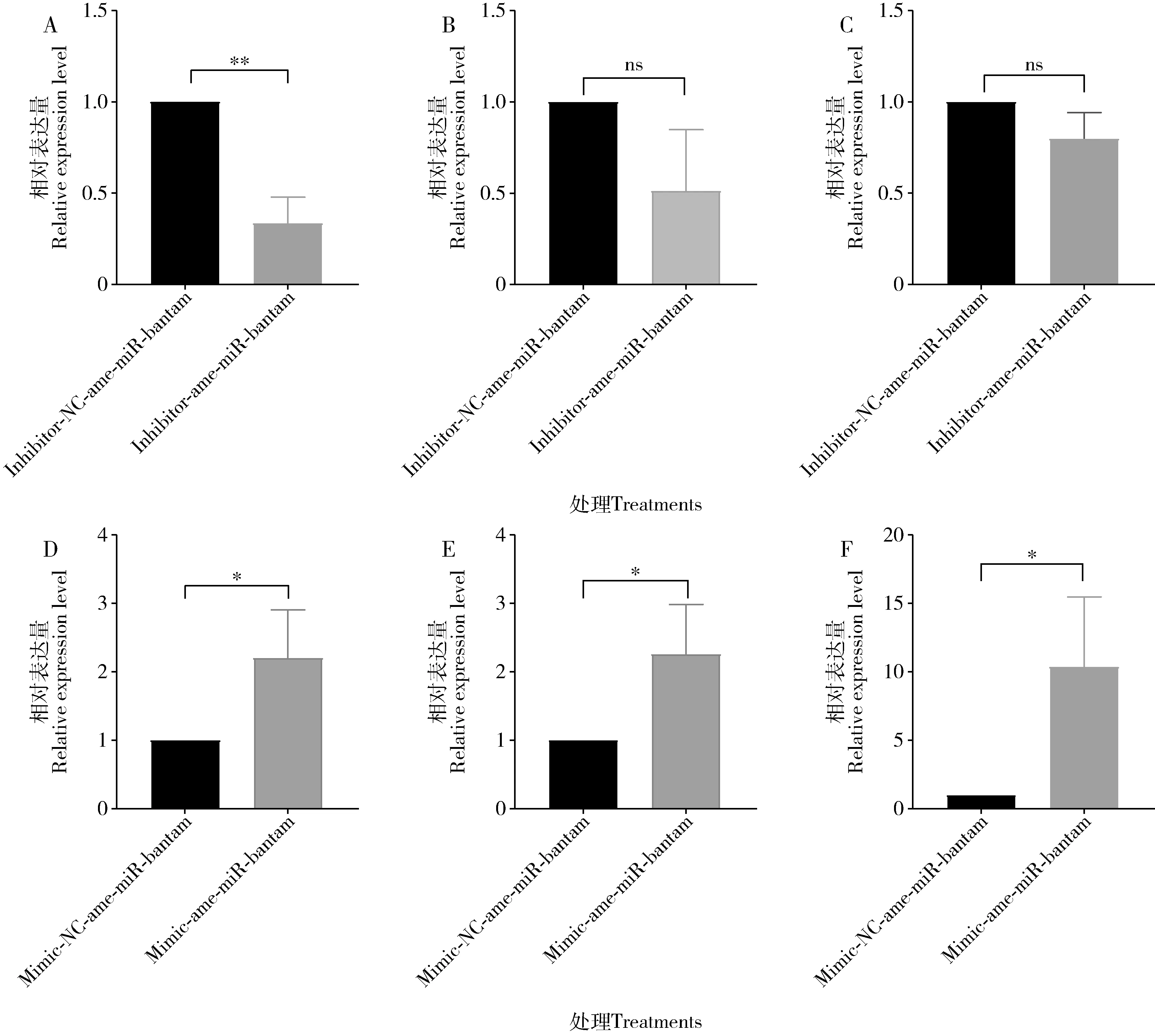
图1 过表达和敲减ame-miR-bantam后意大利蜜蜂4日龄(A, D)、5日龄(B, E)和6日龄(C, F)工蜂幼虫肠道中ame-miR-bantam的相对表达量Fig. 1 Relative expression levels of ame-miR-bantam in the larval gut of the 4-day-old (A, D), 5-day-old (B, E) and 6-day-old (C, F) workers of Apis mellifera ligustica after overexpression and knockdown of ame-miR-bantam给工蜂饲喂mimic-ame-miR-bantam和inhibitor-ame-miR-bantam分别进行ame-miR-bantam的过表达和敲减,以饲喂mimic-NC-ame-miR-bantam和inhibitor-NC-ame-miR-bantam的工蜂分别作为对应的阴性对照。图中数据为平均值±标准误;柱上符号表示两组间的差异显著性(nsP>0.05; *P<0.05; **P<0.01)(Student氏t检验)。图4和5同。Mimic-ame-miR-bantam and inhibitor-ame-miR-bantam were fed to workers to perform overexpression and knockdown of ame-miR-bantam, respectively, and workers fed with mimic-NC-ame-miR-bantam and inhibitor-NC-ame-miR-bantam, respectively, were used as their corresponding negative controls. Data in the figure are mean±SE. Symbols above bars indicate the significance of difference between two groups (nsP>0.05; *P<0.05; **P<0.01)(Student’s t-test). The same for Figs. 4 and 5.
2.2 ame-miR-bantam的靶基因
靶向预测结果显示ame-miR-bantam共靶向506条mRNA,对应222个靶基因,这些靶基因可注释到细胞进程(cellular process)、应激反应(response to sitimulus)和生物学过程调控(regulation of biological process)等35个GO条目(图2: A),以及Wnt, Hippo和Notch信号通路等160条KEGG通路(图2: B)。

图2 意大利蜜蜂工蜂幼虫肠道中ame-miR-bantam靶基因的GO(A)和KEGG(B)注释Fig. 2 GO (A) and KEGG (B) annotation of target genes of ame-miR-bantam in the larval gut of Apis mellifera ligustica workers
2.3 ame-miR-bantam敲减和过表达后靶基因USP和P300的表达量变化
ame-miR-bantam的“种子区”与靶基因USP和P300的mRNA特定区域的碱基配对结合关系如图3所示。
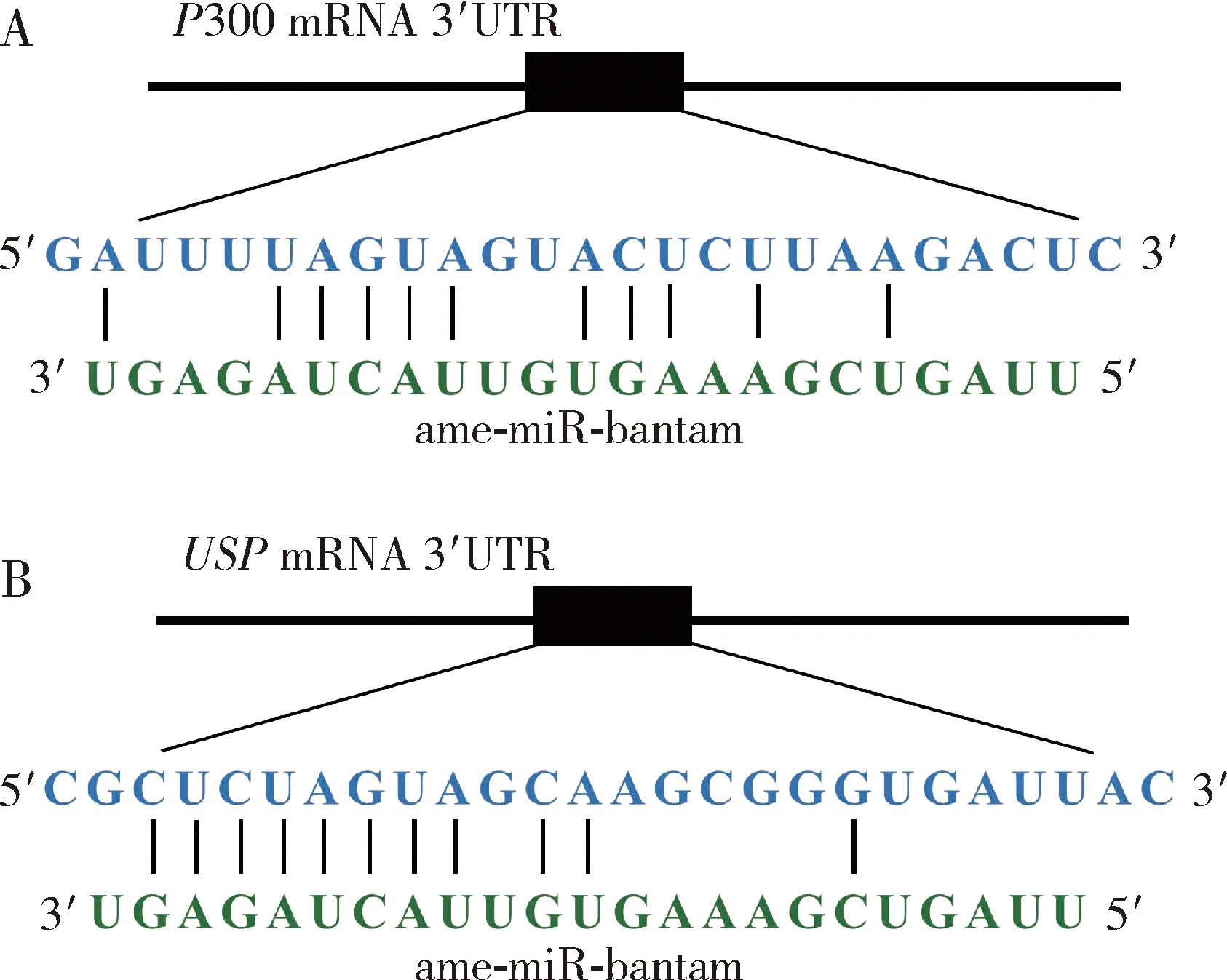
图3 意大利蜜蜂工蜂幼虫肠道中ame-miR-bantam与靶基因P300(A)和USP(B)相应mRNA的结合关系Fig. 3 Binding relationship between ame-miR-bantam and the corresponding mRNAs targeting P300 (A) and USP (B) in the larval gut ofApis mellifera ligustica workers
RT-qPCR结果显示,相较于饲喂inhibitor-NC-ame-miR-bantam的阴性对照组,inhibitor-ame-miR-bantam饲喂组4和5日龄工蜂幼虫肠道中USP(GenBank登录号: NM_001011634.2)上调表达(P>0.05),6日龄工蜂幼虫肠道中USP显著上调表达(P<0.01)(图4: A-C);相较于饲喂mimic-NC-ame-miR-bantam的阴性对照组,mimic-ame-miR-bantam饲喂组4日龄工蜂幼虫肠道中USP的表达量呈上调趋势(P>0.05),5日龄工蜂幼虫肠道中USP的表达量下调(P>0.05), 6日龄工蜂幼虫肠道中USP显著下调表达(P<0.01)(图4: D-F)。
与饲喂inhibitor-NC-ame-miR-bantam的阴性对照组相比,inhibitor-ame-miR-bantam饲喂组的4-6日龄工蜂幼虫肠道中P300(GenBank登录号: XM_006568834.2)的表达量均为上调(P>0.05)(图5: A-C);相较于饲喂mimic-NC-ame-miR-bantam的阴性对照组,mimic-ame-miR-bantam饲喂组的4日龄工蜂幼虫肠道中P300上调表达(P>0.05),而5和6日龄工蜂幼虫肠道中P300显著下调表达(P<0.05)(图5: D-F)。

图5 敲减和过表达ame-miR-bantam后意大利蜜蜂4日龄(A, D)、5日龄(B, E)和6日龄(C, F)工蜂幼虫肠道中靶基因P300的相对表达量Fig. 5 Relative expression levels of the target gene P300 in the larval gut of the 4-day-old (A, D), 5-day-old (B, E) and 6-day-old (C, F) workers of Apis mellifera ligustica after knockdown and overexpression of ame-miR-bantam
3 讨论
笔者团队前期通过Stem-loop RT-PCR和Sanger测序证实了ame-miR-bantam在意大利蜜蜂工蜂蛹期的真实存在和表达(祝智威等, 2022)。本研究利用含模拟物或抑制物的饲料饲喂意大利蜜蜂工蜂3日龄幼虫,RT-qPCR结果显示,与阴性对照组相比,饲喂mimic-ame-miR-bantam后ame-miR-bantam在4-6日龄工蜂幼虫肠道中皆显著上调表达(图1: D-F);饲喂inhibitor-ame-miR-bantam后ame-miR-bantam在4日龄工蜂幼虫肠道中显著下调表达,在5和6日龄工蜂幼虫肠道中下调表达(图1: A-C),说明通过饲喂模拟物和抑制物能分别有效实现意蜂工蜂幼虫肠道中ame-miR-bantam的过表达和敲减。此前,笔者所在团队通过饲喂相应的模拟物和抑制物对意蜂工蜂幼虫肠道中的ame-miR-13b分别进行了有效过表达和敲减。以上结果共同为深入开展意蜂工蜂幼虫的miRNA功能研究提供了可靠的理论依据和技术保障。
研究表明miR-bantam在果蝇和小菜蛾等昆虫的幼虫发育等方面起到重要的调控作用(Liangetal., 2013)。Guo等(2013)研究发现ame-miR-bantam可参与调节西方蜜蜂的级型分化。本研究中,靶向预测结果显示ame-miR-bantam共靶向222个基因,上述靶基因可注释到35个GO条目,包括与生长发育有关的细胞进程、应激反应和生物学过程调控等;此外还能注释到160条KEGG通路,包括与生长发育密切相关的Wnt, Hippo和Notch等信号通路等(图2)。以上结果说明ame-miR-bantam潜在参与调控意蜂工蜂幼虫肠道的生长发育。
昆虫幼虫的发育受到蜕皮激素的严格调控,蜕皮激素作用的靶点由蜕皮激素受体(ecdysteroid receptor, EcR)和USP组成,蜕皮激素与EcR/USP二聚体相互作用,进而结合蜕皮激素反应因子(ecdysteroid response element, EcRE)以控制基因的转录(Browningetal., 2021)。本研究发现ame-miR-bantam与USP之间存在潜在的靶向结合关系;与阴性对照组相比,过表达ame-miR-bantam后,5日龄工蜂幼虫肠道中USP的表达量下调,6日龄工蜂幼虫肠道中USP的表达量显著下调(图4: E, F);敲减ame-miR-bantam后,USP在4和5日龄工蜂幼虫肠道中上调表达,在6日龄工蜂幼虫肠道中显著上调表达(图4: A-C)。这表明ame-miR-bantam可负调控意蜂工蜂幼虫肠道中USP的表达。但是否调节蜕皮激素并影响意蜂工蜂幼虫肠道发育需要进一步研究。此前,祝智威等(2022)研究发现敲减ame-miR-13b后意蜂6日龄工蜂幼虫肠道中Ecr显著上调表达。这些结果共同表明ame-miR-bantam与ame-miR-13b可协同靶向调控USP和Ecr表达进而调节意蜂工蜂幼虫肠道的发育过程。
Wnt信号通路在人类和果蝇等动物的组织和器官发育中发挥关键作用(Katoh, 2005; Swarupand Verheyen, 2012)。本研究发现,ame-miR-bantam与Wnt信号通路上的P300基因存在潜在的靶向结合关系,与阴性对照组相比,过表达ame-miR-bantam后,P300表达量在5和6日龄工蜂幼虫肠道中均显著下调(图5: E, F);敲减ame-miR-bantam后,4-6日龄工蜂幼虫肠道中P300的表达量均为上调(图5: A-C)。这些结果表明ame-miR-bantam对意蜂工蜂幼虫肠道中P300的表达具有负调控作用。推测ame-miR-bantam通过负调控P300的表达调节Wnt信号通路进而影响意蜂工蜂幼虫肠道发育。
通过饲喂模拟物和抑制物能够分别实现意大意蜜蜂工蜂幼虫肠道中ame-miR-bantam的有效过表达和敲减;幼虫肠道中ame-miR-bantam对USP和P300的表达可能具有负调控作用。
