基于网络药理学、分子对接与实验验证揭示薯蓣皂苷元治疗动脉粥样硬化的作用机制
2022-12-28王肖龙
王 丹,王肖龙*
基于网络药理学、分子对接与实验验证揭示薯蓣皂苷元治疗动脉粥样硬化的作用机制
王 丹1, 2,王肖龙1, 2*
1. 上海中医药大学附属曙光医院 国家中医心血管病临床医学研究中心分中心,上海 201203 2. 上海中医药大学附属曙光医院 心血管病研究所,上海 201203
通过网络药理学、分子对接结合体外验证的方法,探究薯蓣皂苷元抗动脉粥样硬化(atherosclerosis,AS)的潜在靶点及作用机制。通过SwissTargetPrediction、Pharmmapper、CheMBL数据库挖掘薯蓣皂苷元作用靶点,然后通过OMIM、Drugbank、Genecards、DisGeNET数据库预测与AS相关的靶点,取两者共同靶点,构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络;通过Cytoscape 3.7.2软件进行可视化,筛选核心靶点并进行基因本体(gene ontology,GO)功能和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;使用AutodockTools、PyMOL和Discovery Studio软件进行分子对接以验证薯蓣皂苷元和靶点的相关性。通过构建体外泡沫细胞模型,考察薯蓣皂苷元对泡沫细胞脂质代谢、促炎细胞因子水平及关键靶点表达的影响。共获得588个薯蓣皂苷元靶点和5489个与AS相关的靶点,获得275个薯蓣皂苷元与AS的交叉靶点,通过PPI网络筛选获得Src、信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)等52个关键靶点。GO功能富集分析表明,这些靶点主要与蛋白质磷酸化、细胞对脂质的反应,细胞迁移的正向调节、炎症反应等过程相关。KEGG通路富集分析发现,薯蓣皂苷元抗AS与脂质和动脉粥样硬化通路、核因子-κB(nuclear factor-κB,NF-κB)信号通路等有关。分子对接表明,薯蓣皂苷元与Src、STAT3具有良好的结合亲和力。体外实验表明,薯蓣皂苷元显著抑制THP-1巨噬细胞脂质堆积和促炎细胞因子水平(<0.05、0.01、0.001),显著下调Src和STAT3的磷酸化水平(<0.05、0.01、0.001)。薯蓣皂苷元能够通过调节多个靶点和通路发挥抗AS作用,其作用机制可能与调节Src/STAT3通路从而改善脂质代谢和炎症有关。
薯蓣皂苷元;动脉粥样硬化;网络药理学;分子对接;Src;信号传导及转录激活蛋白3
动脉粥样硬化(atherosclerosis,AS)是一种发生在大中动脉内膜层的慢性炎症性疾病[1]。脂质代谢失衡是最初的公认原因,后来研究发现炎症过程贯穿AS的始终。近年来,研究者逐渐认识到先天性和适应性免疫机制在AS进程中的重要作用[2]。AS晚期斑块常造成血管狭窄、不稳定斑块破裂以及血栓形成,引起血管闭塞,导致致命的心血管疾病,这也成为老年人死亡最常见的原因之一[3]。目前临床治疗主要集中于降低低密度脂蛋白胆固醇水平和对并发症进行治疗。尽管目前抗胆固醇合成药物中的他汀类药物及抗血小板药物在AS的防治中起到了积极的作用,但临床应用中也发现了许多不良反应,例如他汀类药物可引起肌炎、肌痛[4],因此有必要开发更多替代药物以扩充临床用药选择。
中药以及从中药中提取的天然化合物由于其高治疗价值、低全身毒性和广泛的药理活性而受到越来越多的关注。薯蓣皂苷元是一种来源于薯蓣属植物(如盾叶薯蓣、黄山药)的天然甾体皂苷元[5],是地奥心血康、盾叶冠心宁的主要活性成分。地奥心血康、盾叶冠心宁主要用于治疗冠心病、心绞痛、高脂血症等。薯蓣皂苷元与胆固醇具有类似的化学结构,在肠道中可竞争性地抑制膳食胆固醇吸收[6-7]、调节脂质代谢[8-9]、改善高胆固醇血症[10-11],同时还具有抗氧化[12]、抗炎[13]、抗增殖[14]等药理作用,因此有望成为一种新型抗AS药物。然而,目前关于薯蓣皂苷元在AS中研究仍处于初级阶段,其潜在靶点及药理学作用机制有待进一步研究。
网络药理学是一种基于系统生物学发展起来的,与高通量筛选、下一代测序、多组学应用相关的新型药物研究范式[15]。其打破了传统的“一种疾病-一个靶点-一种药物”的思维范式,通过多靶点、多途径的方式阐述复杂疾病的发病机制[16-17]。对于多靶点的天然产物未知药理学作用的探索具有积极的预测作用。目前尚无薯蓣皂苷元抗AS的网络药理学相关研究,因此本研究拟通过网络药理学和分子对接技术预测薯蓣皂苷元与潜在靶标之间的相关性,并通过体外实验对相关靶点和通路进行验证,以期为薯蓣皂苷元抗AS的机制研究提供新思路。
1 材料
1.1 细胞
人单核THP-1细胞(批号20210723A1)购自大连美仑生物科技有限公司。
1.2 药品与试剂
RPMI 1640培养基(批号AG2957469)购自美国HyClone公司;薯蓣皂苷元(质量分数≥98%,批号1105F023)购自北京索莱宝科技有限公司;阿托伐他汀(批号LRAC0148)购自美国Sigma公司;胎牛血清购自BI公司;氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL,批号YB-002)购自益源生物科技有限公司;白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6 ELISA试剂盒(批号EH6306M、EH6281M、EH6513M)购自上海威奥生物科技有限公司;Src抗体(批号36D10)、磷酸化Src(Tyr416)抗体(批号D49G4)购自美国CST公司;信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)抗体(批号EP2147Y)、β-actin抗体(批号10021787)购自美国Proteintech公司;磷酸化STAT3(Tyr705)抗体(批号ab76315)购自英国Abcam公司;油红O染液(批号052821210930)、CCK-8试剂盒(批号031921211102)购自碧云天生物技术有限公司;佛波醇肉豆蔻酸乙酸酯(phorbol 12-myristate 13-acetate,PMA,批号P3102110)、山羊抗小鼠IgG抗体(批号P3221170)购自翌圣生物科技有限公司;山羊抗兔IgG抗体(批号8715)购自SAB公司;胆甾烯酮对照品(质量分数≥98%,批号21J040-A3)购自上海甄准生物科技有限公司;胆固醇氧化酶(批号J08HS184254)、胆固醇酯酶(批号M26HS179245)、TritonX-100(批号A20GS158556)、胆酸钠(批号1305S11J123719)、无水MgCl2(批号S25O10T100980)、Tri-HCl缓冲液(批号N01GR166405)购自源叶生物科技有限公司。
1.3 仪器
Eclipse E100型正置光学显微镜(日本尼康公司);DENLEY DRAGON Wellscan MK型酶标仪、BB5060型CO2培养箱(美国Thermo Fisher Scientific公司);PYX-DHS型数字显示隔水式电热恒温培养箱(上海跃进医疗器械厂);TGL-168型离心机(上海安亭科学仪器厂);蛋白电泳系统(美国Bio-Rad公司);XW-80A型漩涡混合器(上海青浦沪西仪器厂);ChemiScope系列荧光及化学发光成像系统(勤翔科学仪器有限公司);1200型高效液相色谱仪(美国Agilent公司)。
2 方法
2.1 网络药理学分析
2.1.1 薯蓣皂苷元靶点的预测 通过SwissTargetPrediction(http://www.swisstargetprediction. ch)[18]、Pharmmapper(http://lilab.ecust.edu.cn/ pharmmapper/index.php)[19]、CheMBL(http://www. ebi.ac.uk/chembl/)[20]数据库进行薯蓣皂苷元靶点预测,所有靶点限定为“human”。去除重复数据后,将预测的靶点输入到UniProt数据库(https://www. uniprot.org/)中进行标准化。
2.1.2 AS靶点的预测 在OMIM数据库(https://omim.org/)[21-22]、Drugbank数据库(https:// www.drugbank.ca)、Genecards数据库(https://www. genecards.org/)和[23]DisGeNET数据库(http://www. disgenet.org/)[24]搜索关键词“atherosclerosis”,预测AS相关靶点。
2.1.3 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建 通过Venny2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,筛选出薯蓣皂苷元和AS共同靶点。将这些靶点上传到STRING数据库(https://string-db.org/)中生成PPI网络[25],将条件设置为“human”,置信度设置为最高置信度(得分值>0.9)并隐藏网络中断开连接的节点,将得到的PPI网络保存为TSV文件,导入Cytoscape 3.7.2软件构建和可视化靶网,并通过设定度值大于平均值筛选出核心靶点[26]。
2.1.4 基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 通过Metascape对交集靶点进行GO功能和KEGG通路富集分析,选择物种为“human”,分别对生物过程(biological process,BP)、细胞成分(cellular component,CC)、分子功能(molecular function,MF)和KEGG进行富集分析,以获得主要生物学功能和信号通路,筛选<0.01、最小计数为3且富集因子>1.5的条目。采用OmicShare工具(http://www.omicshare.com/tools)可视化KEGG气泡图。
2.1.5 分子对接 使用PubChem数据库(http://pubchem.ncbi.nlm.nih.gov)[27]获得薯蓣皂苷元的SDF格式文件,通过Open Babel GUI软件转换为“mol2”格式文件,通过PDB数据库(https://www.rcsb.org/)获得核心靶蛋白的PDB格式文件,然后使用Pymol软件去除所有配体和水分子,并保存为PDB格式。通过Auto Dock Tools进行对接模拟,采用PyMOL 2.3.0和Discovery Studio 4.5 Client进行结果处理和可视化[28]。结合能小于−20.92 kJ/mol,认为配体和受体蛋白之间对接结果稳定。
2.2 体外实验验证
2.2.1 THP-1巨噬细胞源性泡沫细胞的培养、模型构建及给药 THP-1细胞用含10%胎牛血清、1%青霉素-链霉素的RPMI 1640培养基,于37 ℃、5% CO2的培养箱中孵育。用100 ng/mL PMA孵育2 d诱导贴壁巨噬细胞形成,之后用含100 μg/mL ox-LDL和0.2%胎牛血清的RPMI 1640培养基诱导巨噬细胞分化为泡沫细胞,给予低、中、高剂量(0.1、1.0、10.0 μmol/L)的薯蓣皂苷元或阿托伐他汀(1 μmol/L)干预48 h,对照组为未经分化的巨噬细胞。
2.2.2 CCK-8法检测细胞活力 将THP-1细胞用PMA诱导分化为贴壁巨噬细胞,以1×105个/孔接种于96孔板中,每孔加入100 μL不同浓度(0.01、0.1、1、10、20、40、80、160 μmol/L)的薯蓣皂苷元,对照组加入不含药物的培养基,培养48 h后,每孔加入10 μL CCK-8溶液,培养箱中孵育2 h,采用酶标仪测定450 nm处的吸光度()值。
2.2.3 油红O染色评估泡沫细胞形成 将2 mL THP-1细胞以1×106个/mL接种于6孔板中,按“2.2.1”项下方法诱导泡沫细胞形成,并给予药物干预48 h后,将细胞于4%多聚甲醛中固定10 min,用60%异丙醇漂洗15 s;用油红O染液染色15 min,用60%异丙醇洗涤10 s;用苏木精复染细胞1 min,用PBS洗涤3次后,在倒置显微镜下对阳性染色的细胞(红色)进行拍照,使用Image-Pro Plus 6.0软件分析油红染色中脂滴与整个图像面积的面积比进行定量。
2.2.4 HPLC分析细胞内脂质水平[29]按“2.2.3”项下方法处理细胞并给药后,用0.1% TritonX-100裂解细胞,测定蛋白质浓度后,用10 μL酶促反应混合液[含500 mmol/L MgCl2、500 mmol/L Tris-HCl、10 mmol/L DTT、5%胆酸钠]加入到100 μL细胞裂解液中混匀,然后将胆固醇酯酶联合胆固醇氧化酶加入细胞裂解液中,37 ℃各作用1 h,用于测定细胞内总胆固醇(total cholesterol,TC)含量;或仅加入胆固醇氧化酶用于测定细胞内游离胆固醇(free cholesterol,FC)含量;最后加入甲醇-乙醇混合液终止反应,10 000 r/min离心15 min,取10 μL上清液用于HPLC分析。胆固醇酯(cholesteryl ester,CE)含量为TC与FC的差值。
2.2.5 ELISA检测细胞上清液中炎性细胞因子水平 按“2.2.3”项下方法处理细胞并给药后,收集细胞上清液,按照ELISA试剂盒说明书测定上清液中IL-1β、TNF-α和IL-6水平。
2.2.6 Western blotting检测Src/STAT3通路相关蛋白表达 按“2.2.3”项下方法处理细胞并给药后,收集细胞,用含或不含磷酸酶抑制剂的RIPA缓冲液裂解细胞,使用BCA蛋白定量试剂盒测定蛋白浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入封闭液,37 ℃封闭2 h,分别加入Src(1∶1000)、p-Src(1∶1000)、STAT3(1∶500)、p-STAT3(1∶2000)、β-actin(1∶5000)抗体,4 ℃孵育过夜;TBST洗涤3次,每次5 min,加入HRP标记的山羊抗兔/小鼠IgG抗体(1∶5000),室温孵育1 h;TBST洗涤3次后,加入化学发光试剂显影,采用ChemiScope Capture图像分析软件对条带灰度值进行定量分析。

3 结果
3.1 薯蓣皂苷元和AS的潜在靶点筛选
通过SwissTargetPrediction、Pharmmapper、CheMBL数据库分别预测出100、278、246个薯蓣皂苷元靶点。去除重复靶点,共获得588个候选靶点。通过OMIM、Genecards、DisGeNET和Drugbank数据库分别预测出626、4710、2044、33个抗AS的相关靶点,去除1891重复靶点,共获得5489个与AS相关的靶点。
3.2 PPI网络构建
通过Omicshare网站获得275个薯蓣皂苷元与AS的交叉靶点(图1),将这275个靶点导入String 数据库,将生成的PPI网络导入Cytoscape软件,计算所有节点的拓扑特征并进行可视化。移除PPI网络中与主要网络离散且边缘较少的节点后,最终呈现191个靶点、604条边。根据度值≥6.324 6,鉴定出包括Src、STAT3在内的52个关键靶点,如图2所示,颜色越红,面积越大代表度值越高,52个关键靶点分别位于圆圈中心2层。
3.3 GO功能和KEGG通路富集分析
对191个靶点进行GO功能和KEGG通路富集分析,共富集出198条分子功能、1818条生物学过程、111条细胞成分。图3列出了前20个BP、MF、CC条目(<0.01),结果表明薯蓣皂苷元对AS的潜在靶点与蛋白激酶活性、蛋白酪氨酸激酶活性、核受体活性等分子功能有关,与蛋白质磷酸化、细胞对脂质的反应、细胞迁移的正向调节等生物学过程有关,与受体复合物、细胞体、膜筏等细胞成分有关。图4列出了前20条KEGG信号通路,去除不相关的广谱通路,KEGG富集分析显示主要涉及脂质与动脉粥样硬化途径、钙信号通路、核因子-κB(nuclear factor-κB,NF-κB)信号通路等通路。表明薯蓣皂苷元可能通过调节脂质代谢和炎症对AS发挥作用。其中,脂质与动脉粥样硬化途径是一个包含27个靶基因的重要途径,涵盖了包括、等众多靶基因(图5),因此基于Src/STAT3通路进行后续研究。
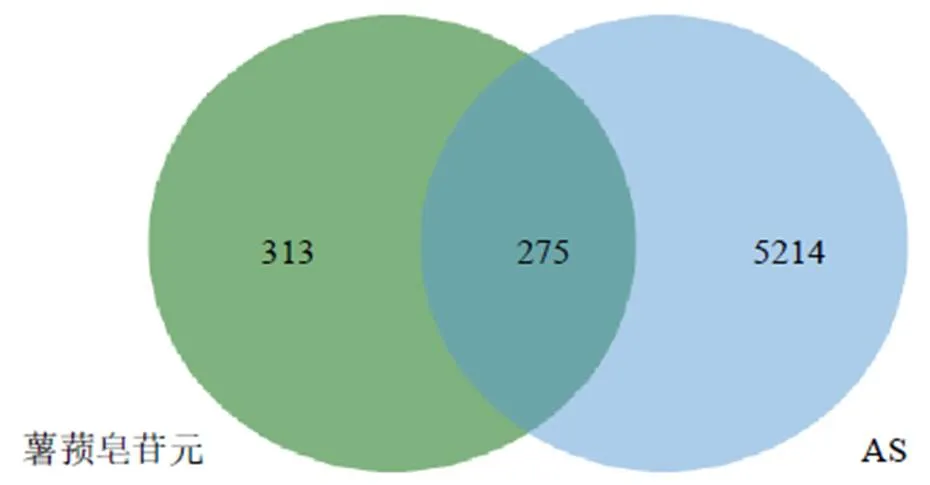
图1 薯蓣皂苷元治疗AS靶点的Venn图
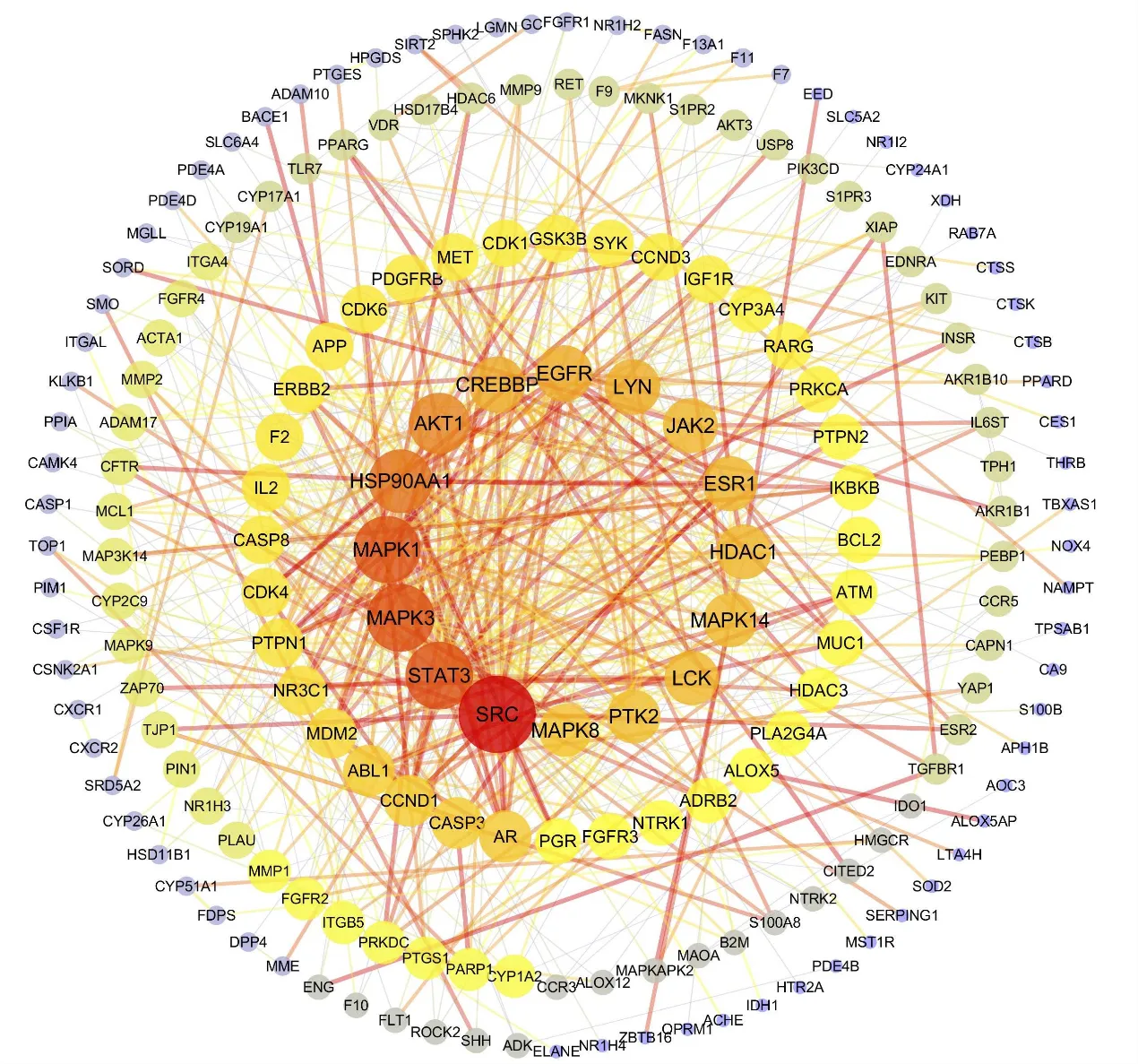
圆点代表靶点,圆点越大越红代表度值越高,圆点越小越紫代表度值越低;连线代表蛋白间的功能关联,连线颜色越深越粗代表关联越强
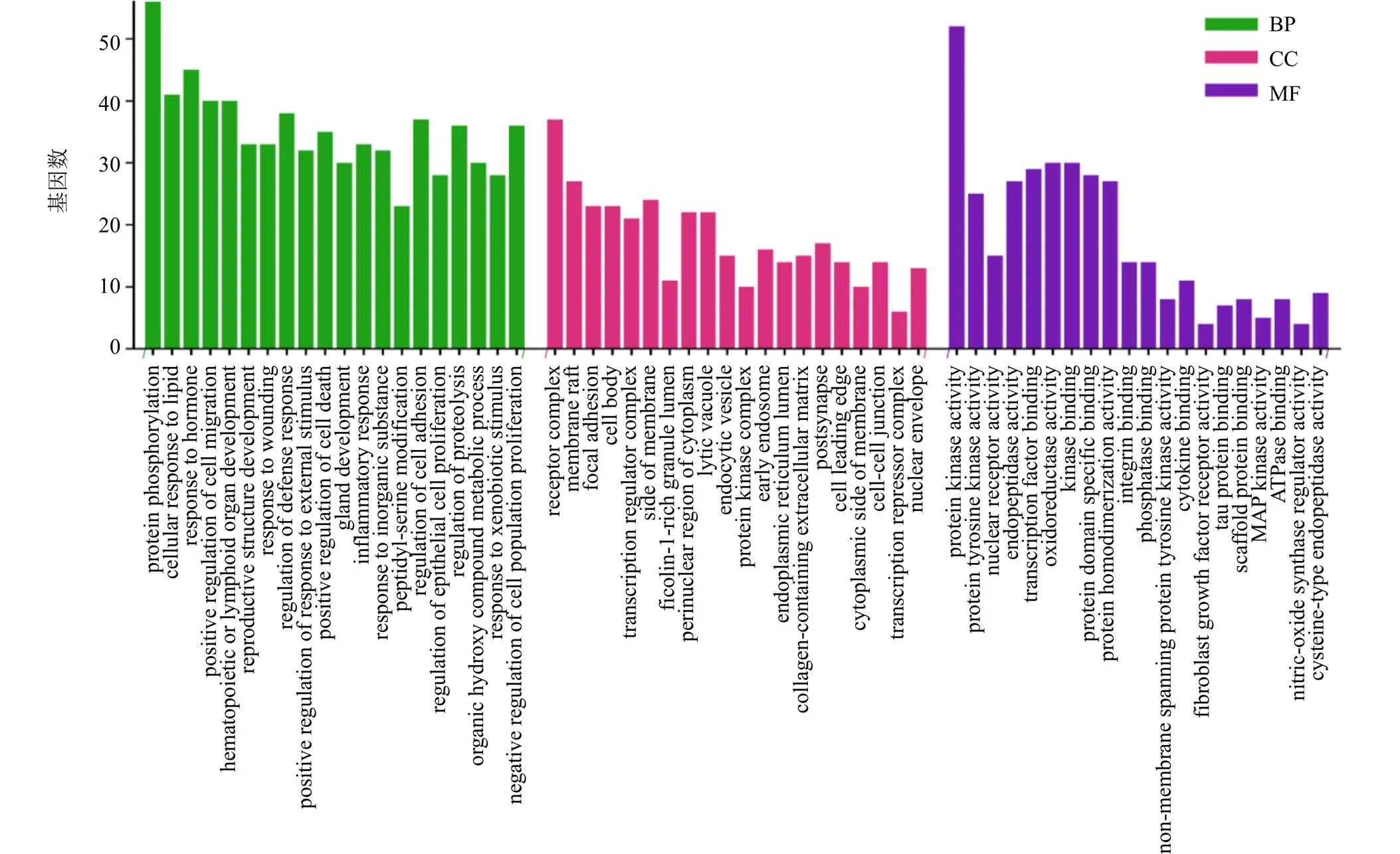
图3 薯蓣皂苷元治疗AS的GO功能富集分析(前20)

图4 薯蓣皂苷元治疗AS的KEGG通路富集分析(前20)

图5 薯蓣皂苷元参与脂质与动脉粥样硬化途径
3.4 分子对接分析
如图6所示,薯蓣皂苷元和Src的残基LYSA:298氢键结合有助于结构的稳定,其次薯蓣皂苷元和Src间形成alkyl键、Pi-alkyl键和范德华力作用。薯蓣皂苷元和STAT3的残基ASPA:334氢键结合有助于结构的稳定,其次薯蓣皂苷元和STAT3间也形成alkyl键、Pi-alkyl键和范德华力作用。薯蓣皂苷元与Src、STAT3的相互作用能分别为−34.31、−34.73 kJ/mol,均小于−20.92 kJ/mol,表明薯蓣皂苷元与2个靶点之间具有良好的结合亲和力。
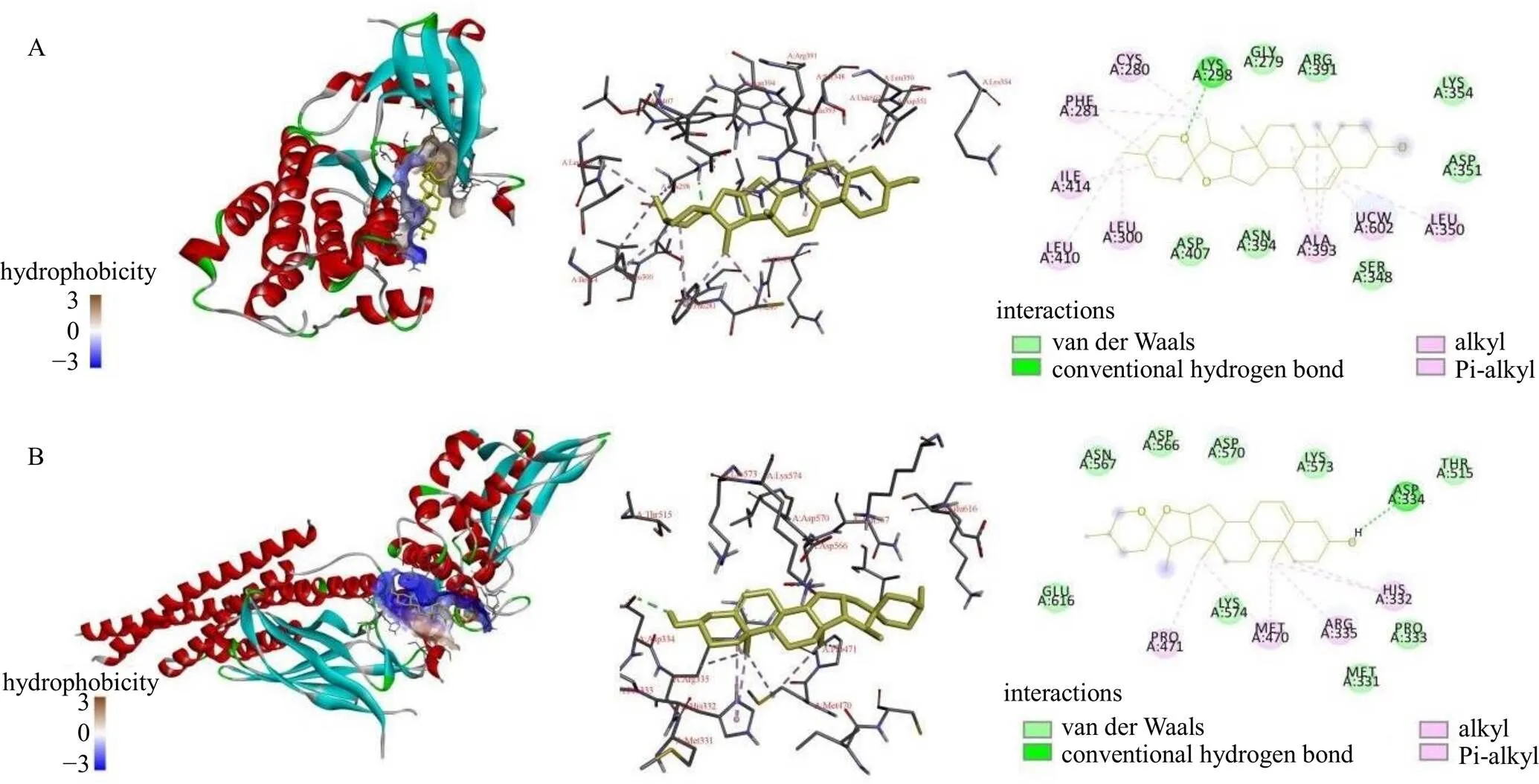
图6 薯蓣皂苷元与Src (A) 和STAT3 (B)的分子对接结果
3.5 体外实验验证结果
3.5.1 薯蓣皂苷元对巨噬细胞活力的影响 如图7所示,当薯蓣皂苷元浓度低于20 μmol/L时,对细胞活性无显著影响;当薯蓣皂苷元浓度高于20 μmol/L时,呈剂量相关性地抑制细胞活力(<0.01、0.001),因此以0.1、1.0、10.0 μmol/L作为薯蓣皂苷元的低、中、高剂量进行后续实验。
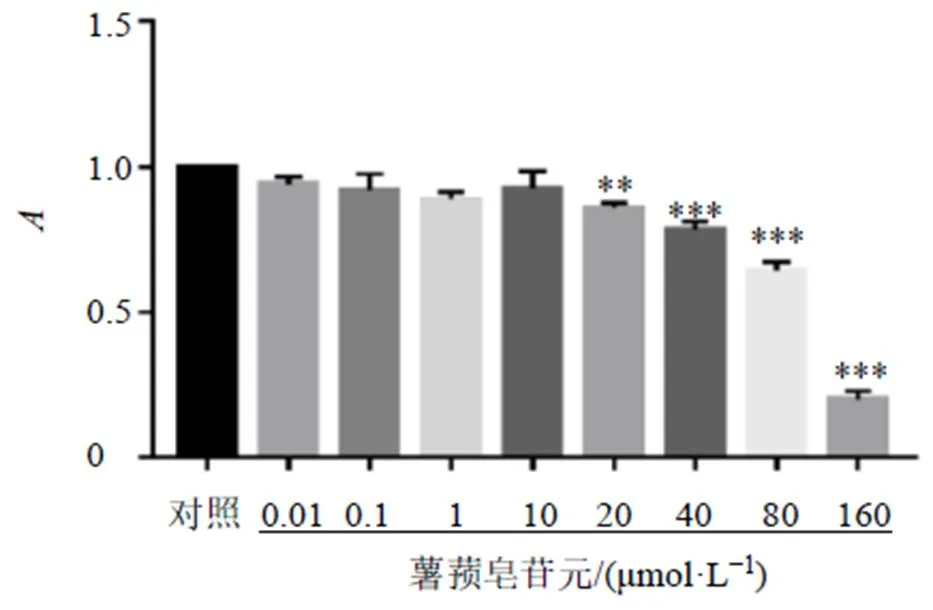
与对照组比较:**P<0.01 ***P<0.001
3.5.2 薯蓣皂苷元对泡沫细胞形成的影响 如图8所示,与对照组比较,ox-LDL负载显著增加脂滴染色(<0.001),表明泡沫细胞诱导成功;与模型组比较,薯蓣皂苷元中、高剂量组和阿托伐他汀组显著抑制泡沫细胞中脂质的积累(<0.001)。
3.5.3 薯蓣皂苷元对THP-1巨噬细胞衍生的泡沫细胞TC、FC和CE水平的影响 如表1所示,与对照组比较,模型组TC、FC和CE水平均显著升高(<0.01);与模型组比较,各给药组TC和CE水平均显著降低(<0.05、0.01),薯蓣皂苷元中、高剂量组和阿托伐他汀组FC水平均显著降低(<0.05、0.01)。
3.5.4 薯蓣皂苷元对THP-1巨噬细胞衍生泡沫细胞上清液中促炎细胞因子水平的影响 如图9所示,与对照组比较,模型组细胞上清液中IL-6、IL-1β和TNF-α水平均显著升高(<0.001);与模型组比较,各给药组细胞上清液中TNF-α水平显著降低(<0.001),薯蓣皂苷元中、高剂量组和阿托伐他汀组细胞上清液中IL-6和IL-1β水平均显著降低(<0.05、0.01、0.001)。

与对照组比较:###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下图同

表1 薯蓣皂苷元对泡沫细胞脂质积累的影响(, n = 3)
与对照组比较:##<0.01;与模型组比较:*<0.05**<0.01
##< 0.01control group;*< 0.05**< 0.01model group

图9 薯蓣皂苷元对泡沫细胞上清液中IL-6、IL-1β和TNF-α水平的影响(, n = 6)
3.5.5 薯蓣皂苷元对THP-1巨噬细胞衍生泡沫细胞中Src/STAT3信号通路相关蛋白表达的影响 Src是STAT3信号传导的重要调节剂[30],Src激活可触发STAT3活性[31]。此外,ox-LDL可显著上调大鼠胸主动脉平滑肌VSMC细胞中Src磷酸化水平,而沉默Src可显著逆转这一效应[32]。如图10所示,与对照组比较,模型组Src和STAT3的磷酸化水平均显著升高(<0.001);与模型组比较,各给药组Src和STAT3的磷酸化水平均显著降低(<0.05、0.01、0.001)。因此,薯蓣皂苷元可能通过抑制Src/STAT3信号通路,减轻脂质代谢和促炎细胞因子的分泌,进而改善AS。

图10 薯蓣皂苷元对泡沫细胞Src/STAT3信号通路相关蛋白表达的影响(, n = 3)
4 讨论
AS是造成急性冠脉综合征、脑卒中等心脑血管疾病的关键病理基础。薯蓣属植物作为一种药食同源的植物,其毒性极低,产量丰富,价格低廉,并且含有丰富的甾体皂苷,这些甾体皂苷经提取已被制成多种心血管病临床药物。薯蓣皂苷元作为盾叶冠心宁、地奥心血康的最主要的活性成分之一,具有广泛的临床应用价值。薯蓣皂苷元在多种慢性病中发挥重要作用[33]。研究发现,薯蓣皂苷元可以抑制AS小鼠疾病进展[34],降低高脂饮食喂养大鼠血清中TC、三酰甘油、低密度脂蛋白胆固醇和极低密度脂蛋白胆固醇水平,下调NF-κB表达,减轻炎症反应[35]。薯蓣皂苷元抗AS的作用机制尚未被全面揭示。
近年来,网络药理学的兴起无疑为多靶点疾病机制的探讨以及多靶点药物药理作用的探讨提供了一种新的分析工具[36-37]。本研究通过公开数据库筛选了薯蓣皂苷元和AS共同靶点,并构建PPI网络以获得核心靶点。通过GO功能和KEGG通路富集分析探讨薯蓣皂苷元抗AS的作用机制。KEGG分析结果中涉及癌症通路、癌症中的转录失调、甲状腺癌等癌症相关信号通路,推测Src、STAT3、丝裂原活化蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)、蛋白激酶B1(protein kinase B1,AKT1)等多个靶点共同参与癌症与AS相关信号通路,并在发病机制上显示出一些相似性,如抑制细胞的增殖与迁移、抑制血管新生、抑制炎症等。在剔除不相关的信号通路后,发现薯蓣皂苷元抗AS主要与脂质代谢和炎症相关,涉及脂质与动脉粥样硬化途径、Janus激酶(Janus kinase,JAK)-STAT信号通路、NF-κB信号通路等。此外,GO功能分析表明了薯蓣皂苷元抗AS涉及蛋白质磷酸化、细胞对脂质的反应、细胞迁移的正向调节、炎症反应、细胞黏附的调节、上皮细胞增殖的调节、细胞群增殖的负调控、细胞死亡等生物学过程。提示薯蓣皂苷元可能在脂质代谢、炎症、上皮细胞与血管平滑肌细胞的增殖与迁移、巨噬细胞的迁移与黏附、血管生成、细胞凋亡等AS病理环节中发挥重要作用。在筛选的52个核心靶点中,Src与STAT3度值最高,同时富集出现在脂质和动脉粥样硬化通路、黏附连接、凋亡、炎症相关信号通路、JAK-STAT信号通路等9条通路中,并且Src处于STAT3上游。Src激活可触发STAT3活性,促进磷酸化STAT3表达[30]。分子对接结果也表明Src、STAT3与薯蓣皂苷元具有较高的结合亲和力。
Src是一种与迁移相关的非受体酪氨酸激酶,抑制Src信号通路可抑制血管平滑肌细胞的增殖和迁移[38-39]。Src在调节巨噬细胞功能中发挥重要作用,尤其是巨噬细胞介导的炎症反应和免疫反应。巨噬细胞的黏附迁移和炎症作为AS的重要环节,而Src参与调节所有Toll样受体(Toll-like receptor,TLR)家族成员介导的炎症信号通路,表明Src在AS巨噬细胞炎症中发挥潜在作用[40]。此外,Src的激活提供了初始炎症信号,触发了NF-κB介导的炎症途径,NF-κB可刺激IL-6表达,IL-6的激活又可促进STAT3的激活,以响应炎症信号[41]。在巨噬细胞脂质代谢中,Src活性的抑制可减轻巨噬细胞脂质积累[42]。Src家族激酶还通过参与解整合素-金属蛋白酶15(a disintegrin and metalloproteinase 15,ADAM15)诱导的内皮屏障功能障碍,减轻AS[43]。在肿瘤研究中发现,抑制Src可以抑制STAT3的激活[44]。薯蓣皂苷可通过抑制Src/STAT3信号通路减少血管生成,在抑制黑色素瘤的生长中发挥重要作用[45]。薯蓣皂苷是薯蓣皂苷元的糖苷形式,两者具有相似的效应,推测薯蓣皂苷元对Src/STAT3信号通路也有积极的调控作用。
STAT3是一种重要的核转录因子,在AS过程中参与内皮功能障碍、脂质代谢、巨噬细胞极化、炎症调节、血管平滑肌增殖与迁移[46]。STAT3抑制剂可抑制ox-LDL诱导的巨噬细胞脂质积累,减轻巨噬细胞炎症反应[47]。在体内和体外实验中,抑制JAK2/STAT3通路可降低巨噬细胞内三酰甘油、TC和低密度脂蛋白胆固醇水平[48],抑制血管平滑肌细胞增殖,减轻颈动脉内膜厚度[49]。STAT3在不稳定斑块中可能也发挥重要作用,抑制STAT3可能通过抑制内皮细胞的增殖和迁移,减少血管生成,延缓不稳定斑块的进展[50]。本研究通过体外诱导泡沫细胞模拟AS斑块中泡沫细胞的形成过程,探索薯蓣皂苷元抗AS的作用机制,结果显示,薯蓣皂苷元可显著降低ox-LDL诱导的巨噬细胞脂质堆积,表现为泡沫细胞脂滴明显减少,TC、CE和FC水平降低,同时炎症因子IL-1β、IL-6和TNF-α水平也显著降低;此外,薯蓣皂苷元可抑制Src和STAT3的磷酸化水平,表明薯蓣皂苷元可能通过抑制Src/STAT3信号通路,抑制巨噬细胞脂质堆积和促炎因子表达,改善AS。
本研究通过网络药理学结合分子对接和体外实验验证,探讨了薯蓣皂苷元治疗AS的作用机制。薯蓣皂苷元参与调节多条与AS相关的通路,涵盖众多靶点和细胞成分。薯蓣皂苷元可减轻巨噬细胞炎症及脂质堆积,这一效应可能与抑制Src/STAT3信号通路有关。本研究拓展了薯蓣皂苷元抗AS的机制,为AS的治疗和新药研发提供了一种思路。
利益冲突 所有作者均声明不存在利益冲突
[1] Weber C, Noels H. Atherosclerosis: Current pathogenesis and therapeutic options [J]., 2011, 17(11): 1410-1422.
[2] Kobiyama K, Ley K. Atherosclerosis [J]., 2018, 123(10): 1118-1120.
[3] Zhu Y H, Xian X M, Wang Z Z,. Research progress on the relationship between atherosclerosis and inflammation [J]., 2018, 8(3): E80.
[4] Tomaszewski M, Stępień K M, Tomaszewska J,. Statin-induced myopathies [J]., 2011, 63(4): 859-866.
[5] Li X F, Liu S L, Qu L P,. Dioscin and diosgenin: Insights into their potential protective effects in cardiac diseases [J]., 2021, 274: 114018.
[6] Ondevilla J C, Hanashima S, Mukogawa A,. Diosgenin-induced physicochemical effects on phospholipid bilayers in comparison with cholesterol [J]., 2021, 36: 127816.
[7] Laguna J, Gomez-puyou A, Pena A,. Effect of diosgenin on cholesterol metabolism [J]., 1962, 2: 459-470.
[8] Cayen M N, Dvornik D. Effect of diosgenin on lipid metabolism in rats [J]., 1979, 20(2): 162-174.
[9] Sun F C, Yang X F, Ma C Q,. The effects of diosgenin on hypolipidemia and its underlying mechanism: A review [J]., 2021, 14: 4015-4030.
[10] Li R Q, Liu Y, Shi J J,. Diosgenin regulates cholesterol metabolism in hypercholesterolemic rats by inhibiting NPC1L1 and enhancing ABCG5 and ABCG8 [J]., 2019, 1864(8): 1124-1133.
[11] Yu L, Lu H F, Yang X F,. Diosgenin alleviates hypercholesterolemia via SRB1/CES-1/CYP7A1/FXR pathway in high-fat diet-fed rats [J]., 2021, 412: 115388.
[12] Jayachandran K S, Vasanthi H R, Rajamanickam G V. Antilipoperoxidative and membrane stabilizing effect of diosgenin, in experimentally induced myocardial infarction [J]., 2009, 327(1/2): 203-210.
[13] Choi K W, Park H J, Jung D H,. Inhibition of TNF-α-induced adhesion molecule expression by diosgenin in mouse vascular smooth muscle cells via downregulation of the MAPK, Akt and NF-κB signaling pathways [J]., 2010, 53(5/6): 273-280.
[14] Esfandiarei M, Lam J T, Yazdi S A,. Diosgenin modulates vascular smooth muscle cell function by regulating cell viability, migration, and calcium homeostasis [J]., 2011, 336(3): 925-939.
[15] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[16] Nogales C, Mamdouh Z M, List M,. Network pharmacology: Curing causal mechanisms instead of treating symptoms [J]., 2022, 43(2): 136-150.
[17] He R P, Jin Z, Ma R Y,. Network pharmacology unveils spleen-fortifying effect ofon different gastric diseases based on theory of “same treatment for different diseases” in traditional Chinese medicine [J]., 2021, 13(2): 189-201.
[18] Daina A, Michielin O, Zoete V. SwissTargetPrediction: Updated data and new features for efficient prediction of protein targets of small molecules [J]., 2019, 47(W1): W357-W364.
[19] Wang X, Shen Y H, Wang S W,. PharmMapper 2017 update: A web server for potential drug target identification with a comprehensive target pharmacophore database [J]., 2017, 45(W1): W356-W360.
[20] Gaulton A, Hersey A, Nowotka M,. The ChEMBL database in 2017 [J]., 2017, 45(D1): D945-D954.
[21] Amberger J S, Hamosh A. Searching online Mendelian inheritance in man (OMIM): A knowledgebase of human genes and genetic phenotypes [J]., 2017, 58: 1-20.
[22] Amberger J S, Bocchini C A, Schiettecatte F,. OMIM.org: Online Mendelian Inheritance in Man (OMIM®), an online catalog of human genes and genetic disorders [J]., 2015, 43: D789-D798.
[23] Rebhan M, Chalifa-Caspi V, Prilusky J,. GeneCards: Integrating information about genes, proteins and diseases [J]., 1997, 13(4): 163.
[24] Piñero J, Queralt-Rosinach N, Bravo À,. DisGeNET: A discovery platform for the dynamical exploration of human diseases and their genes [J]., 2015, 2015: bav028.
[25] Szklarczyk D, Morris J H, Cook H,. The STRING database in 2017: Quality-controlled protein-protein association networks, made broadly accessible [J]., 2017, 45(D1): D362-D368.
[26] Shannon P, Markiel A, Ozier O,. Cytoscape: A software environment for integrated models of biomolecular interaction networks [J]., 2003, 13(11): 2498-2504.
[27] Kim S, Thiessen P A, Bolton E E,. PubChem substance and compound databases [J]., 2016, 44(D1): D1202-D1213.
[28] Seeliger D, de Groot B L. Ligand docking and binding site analysis with PyMOL and Autodock/Vina [J]., 2010, 24(5): 417-422.
[29] 马卫列, 龚晓华, 李观强, 等. HPLC法测定apoA-1介导的泡沫细胞胆固醇流出的实验研究 [J]. 重庆医学, 2015, 44(29): 4116-4119.
[30] Kim M, Morales L D, Jang I S,. Protein tyrosine phosphatases as potential regulators of STAT3 signaling [J]., 2018, 19(9): E2708.
[31] Zhu J Y, Luo L, Tian L X,. Aryl hydrocarbon receptor promotes IL-10 expression in inflammatory macrophages through Src-STAT3 signaling pathway [J]., 2018, 9: 2033.
[32] Zhang W, Zhang L M, Zhang X S. Anti-atherosclerotic effects of genistein in preventing ox-low-density lipoprotein-induced smooth muscle-derived foam cell formation via inhibiting SRC expression and L-Ca channel currents [J]., 2022, 10(12): 700.
[33] Parama D, Boruah M, Yachna K,. Diosgenin, a steroidal saponin, and its analogs: Effective therapies against different chronic diseases [J]., 2020, 260: 118182.
[34] Lv Y C, Yang J, Yao F,. Diosgenin inhibits atherosclerosis via suppressing the-induced downregulation of ATP-binding cassette transporter A1 [J]., 2015, 240(1): 80-89.
[35] Binesh A, Devaraj S N, Devaraj H. Expression of chemokines in macrophage polarization and downregulation of NF-κB in aorta allow macrophage polarization by diosgenin in atherosclerosis [J]., 2020, 34(2): e22422.
[36] Hopkins A L. Network pharmacology [J]., 2007, 25(10): 1110-1111.
[37] Zhang Y Y, Wang Z, Wang Y Y. Multi-hierarchical profiling: An emerging and quantitative approach to characterizing diverse biological networks [J]., 2017, 18(1): 57-68.
[38] Cho H M, Choi S H, Hwang K C,. The Src/PLC/PKC/MEK/ERK signaling pathway is involved in aortic smooth muscle cell proliferation induced by glycated LDL [J]., 2005, 19(1): 60-66.
[39] Lang Y S, Chen D, Li D Y,. Luteolin inhibited hydrogen peroxide-induced vascular smooth muscle cells proliferation and migration by suppressing the Src and Akt signalling pathways [J]., 2012, 64(4): 597-603.
[40] Byeon S E, Yi Y S, Oh J,. The role of Src kinase in macrophage-mediated inflammatory responses [J]., 2012, 2012: 512926.
[41] Iliopoulos D, Hirsch H A, Struhl K. An epigenetic switch involving NF-kappaB, Lin28, Let-7 microRNA, and IL6 links inflammation to cell transformation [J]., 2009, 139(4): 693-706.
[42] Yang K, Wang X Q, Liu Z H,. Oxidized low-density lipoprotein promotes macrophage lipid accumulation via the toll-like receptor 4-Src pathway [J]., 2015, 79(11): 2509-2516.
[43] Sun C X, Wu M H, Lee E S,. A disintegrin and metalloproteinase 15 contributes to atherosclerosis by mediating endothelial barrier dysfunction via Src family kinase activity [J]., 2012, 32(10): 2444-2451.
[44] Giordano M, Decio A, Battistini C,. L1CAM promotes ovarian cancer stemness and tumor initiation via FGFR1/SRC/STAT3 signaling [J]., 2021, 40(1): 319.
[45] Liu Y X, Xu B W, Niu X D,. Inhibition of Src/STAT3 signaling-mediated angiogenesis is involved in the anti-melanoma effects of dioscin [J]., 2022, 175: 105983.
[46] Chen Q, Lv J J, Yang W W,. Targeted inhibition of STAT3 as a potential treatment strategy for atherosclerosis [J]., 2019, 9(22): 6424-6442.
[47] Wang R, Zhang Y J, Xu L R,. Protein inhibitor of activated STAT3 suppresses oxidized LDL-induced cell responses during atherosclerosis in apolipoprotein E-deficient mice [J]., 2016, 6: 36790.
[48] Yang L W, Song Z K, Pan Y,. PM2.5 promoted lipid accumulation in macrophage via inhibiting JAK2/STAT3 signaling pathways and aggravating the inflammatory reaction [J]., 2021, 226: 112872.
[49] Song H T, Cui Y, Zhang L L,. Ruxolitinib attenuates intimal hyperplasia via inhibiting JAK2/STAT3 signaling pathway activation induced by PDGF-BB in vascular smooth muscle cells [J]., 2020, 132: 104060.
[50] Li S F, Geng Q, Chen H,. The potential inhibitory effects ofon vulnerable plaque formation via the suppression of STAT3 transcriptional activity [J]., 2018, 41(2): 859-867.
Mechanism of diosgenin in treatment of atherosclerosis based on network pharmacology, molecular docking and experimental validation
WAND Dan1, 2, WANG Xiao-long1, 2
1. Branch of National Clinical Research Center for Chinese Medicine Cardiology, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 2. Cardiovascular Research Institute of Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
To explore the potential targets and mechanism of diosgenin against atherosclerosis (AS) through network pharmacology, molecular docking andverification.The targets of diosgenin were mined by SwissTargetPrediction, Pharmmapper and CheMBL databases, and then the targets related to AS were predicted by OMIM, Drugbank, Genecards and DisGeNET databases, and protein-protein interaction (PPI) network was constructed by taking the common targets of them. Cytoscape 3.7.2 software was used to visualize, then core targets were screened out and performed gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) enrichment analysis. AutodockTools, PyMOL and Discovery Studio software were used for molecular docking to verify the correlation between diosgenin and targets. The effects of diosgenin on lipid metabolism, levels of pro-inflammatory cytokines and expressions of key targets in foam cells were investigated by constructing foam cell model.A total of 588 targets of diosgenin and 5489 targets related to AS were obtained, and 275 cross targets between diosgenin and AS were obtained. Through PPI network screening, 52 key targets such as Src, signal transducer and activator of transcription 3 (STAT3) were obtained. GO function enrichment analysis showed that these targets were mainly related to the phosphorylation of protein, reaction of cells to lipids, positive regulation of cell migration, inflammatory reaction and other processes. KEGG pathway enrichment analysis showed that the effect of diosgenin on AS was related to lipid and atherosclerosis pathway, nuclear factor-κB (NF-κB) signaling pathway, etc. Molecular docking showed that diosgenin had good binding affinity with Src and STAT3.experiments showed that diosgenin significantly inhibited THP-1 macrophage lipid accumulation and pro-inflammatory cytokine levels (< 0.05, 0.01, 0.001), significantly up-regulated Src and STAT3 phosphorylation levels (< 0.05, 0.01, 0.001).Diosgenin plays an anti-AS role by regulating multiple targets and pathways, and its mechanism may be related to improving lipid metabolism and inflammation by regulating Src/STAT3 pathway.
diosgenin; atherosclerosis; network pharmacology; molecular docking; Src; signal transducer and activator of transcription 3
R285.5
A
0253 - 2670(2022)24 - 7783 - 12
10.7501/j.issn.0253-2670.2022.24.016
2022-09-06
国家自然科学基金面上项目(81573647);国家自然科学基金面上项目(82074222);上海市中医临床重点实验室(14DZ2273200);上海市科委引导类项目(19401934300);上海市卫健委中医药事业发展三年行动计划(ZY[2018-2020]-CCCX-2003-07);上海市临床重点专科项目(shslczdzk05301)
王 丹(1994—),女,硕士研究生,研究方向为中西医结合治疗心血管疾病。E-mail: 1055466579@qq.com
王肖龙,博士生导师,教授。E-mail: wxlqy0214@163.com
[责任编辑 李亚楠]
