代谢综合征与转移性前列腺癌预后的相关性
2022-12-28王路路马东升赛麦提喀日阿布都巴日王玉杰安恒庆
王路路,陶 宁,马东升 ,赛麦提喀日·阿布都巴日,王玉杰,3,安恒庆,3
(1.新疆医科大学第一附属医院泌尿中心,新疆乌鲁木齐 830054;2.新疆医科大学公共卫生学院,新疆乌鲁木齐 830011;3.新疆泌尿男生殖系疾病临床医学研究中心,新疆乌鲁木齐 830054)
前列腺癌(prostate cancer,PCa)是目前全球男性生殖系统最高发的恶性肿瘤,在男性中发病率与死亡率分别位于恶性肿瘤的第2位和第5位[1-2]。由于PCa高发于中老年男性,发病较为隐匿,患者往往初次就诊时已处于PCa中晚期阶段[3-4],其中转移性前列腺癌 (metastatic prostate cancer,mPCa)是严重影响PCa患者预后的重要疾病阶段。在欧美人群中,mPCa仅占新发PCa的5%~6%,5年总体生存率约为30%[5];而在我国mPCa占初诊PCa患者比例则高达54%,马春光等[6]研究显示mPCa患者5年总体生存率为40%~52%,比欧美人种预后更好[6]。2004年首次提出代谢综合征(metabolic syndrome,MetS)是一种与PCa风险相关的复合因素[7]。最近,PORRETTI等[8]发现,在MetS疾病中,通过表观遗传调控,促进PCa的进展和复发。既往文献旨在研究 MetS与PCa发病风险之间的关系,本研究主要探讨MetS与mPCa发生、进展及预后的相关性。
1 资料与方法
1.1 一般资料回顾性分析2010年1月—2020年12月新疆医科大学第一附属医院泌尿外科171例经病理及影像学诊断为mPCa患者的临床资料,其中合并MetS组102例、单纯mPCa组69例。收集两组患者的体质指数(body mass index,BMI)、血压(blood pressure,BP)、甘油三酯(glycerin trilaurate,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、总胆固醇(cholesterol total,TC)、空腹血糖(fasting blood-glucose,FBG)、血清睾酮、前列腺特异性抗原(prostate-specific antigen,PSA)以及格林森(Gleason)评分、肿瘤T分期等指标数据。
1.2 MetS诊断标准参照由国际糖尿病联合会(International Diabetes Federation,IDF)、美国心脏协会和美国心脏、肺和血液研究所(American Heart Lung and Blood Institute,NHLBI)共同发布的2009年版解读定义[9],即:①肥胖定义为:BMI指数≥25 kg/m2;②TG水平至少为150 mg/dL(1.7 mmol/L)或针对TG升高的药物治疗;③HDL-C低于40 mg/dL(1.0 mmol/L)或针对HDL-C降低的药物治疗;④血压升高(有高血压病史的患者收缩压(systolic blood pressure,SBP)≥130 mmHg和/或舒张压(diastolic blood pressure,DBP)≥85 mmHg或抗高血压药物治疗;⑤FBG至少100 mg/dL(5.6 mmol/L)或药物治疗。每符合上述1项标准就赋值1分,代谢评分≥3可诊断为MetS。
1.3 纳入与排除标准纳入标准:①初次到我院就诊病理及影像学诊断为mPCa的患者,选择Gleason评分系统进行评分,肿瘤分期采用美国癌症联合委员会(American Joint Committee on Cancer, AJCC)标准;②末经任何雄激素剥夺治疗(androgen deprivation thearpy,ADT)等可能影响观察指标的患者;③临床资料完整者。
排除标准:①既往诊断为mPCa并接受新辅助治疗等措施的患者;②初诊时罹患其他恶性肿瘤的患者;③合并严重心肺疾病患者;④临床资料不完整者。
1.4 观察指标及临床生化代谢指标的测定用校正的身高测量仪测量身高(除去鞋子),采用校正后的秤测量体重(除去外套等厚重物品),体质量指数(body mass index,BMI)计算公式:BMI=体重(kg)/身高(m)2。采用校正的水银柱式血压计按照间接测量法规范测量血压。利用全自动生化分析仪,采用酶法测定FBG 、TG、TC,采用化学沉淀法测定HDL-C及LDL-C水平。
1.5 统计学方法采用SPSS 21.0统计软件进行数据处理和分析。计量资料组间采用t检验,多组间比较采用单因素方差分析;计数资料用率描述,组间比较采用χ2检验;采用Kaplan-Meier法对生存指标进行生存分析。检验水准取α=0.05。
2 结 果
2.1 mPCa合并MetS与单纯mPCa组患者的基线临床特征比较两组在年龄、民族、吸烟和饮酒史、初始PSA水平、内脏转移及神经侵犯比较,差异无统计学意义(P>0.05);而睾酮水平、ADT治疗7月后PSA水平及Gleason评分≥8、肿瘤负荷高、T分期>3的百分率,mPCa合并MetS组均高于mPCa组(P<0.05,表1)。
2.2 两组患者进展至去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)的时间比较单纯mPCa组与mPCa合并MetS组进展至CRPC的时间分别为(22.25±10.87)个月、(17.79±7.80)个月,差异有统计学意义(t=3.05,P=0.003),即mPCa合并MetS患者更快进展至CRPC。
2.3 复合代谢评分各亚组进展至CRPC的时间比较复合代谢评分各亚组进展至CRPC的时间比较,0~5分分别为(21.07±2.17)、(20.68±10.89)、(24.18±11.66)、(17.52±8.17)、(17.51±6.98)、(18.57±8.81)个月,差异有统计学意义(F=2.747,P=0.021)。
2.4 mPCa患者与mPCa合并MetS患者5年生存率比较单纯mPCa组患者与mPCa合并MetS组患者中位生存时间分别为58个月和27个月。单纯mPCa组的5年生存率高于mPCa合并MetS组(P=0.044,图1)。

表1 mPCa与mPCa合并MetS组临床资料比较 [例(%)]
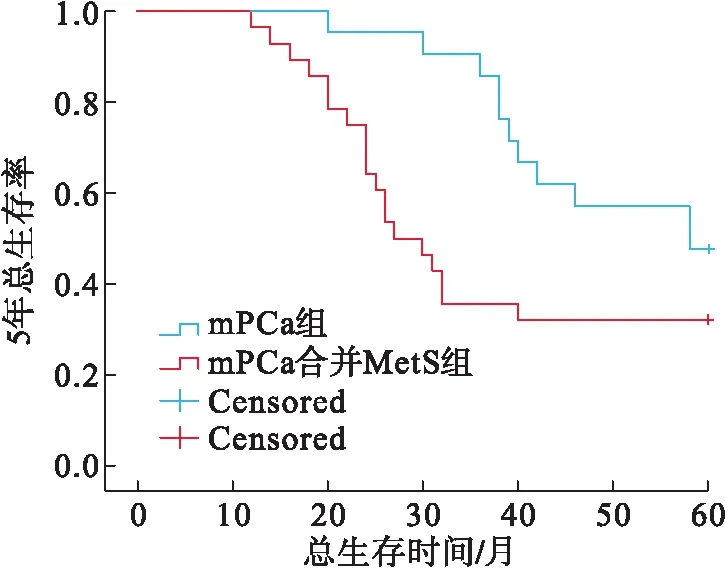
图1 单纯mPCa组与mPCa合并MetS组5年生存曲线比较
2.5 mPCa合并MetS组中复合代谢评分各亚组患者5年生存率比较mPCa合并MetS组患者中复合代谢0~2、3及4~5分者中位生存时间分别为58、31、25个月。3组5年生存率比较,差异有统计学意义(P=0.044)。两两比较结果显示:复合代谢0~2分组的生存率高于4~5分组,差异有统计学意义(P<0.001,图2)。
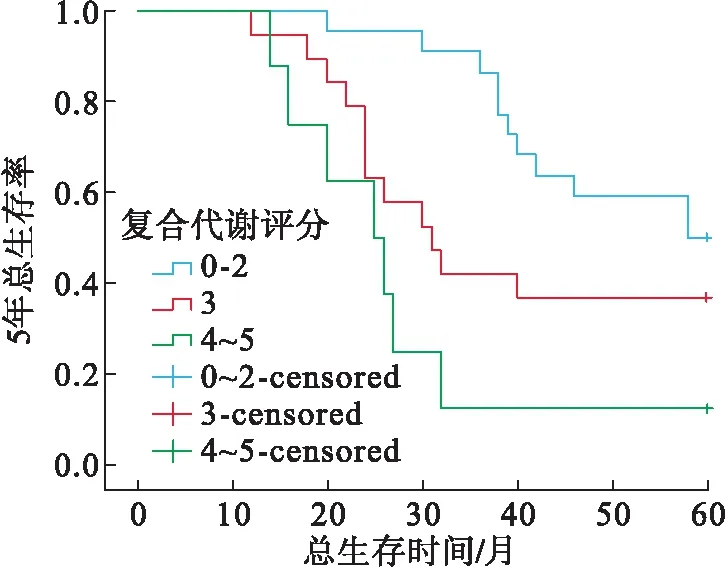
图2 mPCa合并MetS组中复合代谢评分各亚组mPCa患者5年生存曲线图
3 讨 论
目前全球PCa发病率呈上升趋势[10],而mPCa是严重影响患者预后的重要疾病阶段。MetS作为一组老年常见代谢性疾病,与肿瘤发生、发展的关系有学者进行了研究:GACCI等[11]Meta分析显示,MetS与侵袭进展、精囊受侵、包膜外扩散和生化复发密切相关。LEBDAI等[12]研究发现,MetS是ISUP和手术切缘阳性的独立危险因素,SUP组≥4在RP样本上(OR:1.5,95%CI1.1~2.3,P=0.035;OR:2.0,95%CI1.1~4.0,P=0.044);高密度脂蛋白胆固醇水平低与PCa局部晚期相关(OR: 1.6,95%CI1.1~2.4,P=0.024);此外,不良病理特征的风险随着MetS成分数量的增加而增加,≥4 MetS成分与Gleason评分≥8和阳性边缘风险的高风险显著相关(OR:1.9,95%CI1.1~3.3,P=0.017;OR:1.8,95%CI1.1~2.8,P=0.007)。
本研究结果显示:mPCa合并MetS患者有更高的Gleason评分和肿瘤T分期(P<0.05),这与GACCI、LEBDAI等[11-12]的研究结果一致,即合并MetS的mPCa患者的肿瘤恶性程度更高。我们根据肿瘤负荷定义分组发现,mPCa合并MetS患者高瘤负荷组所占比例高,意味着合并MetS的mPCa患者骨转移灶数目更多、肿瘤侵袭性更高。此外,我们还评估了mPCa与mPCa合并MetS患者初始PSA及给予内分泌治疗7月后的PSA水平。两组初始PSA水平比较无差异,这与既往研究MetS引起PSA水平下降不符[13],结合本研究有以下原因:由于mPCa合并MetS患者睾酮水平高于单纯mPCa患者(P=0.003),睾酮会刺激前列腺细胞甚至癌细胞的增长,产生更多的PSA。但由于MetS各个成分对患者PSA影响所占比重不同,总的效应引起PSA下降[14]。在两者的共同作用下,导致患者体内PSA变化不大。因此,在进行健康体检时,如果PSA水平在前列腺穿刺临界值的边缘升高,那么在决定是否进行前列腺穿刺时,应考虑到MetS的降低效应。而在给予mPCa患者ADT治疗后,mPCa合并Met S患者7月后的PSA水平更高(P=0.002)。可能的原因是:首先在ADT治疗期间,虽然ADT的给药剂量相同,但由于合并肥胖患者体表面积较大,未达到理想的给药剂量,睾酮抑制不足,导致PSA下降缓慢;其次,合并MetS患者通过下丘脑性腺轴,引起体内激素分泌紊乱,这类患者行内分泌治疗加重原有的代谢程度,ÇAKICI和PALUMBO等[15-16]的研究也显示患者行内分泌治疗会显著增加MS及其组分的发病率,最终可能导致PSA缓解率降低。
本研究中,mPCa合并MetS患者进展至CRPC的时间明显较短,这可能与MetS导致了PCa更具有侵袭性相关,由于MetS引起慢性炎症,使得肿瘤坏死因子-a、白介素(interleukin,IL)-8、IL-6和IL-1b等促炎性细胞因子水平升高[17-18]。其中IL-6和IL-8是雄激素受体(androgen receptor,AR)的非配体激活剂,也是PCa的关键调节因子[19]。这些炎性因子通过刺激癌症中上皮-间质转化以及促进局部骨转移或激活核因子-kB(nuclear factor kappa-B,NF-kB)通路等方法来影响PCa的发生和进展[20-21]。PCa主要由AR阳性的腔内细胞组成,它们需要AR转录活性才能生存和增殖。不幸的是,晚期PCa患者可能由于突变、变异或过表达AR而发展为不可治愈的CRPC。研究表明NF-kB的激活与去势抵抗前列腺癌的产生密切相关,无论CRPC是由于异常的AR活性还是AR独立引起,NF-kB信号通路均参与CRPC的起始和维持[22]。此外,ADT的有益作用可能会部分被前列腺周围脂肪组织的代谢和炎症副作用所抵消[23]。以上最终导致合并MetS的患者进展至CRPC的时间更快。进一步探讨复合代谢评分各亚组进展至CRPC的时间发现,复合代谢评分越高,进展至CRPC时间越短,疾病进展也越快:其原因可能是 MetS各指标之间的相互影响;此外,合并MetS的患者行内分泌治疗可能加重原有的MetS紊乱程度,或使MetS诊断异常指标个数增加,加快患者的疾病进展,使得预后更差。这也提示我们对于临床上合并MetS的患者,针对不同的代谢成分应积极地给予相应治疗,延缓疾病进展。
一项近期研究表明,高能量食物摄入、高酒精摄入、缺乏体力活动和吸烟等生活习惯较差的男性中,致死性的发生率较高[24]。研究MetS在根治术肿瘤预后中的作用发现,MetS患者总体死亡率更高[25]。本研究5年生存分析共纳入50例患者,通过5年生存分析得出:mPCa中位生存时间远远高于mPCa合并MetS患者。可能的原因是,由于合并MetS患者更容易进展为CRPC,细胞在微环境下仍能产生雄激素,可能使AR提前被活化,应用 ADT和化学疗法后,肿瘤细胞对微量雄激素的反应更为灵敏,加速病情的发展,从而导致患者的存活期缩短。复合代谢0~2分患者5年生存率高于4~5分患者。HGGSTRÖM等[26]研究报告MetS因素的复合评分和特异性死亡风险呈正相关(RR=1.13,95%CI1.03~1.25)。表明MetS患者疾病的严重程度,可能影响患者的生存,这也与本研究得出结论相一致,即复合代谢评分越高,mPCa患者预后越差,死亡率越高。
本研究的局限性:首先未能深入剖析MetS各个组分(高血压、糖尿病、肥胖等)与发生发展及疾病侵袭性之间的相关性;其次,研究数据是基于新疆地区的就诊人群,存在饮食结构、生活习惯等差异性。综上所述,本研究归纳为mPCa合并MetS患者对ADT不敏感、肿瘤进展快、中位生存时间短、预后差。有限的研究结果表明MetS与死亡率和肿瘤侵袭性增加存在相关性。且复合代谢评分等级与肿瘤疾病关联也愈发明确,可以作为很好的预后参考标准,有望在今后的临床诊疗纳入评价体系。
