姜黄素抗结肠癌作用机制的研究进展
2022-12-27高飞云张转红王彦钧张育贵孙宇靖李越峰
刘 婷,高飞云,张转红,王彦钧,张育贵,孙宇靖,李越峰*
姜黄素抗结肠癌作用机制的研究进展
刘 婷1, 2, 3,高飞云1, 2, 3,张转红1, 2, 3,王彦钧1, 2, 3,张育贵1, 2, 3,孙宇靖1, 2, 3,李越峰1, 2, 3*
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中药质量与标准研究重点实验室,甘肃 兰州 730000 3. 甘肃省中药制药工艺工程研究中心,甘肃 兰州 730000
姜黄素是提取于姜科姜黄属植物姜黄、温郁金等根茎中的多酚类化合物,具有抗炎、抗肿瘤等药理作用。研究表明姜黄素对结肠癌发生、发展的多个阶段具有预防作用和显著的治疗作用。姜黄素可通过抑制结肠炎症、抑制结肠癌细胞增殖、诱导凋亡、抑制侵袭转移和化疗耐药性等发挥抗结肠癌的作用。主要综述了姜黄素对炎性驱动结肠癌的早期预防作用、结肠癌细胞的治疗作用和相关信号通路的调控作用,为姜黄素的进一步开发和临床应用提供参考。
姜黄素;结肠癌;细胞增殖;诱导凋亡;侵袭转移;化疗耐药性;信号通路
姜黄素是从姜科姜黄属植物姜黄L.、温郁金Y. H. Chen et C. Ling等根茎中提取出来的一种多酚类化合物,常用作着色剂和食品添加剂。大量研究表明,姜黄素具有抗炎、抗肿瘤、抗氧化、抗微生物、抗纤维化等药理作用[1]。近年来姜黄素的抗肿瘤作用备受关注,对胃癌[2]、前列腺癌、鼻咽癌、结肠癌等均有治疗效果,尤对结肠癌发生、发展的多个阶段治疗效果显著。结肠癌是一种常见的胃肠道恶性肿瘤,以结肠的储存、发酵、吸收、分泌和运动为特征,主要发生在直肠和乙状结肠交界处[3]。西医对于结肠癌的治疗常采用手术、放疗和化疗的手段,除此之外,中医药治疗也是重要的治疗方式之一,但中药化学成分复杂,作用机制多样,缺乏一定的精准性,与传统中药相比,姜黄素作为中药单体,具有低剂量、低不良反应、作用机制明确、抗肿瘤作用良好等优点,在基础研究和新药研发中具有一定优势[4]。因此,本文主要从姜黄素对炎性驱动结肠癌的早期预防、对结肠癌细胞的治疗作用和相关信号通路的调控作用进行综述,以期为姜黄素治疗结肠癌的深入研究和临床应用提供参考。
1 对炎性驱动结肠癌的早期预防
慢性炎症是恶性肿瘤的重要触发因素,许多恶性肿瘤的发生是在慢性炎症的基础上逐步发展而来,结肠癌是消化道常见的恶性肿瘤,慢性炎症显著增加了结肠癌的发病风险,若结肠炎症长期得不到控制,会逐渐向癌变的方向发展[5]。姜黄素可抑制炎症介质和转录因子发挥抗炎作用,通过调节促炎因子和抑炎因子间的平衡,治疗结肠炎的炎性损伤。姜黄素对结肠炎症有明显的抑制作用,能明显增加丙二醛含量、降低巯基含量和过氧化氢酶活性,发挥抗炎作用[6]。研究表明,姜黄素可显著抑制葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体活化,减轻结肠炎症,其作用机制为姜黄素激活NLRP3炎症小体,阻止DSS诱导的K+流出,细胞内活性氧的形成以及组织蛋白酶B的释放,并降低白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、单核细胞趋化蛋白1等多种炎症因子的表达,进而发挥抑制结肠炎症的作用[7]。Wei等[8]研究发现,姜黄素可抑制由DSS诱导的小鼠肠道炎症反应,其作用机制为姜黄素通过调节辅助性T细胞17(T helper cell 17,Th17)和调节性T细胞(regulatory T cells,TREG)的平衡,提高抗炎细胞因子IL-10的水平,降低促炎因子IL-23、IL-17、IL-6的水平,通过抑制IL-23/Th17信号通路发挥治疗作用。研究发现,TREG通过释放免疫抑制分子,如转化生长因子-β(transforming growth factor-β,TGF-β),抑制抗肿瘤免疫效应细胞,从而破坏机体对肿瘤的免疫监视[9]。姜黄素可抑制叉头框蛋白P3(forkhead box protein P3,)基因表达,促进γ干扰素的产生,使TREG转化为Th1。同时,姜黄素能减少和抑制中性粒细胞和巨噬细胞的渗出,调节肠道免疫紊乱,减轻肠道内皮细胞肿胀,增加通透性,进一步减轻肠道炎症[10-11]。综上所述,姜黄素主要通过调节TREG和Th17的平衡,从而维持机体对肿瘤的免疫监控,进一步调节促炎因子与抑炎因子的平衡,减轻结肠炎症,对炎性驱动结肠癌具有显著的早期预防作用,见图1。
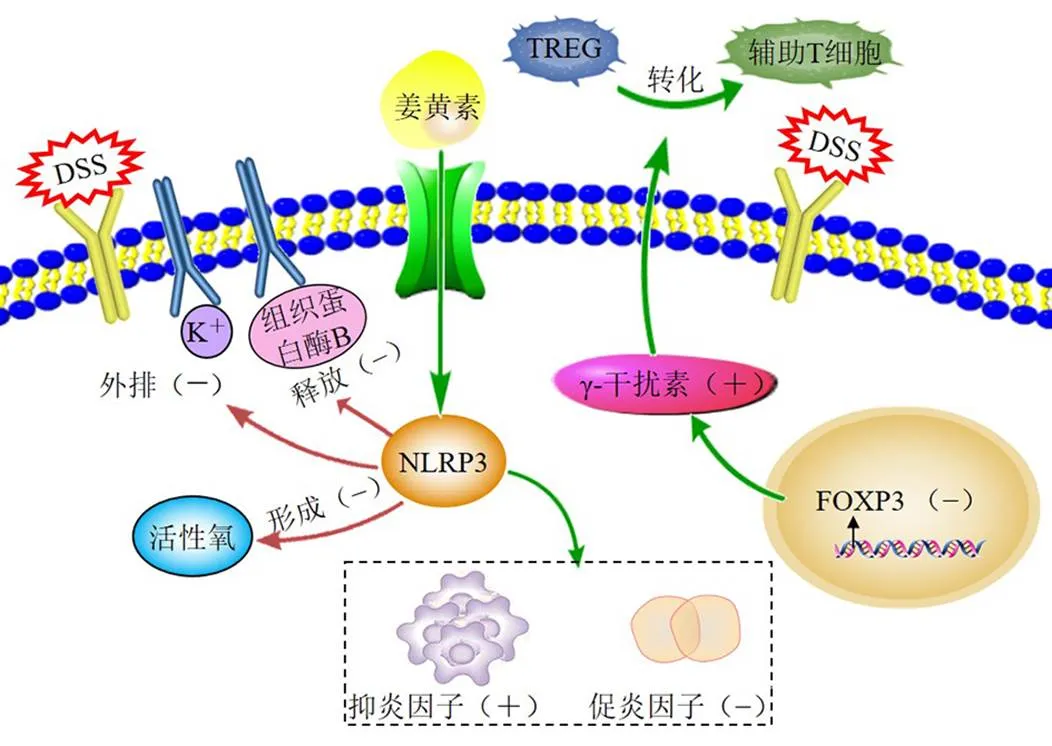
“+”表示促进、增加 “-”表示抑制、减少,下同
2 对结肠癌细胞的治疗作用
2.1 抑制结肠癌细胞增殖
在结肠癌的发生、发展过程中,结肠上皮细胞从正常的良性细胞逐渐恶化为肿瘤细胞,获得无限分裂的潜能,导致细胞周期转运失控,表现出无限增殖的特性[3]。姜黄素呈时间和剂量相关性抑制结肠癌细胞增殖,是发挥抗结肠癌作用的机制之一。方丽等[12]用不同浓度的姜黄素稀释液干预人结肠癌HT-29细胞,对HT-29细胞的生存、细胞周期及细胞中基因表达的影响进行检测,结果表明姜黄素通过诱导G0/G1期阻滞,显著降低HT-29细胞中细胞周期蛋白D1(Cyclin D1)的表达,抑制HT-29细胞的生长,且呈时间和剂量相关性。向磊[3]以人结肠癌HCT-116细胞作为研究对象进行体外培养,探索姜黄素对结肠癌细胞的抗肿瘤效应,并与结肠癌化疗药物5-氟尿嘧啶(5-fluorouracil,5-FU)进行比较研究,结果显示,姜黄素可显著诱导HCT-116细胞阻滞在S期,并且呈剂量相关性,姜黄素30 μmol/L与5-FU 500 μmol/L相比,诱导HCT-116细胞阻滞在S期的比例可以达到5-FU的作用效果。陈海滔[13]用淋巴细胞增殖检测法对人结肠癌SW620细胞的增殖活性进行检测,结果表明,姜黄素具有抑制SW620细胞增殖活性的作用。龚邵新[14]以结肠癌SW480细胞为研究对象,探讨姜黄素调控微小RNA-9(microRNA-9,miR-9)抑制结肠癌细胞增殖的作用机制,结果表明,姜黄素通过下调miR-9在结肠癌中的表达,上调其相应靶基因上皮钙黏附素(-cadherin)的表达水平,发挥抗肿瘤作用。综上所述,姜黄素主要通过干预细胞周期,影响各周期蛋白质表达和DNA的合成,使结肠癌细胞不能严格按照G1→S→G2→M的过程进行分裂,从而发挥抑制增殖的作用,见图2。
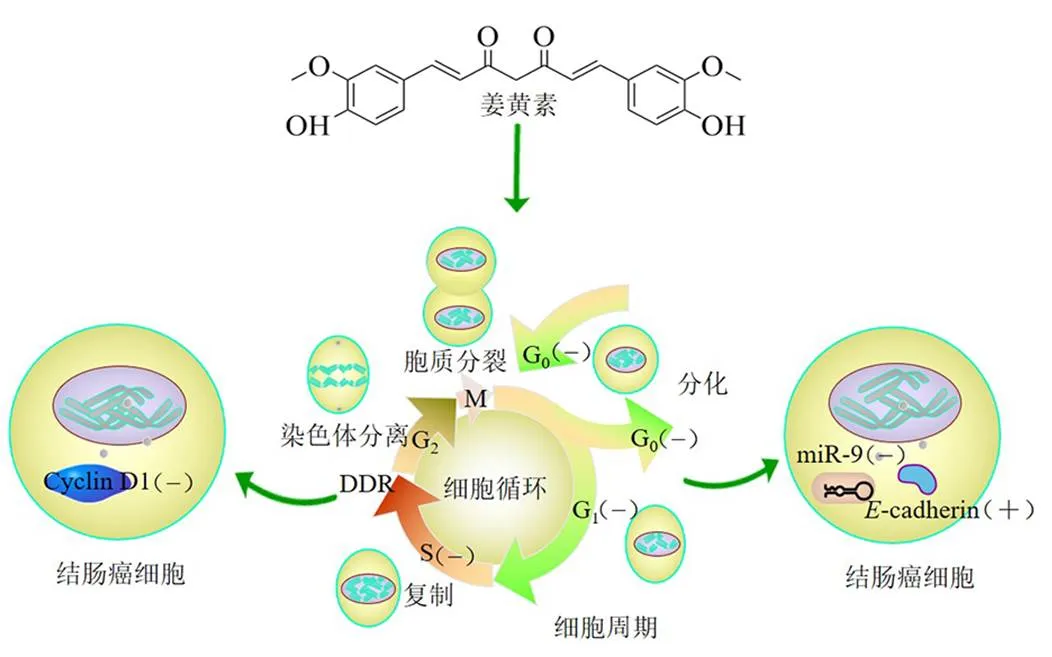
图2 抑制结肠癌细胞增殖作用机制
2.2 诱导结肠癌细胞凋亡
细胞凋亡又称程序性细胞死亡,由特定基因控制的高度有序的细胞自主死亡过程,其目的是为了更好的适应生存环境,维持正常生命活动,调控机体发育[3,15]。调控肿瘤细胞自发凋亡是当前肿瘤治疗的一种方式。相关研究表明,姜黄素能诱导HCT-116和SW620细胞发生凋亡,呈时间和剂量相关性,且HCT-116细胞对姜黄素更为敏感[3]。研究表明,线粒体介导的凋亡通路受B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族成员调控,依赖于抗凋亡蛋白Bcl-2和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的平衡,姜黄素可以抑制Bcl-xL水平,导致线粒体膜电位降低,使Bcl-2家族成员的平衡向凋亡方向转变,通过上调Bax、下调Bcl-2抑制裸鼠皮肤下肿瘤细胞的生长,减小肿瘤体积,减轻肿瘤质量,诱导细胞凋亡,达到抗肿瘤的作用[16-17]。向磊[3]研究发现,姜黄素作用于HCT-116细胞后,Fas死亡受体通路上的相关mRNA表达发生显著变化,姜黄素通过上调凋亡相关因子Fas重组蛋白、Fas相关死亡结构域蛋白(fas associated via death domain,FADD)、半胱氨酸天冬氨酸蛋白酶-8(cystein-asparate protease-8,Caspase-8)、Caspase-3等的表达,下调HCT-116细胞中核因子-κB p65的表达,诱导细胞凋亡。邵斌等[18]用姜黄素干预HCT-116细胞,结果显示,随着姜黄素浓度的升高,细胞的凋亡水平不断提高,miR-21-3p靶向自噬相关基因10(autophagy related gene 10,),miR-21-5p靶向凋亡酶激活因子-1(apoptotic protease activating factor-1,),姜黄素通过抑制miR-21-3p和miR-21-5p的表达量减少和的表达量,最终促进HCT-116细胞自噬和凋亡。武嘉庚[19]通过检测姜黄素对结肠癌细胞中miR-211表达的影响,对miR-211调控结肠癌细胞增殖和凋亡进行研究,结果显示,HCT-116细胞高表达miR-211,姜黄素可通过抑制miR-211的表达,抑制结肠癌细胞增殖并促进凋亡,且呈剂量相关性。吴亚丽等[20]用不同浓度的姜黄素对人结肠癌LoVo细胞进行干预,采用反转录聚合酶链反应检测、和的mRNA表达水平,Annexin V-FITC/PI标记法检测细胞凋亡率,结果显示,姜黄素可激活细胞中和的mRNA表达,抑制mRNA和基因表达,诱导LoVo细胞凋亡。综上所述,姜黄素诱导结肠癌细胞凋亡,其作用机制与细胞凋亡主要的2条途径密切相关,一是由线粒体介导的内部途径,姜黄素通过上调促凋亡蛋白Bax的表达,下调抗凋亡蛋白Bcl-2、Bcl-xL等的表达,导致线粒体膜电位降低,打破Bcl-2家族的平衡,致使向凋亡方向转变;二是由胞外信号激活胞内凋亡酶Caspase的外部途径,姜黄素通过上调Fas、FADD等的表达,利用细胞之间的死亡配基Fas配基去活化“死亡受体”,Fas受体与FasL配体结合导致细胞走向凋亡,凋亡信号使启动子Caspase-8和执行因子Caspase-3进入凋亡程序,进而使各种细胞底物被降解致使细胞崩解。见图3。
2.3 抑制结肠癌细胞侵袭转移
肿瘤转移受到许多肿瘤转移调控机制的影响,目前发现,上皮细胞间质转化(epithelial-mesenchymal transition,EMT)与肿瘤细胞的侵袭和转移密切相关[21],相关研究证实,通过激活Wnt/β-连环蛋白(β-catenin)通路、TGF-β/Smad通路、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路、Src通路、Notch通路等,调控Snail、Twist和-盒结合锌指蛋白(zinc finger-box-binding protein,ZEB)等转录因子,诱导EMT,增强肿瘤细胞的侵袭转移能力[22-23]。有研究报道,姜黄素具有抑制肿瘤EMT的作用,Wnt/β-catenin信号通路是EMT相关信号通路之一,其主要功能是调节细胞内β-catenin的浓度,β-catenin是一种多功能蛋白,参与细胞黏附、细胞迁移和与细胞生存、增殖和分化相关的基因转录,对肿瘤的发生发展起着重要的作用,姜黄素通过降低基因表达水平,抑制Wnt信号通路,发挥抗肿瘤作用[24]。其中,β-catenin和糖原合成酶激酶-3在Wnt信号通路中发挥关键作用,姜黄素诱导凋亡蛋白的表达,并通过降低β-catenin和磷酸化糖原合成酶激酶-3抑制Wnt信号通路,起到抗肿瘤的作用[25]。研究表明,姜黄素可显著上调裸角质膜同源蛋白2(naked cuticle homolog 2,NKD2)的表达水平,NKD2是Wnt信号通路的负调控因子,其在细胞中过表达可显著降低体外细胞增殖、迁移和侵袭能力,下调则增强迁移和侵袭能力[26]。陈海滔[13]研究发现,姜黄素通过上调Wnt通路中的上游抑制基因的表达,抑制Wnt通路,进而抑制结肠癌细胞的EMT及趋化因子受体4(chemokine receptor 4,CXCR4)的表达,抑制SW620细胞的侵袭转移。龚邵新[14]采用转染miR-9抑制剂技术发现,干扰miR-9可抑制SW480细胞的迁移。综上所述,姜黄素通过上调Wnt通路上游抑制基因的表达,抑制Wnt信号通路,调控β-catenin的表达,减少细胞内β-catenin的浓度,调控Snail、Twist和ZEB等转录因子,抑制EMT,进而影响细胞黏附、细胞迁移和与细胞生存、增殖和分化,发挥抗肿瘤作用,见图4。

图3 诱导结肠癌细胞凋亡的作用机制
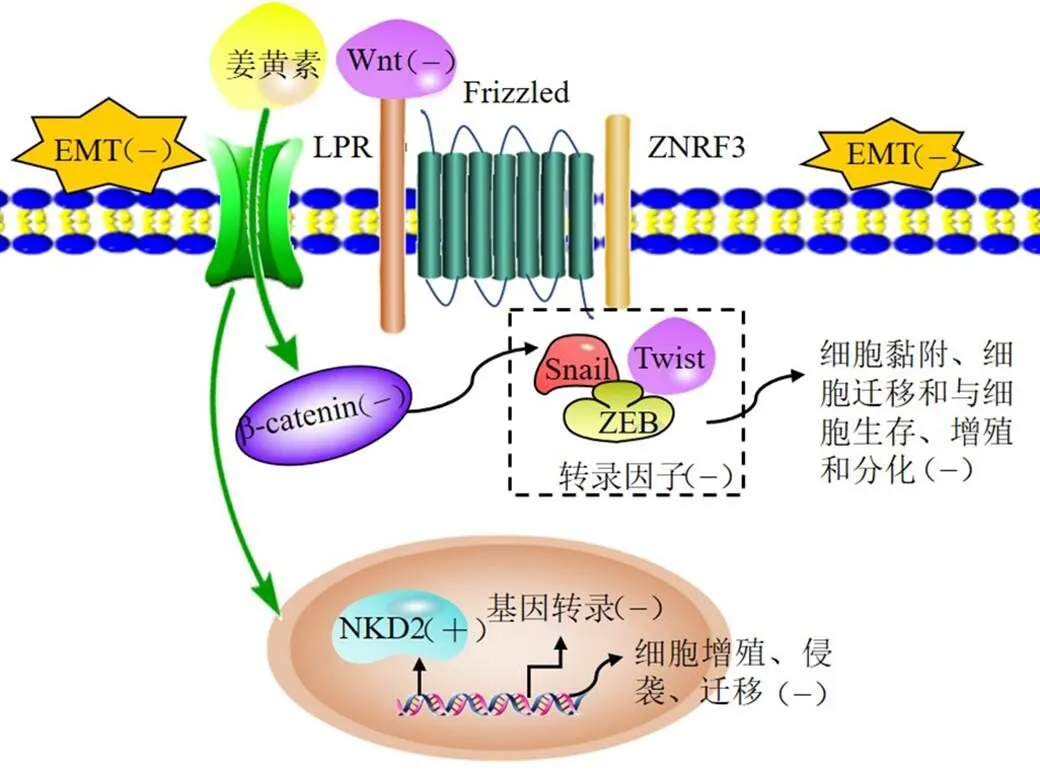
ZNRF3-锌指环指蛋白3
2.4 抑制结肠癌细胞化疗耐药性
肿瘤的化疗耐药机制复杂,众所周知,癌细胞中药物转运蛋白过表达会对多种细胞毒性药物产生耐药性[27]。李尤玲等[28]研究发现,姜黄素64 μmol/L,与奥沙利铂和5-FU常规化疗药物相比,可明显抑制耐药结肠癌细胞的增殖作用,且干细胞的存在,可能是其产生耐药性的原因之一,姜黄素抑制耐药结肠癌细胞干细胞标志物跨膜蛋白CD133、乙醛脱氢酶-1等的表达,从而抑制结肠癌细胞的耐药性。陆怡等[29]用不同浓度的姜黄素干预SW480细胞和SW480耐药细胞,结果显示,姜黄素可使SW480细胞和SW480耐药细胞的细胞活力逐渐降低,能够阻滞SW480耐药细胞的细胞周期于G0/G1期,增加SW480耐药细胞的总凋亡率,呈剂量相关性。Zhang等[30]研究发现,姜黄素可通过降低鸟氨酸脱羧酶表达,抑制-谷氨酰胺代谢,进而降低SW620耐药细胞的抗氧化应激能力和P-糖蛋白转运活性,逆转P-糖蛋白介导的SW620耐药细胞的耐药性。徐露等[31]研究发现,姜黄素可通过抑制IL-6/转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路,抑制EMT进程发挥修复5-FU化疗引起肠黏膜损伤的作用。综上,姜黄素对结肠癌细胞化疗耐药的抑制作用主要体现在2方面:(1)姜黄素可阻滞结肠癌耐药细胞的细胞周期,增加凋亡率,降低耐药细胞的抗氧化应激能力;(2)姜黄素能抑制EMT进程,修复由化疗药物引起的肠黏膜损伤,进而增强机体对化疗药物的耐受性。见图5。

图5 抑制化疗耐药作用机制
3 调控信号通路对结肠癌细胞的作用
3.1 对Wnt信号通路的调控
Wnt信号通路分为经典和非经典通路,在经典通路中,β-catenin的稳定导致其易位到细胞核中并转录β-catenin反应基因;在非经典通路中并不依赖β-catenin,而是由Rho相关蛋白激酶和c-Jun氨基末端激酶途径介导的细胞骨架反应[32]。研究表明,Wnt信号通路的损伤可能与结直肠癌等多种复杂疾病有关,这表明Wnt通路在维持生理状态中的关键作用,姜黄素可以通过调节Wnt信号通路中的经典通路,即Wnt/β-catenin信号通路,改变肿瘤细胞的活力和增殖。Dou等[33]研究发现,miR-130a过表达可以消除姜黄素的抗肿瘤活性,姜黄素可通过下调miR-130a,抑制Wnt/β-catenin途径来抑制结肠癌细胞增殖。刘英等[34]研究发现,姜黄素通过降低磷酸化β-catenin的蛋白水平,抑制Wnt/β-catenin信号通路中Cyclin D1、survivin、c-Myc的表达,使人结肠癌HT29细胞发生G0/G1期阻滞,从而抑制增殖,通过调节cleaved-Caspase-3、Bax、Bcl-2蛋白水平,促进HT-29细胞凋亡。Jiang等[35]研究发现,姜黄素通过抑制Wnt/β-catenin信号通路的尾型同源盒基因转录因子2的表达,抑制β-catenin的核转运及Wnt-3a和Wnt下游信号转导基因、、的表达,降低SW620细胞的细胞活力并增加细胞凋亡。陆怡等[29]通过构建裸鼠移植瘤模型,给予不同剂量的姜黄素进行体内实验,通过检测肿瘤的体积变化,计算姜黄素在体内的抑瘤率,Western blotting检测肿瘤组织中相关蛋白的变化,结果显示,姜黄素可有效抑制裸鼠移植瘤的生长,通过激活Wnt信号通路,使得SW480耐药细胞EMT水平增加,细胞中-cadherin和轴抑制蛋白(axis ihibition protein,Axin)表达降低,波形蛋白、β-catenin以及转录因子4表达显著升高。综上所述,姜黄素通过调控Wnt/β-catenin信号通路,Axin-APC-糖原合成酶激酶-3(glycogen synthase kinase-3,GSK-3)复合物与β-catenin结合,使β-catenin磷酸化进而被胞浆内的蛋白酶体降解,降低细胞中β-catenin的表达水平,抑制、C、等相关靶基因的表达,抑制结肠癌细胞活力及增殖能力,诱发凋亡,见图6。

LRP-低密度脂蛋白受体相关蛋白 CK1α-酪蛋白激酶1α TCF/LEF-转录因子/淋巴增强因子
3.2 对其他信号通路的调控
STAT3是信号转导和转录活化因子家族的重要成员,是表皮生长因子受体、IL-6/Janus激酶、人可溶性补体受体,在多种组织和肿瘤细胞中都有激活[36]。研究发现,STAT3激活后表现出致癌作用,其活性在结肠癌、乳腺癌等多种组织及细胞系中异常增高,STAT3可调控P-糖蛋白的表达,在肿瘤耐药中发挥作用[37-38]。马亮等[39]研究发现,姜黄素通过抑制STAT3总蛋白及磷酸化蛋白的水平,下调STAT3下游信号Bcl-2、c-Myc、survivin的表达,抑制结肠癌细胞的增殖。文坤明等[37]研究发现,姜黄素通过抑制STAT3信号通路,降低P-糖蛋白的表达,调控结肠癌细胞的耐药性。Lin等[40]观察STAT3对结肠癌干细胞的抑制作用,研究发现,STAT3是结肠癌干细胞一个新的治疗靶点。因此,抑制STAT3信号通路是治疗结肠癌的关键途径之一。
Notch信号通路与肿瘤的相关性最早是在T细胞型急性淋巴细胞白血病中确定,认为Notch信号通路失调诱发肿瘤,属于致癌信号通路[41]。Notch1信号通路是Notch信号通路之一,在多种肿瘤组织中均能检测出表达,研究表明,Notch1信号通路在结肠癌组织中高表达,在结肠癌发展过程中起致癌作用[42]。刘少琼等[43]、杨芳等[44-45]基于Notch1信号通路探讨姜黄素对SW480细胞的影响,研究发现,姜黄素通过下调Notch1信号通路中的Notch1、Notch1受体胞内结合域(Notch1 intracellular domain,NICD)和Hes家族BHLH转录因子-1(Hes family BHLH transcription factor-1,Hes-1)蛋白表达水平,下调、的mRNA水平,呈剂量相关性抑制SW480细胞的增殖并促进凋亡。综上所述,STAT3、Notch等信号通路在结肠癌的治疗过程中具有重要作用,主要体现在姜黄素通过调控信号通路,进一步调控相关蛋白和mRNA表达水平,诱导结肠癌细胞凋亡,抑制增殖和对化疗药物的耐药性。
4 其他作用
越来越多的研究表明肠道菌群已成为结肠癌发生发展的一个潜在因素。研究发现,姜黄素能抑制创伤弧菌的细菌运动和细胞毒性,抑制感染期间幽门螺杆菌的生长和铜绿假单胞菌的生物膜形成[46-48]。McFadden等[49]研究发现,姜黄素能够通过增加结肠菌群丰富度和乳酸杆菌相对丰度,降低结肠肿瘤负担。此外,姜黄素还具有平衡活性氧的能力,其作用机制为通过清除自由基,抑制单线态氧的形成,保护结肠免受氧化应激,刺激结肠修复机制,通过参与结肠防御系统的内源性氧化酶,如过氧化氢酶、超氧化物歧化酶、硫醇和丙二醛来对抗氧化偶氮甲烷引起的氧化应激,从而发挥对结肠损伤的保护作用[6,50]。综上,姜黄素发挥抗结肠癌作用具有多条途径,除了通过抗炎、直接干预结肠癌细胞发挥抗结肠癌作用以外,还可以通过调节肠道菌群、平衡活性氧等保护结肠,间接发挥抗结肠癌作用。
5 结语与展望
姜黄素是提取于姜科姜黄属植物姜黄、温郁金等根茎中的多酚类化合物,通过多途径发挥抗肿瘤和化疗增敏的作用,又作为一种无毒的膳食物质,来源广泛、价格低廉,与传统的化疗药物与抗肿瘤药物相比,其具有更高的安全性,可广泛应用于结肠癌的预防和治疗过程中[51-52]。本文从姜黄素抑制结肠癌细胞增殖、诱导凋亡、侵袭转移、化疗耐药性以及调控信号通路方面进行总结,归纳姜黄素抗结肠癌的作用机制。姜黄素通过干预细胞周期,影响各周期蛋白质和DNA的合成,使结肠癌细胞不能严格按照G1→S→G2→M的发展过程进行分裂,从而发挥抑制增殖的作用,通过影响凋亡途径,调控相关转录因子,影响抗凋亡蛋白Bcl-2和促凋亡蛋白Bax的平衡及各蛋白的表达,诱发细胞凋亡,抑制EMT来调控Wnt等相关通路的转录因子,从而抑制癌细胞的侵袭转移,作用于肿瘤细胞,使细胞膜上P-糖蛋白的表达下降,减少细胞膜上P-糖蛋白的数量,阻止药物外排,从而使细胞内药物浓度升高,达到杀灭肿瘤细胞的药物浓度,发挥逆转耐药作用,通过抑制Wnt/β-catenin信号通路诱导肿瘤细胞的抗肿瘤活性,降低癌细胞的生存能力、增殖能力和侵袭能力,调节肠道菌群,清除自由基,保护结肠免受氧化应激间接发挥抗结肠癌作用。这些作用机制相互影响、相互调控,共同发挥抗结肠癌的作用。综上,姜黄素可显著抑制结肠癌细胞增殖与侵袭,诱导凋亡,并呈时间和剂量相关性,有效逆转化疗药物的耐药性,在体内有效修复由化疗药引起的肠黏膜损伤,在抗结肠癌方面作用明显,作用机制明确,有待进一步开发利用。
姜黄素具有多方面药理作用[53-54],在结肠癌的治疗中作用突出,但也存在水溶性差、生物利用度低、稳定性差等缺点,这些缺点制约了姜黄素在治疗结肠癌中的应用。因此,有必要对姜黄素的新剂型进行研发,以便充分发挥其在抗肿瘤方面的作用。冷怡林[55]利用生物安全性及抗多药耐药性较好的聚乙二醇-去氧胆酸聚合物及衍生物包载姜黄素,其所得的姜黄素聚合物胶束较姜黄素溶液有明显的缓释效果,可达到靶向给药的目的。Elbassiouni等[56]研究发现,姜黄素生物利用度因血清水平低、组织分布受限、代谢明显快、半衰期短而严重降低,而纳米姜黄素有更长的循环长度,更好的渗透性,且姜黄素被放置在纳米颗粒上后,其活性变得更强。故而开发新的姜黄素衍生物或新型姜黄素纳米制剂,对提高姜黄素生物利用度、增强抗癌效果,更好的应用于临床,具有积极的意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘伟, 顾秀竹, 吴筱霓, 等. 姜黄素药理作用的研究进展 [J]. 华西药学杂志, 2021, 36(3): 336-340.
[2] Zhang W S, Cui N, Ye J,Curcumin’s prevention of inflammation-driven early gastric cancer and its molecular mechanism [J]., 2022, 14(2): 244-253.
[3] 向磊. 姜黄素对结肠癌细胞增殖、凋亡与转移的影响及机制研究 [D]. 武汉: 湖北中医药大学, 2021.
[4] 徐晓华, 吴煜. 基于Wnt/β-catenin信号通路的中药单体治疗结直肠癌的作用机制研究进展 [J]. 医学综述, 2021, 27(20): 4022-4027.
[5] 李晓玲, 吴玉泓, 郝民琦, 等. 中医药调控肿瘤微环境延缓结肠炎-癌转化的研究概况 [J]. 中医药学报, 2022, 50(3): 97-102.
[6] Marjaneh R M, Rahmani F, Hassanian S M,. Phytosomal curcumin inhibits tumor growth in colitis-associated colorectal cancer [J]., 2018, 233(10): 6785-6798.
[7] Gong Z Z, Zhao S N, Zhou J F,. Curcumin alleviates DSS-induced colitis via inhibiting NLRP3 inflammsome activation and IL-1β production [J]., 2018, 104: 11-19.
[8] Wei C, Wang J Y, Xiong F,. Curcumin ameliorates DSS‑induced colitis in mice by regulating the Treg/Th17 signaling pathway [J]., 2021, 23(1): 34.
[9] Waldmann T A. Effective cancer therapy through immunomodulation [J]., 2006, 57: 65-81.
[10] Hardenberg G, Steiner T S, Levings M K. Environmental influences on T regulatory cells in inflammatory bowel disease [J]., 2011, 23(2): 130-138.
[11] Shen W, Durum S K. Synergy of IL-23 and Th17 cytokines: New light on inflammatory bowel disease [J]., 2010, 35(6): 940-946.
[12] 方丽, 周进, 谢华, 等. 姜黄素对结肠癌HT-29细胞生长增殖、细胞周期分布及Cyclin D1基因表达的影响 [J]. 重庆医学, 2016, 45(32): 4479-4481.
[13] 陈海滔. 姜黄素调控NKD2-Wnt-CXCR4通路抑制结肠癌细胞的侵润转移 [D]. 杭州: 浙江中医药大学, 2017.
[14] 龚邵新. 姜黄素下调miR-9抑制人结肠癌SW480细胞增殖与迁移的初步研究 [D]. 衡阳: 南华大学, 2012.
[15] 崔晓. 小檗碱通过AMPK/mTOR通路调节自噬溶酶体功能改善糖尿病肾病的机制研究 [D]. 天津: 天津医科大学, 2020.
[16] Balasubramanian S, Eckert R L. Curcumin suppresses AP1 transcription factor-dependent differentiation and activates apoptosis in human epidermal keratinocytes [J]., 2007, 282(9): 6707-6715.
[17] Yang J Y, Ning J P, Peng L L,. Effect of curcumin on Bcl-2 and Bax expression in nude mice prostate cancer [J]., 2015, 8(8): 9272-9278.
[18] 邵斌, 刘志先, 张斌, 等. 姜黄素通过调控microRNA-21表达影响结肠癌细胞自噬和凋亡的研究 [J]. 中国卫生检验杂志, 2021, 31(18): 2189-2193.
[19] 武嘉庚. 姜黄素通过下调microRNA-211表达促进结肠癌细胞的凋亡及其机制 [J]. 中国现代医学杂志, 2016, 26(24): 18-23.
[20] 吴亚丽, 谢俊霞, 卢楠, 等. 姜黄素对结肠癌细胞增殖抑制和凋亡诱导的作用研究 [J]. 现代食品科技, 2014, 30(4): 74-79.
[21] 陆虹旻, 马俐君. 上皮间质细胞转化的分子机制及其在肿瘤转移中的作用 [J]. 中国肿瘤生物治疗杂志, 2009, 16(5): 541-545.
[22] 孙丹, 辛彦. 上皮间质转化与肿瘤侵袭转移关系的研究进展 [J]. 现代肿瘤医学, 2011, 19(10): 2088-2091.
[23] 张满, 卓纳, 郭占林. 上皮间质转化的机制及其在肿瘤转移中的作用 [J]. 中国医药导报, 2014, 11(35): 163-165.
[24] Tan C W, Gardiner B S, Hirokawa Y,. Analysis of Wnt signaling β-catenin spatial dynamics in HEK293T cells [J]., 2014, 8: 44.
[25] Kim H J, Park S Y, Park O J,. Curcumin suppresses migration and proliferation of Hep3B hepatocarcinoma cells through inhibition of the Wnt signaling pathway [J]., 2013, 8(1): 282-286.
[26] Zhao S, Kurenbekova L, Gao Y,. NKD2, a negative regulator of Wnt signaling, suppresses tumor growth and metastasis in osteosarcoma [J]., 2015, 34(39): 5069-5079.
[27] Fang W B, Yao M, Cheng N. Priming cancer cells for drug resistance: Role of the fibroblast niche [J]., 2014, 9(2): 114-126.
[28] 李尤玲, 雷飞飞, 樊旭, 等. 姜黄素对结肠癌细胞化疗耐药的抑制作用研究 [J]. 湖北医药学院学报, 2021, 40(4): 338-341.
[29] 陆怡, 张鑫杰, 张闰哲, 等. 姜黄素体内外逆转结肠癌的5-氟尿嘧啶耐药研究及机制探讨[J]. 中国现代应用药学, 2020, 37(15): 1793-1800.
[30] Zhang N, Gao M, Wang Z H,. Curcumin reverses doxorubicin resistance in colon cancer cells at the metabolic level [J]., 2021, 201: 114129.
[31] 徐露, 王娴, 王宣璎, 等. 姜黄素介导IL-6/STAT3信号通路修复结肠癌5-FU化疗引起的肠黏膜损伤 [J]. 中国中药杂志, 2021, 46(3): 670-677.
[32] Ashrafizadeh M, Ahmadi Z, Mohamamdinejad R,. Curcumin therapeutic modulation of the Wnt signaling pathway [J]., 2020, 21(11): 1006-1015.
[33] Dou H Q, Shen R H, Tao J X,. Curcumin suppresses the colon cancer proliferation by inhibiting Wnt/β-catenin pathways via miR-130a [J]., 2017, 8: 877.
[34] 刘英, 张霄程, 陈启文. 姜黄素对结直肠癌细胞增殖、凋亡的作用机制研究 [J]. 现代消化及介入诊疗, 2020, 25(11): 1475-1479.
[35] Jiang X E, Li S G, Qiu X M,. Curcumin inhibits cell viability and increases apoptosis of SW620 human colon adenocarcinoma cells via the caudal type homeobox-2 (CDX2)/Wnt/β-catenin pathway [J]., 2019, 25: 7451-7458.
[36] 王超. STAT3信号通路在小鼠结肠癌种植瘤淋巴管生成中作用机制研究 [D]. 天津: 天津医科大学, 2012.
[37] 文坤明, 冷敏, 程家平, 等. 姜黄素通过抑制STAT3通路调控人结肠癌耐奥沙利铂细胞株的耐药性 [J]. 中国免疫学杂志, 2015, 31(8): 1056-1059.
[38] Zhang X L, Xiao W H, Wang L H,. Deactivation of signal transducer and activator of transcription 3 reverses chemotherapeutics resistance of leukemia cells via down-regulating P-gp [J].. 2011, 6(6): e20965.
[39] 马亮, 孙一鸣, 张语涵, 等. 姜黄素通过STAT3信号通路抑制结直肠癌细胞增殖机制研究 [J]. 包头医学院学报, 2022, 38(3): 5-9.
[40] Lin L, Fuchs J, Li C L,. STAT3 signaling pathway is necessary for cell survival and tumorsphere forming capacity in ALDH+/CD133+stem cell-like human colon cancer cells [J]., 2011, 416(3/4): 246-251.
[41] Ellisen L W, Bird J, West D C,. TAN-1, the human homolog of the Drosophila Notch gene, is broken by chromosomal translocations in T lymphoblastic neoplasms [J]., 1991, 66(4): 649-661.
[42] Huang R, Tang Q C, You Q,. Disparity expression of Notch1 in benign and malignant colorectal diseases [J]., 2013, 8(12): e81005.
[43] 刘少琼, 杨芳, 禹正杨, 等. 姜黄素调控Notch1信号通路诱导结肠癌SW480细胞株凋亡 [J]. 湖南中医药大学学报, 2015, 35(8): 13-16.
[44] 杨芳. 姜黄素下调Notch1信号通路影响结肠腺癌SW480细胞株增殖的研究 [D]. 衡阳: 南华大学, 2015.
[45] 杨芳, 刘少琼, 李春花, 等. 姜黄素下调结直肠癌细胞Notch1信号通路研究 [J]. 湖南中医药大学学报, 2015, 35(4): 10-13.
[46] De R, Kundu P, Swarnakar S,. Antimicrobial activity of curcumin againstisolates from India and during infections in mice [J]., 2009, 53(4): 1592-1597.
[47] Na H S, Cha M H, Oh D R,. Protective mechanism of curcumin againstinfection [J]., 2011, 63(3): 355-362.
[48] Rudrappa T, Bais H P. Curcumin, a known phenolic from, attenuates the virulence ofPAO1 in whole plant and animal pathogenicity models [J]., 2008, 56(6): 1955-1962.
[49] McFadden R M T, Larmonier C B, Shehab K W,. The role of curcumin in modulating colonic microbiota during colitis and colon cancer prevention [J]., 2015, 21(11): 2483-2494.
[50] Waly M I, Ali A, Guizani N,. Pomegranate () peel extract efficacy as a dietary antioxidant against azoxymethane-induced colon cancer in rat [J]., 2012, 13(8): 4051-4055.
[51] 郭立达, 薛佳伟, 渠开跃, 等. 姜黄素联合奥沙利铂对人结肠癌LoVo细胞裸鼠移植瘤的抗癌作用研究 [J]. 中草药, 2013, 44(16): 2261-2266.
[52] 张惜琴, 范媛媛, 梁靓靓, 等. 姜黄素纳米制剂抗消化系统肿瘤的药理作用研究进展[J]. 药物评价研究, 2022, 45(7): 1440-1445.
[53] 赵爽, 程学敏, 黎海娟, 等. 姜黄素干预中枢神经系统疾病生物学机制研究进展 [J]. 中草药, 2016, 47(3): 512-518.
[54] 郑蕾, 黄红, 吴涵, 等. 姜黄素抗肺纤维化作用的分子机制研究进展[J]. 中草药, 2022, 53(21): 6909-6918.
[55] 冷怡林. 姜黄素胶束的制备与体内外抗肿瘤活性研究 [D]. 开封: 河南大学, 2020.
[56] Elbassiouni F E, El-Kholy W M, Elhabibi E M,. Comparative study between curcumin and nanocurcumin loaded PLGA on colon carcinogenesis induced mice [J]., 2022, 12(3): 324.
Research progress on mechanism of curcumin against colon cancer
LIU Ting1, 2, 3, GAO Fei-yun1, 2, 3, ZHANG Zhuan-hong1, 2, 3, WANG Yan-jun1, 2, 3, ZHANG Yu-gui1, 2, 3, SUN Yu-jing1, 2, 3, LI Yue-feng1, 2, 3
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Key Laboratory of Standard and Quality of Chinese Medicine Research of Gansu, Lanzhou 730000, China 3. Gansu Engineering Research Center for Chinese Medicine Pharmaceutical Technology, Lanzhou 730000, China
Curcumin is a polyphenolic compound extracted from the rhizomes of,and other plants of the genusin Zingiberaceae. It has anti-inflammatory, anti-tumor and other pharmacological effects. Studies have shown that curcumin has a preventive and significant therapeutic effect on the occurrence and development of colon cancer. Curcumin can play an anti-colon cancer role by inhibiting colon inflammation, inhibiting colon cancer cell proliferation, inducing apoptosis, inhibiting invasion and metastasis and chemotherapy resistance. The early prevention effect of curcumin on inflammatory colon cancer, the therapeutic effect of colon cancer cells and the regulation of related signaling pathways were mainly reviewed in this paper, which provided reference for the further development and clinical application of curcumin.
curcumin; colon cancer; cell proliferation; inducing apoptosis; invasion and metastasis; chemotherapy resistance; signaling pathway
R282.710.5
A
0253 - 2670(2022)24 - 7933 - 08
10.7501/j.issn.0253-2670.2022.24.031
2022-08-03
国家自然科学基金资助项目(81960713);国家自然科学基金资助项目(82160750);国家自然科学基金资助项目(81460611);甘肃省教育厅产业支撑计划项目(2021CYZC-21);甘肃省中药制药工艺工程研究中心开放课题(ZYGY202003);甘肃省科技计划(创新基地与人才计划)基础研究创新群体项目(21JR7RA569)
刘 婷(1999—),女,硕士研究生,研究方向中药及复方加工炮制机制及活性成分。E-mail: 2305238940@qq.com
李越峰(1976—),女,教授,博士生导师,研究方向中药及复方加工炮制机制及活性成分。E-mail: lyfyxk@126.com
[责任编辑 崔艳丽]
