Angiopep-2修饰白藜芦醇脂质体的处方优化与体外评价
2022-12-27刘婉滢李沣芮李学涛
于 洋,孔 亮,刘婉滢,李沣芮,李学涛
Angiopep-2修饰白藜芦醇脂质体的处方优化与体外评价
于 洋,孔 亮,刘婉滢,李沣芮,李学涛*
辽宁中医药大学药学院,辽宁 大连 116600
制备Angiopep-2(Ang)修饰的白藜芦醇(resveratrol,Res)脂质体(Ang-Lip/Res),并对其进行处方优化和体外脑靶向性研究。采用薄膜分散法制备Ang-Lip/Res,利用Box-Benhken响应面法对影响其包封率的3因素(磷脂的质量浓度、磷脂与药物的质量比、磷脂与胆固醇的质量比)进行优化处方最佳制备工艺并验证脂质体的包封率;采用磺酰罗丹明B蛋白法考察脂质体对小鼠神经细胞的毒性;采用流式细胞仪和荧光显微镜探究细胞摄取情况;构建体外血脑屏障模型,比较白藜芦醇脂质体(Res-Lip)跨越血脑屏障的能力。Ang-Lip/Res的最优处方:磷脂的质量浓度为4.4 mg/mL,磷脂与白藜芦醇的质量比为11∶1,磷脂与胆固醇的质量比为5.5∶1。按照最佳处方,以磷脂、胆固醇、DSPE-PEG2000及DSPE-PEG2000-Ang为膜材制备的Ang-Lip/Res包封率为(93.28±1.35)%。细胞毒实验结果表明,50 μmol/L浓度以内,Ang-Lip/Res对小鼠神经细胞N2a和bEnd.3无明显毒性;体外细胞摄取实验结果表明,与非靶向Res-Lip相比,Ang的修饰明显增加了bEnd.3细胞对脂质体的摄取,提高了脂质体体外BBB渗透率。成功制备Ang-Lip/Res,可进一步应用于防治脑部疾病的研究。
白藜芦醇;Angiopep-2;脂质体;细胞摄取;体外靶向性
白藜芦醇(3,5,4-三羟基二苯乙烯,resveratrol,Res)是一种存在于虎杖、花生和葡萄等植物中的多酚类化合物,因其具有多种保护健康的生物学特性,而备受国内外专家学者的高度重视[1]。在相关报道中,白藜芦醇表现出卓越的抗炎、抗氧化及神经保护活性,常用于脑部疾病的研究[2]。然而,白藜芦醇存在水溶性低、稳定性差、不能穿过高选择性的血脑屏障(blood-brain barrier,BBB)、生物利用度低等问题,严重阻碍了其应用。为了解决上述问题,研究人员做出了很多努力,其中研发纳米给药系统是较为有效的手段之一。脂质体是目前应用最广泛的纳米给药系统,较其他纳米给药系统具有更好的生物相容性,在靶向递药、缓释控释及减小药物毒性等方面均具备独特优势。研究人员将白藜芦醇包载在脂质体的双分子层闭合囊泡状结构中,应用于阿尔茨海默病、帕金森病等脑部疾病的治疗,相比于游离的白藜芦醇,脂质体使白藜芦醇的生物利用度大幅提高[3]。此外,将合适的配体修饰在脂质体表面,可以增加脂质体的主动靶向性,实现药物的精准递送[4]。Angiopep-2(Ang)是Angiopeps家族中的一种人工肽,可以通过低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein,LRP)受体介导跨越BBB,常应用于修饰脑靶向递药系统,增强BBB穿透率[5]。
脂质体的制备主要有乙醇注入法、硫酸铵梯度法、逆向蒸发法及薄膜分散法等,需根据药物的性质不同选择合适的制备方法。薄膜分散法适用于脂溶性药物脂质体的制备,且操作简单,白藜芦醇是脂溶性药物,宜采用薄膜分散法制备[6]。基于此,本研究采用薄膜分散法制备Ang修饰的白藜芦醇脂质体(Ang modified resveratrol liposomes,Ang-Lip/ Res),通过Box-Behnken设计-响应面法优化制剂处方工艺,并进一步对Ang-Lip/Res的神经细胞毒性、体外靶向性、体外BBB渗透能力进行考察,以期为白藜芦醇制剂研发提供参考。
1 仪器与材料
1.1 仪器
FA1004型电子天平,上海越平科学仪器有限公司;RE52CS型旋转蒸发器,上海亚荣生化仪器厂;KQ3200E型超声波清洗器,昆山市超声仪器有限公司,超声功率150 W,工作频率40 kHz;JY92-2D型超声波细胞破碎机,宁波新芝生物科技股份有限公司;85-1型磁力搅拌器,巩义市予华仪器有限责任公司;2010型液相色谱仪,UV检测器,岛津色谱工作站;Agilent C18色谱柱(250 mm×4.6 mm,5 μm),月旭科技股份有限公司;葡聚糖凝胶Sephadex G-50柱,上海华蓝化学科技有限公司;WJ-80B-II型CO2细胞培养箱,上海新苗医疗器械制造有限公司;T1-S型倒置荧光显微镜,日本Nikon公司;HBS-1096A型酶标仪,南京德铁实验设备有限公司。
1.2 材料
白藜芦醇,大连美仑生物技术有限公司,批号J1101A,质量分数≥97%;pH 7.4磷酸盐缓冲液(PBS),北京索莱宝科技有限公司,批号1022Q021;二硬脂酰基磷脂酰乙醇胺-聚乙二醇-靶向多肽Ang(DSPE-PEG2000-Ang),辽宁中医药大学药剂实验室合成,质量分数≥95%;蛋黄卵磷脂(egg yolk phosphatidylcholine,EPC),日本NOF公司,批号120015,质量分数>98%;胆固醇,大连美仑生物技术有限公司,批号F0119A;磺酰罗丹明B(sulforhodamine B,SRB),大连美仑生物科技有限公司,批号MB1808-1;纯净水,杭州娃哈哈集团有限公司;香豆素,大连美仑生物科技有限公司,批号MB4815;白藜芦醇分析对照品,成都普菲德生物科技有限公司,批号19042607,质量分数≥99%;0.25%胰蛋白酶,美国Gibco公司,批号2186964;青霉素/链霉素溶液,大连美伦生物科技有限公司,批号MA0110-Aug-13G;甲醇为色谱纯。
小鼠脑微血管内皮细胞bEnd.3,中科院上海细胞库;小鼠神经瘤母细胞N2a,中国医学科学院基础医学研究所。
2 方法与结果
2.1 Ang-Lip/Res的制备
采用薄膜分散法制备Ang-Lip/Res,精密称取适量DSPE-PEG2000-Ang、DSPE-PEG2000、白藜芦醇、卵磷脂和胆固醇于50 mL圆底烧瓶中,加入甲醇超声溶解,旋转蒸发仪除去甲醇,此时圆底烧瓶内壁形成一层均匀的薄膜;加入5 mL PBS,超声振荡使薄膜溶解;将混合液转移至10 mL EP管中,冰浴下超声波细胞粉碎机超声10 min(单次超声时长10 s,超声间隔5 s),最后用0.22 μm聚碳酸酯膜挤压2次,即得Ang-Lip/Res。
采用同样的方法制备不加DSPE-PEG2000-Ang的白藜芦醇脂质体(Res-Lip),不加白藜芦醇的空白脂质体(B-Lip)。
2.2 白藜芦醇含量测定的方法学建立
2.2.1 空白溶液的制备 精密吸取1 mL的B-Lip和适量甲醇置于10 mL棕色量瓶中,超声破乳,定容至刻度,4 ℃保存备用。
2.2.2 供试品溶液的制备 精密吸取1 mL的Ang-Lip/Res和适量甲醇置于10 mL棕色量瓶中,超声破乳,定容至刻度,4 ℃保存备用。
2.2.3 对照品溶液的制备 精密称取白藜芦醇对照品10 mg,以甲醇为溶剂,配成1.0 mg/mL的白藜芦醇对照品母液。稀释母液制成质量浓度为0.01、0.10、0.19、0.28、0.37、0.46 mg/mL的系列对照品溶液,低温避光保存,备用。
2.2.4 色谱条件 色谱柱为Agilent C18柱(250 mm×4.6 mm,5 μm);柱温28 ℃;检测波长306 nm;体积流量1.0 mL/min;流动相为甲醇-水(55∶45);进样量10 μL。
2.2.5 专属性考察 精密吸取10 μL的白藜芦醇对照品溶液(0.10 mg/mL)、供试品溶液和空白溶液,注入液相色谱仪。结果如图1所示,白藜芦醇色谱峰在5.9 min左右出现,空白溶液无干扰,说明此色谱条件可用于该脂质体中白藜芦醇的含量测定,该方法专属性良好。
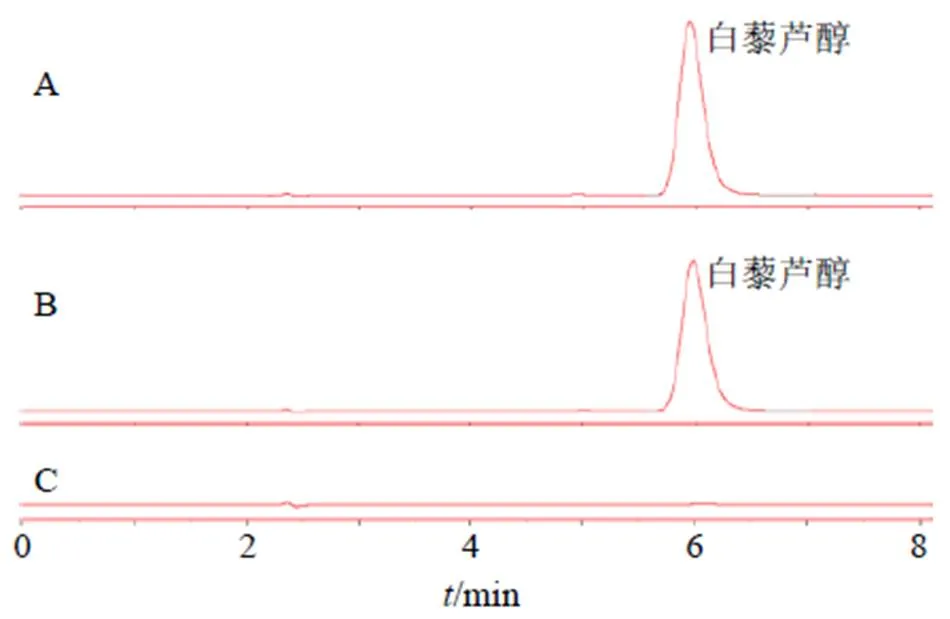
图1 白藜芦醇对照品溶液(A)、Ang-Lip/Res供试品溶液(B)、空白溶液(C)的HPLC图
2.2.6 线性关系考察 按“2.2.4”项色谱条件对“2.2.3”项中系列白藜芦醇对照品溶液进样分析,以系列白藜芦醇对照品溶液的质量浓度为横坐标(),对应的峰面积为纵坐标(),绘制标准曲线,进行线性回归,得线性回归方程=22 337+701.72,2=0.999 1。结果表明,白藜芦醇在0.01~0.46 mg/mL线性关系良好。
2.2.7 精密度试验 取“2.2.3”项下白藜芦醇对照品溶液,同1 d内连续进样6次,计算日内精密度;连续进样5 d,计算日间精密度。结果,日内精密度RSD为0.44%,日间精密度RSD为0.57%,证明仪器精密度良好。
2.2.8 重复性试验 按“2.2.2”项下方法平行制备6份供试品溶液,按照“2.2.4”项色谱条件进行HPLC分析。结果白藜芦醇峰面积的RSD为1.01%,结果表明该方法重复性良好。
2.2.9 稳定性试验 按“2.1”项下方法制备Ang- Lip/Res,按“2.2.2”项下方法制备供试品溶液,分别在制备后0、2、4、8、12、24 h时进样测定,结果,白藜芦醇峰面积的RSD为0.93%,结果表明供试品溶液在24 h内稳定性良好。
2.2.10 加样回收率试验 精密吸取1 mL B-Lip,1 mL白藜芦醇对照品溶液于10 mL棕色量瓶中,加甲醇超声破乳、定容,制成供试品溶液,平行6份,进样分析。结果,白藜芦醇的平均加样回收率为102.25%,RSD为0.39%,表明该方法符合要求。
2.2.11 最低检测限和最低定量限 按“2.2.3”项方法制备白藜芦醇对照品溶液,进样检测,当信噪比(/)=3时,对应的白藜芦醇质量浓度为检测限;当/=10时,对应的白藜芦醇质量浓度为定量限。结果,白藜芦醇检测限为0.3 μg/mL,定量限为1.5 μg/mL。
2.3 包封率测定
2.3.1 过柱前脂质体药物含量 精密吸取1 mL Ang-Lip/Res,用PBS定容至5 mL,加等量甲醇超声破乳混匀,过0.45 μm微孔滤膜,备用。
2.3.2 过柱后脂质体药物含量 使用Sephadex G-50凝胶柱洗脱1 mL Ang-Lip/Res,将洗脱液用PBS定容至5 mL,加等量甲醇超声破乳混匀,过0.45 μm微孔滤膜,备用。
2.3.3 包封率的测定 将上述溶液进样分析,根据回归方程得白藜芦醇的含量,计算包封率。
包封率=过柱后脂质体药物含量/过柱前脂质体药物含量
2.4 处方优化
在文献调研及前期预试验的基础上,确定以磷脂的质量浓度(1)、磷脂与药物的质量比(2)、磷脂与胆固醇的质量比(3)这3个因素为考察对象,其中各因素的取值范围:12.2~6.6 mg/mL,26∶1~16∶1,33∶1~8∶1;以Ang-Lip/Res包封率()为响应值进行考察。利用Design-Expert 8.0.6.1软件进行响应面分析,建立拟合数学模型,描绘三维效应面图,从效应面的较优区域选取最优处方。试验因素水平设计及结果见表1,试验方差分析结果见表2。
利用Design-Expert 8.0.6.1软件,根据表2所得试验数据分别将影响因素与包封率进行多元2次项拟合,得到拟合方程为=51.551 10-8.217 051-2.474 102+36.102 803+0.104 5512+1.140 9113+1.542 0023-0.125 0012-0.270 2022-6.116 8032,2=0.964 6,<0.05。说明该模型能较好地反映出响应值的变化,可用于筛选Ang-Lip/ Res的最优处方。

表1 Box-Benhnken试验设计及结果

表2 回归模型及方差分析
对上述拟合模型进行显著性检验。由表2可以看出,所建模型具有极高的显著性(<0.01),而失拟项>0.05,表明失拟不显著。模型的相关系数2=0.964 6,表明该模型与实际试验拟合程度良好,用该模型分析和预测Ang-Lip/Res的制备工艺是合适的。通过Design-Expert 8.0.6.1软件对各因素之间的交互作用进行效应面分析,绘制因变量的等高线图与3D响应面图(图2)。
通过Design-Expert 8.0.6.1软件进行分析优化,结合脂质体性状要求,制备经验及脂质体制备的实际情况最终确定Ang-Lip/Res的最优处方为14.4 mg/mL,211∶1,35.5∶1,DSPE-PEG20003.5 mg,DSPE-PEG2000-Ang 2 mg,超声功率500 W,处方量5 mL。
2.5 最优处方确定和验证
根据优化所得最佳处方,按相同条件制备3批Ang-Lip/Res进行验证,结果3批Ang-Lip/Res的包封率分别为92.17%、93.02%、94.65%,平均包封率为(93.28±1.35)%,包封率的实测值与Box- Behnken响应面法预测值96.35%相近,表明所建立的数学模型具有良好的预测性,所选处方稳定性与重现性良好。
2.6 脂质体的生物活性初步评价
2.6.1 细胞的培养 将bEnd.3细胞和N2a细胞接种于含10%胎牛血清和1%青霉素/链霉素的DMEM培养液中,在37 ℃、5% CO2的恒温细胞培养箱中培养。使用0.25%胰酶+1 mmol/L EDTA为消化液进行消化和传代。
2.6.2 脂质体对bEnd.3细胞和N2a细胞存活率的影响 采用SRB染色法对细胞存活率进行考察。以2.0×104个/孔的密度和1.8×104个/孔的密度将bEnd.3细胞和N2a细胞接种于96孔板,培养24 h后,根据预实验结果加入不同浓度的白藜芦醇、B-Lip、Res-Lip、Ang-Lip/Res,以DMEM培养基为空白对照,每个浓度设置5个复孔。继续培养48 h后用10%三氯乙酸固定,蒸馏水洗,SRB染色,晾干,1%冰醋酸洗,加入Tris缓冲液振摇30 min,540 nm处测量样品吸光度()值。细胞存活率=A/0(式中A为给药组的值,0为空白对照组的值),各组细胞存活率测定结果见表3。数据显示,在0~50 μmol/L,B-Lip、Res-Lip和Ang-Lip/Res组细胞存活率在90%以上,白藜芦醇组细胞存活率比脂质体组低,表明将药物制成脂质体可减弱药物毒性;在0~50.0 μmol/L制剂膜材对细胞无明显毒性,给药制剂组不会损伤神经细胞活力,可用于进一步的实验研究。

图2 各因素(X1, X2, X3)与响应值包封率的三维效应面图和等高线图
2.6.3 脂质体体外摄取情况考察
(1)荧光探针脂质体的制备:由于白藜芦醇不具有荧光性,因此本实验选用具有荧光性的香豆素作为荧光探针来评价脂质体的体外细胞摄取情况。精密称取处方量的EPC、胆固醇、DSPE-PEG2000、DSPE-PEG2000-Ang及香豆素于圆底烧瓶中,按“2.4”项所述最优处方的方法制备B-Lip、香豆素脂质体(coumarin liposome,Cou-Lip)及Angiopep-2修饰的香豆素脂质体(Ang-Lip/Cou)。
(2)荧光显微镜观察脂质体摄取情况:将bEnd.3细胞以1.5×105个/孔接种于48孔板中培养24 h。将B-Lip、Cou-Lip和Ang-Lip/Cou加到细胞板中(各孔中香豆素的终浓度均为3 μmol/L。以B-Lip作为对照,每组3个复孔),继续孵育1 h,DAPI室温避光染色15 min,利用荧光显微镜观察荧光强度并拍照,结果如图3所示,可见,与Cou-Lip组(荧光强度309 207.00±11 792.04)相比,Ang-Lip/Cou组(荧光强度345 500.66±9 812.65)荧光强度具有显著性(<0.05)。结果显示,对照组细胞未见香豆素摄取,给药组具有明显香豆素摄取,摄取效果为B-Lip<Cou-Lip<Ang-Lip/Cou,表明通过Ang修饰脂质体可显著增加细胞对药物的摄取。

表3 不同浓度制剂的细胞毒性

图3 不同脂质体对bEnd.3细胞的摄取
(3)流式细胞仪考察脂质体摄取情况:细胞模型的建立同上述方法,bEnd.3细胞在含药培养基中培养1 h后,用冷PBS洗3次,消化后用0.3 mL PBS复悬,采用流式细胞仪测定与细胞结合的香豆素的荧光强度如图4所示,可见,B-Lip组的荧光强度为19.13±1.53,与Cou-Lip组(荧光强度406.00±33.41)相比,Ang-Lip/Cou组(荧光强度451.33±9.29)荧光强度具有显著性(<0.05)。流式细胞仪的测定结果与荧光显微镜观察结果相一致,进一步验证Ang-Lip/Cou在bEnd.3细胞中表现出更好的穿透性,使药物更容易蓄积。
2.6.4 脂质体跨BBB能力的研究
(1)荧光显微镜测定:依照文献方法[7]利用bEnd.3细胞和N2a细胞共培养建立体外血脑屏障模型。将bEnd.3细胞以5×105细胞/孔的密度接种在Transwell板的上室,N2a细胞以1×105个/孔接种在下室,培养24 h后,将B-Lip、Cou-Lip和Ang- Lip/Cou用培养基稀释后加至bEnd.3细胞层继续培养2 h(香豆素的终浓度均为3 μmol/L。以B-Lip作为对照),处理时用PBS洗3次,加4%多聚甲醛固定20 min,PBS洗3次,DAPI染色15 min,再次用PBS洗3次,自然挥干,用荧光显微镜观察并拍照,见图5。如图5所示,B-Lip组N2a细胞无香豆素摄取,Cou-Lip(荧光强度3 760.67±144.69)和Ang-Lip/Cou(荧光强度4 072.79±84.85)表现为明显的香豆素摄取,且Ang-Lip/Cou组香豆素摄取效果最好,二者相比具有显著性意义(<0.05),说明Ang的修饰增强了脂质体体外BBB渗透率。

图4 荧光强度用流式细胞仪分析
(2)流式细胞仪测定:体外BBB模型的建立同上述方法,bEnd.3细胞在含药培养基中培养2 h后,PBS洗3次,0.25%胰酶消化收集细胞,PBS复悬,使用流式细胞仪检测各组N2a细胞的荧光强度,评价靶向脂质体透过血脑屏障的效率,如图6所示,可见,B-Lip组的荧光强度为10.78±2.18,与Cou-Lip组(荧光强度172.00±4.36)相比,Ang-Lip/Cou组(荧光强度119.00±6.56)荧光强度具有显著性(<0.05)。流式细胞仪检测结果进一步确定Ang修饰后显著提高脂质体穿透BBB的转运能力。
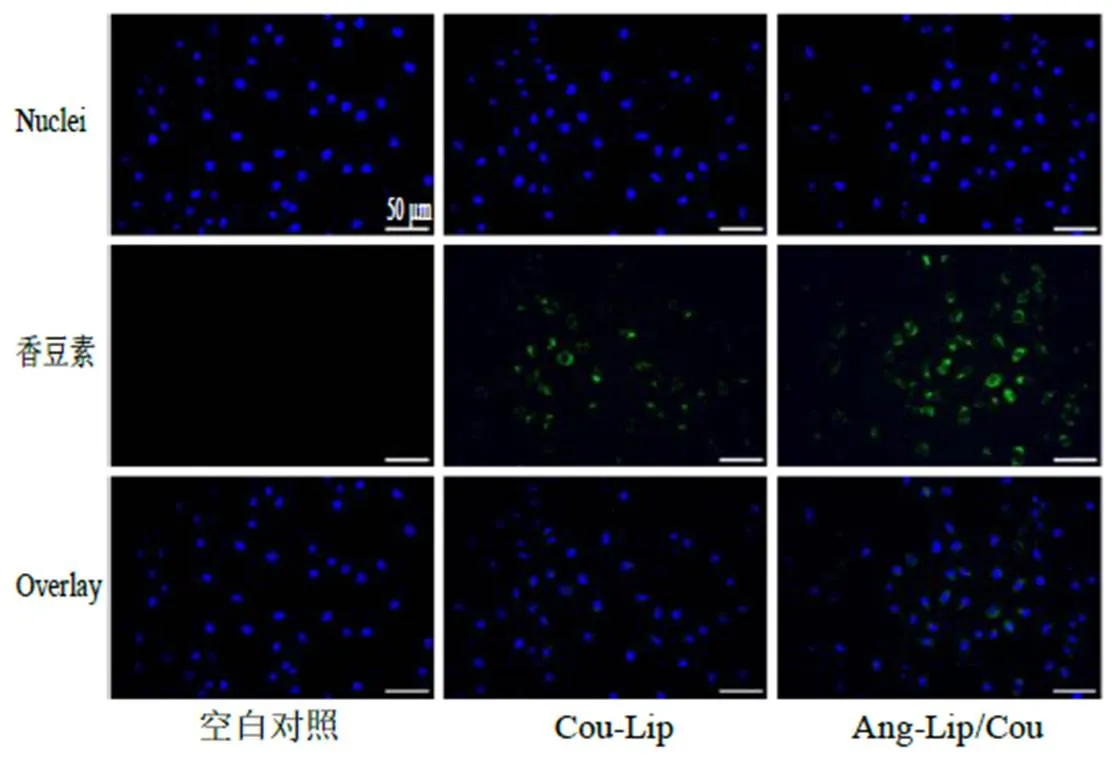
图5 通过显微镜观察N2a细胞内的荧光信号评估脂质体在体外跨BBB的能力

图6 荧光强度用流式细胞仪分析
3 讨论
BBB通过调节离子和大分子透过毛细血管壁扩散维持脑组织成分稳定,保持中枢神经系统平衡,防止血液循环中的致病物质进入大脑[7]。然而,BBB也会阻断大部分药物入脑,致使药物难以在脑内达到有效的治疗浓度,给中枢神经系统疾病的治疗增大障碍[8]。
长期以来,白藜芦醇被广泛报道具有较强的抗衰老[9]、神经保护等生理活性[10-12]。但其尚存在水溶性差、难以跨越BBB、代谢迅速等问题,限制了其应用[13]。脂质体是由磷脂和胆固醇合成的具有与细胞膜相似结构的纳米递药系统,它既能包载亲水性药物又能包载疏水性药物,具有改善药物溶解性,保持药物活性,使药物在血液中长效循环等优势[14]。此外,在脂质体表面修饰合适配体,利用配体和受体特异性结合,可将脂质体靶向递送至受体过表达的病灶处,使脂质体具有特异性靶向作用;在此基础上,利用脑靶向基团识别脑血管内皮细胞膜上内源性受体即可实现脂质体的主动脑靶向作用[15-16]。
Ang是由19个氨基酸组成的能够靶向低密度脂蛋白受体相关蛋白结构域的多肽,具有辅助纳米载体穿透BBB的能力。研究表明,Ang修饰的纳米载体,可以通过BBB上表达的LRP介导内吞进入脑组织,且BBB穿透率比转铁蛋白,乳铁蛋白高数十倍,大幅提高中枢神经系统疾病的治疗效果[17-19]。Ang修饰脑靶向给药系统的制备方式有2种:①在已制备完成的纳米给药系统表面用Ang修饰;②将末端修饰的Ang共价连接到脂质链或聚乙二醇(polyethyleneglycol,PEG)链的末端与其他材料共同构建纳米给药系统。第1种方法较为灵活,但后处理步骤繁琐。第2种方法操作简便,有利于脂质体的纯化,且靶向肽装载率更高[20]。因此,本研究利用DSPE-PEG2000-Ang与其他材料共同构建纳米靶向递药系统,制备Ang-Lip/Res。
本研究采用薄膜分散法制备Ang-Lip/Res,通过Box-Behnken响应面法确定最优处方,经验证脂质体包封率在90%以上。本研究通过细胞毒实验考察Ang-Lip/Res对神经细胞存活率的影响,结果显示低剂量Ang-Lip/Res具备生物安全性。此外,本研究进一步通过体外摄取实验,验证Ang修饰脂质体在小鼠bEnd.3细胞中的摄取情况显著高于未修饰脂质体。Transwell实验结果显示Ang修饰脂质体体外BBB渗透能力高于未修饰脂质体。本制剂将为后续脑部疾病的治疗与研究提供参考,为脑靶向制剂的研发提供实验依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 张琪, 苏兰, 何龙希, 等. 白藜芦醇的药理作用及其临床应用的研究进展 [J]. 华西药学杂志, 2022, 37(2): 214-217.
[2] Katila N, Duwa R, Bhurtel S,. Enhancement of blood-brain barrier penetration and the neuroprotective effect of resveratrol [J]., 2022, 346: 1-19.
[3] Kong D H, Hong W Y, Yu M,. Multifunctional targeting liposomes of epirubicin plus resveratrol improved therapeutic effect on brain gliomas [J]., 2022, 17: 1087-1110.
[4] Su Y G, Guo C J, Chen Q,. Novel multifunctional bionanoparticles modified with sialic acid for stroke treatment [J]., 2022, 214: 278-289.
[5] Wang J, Kong L, Guo R B,. Multifunctional icariin and tanshinone IIAco-delivery liposomes with potential application for Alzheimer’s disease [J]., 2022, 29(1): 1648-1662.
[6] Liu W, Hou Y, Jin Y,. Research progress on liposomes: Application in food, digestion behavior and absorption mechanism [J]., 2020, 104: 177-189.
[7] Hajal C, Le R B, Kamm R D,Biology and models of the blood-brain barrier [J]., 2021, 23: 359-384.
[8] Dos Santos Rodrigues B, Lakkadwala S, Kanekiyo T,. Dual-modified liposome for targeted and enhanced gene delivery into mice brain [J]., 2020, 374(3): 354-365.
[9] Zhou D D, Luo M, Huang S Y,. Effects and mechanisms of resveratrol on aging and age-related diseases [J]., 2021, 2021: 9932218.
[10] Islam F, Nafady M H, Islam M R,. Resveratrol and neuroprotection: An insight into prospective therapeutic approaches against Alzheimer’s disease from bench to bedside [J]., 2022, 59 (7): 4384-4404.
[11] Kung H C, Lin K J, Kung C T,Oxidative stress, mitochondrial dysfunction, and neuroprotection of polyphenols with respect to resveratrol in Parkinson’s disease [J]., 2021, 9(8): 918.
[12] Rahman M H, Akter R, Bhattacharya T,Resveratrol and neuroprotection: Impact and its therapeutic potential in Alzheimer’s disease [J]., 2020, 11: 619024.
[13] Han D G, Seo S W, Choi E,Impact of route-dependent phase-II gut metabolism and enterohepatic circulation on the bioavailability and systemic disposition of resveratrol in rats and humans: A comprehensive whole body physiologically-based pharmacokinetic modeling [J]., 2022, 151: 113141.
[14] Khaledian S, Dayani M, Fatahian A,. Efficiency of lipid-based nano drug delivery systems in crossing the blood-brain barrier: A review [J]., 2022, 346: 118278.
[15] Teixeira S, Carvalho M A, Castanheira E M S. Functionalized liposome and albumin-based systems as carriers for poorly water-soluble anticancer drugs: An updated review [J]., 2022, 10(2): 486.
[16] Ruan S B, Zhou Y, Jiang X G,. Rethinking CRITID procedure of brain targeting drug delivery: Circulation, blood brain barrier recognition, intracellular transport, diseased cell targeting, internalization, and drug release [J]., 2021, 8(9): 2004025.
[17] Habib S, Singh M. Angiopep-2-modified nanoparticles for brain-directed delivery of therapeutics: A review [J]., 2022, 14(4): 712.
[18] 张燕, 费伟东, 陶姣阳, 等. Angiopep-2修饰的载三氧化二砷介孔二氧化硅脂质囊纳米递药系统的构建及体外评价 [J]. 中草药, 2018, 49(6): 1289-1297.
[19] Zhu Z C, Zhai Y X, Hao Y,. Specific anti-glioma targeted-delivery strategy of engineered small extracellular vesicles dual-functionalised by Angiopep-2 and TAT peptides [J]., 2022, 11(8): e12255.
[20] Moosavian S A, Sahebkar A. Aptamer-functionalized liposomes for targeted cancer therapy [J]., 2019, 448: 144-154.
Preparation optimization andevaluationof Angiopep-2 modified resveratrol liposomes
YU Yang, KONG Liang, LIU Wan-ying, LI Feng-rui, LI Xue-tao
School of Pharmacy, Liaoning University of Traditional Chinese Medicine, Dalian 116600, China
To prepare and optimize the prescription of Angiopep-2 (Ang) modified resveratrol (Res) liposomes (Ang-Lip/ Res) and performbrain targeting study.The Ang-Lip/Res were prepared by thin film dispersion method, and the three factors [the egg yolk phosphatidylcholine (EPC) concentration, the mass ratio of EPC to cholesterol, and the mass ratio of to Res] affecting liposomes encapsulation rate were optimized using Box-Benhken response surface methodology, and the encapsulation rates of the liposomes were verified; The antiproliferation effect of liposomes on N2a and bEnd.3 cells was investigated by SRB assay. Flow cytometry and microscope were utilized for exploring the cellular uptake. Anmodel of the blood-brain barrier was constructed to compare the ability of resveratrol liposomes to cross the blood-brain barrier.The optimized preparation process and formulation were as follow: EPC concentration of 4.4 mg/mL, EPC to cholesterol mass ratio of 11:1, EPC to resveratrol mass ratio of 5.5:1. According to the optimal prescription, the encapsulation efficiency of Ang-Lip/Res prepared with EPC, cholesterol, DSPE-PEG2000and DSPE- PEG2000-Ang as membrane materials were (93.28 ± 1.35)%. The results of cytotoxicity assay showed that Ang-Lip/Res within 50 μmol/L concentration range was not significantly toxic to mouse neuronal cells N2a and bEnd.3 cells. Thecell uptake results showed that modification of Ang significantly increased uptake efficiency of Ang-Lip/Res by bEnd.3 cells compared to non-targeted Res-Lip and improved its BBB penetration.The Ang-Lip/Res is successfully prepared, which can be used for further research of prevention and treatment of brain diseases.
resveratrol; Angiopep-2; liposomes; cellular uptake;targeting
R283.6
A
0253 - 2670(2022)24 - 7706 - 08
10.7501/j.issn.0253-2670.2022.24.008
2022-06-27
国家自然科学基金项目(81874347);辽宁中医药大学高层次引进人才科研启动资金资助项目(2100221005);辽宁中医药大学2021年博士后启动资金(21601A2100)
于 洋(1994—),女,讲师,研究方向为新型给药系统。Tel: 15764399825 E-mail: yuqn0702@163.com
李学涛(1979—),男,教授,博士生导师,研究方向为新型给药系统。Tel: (0411)85890145 E-mail: lixuetao1979@163.com
[责任编辑 郑礼胜]
