去氢骆驼蓬碱包合物脂质体的制备及体外性质评价
2022-12-27周伟成刘宇灵陈颖翀管咏梅黄丽珍刘丽丽岳鹏飞
周伟成,刘宇灵,陈颖翀*,管咏梅,黄丽珍,范 晖,刘丽丽,岳鹏飞*
去氢骆驼蓬碱包合物脂质体的制备及体外性质评价
周伟成1,刘宇灵2,陈颖翀1*,管咏梅1,黄丽珍1,范 晖1,刘丽丽1,岳鹏飞1*
1. 江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004 2. 中国中医科学院中药研究所,北京 100700
制备去氢骆驼蓬碱包合物脂质体(harmine drug-in-cyclodextrin-in-liposome,Har-DCL),并评价该制剂的理化性质和体外特性。以包合物溶解度、包合率、体外释放考察为指标考察去氢骆驼蓬碱包合物(harmineinclusion complex,Har-CD)的最佳工艺。采用傅里叶红外光谱仪、扫描电子显微镜、X射线衍射分析等确定Har-CD的包合程度,以证实制备方法的可行性。采用pH梯度主动载药法考察磷脂与胆固醇质量比,Har与脂质体质量比对Har-DCL粒径分布、载药量及包封率的影响,以得到粒径分布均匀,载药量高且稳定的Har-DCL。饱和水溶液法制备的包合物溶解度为42.81 μg/mL,包合率为95.50%,为最佳制备方法。羟丙基-β-环糊精与Har的质量比为8∶1时,制成的包合物溶解度最好,载药量为 (107.0±0.4)mg/g,包合率为(96.33±0.39)%。使用pH梯度法以磷脂与胆固醇质量比为3∶1,药脂比为1∶10制备的脂质体平均粒径为(85.24±0.60)nm,ζ电位为(−3.57±0.28)mV,载药量和包封率分别达到(1.740±0.001)mg/mL和 (95.650±0.003)%。加入20.0 mg/mL乳糖得到的脂质体冻干粉外观饱满,复溶性能良好。使用饱和水溶液法让Har进入环糊精的空腔结构,可以有效增强Har水溶性。Har以Har-CD的形式从脂质体双分子层之间,转移至内水相而得到的Har-DCL均匀稳定,对Har新剂型的开发提供参考。
去氢骆驼蓬碱;环糊精包合物;脂质体;冷冻干燥;包合物;pH梯度主动载药法;饱和水溶液法;溶解度;复溶性;包封率;载药量
去氢骆驼蓬碱(harmine,Har)为蒺藜科骆驼蓬属植物骆驼蓬L.的种子中提取分离得到的一种三环β-咔啉类生物碱,为骆驼蓬的主要活性成分[1]。Har具有良好的抗菌、抗炎、抗氧化、抗肿瘤等作用,还具有显著抑制单胺氧化酶和乙酰胆碱酯酶活性的作用[2-3]。因此,Har具有良好的应用开发前景。然而Har水溶性差,导致其生物利用度低,且神经毒性较强,严重限制了其临床应用[4]。目前,文献报道中Har有醇质体、磁纳米脂质体、固体脂质纳米粒等递药载体以改善Har的水溶性及神经毒性[5-7]。
脂质体是由一种具有类生物膜排列有序的脂质双分子层组成的球形囊状物,不仅可包载水溶性药物,还可包载脂溶性药物。同时脂质体在实现靶向给药、缓释给药、提高难溶性药物与多肽药物的生物利用度、减轻药物不良反应等方面表现出良好的应用前景。然而采用脂质体包载难溶性药物也存在稳定性差、易泄漏等不足。此外,药物包载在脂质双分子层中比包载在脂质体内水核中更易释放,因此限制了脂质体技术在难溶性药物中的应用[8]。1994年,McCormack和Gregoriadis发现可以使用环糊精包合物将药物载入脂质体内水核,且避免使用有机溶剂,形成新型的脂质体即环糊精包合物脂质体(drug-in-cyclodextrin-in-liposome,DCL)[9],能够改善难溶性药物在脂质体中存在的问题。
本实验采用两步法制备去氢骆驼蓬碱包合物脂质体(harmine drug-in-cyclodextrin-in-liposome,Har-DCL)[10]。第1步先采用水溶性较好的羟丙基-β-环糊精(hydroxy-β-cyclodextrin,HP-β-CD)[11-13]为包合材料制备去氢骆驼蓬碱包合物(harmine inclusion complex,Har-CD),并对其进行表征评价,确保Har-CD制备成功。第2步采用pH梯度法制备空白脂质体,利用内外pH相差的梯度将包合物推入脂质体的内水相[14],形成Har-DCL,以粒径分布、载药量和包封率等为指标筛选脂质体处方,并采用冷冻干燥法对其进行固化,以便Har-DCL的长期储存[15]。
1 仪器与材料
1.1 仪器
EL104型电子天平,梅特勒-托利多仪器(上海)有限公司;KQ5200B型超声波清洗器,昆山市超声仪器有限公司;Zetasizer Nano-S型纳米粒度仪及分析软件,英国Malvern公司;Quanta250型扫描电子显微镜(SEM)、Tecnai G2 Spirit型透射电子显微镜(TEM),美国FEI公司;B11-3型恒温磁力搅拌器,上海司乐仪器有限公司;Diamond差示扫描量热仪(DSC),美国Perkin-Elmer公司;THZ型恒温摇床,上海一恒科学仪器有限公司;D8 Advance X型射线衍射仪(XRD),德国布鲁克公司;TGL-20MC型高速冷冻离心机,湖南湘鑫仪器仪表有限公司;透析袋7000,上海瑞永生物科技有限公司;Sprucm Two型傅里叶变换红外光谱仪,美国Perkin-Elmer公司;Scientz-10N型真空冷冻干燥机,宁波新芝生物科技股份有限公司;ZBS-8G智能溶出仪,天大天发科技有限公司;Agilent 1260 HPLC系统化学工作站,美国Agilent公司;色谱柱:Titank C18柱(250 mm×4.6 mm,5.0 µm),广州菲罗门科学仪器有限公司。
1.2 药品与试剂
Har对照品,批号RFS-Q0410190325,质量分数>98%,成都瑞芬思生物科技有限公司;氢化大豆卵磷脂(HSPC),批号B60455,艾伟拓(上海)医药科技有限公司;胆固醇,批号624J034,北京索莱宝科技有限公司;HP-β-CD,批号RH171208,上海易恩化学技术有限公司;蔗糖,批号1403011,西陇化工股份有限公司;-甘露醇,批号170716,Freund集团;乳糖,批号683833,DFE Pharma公司;乙酸铵,质量分数77.08%,国药集团化学试剂有限公司;乙腈、甲醇,色谱纯,美国Tedia公司;其余试剂均为分析纯。
2 方法与结果
2.1 Har的含量测定方法
2.1.1 色谱条件 色谱柱为Titank C18柱(250 mm×4.6 mm,5.0 µm,菲罗门);UV检测器、Agilent 1260 HPLC系统化学工作站(美国Agilent公司);流动相为乙腈-0.077%乙酸铵缓冲盐(65∶35)[16];检测波长320 nm;体积流量1 mL/min;柱温35 ℃;进样量10 μL。
2.1.2 对照品溶液的配制 精密称取10 mg Har对照品置于50 mL量瓶中,使用65%乙腈溶液溶解定容,得200 μg/mL Har对照品溶液。
2.1.3 供试品溶液的配制 精密量取Har-DCL溶液0.5 mL置于50 mL量瓶中,使用65%乙腈溶液破乳定容,即得Har-DCL破乳溶液。同法制备空白DCL破乳溶液。
2.1.4 专属性考察 分别取空白DCL破乳溶液、Har对照品溶液、Har-DCL破乳溶液,过0.22 μm微孔滤膜,各进样10 μL,记录色谱图(图1),实验结果证明此色谱条件下,Har峰形良好,载体辅料对Har测定无干扰。
2.1.5 线性关系考察 精密量取Har对照品溶液适量,用65%乙腈溶液稀释成质量浓度为2、10、20、40、80、100、160、200 μg/mL的系列对照品溶液,按照“2.1.1”项下色谱条件进样分析并记录峰面积,以Har质量浓度为横坐标(),峰面积为纵坐标()进行线性回归,所得线性方程为=31.447-1.552,2=0.999 9,结果表明Har在2~200 μg/mL与峰面积具有良好的线性关系。
2.1.6 精密度考察 精密量取适量的Har对照品溶液,加适量65%乙腈配制低、中、高(2、80、200 μg/mL)3个质量浓度的对照品溶液。按“2.1.1”项色谱条件,于1、3、5 d各进样6次,考察日内、日间精密度。结果测得低、中、高3个质量浓度对照品溶液的日内精密度分别为0.01%、0.09%、1.52%,日间精密度分别为0.03%、1.28%、0.63%。

图1 空白DCL破乳溶液 (A)、Har对照品溶液(B)、Har-DCL破乳溶液(C) 的HPLC图
2.1.7 加样回收率考察 精密量取Har-DCL溶液0.25 mL,加入Har对照品溶液(200 μg/mL)0.25 mL,涡旋混匀,按“2.1.3”项下方法平行制备6份供试品溶液进行测定,计算得Har的平均加样回收率为100.18%,RSD值为0.14%。
2.2 Har-CD的制备
2.2.1 包合物制备方法的选择 分别采用饱和水溶液法、研磨法及旋转蒸发法制备Har-CD,以溶解度及包合率为指标考察Har-CD的制备方法,制备方法以及溶解度、包合率测定方法如下。
(1)饱和水溶液法:将溶有Har的无水乙醇慢慢滴入HP-β-CD水溶液中,持续搅拌48 h至乙醇挥尽,4 ℃下放置过夜后于烘箱50 ℃烘干,即得Har-CD。
(2)研磨法:称取HP-β-CD适量于研钵中,加入一定量双蒸水,研磨至糊状,加入一定量Har充分研磨,真空冷冻干燥,即可得Har-CD。
(3)旋转蒸发法:分别称取适量Har与HP-β-CD置于烧杯中,加入适宜溶剂分别溶解后,混合并振摇均匀,封口。置于超声波条件下进行包合反应。包合结束后,减压蒸发多余溶剂,即得Har-CD[17]。
(4)溶解度的测定:取过量Har-CD加至3 mL双蒸水中,摇床振摇(37 ℃、160 r/min、48 h)。振摇结束,于4 ℃放置过夜后取1 mL上清液经0.22 µm滤膜滤过,取续滤液,按照“2.1.1”项下色谱条件进样分析,计算溶解度。
(5)包合率的测定:取Har-CD 20 mg置于50 mL量瓶中,用65%乙腈溶解并定容,得样品,取1 mL经0.22 µm滤膜滤过,按照“2.1.1”项下色谱条件下进样分析,计算包合物中总药量(1),包合物中投入Har的总质量为2,按下列公式计算药物包合率。
包合率=1/2
结果如表1所示,3种方法制备的Har-CD均有较好的溶解度及包合率,其中饱和水溶液法制备的Har-CD溶解度及包合率最佳,分别为(42.81±0.09)μg/mL、(95.50±0.92)%,与旋转蒸发法相比有显著性差异(<0.01)。饱和水溶液法虽制备时间较长,但操作简便,所制备的Har-CD的溶解度及包合率均较高,因此适合Har-CD的制备。

表1 不同制备方法对Har溶解度和包合率的影响(, n = 3)
与旋转蒸发法比较:**<0.01
**< 0.01rotary evaporation method
2.2.2 Har与HP-β-CD的比例筛选 通过平衡溶解度试验筛选Har与HP-β-CD的比例。采用饱和水溶液法分别制备HP-β-CD与Har质量比分别为6∶1、8∶1、10∶1、12∶1的Har-CD。
摇床法溶解度测定:取过量不同比例的Har-CD,分别加至3 mL双蒸水和0.5%聚山梨酯-80水溶液中,摇床振摇(37 ℃、160 r/min、48 h)。振摇结束后,于4 ℃放置过夜后取1 mL上清液经0.22 µm滤膜滤过,取续滤液,按照“2.1.1”项色谱条件进行HPLC分析,记录对应峰面积,计算各平衡溶解度。
由表2可知,Har-CD的溶解度与HP-β-CD的用量呈现不完全相关性,当HP-β-CD与Har的质量比为8∶1时,Har-CD在水和0.5%聚山梨酯-80中的溶解度均最高,分别为(32.21±2.38)、(123.40±10.04)μg/mL,与其他比例组比较均有显著性差异(<0.01)。

表2 不同HP-β-CD与Har质量比时Har-CD的溶解度(, n = 3)
与6∶1组比较:**<0.01
**< 0.016∶1 group
2.3 Har-CD的表征与评价
2.3.1 差示扫描量热(differential scanning calorimetry,DSC)分析 精密称取Har-CD样品2~5 mg于铝盘中,设置升温速率10 ℃/min,检测温度范围为室温至310 ℃。分别对Har、HP-β-CD、Har与HP-β-CD物理混合物(质量比为1∶8)及Har-CD(Har与HP-β-CD的质量比1∶8)进行DSC分析[18]。结果见图2,可见Har在265 ℃左右出现1个强吸热峰。物理混合物在258 ℃左右出现1个较弱吸热峰,说明Har仍以原状态存在。而HP-β-CD及Har-CD均未出现明显吸热峰,Har的热性质发生改变,表明Har-CD并不是简单的物理混合状态,HP-β-CD与Har发生了包合作用。
2.3.2 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析 采用KBr压片法分别对Har、HP-β-CD、Har和HP-β-CD的物理混合物以及Har-CD在红外光谱上测定红外光谱吸收曲线,样品与KBr以1∶100比例混合,充分研磨后压片,以2 cm−1的分辨率在4000~400 cm−1进行扫描。结果见图3,Har在1700~1000 cm−1存在集中的吸收峰,且在3500~3100 cm−1存在N-H的吸收。HP-β-CD在3400 cm−1左右出现O-H伸缩振动峰,2930 cm−1处C-H伸缩振动峰和1035 cm−1处的C-O-C的伸缩振动峰等特征峰。Har和HP-β-CD的特征峰在物理混合物中均有所体现。Har-CD中Har的特征峰强度明显减弱,表明Har与HP-β-CD不是简单的混合,而是发生了相互作用,证明包合物已经形成[19]。

图2 Har (A)、HP-β-CD (B)、Har和HP-β-CD的物理混合物 (质量比为1∶8, C) 和Har-CD (质量比为1∶8, D) 的DSC分析图谱
2.3.3 X射线衍射(X-ray diffraction,XRD)分析 X射线衍射的测定条件为CuKα辐射,管压40 kV,石墨单色器,扫描范围为0°~90°,管流为100 mA,扫描速度1°/min。由图4可知,Har的特征晶体衍射峰在10.2°、20.6°和25°出现,HP-β-CD未出现明显晶体衍射峰,物理混合物呈现出与Har类似的特征晶体衍射峰,而Har-CD未出现尖锐的特征晶体衍射峰,结果表明Har被包裹进HP-β-CD的空腔结构中,形成非晶态结构。
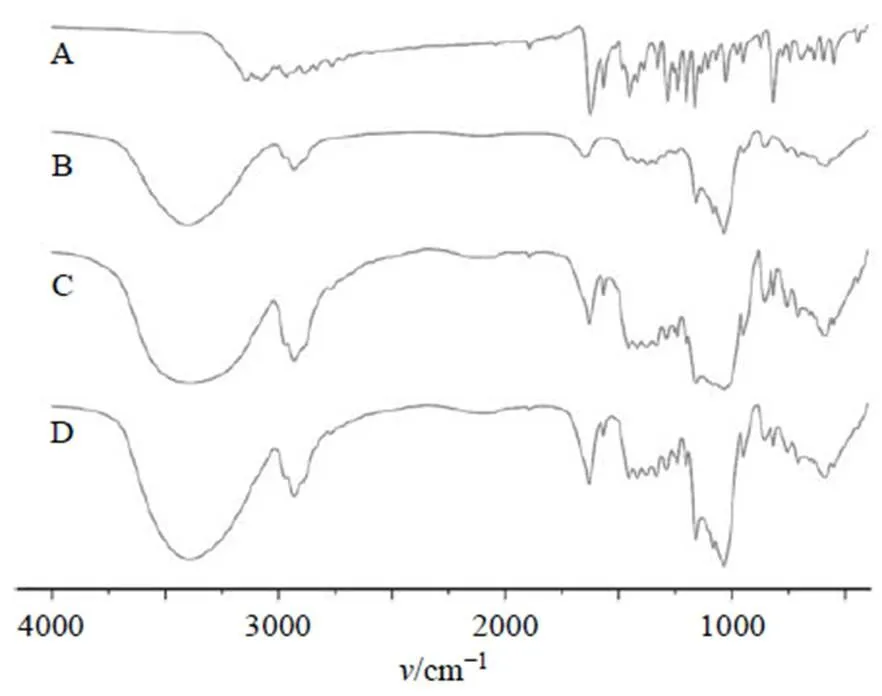
图3 Har(A)、HP-β-CD (B)、Har和HP-β-CD的物理混合物 (质量比为1∶8, C) 和Har-CD (质量比为1∶8, D) 的FTIR分析图谱

图4 Har(A)、Har-CD (质量比为1∶8, B)、Har和HP-β-CD的物理混合物(质量比为1∶8, C)和HP-β-CD (D)的XRD图
2.3.4 形态观察 采用真空镀金方法制备了Har、HP-β-CD、Har和HP-β-CD物理混合物、Har-CD样品,通过SEM对各样品的形态进行观察[20],由图5可知,Har为不规则的棒状晶型结构,HP-β-CD为含有空腔的类球形结构。在物理混合物中观察到了Har和环糊精的特征结构,而在Har-CD中观察到大部分非晶型结构,显示为大小不一的块状结构,这种显著的形态变化可能与Har和环糊精的相互作用有关,从而也进一步证实了DSC和XRD结果。
2.3.5 包合率和载药量的测定 精密称取20 mg Har-CD于50 mL量瓶中,用65%乙腈溶解并定容,得样品,取1 mL经0.22 µm滤膜的滤液,按照“2.1.1”项下色谱条件进行HPLC分析,计算载药量和包合率。结果显示,HP-β-CD与Har的质量比为8∶1时制得的包合物的载药量为(107.0±0.4)mg/g,包合率为(96.33±0.39)%。

图5 Har (A)、HP-β-CD (B)、Har和HP-β-CD的物理混合物(质量比为1∶8, C)和Har-CD(质量比为1∶8, D)的SEM图
2.3.6 平衡溶解度的测定 采用摇床法。取过量Har、Har-CD,分别加至3 mL双蒸水和0.5%聚山梨酯-80溶液中,摇床振摇(37 ℃,160 r/min,48 h)。振摇结束后4 ℃放置过夜,第2天取1 mL上清液,经0.22 µm滤膜滤过,取续滤液,按照“2.1.1”项色谱条件下进行分析,计算Har和Har-CD的平衡溶解度。结果见表3,Har-CD在水溶液和0.5%聚山梨酯-80溶液中的溶解度较Har分别提高了3.17、3.83倍,表明包合物技术可显著提高Har的溶解度。

表3 Har和Har-CD的溶解度(, n = 3)
2.3.7 体外释放实验 采用桨法进行体外释放实验。分别精密称取20 mg各比例Har-CD及Har,同时倒入装有150 mL PBS 7.4溶液的溶出杯中,立即开始转动[(37±2)℃、100 r/min],分别于0.08、0.16、0.25、0.50、1.00、2.00、4.00、8.00 h取样1 mL,过0.22 µm滤膜,取续滤液,同时在溶出杯中补加相同体积(1 mL)和温度的PBS 7.4溶液。将续滤液按照“2.1.1”项色谱条件下进样分析,记录对应的峰面积,计算各样品的累积释放率。结果见图6。由实验结果可知,所有比例的Har-CD包合物的释放均高于Har,表明包合物技术可显著改善Har的体外释放,与前文结果一致。且随着HP-β-CD与Har比例的增加,体外累积释放率也随之增加,但10∶1与12∶1体外释放量接近,在8 h的累积释放率分别为(62.23±4.59)%和(61.25±6.32)%。虽然8∶1 Har-CD 8 h时的累积释放率为(56.49±4.43)%,但其载药量为107.0 mg/g,高于10∶1和12∶1 Har-CD的载药量(91.52、80.06 mg/g)。

图6 Har和不同比例Har-CD的体外释放曲线(, n = 3)
因此,综合体外释放度及载药量考虑,HP-β-CD与Har的比例为8∶1为制备Har-CD的最佳比例。即精密称取300 mg Har溶于180 mL无水乙醇待用,将2.4 g HP-β-CD溶于162 mL双蒸水中,于40 ℃下磁力搅拌,转速500 r/min。将溶有Har的无水乙醇慢慢滴入HP-β-CD溶液中,持续搅拌48 h至乙醇挥尽,4 ℃下放置1夜后于烘箱50 ℃烘干,即得。
2.4 Har-DCL的制备及表征
2.4.1 脂质体制备方法
(1)空白脂质体的制备:精密称取HSPC、胆固醇于圆底烧瓶中,用适量氯仿溶解后,在50 ℃条件下水浴真空旋蒸1 h,圆底烧瓶中形成干燥的白色磷脂膜。加入一定体积250 mmol/L (NH4)2SO4溶液水化,通过超声波细胞粉碎仪冰浴超声得到泛蓝色乳光的脂质体悬液,过0.45 μm滤膜后,即得空白脂质体。
(2)Har-DCL的制备:称取适量Har-CD于西林瓶中,加入一定体积空白脂质体和一定体积双蒸水,在60 ℃水浴条件下加热搅拌2 h,冷却后得Har-DCL[21]。
2.4.2 HSPC与胆固醇质量比考察 精密称取HSPC与胆固醇为2∶1、3∶1、4∶1的质量比,采用上述方法制备Har-DCL,测定粒径、ζ电位、载药量及包封率。
采用超滤法测定包封率[22]。取0.5 mL Har-DCL于超滤离心管(截留相对分子质量10 000)中,于12 000 r/min、4 ℃、15 min条件下离心(离心半径6.2 cm),吸取滤液,按照“2.1.1”项下色谱条件进行分析,结果见表4。由结果可知,随着磷脂与胆固醇的比例增加,载药量逐渐下降,当HSPC与胆固醇为3∶1时,包封率相对较高,形成的脂质体均匀稳定,载药量与2∶1相近,因此选择3∶1的比例制备Har-DCL。
2.4.3 药物与脂质体质量比(药脂比)考察 精密称取药脂比1∶4、1∶6、1∶8、1∶10的量,采用“2.4.1”项下方法制备Har-DCL,测定其粒径、ζ电位、载药量及包封率,结果见表5。由结果可知,随着药脂比的增加,Har-DCL的载药量明显上升,但包封率有所下降,药脂比1∶10时,Har-DCL载药量最高,且包封率与其他比例相差较小,因此选择1∶10的药脂比进行载药。

表4 HSPC与胆固醇质量比考察(, n = 3)
最终确定以HSPC与胆固醇质量比为3∶1,药脂比为1∶10制备Har-DCL,并进行后续研究。
2.4.4 形态分析 取Har-DCL,加入适量双蒸水稀释后,滴至专用铜网上,静置使脂质体粒子在铜网上沉积后自然挥干,用2%磷钨酸负染,采用TEM观察其形态。结果如图7所示,可见Har-DCL呈现均匀球形,脂质体轮廓形状清晰,且未观察到药物晶体沉淀。

表5 药脂比考察(, n = 3)

图7 Har-DCL的TEM图
2.4.5 粒度分布及电位测定 取适量Har-DCL用纯水稀释至一定浓度,用马尔文激光粒度仪测得平均粒径为(85.24±0.60)nm,多分散系数(PDI)为0.193±0.009,粒径呈正态分布(图8),分布范围较窄,ζ电位为(−3.57±0.28)mV。
2.4.6 Har-DCL稳定性考察 将Har-DCL储存在4 ℃冰箱中,分别于储存的第1、3、5、7、15天取出观察外观,并测定脂质体的粒径、ζ电位和包封率,考察Har-DCL的稳定性。结果表明,Har-DCL在4 ℃环境下放置15 d,外观无明显变化,粒径、ζ电位和包封率结果见表6,15 d内的变化幅度较小,表明Har-DCL在低温环境(4 ℃)短时间储存的稳定性良好。

图8 Har-DCL粒径分布

表6 脂质体稳定性考察结果(, n = 3)
2.5 Har-DCL冻干的考察
水态脂质体在长期储存期间存在磷脂的水解和氧化、脂质体囊泡聚集融合和药物泄漏等问题,为提高脂质体的稳定性,延长储存时间,通过冷冻干燥技术将脂质体转化为固态粉末。低温条件的干燥方法可以有效提高脂质体的稳定性,冻干后的脂质体大多呈现出多孔形状,在提高储存时间的同时,还具有良好的复溶特性,可以快速吸收水分,恢复活性[15]。
2.5.1 冻干保护剂的选择 选用糖类作为冻干保护剂,分别称取10.0 mg/mL海藻糖、蔗糖、乳糖、葡萄糖、甘露醇、环糊精于西林瓶中,其中空白对照不加保护剂,分别加入2 mL Har-DCL搅拌溶解后放置在−21 ℃冰箱预冻12 h,冻干后加入2 mL双蒸水复溶测定粒径及ζ电位。由图9可知,空白对照、海藻糖及环糊精所制备的冻干粉出现塌陷,从复溶结果(表7)可得出乳糖的再分散系数(redispersibility index,RDI)接近1,再分散性最好,冻干后的粉末形态饱满,因此,选择乳糖作为Har- DCL的冻干保护剂。
2.5.2 冻干保护剂用量的选择 按照保护剂的用量为2.5、5.0、15.0、20.0、25.0 mg/mL分别称取乳糖于西林瓶中,分别加入2 mL Har-DCL搅拌溶解后放置在−21 ℃冰箱预冻12 h,冻干后加入2 mL双蒸水复溶测粒径及ζ电位。由图10和表8可知,随着冻干保护剂用量的增加,冻干粉均呈现为饱满的白色疏松块状物,但是复溶后Har-DCL的RDI逐渐减小。加入20.0 mg/mL乳糖时,Har-DCL冻干粉的外观良好,复溶后的RDI最低,粒径由冻干前的(112.20±0.46)nm增至(148.60±4.85)nm,复溶后的包封率为(85.860±0.475)%,相较于冻干前的(89.940±0.019)%变化较小。

从左往右依次为空白对照、海藻糖、蔗糖、乳糖、葡萄糖、甘露醇、环糊精

表7 冻干保护剂考察(, n = 3)

从左往右冻干保护剂用量依次为2.5、5.0、15.0、20.0、25.0 mg∙mL−1

表8 冻干保护剂用量考察(, n = 3)
3 讨论
Har药理作用广泛,可以促进如脑胶质瘤、乳腺癌和胰腺癌等多种恶性肿瘤细胞的凋亡,具良好的抗肿瘤作用。另有研究表明Har可以穿越血脑屏障,对脑部疾病有一定的治疗作用。但Har水溶性差、生物利用度低,在普通脂质体中主要存在于磷脂双分子层之间,导致药物容易泄漏,严重影响了其临床应用。DCL作为一种新型的药物载体,综合了包合物提高水溶性和脂质体靶向递药的优势,将Har从双分子层转移至脂质体内水相,提高药物的稳定性和载药效果[23-24]。同时也能提高脂质体的稳定性,减少药物的泄漏,增加缓释性,延长药物的作用时间[25]。
本研究采用两步法制备Har-DCL,两步法需先制备好包合物,如此可以提高药物以包合物形式包裹入脂质体内水相的几率,且不容易发生药物的渗漏,稳定性较高。脂质体虽然可以搭载药物,但是Har作为难溶性药物难以进入内水相,而是嵌入脂质体双分子层之间,容易破环双分子层结构导致泄漏。环糊精包合技术让Har等难溶于水的药物进入环糊精内部空腔,形成环糊精包合物,可有效进入脂质体内水相。由于环糊精的内部空腔有限,环糊精与药物的比例会影响环糊精的包合程度,进而影响药物的利用率。
本研究结果表明采用饱和水溶液法,环糊精与Har的质量比为8∶1时,制备的包合物载药量和包合率分别为(107.0±0.4)mg/g和(96.33±0.39)%,其水溶性提高了3.17倍。体外溶出实验结果表明Har-CD可有效提高Har的释放量。其余表征结果均显示Har-CD的制备成功。包合物脂质体制备的最佳处方为HSPC与胆固醇质量比为3∶1,药脂比为1∶10,固化所选用的冻干保护剂为20.0 mg/mL乳糖。所制备的Har-DCL粒径为(85.24±0.60)nm,ζ电位为(−3.57±0.28)mV,载药量和包封率分别为1.740 mg/mL和95.65%,TEM结果未观察到Har晶体,表明Har-CD成功装载在脂质体中,且未影响脂质体的结构。
综上所述,本研究成功制备了Har-CD,且显著提高了Har的水溶性,所制备的Har-DCL为均匀球体,载药量及包封率均较高。通过冻干技术固化后的Har-DCL外观疏松饱满,复溶性良好,有利于提高长期贮存稳定性,本实验为该制剂体内外的进一步研究等工作打下了坚实地基础。同时DCL技术结合了环糊精包合物和脂质体的优势,通过包合物的形式将药物转移至脂质体内水相,提高药物溶解度的同时,也降低了药物的泄漏,能有效克服难溶性中药成分吸收差、生物利用度低等缺点,表明DCL新型脂质体在解决难溶性中药成分的成药性和剂型设计方面具有广阔的应用前景。
利益冲突 所有作者均声明不存在利益冲突
[1] Kajbaf F, Oryan S, Ahmadi R,. Harmine, a natural β-carboline alkaloid, ameliorates apoptosis by decreasing the expression of caspase-3 in the kidney of diabetic male Wistar rats [J]., 2020, 21: 100863.
[2] Prasad Kushwaha J, Baidya D, Patil S. Harmine-loaded galactosylated pluronic F68-gelucire 44/14 mixed micelles for liver targeting [J]., 2019, 45(8): 1361-1368.
[3] Mennenga S E, Gerson J E, Dunckley T,. Harmine treatment enhances short-term memory in old rats: Dissociation of cognition and the ability to perform the procedural requirements of maze testing [J]., 2015, 138: 260-265.
[4] Li S W, Wang A Q, Gu F,. Novel harmine derivatives for tumor targeted therapy [J]., 2015, 6(11): 8988-9001.
[5] Zhang L, Li D C, Yu S L. Pharmacological effects of harmine and its derivatives: A review [J]., 2020, 43(12): 1259-1275.
[6] Patel K, Gadewar M, Tripathi R,. A review on medicinal importance, pharmacological activity and bioanalytical aspects of beta-carboline alkaloid “Harmine” [J]., 2012, 2(8): 660-664.
[7] Chen W L, Yuan Z Q, Liu Y,. Liposomes coated with-trimethyl chitosan to improve the absorption of harmineand[J]., 2016, 11: 325-336.
[8] Guimarães D, Cavaco-Paulo A, Nogueira E. Design of liposomes as drug delivery system for therapeutic applications [J]., 2021, 601: 120571.
[9] McCormack B, Gregoriadis G. Entrapment of cyclodextrin-drug complexes into liposomes: Potential advantages in drug delivery [J]., 1994, 2(5): 449-454.
[10] Zhang L N, Zhang Q, Wang X,. Drug-in- cyclodextrin-in-liposomes: A novel drug delivery system for flurbiprofen [J]., 2015, 492(1/2): 40-45.
[11] Wang W X, Feng S S, Zheng C H. A comparison between conventional liposome and drug-cyclodextrin complex in liposome system [J]., 2016, 513(1/2): 387-392.
[12] Matloob A H, Mourtas S, Klepetsanis P,. Increasing the stability of curcumin in serum with liposomes or hybrid drug-in-cyclodextrin-in-liposome systems: A comparative study [J]., 2014, 476(1/2): 108-115.
[13] Lim H, Jin S, Jeong Y,. Preparation of hydroxypropyl-β-cyclodextrin-incorporated liposomes and evaluation of their rapid release property [J]., 2021, 100: 59-62.
[14] Goins B, Bao A D, Phillips W T. Techniques for loading technetium-99m and rhenium-186/188 radionuclides into preformed liposomes for diagnostic imaging and radionuclide therapy [J]., 2017, 1522: 155-178.
[15] Chen C J, Han D D, Cai C F,. An overview of liposome lyophilization and its future potential [J]., 2010, 142(3): 299-311.
[16] 马亭云, 姜继宗, 张刘红, 等. 去氢骆驼蓬碱醇质体的制备及处方优化 [J]. 中国实验方剂学杂志, 2018, 24(8): 34-39.
[17] Cid-Samamed A, Rakmai J, Mejuto J C,. Cyclodextrins inclusion complex: Preparation methods, analytical techniques and food industry applications [J]., 2022, 384: 132467.
[18] Yang Y, Gao J H, Ma X Y,. Inclusion complex of tamibarotene with hydroxypropyl-β-cyclodextrin: Preparation, characterization,andevaluation [J]., 2017, 12(2): 187-192.
[19] Yang J J, Ma Y, Luo Q,. Improving the solubility of vorinostat using cyclodextrin inclusion complexes: The physicochemical characteristics, corneal permeability and ocular pharmacokinetics of the drug after topical application [J]., 2022, 168: 106078.
[20] Qiu N, Zhao X, Liu Q M,. Inclusion complex of emodin with hydroxypropyl-β-cyclodextrin: Preparation, physicochemical and biological properties [J]., 2019, 289: 111151.
[21] Arima H, Hagiwara Y, Hirayama F,. Enhancement of antitumor effect of doxorubicin by its complexation with gamma-cyclodextrin in pegylated liposomes [J]., 2006, 14(4): 225-232.
[22] 陈颖翀, 李翔, 张婧, 等. 硫酸长春新碱脂质体含量测定及3种包封率测定方法的比较 [J]. 中国药房, 2014, 25(37): 3504-3507.
[23] Hammoud Z, Gharib R, Fourmentin S,. Drug-in- hydroxypropyl-β-cyclodextrin-in-lipoid S100/cholesterol liposomes: Effect of the characteristics of essential oil components on their encapsulation and release [J]., 2020, 579: 119151.
[24] Gharib R, Greige-Gerges H, Fourmentin S,. Liposomes incorporating cyclodextrin-drug inclusion complexes: Current state of knowledge [J]., 2015, 129: 175-186.
[25] Azzi J, Auezova L, Danjou P-E,. First evaluation of drug-in-cyclodextrin-in-liposomes as an encapsulating system for nerolidol [J]., 2018, 255: 399-404.
Preparation andproperties evaluation of harmine drug-in-cyclodextrin- in-liposome
ZHOU Wei-cheng1, LIU Yu-ling2, CHEN Ying-chong1, GUAN Yong-mei1, HUANG Li-zhen1, FAN Hui1, LIU Li-li1, YUE Peng-fei1
1. Key Lab of Modern Preparation of TCM, Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China 2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
To prepare harmine drug-in-cyclodextrin-in-liposome (Har-DCL) and evaluate the physicochemical properties andcharacteristics of this formulation.The solubility, inclusion rate andrelease of the inclusion complex were used as the evaluation to obtain optimal formulation of harmine inclusion complex (Har-CD). The degree of inclusion of Har-CD was determined using Fourier transform infrared spectroscopy, scanning electron microscopy, X-ray diffraction analysis, etc. to confirm the feasibility of the preparation method. The pH gradient active drug loading method was used to investigate the mass ratio of phospholipid and cholesterol, and the effect of the mass ratio of liposome and Har on the particle size distribution, drug loading and encapsulation efficiency of Har-DCL. Influence of drug dosage and to obtain Har-DCL with uniform particle size distribution, high drug loading and stable Har-DCL.The optimum preparation method was confirmed for Har-CD preparation: the solubility of the inclusion compound prepared by the saturated aqueous solution method was 42.81 μg/mL, and the inclusion rate was 95.50%. The inclusion compound with the mass ratio of hydroxypropyl-β-cyclodextrin and Har of 8:1 had the best solubility, the drug loading capacity and the inclusion rate of Har-CD was (107.0 ± 0.4) mg/g and (96.33 ± 0.39)%, respectively. The mean particle size of liposomes prepared with phospholipid: cholesterol ratio of 3:1 and drug-lipid ratio of 1:10 using the pH gradient method was (85.24 ± 0.60) nm, and the ζ potential was (−3.57 ± 0.28) mV. The drug loading capacity and encapsulation efficiency reached (1.740 ± 0.001) mg/mL and (95.650 ± 0.003)%, respectively. The liposome freeze-dried powder obtained by adding 20.0 mg/mL lactose had a plump appearance and good reconstitution performance.The use of saturated aqueous solution method to make Har into the cavity structure of cyclodextrin can effectively enhance the water solubility of Har. The Har-DCL obtained by transferring Har in the form of Har-CD from the liposome bilayer to the inner aqueous phase is uniform and stable, which provides a reference for the development of new formulation for Har.
harmine; cyclodextrin inclusion compound; liposome; freeze drying; inclusion complex; pH gradient active drug loading method; saturated aqueous solution method; solubility; resolubility; encapsulation efficiency; drug loading capacity
R283.6
A
0253 - 2670(2022)24 - 7696 - 10
10.7501/j.issn.0253-2670.2022.24.007
2022-07-13
江西省自然科学基金资助项目(20202BAB216038);江西中医药大学博士启动基金(2018WBZR001);国家自然科学基金地区项目(82260816);江西中医药大学中药制剂技术与制药装备创新团队(CXTD22006);江西中医药大学大学生创新创业训练计划项目(202210412363)
周伟成(1998—),男,硕士研究生,研究方向为中药新剂型与新技术。E-mail: Zhouwc163@163.com
陈颖翀,女,硕士生导师,研究方向为中药新剂型与新技术。Tel: (0791)87118658 E-mail: yc_chen1020@163.com
岳鹏飞,男,博士生导师,研究方向为中药新技术与新产品开发。Tel: (0791)87118658 E-mail: ypfpharm@126.com
[责任编辑 郑礼胜]
