2-乙酰基毛蕊花糖苷抗破骨细胞形成及其作用机制△
2022-12-26韩晓玲杨云韦秋蔡铭琪毛浩萍
韩晓玲,杨云,韦秋,蔡铭琪,毛浩萍
天津中医药大学 方剂学教育部重点实验室,天津 301617
骨组织生命活动周期包括成骨细胞介导的骨形成与破骨细胞介导的骨吸收,这一过程被称为骨重塑。在骨重塑过程中,骨吸收水平大于骨形成水平时会使骨质减少从而导致骨质疏松(osteoporosis,OP)。OP 是最常见的骨重塑疾病之一,其特点是骨量降低,骨折风险升高。研究显示,OP在发生骨质疏松性骨折之前大多是隐秘不被发觉的,因此被称为“沉默的杀手”[1]。
目前临床治疗OP的药物,主要包括抑制破骨细胞吸收药物如雌激素、降钙素类及选择性雌激素受体调节剂等,以及促进骨形成药物如特立帕肽等。然而上述疗法或药物在发挥其抗骨质疏松药效的同时还带来骨肉瘤等风险,从而限制了其使用。干细胞移植治疗虽然为OP 防治开辟了新方向[2],但在临床实际应用中仍不成熟[3],其有效性仍存有争议。因此中医药治疗OP成为新的研究方向。
2-乙酰基毛蕊花糖苷是来源于肉苁蓉中的一种苯乙醇苷类物质(图1)[4]。现代药理研究表明,肉苁蓉具有较好的抗OP作用,促进骨质疏松性骨折愈合[5-8]。2-乙酰基毛蕊花糖苷作为肉苁蓉中代表性化合物,被证明具有抗炎作用[9],而炎症无论在破骨细胞形成还是OP的病理生理发展过程中均扮演着极其重要的角色。本研究采用原代培养的单个核细胞,检测2-乙酰基毛蕊花糖苷对单个核细胞向破骨细胞分化及其对骨吸收功能的影响,以期阐明2-乙酰基毛蕊花糖苷是肉苁蓉发挥抗OP作用的有效物质及其可能的作用机制。
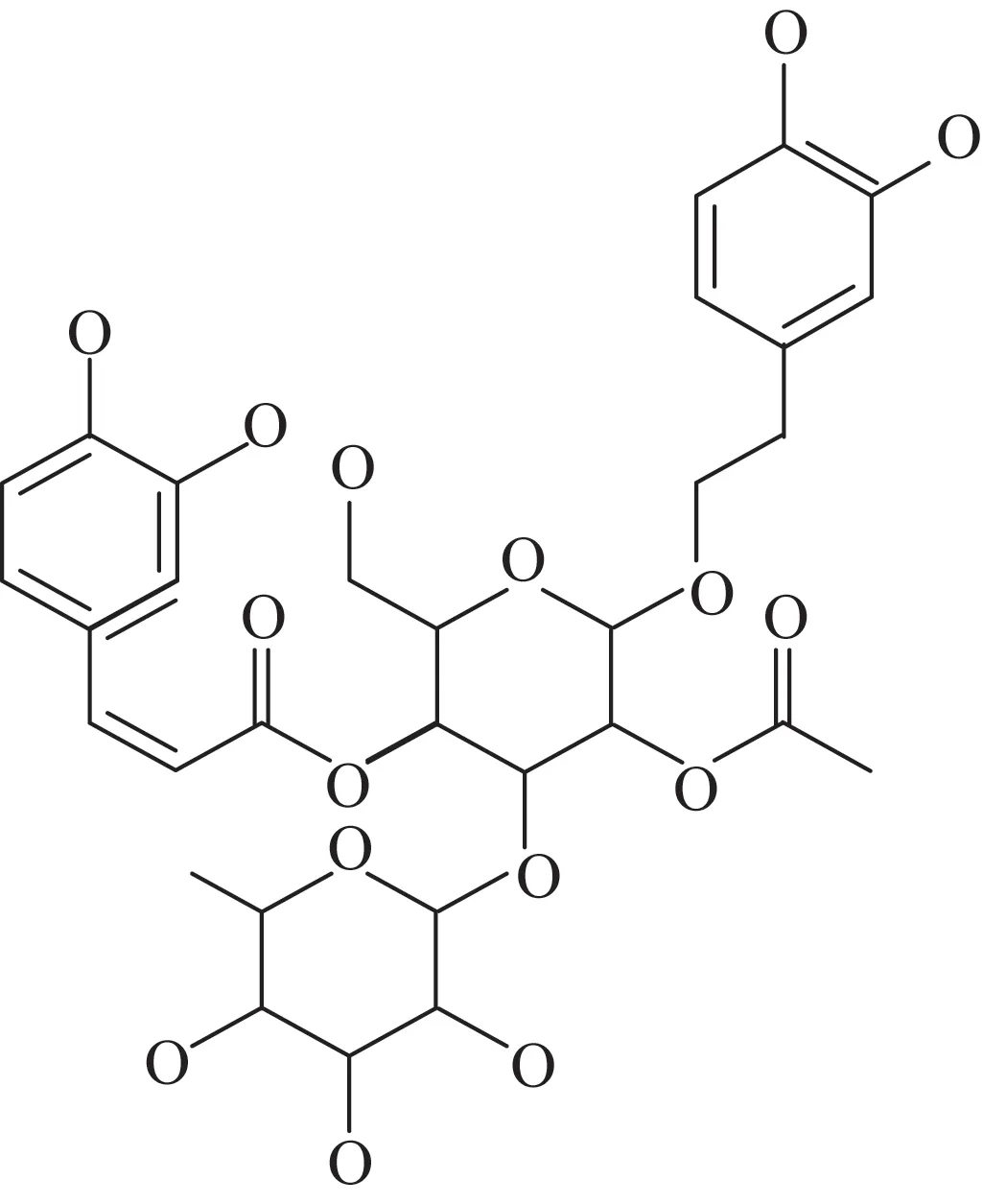
图1 2-乙酰基毛蕊花糖苷的化学结构
1 材料
1.1 实验动物
无特定病原体(SPF)级4 周龄C57BL/6J 雌性小鼠10 只,购于北京斯贝福实验动物技术有限公司,动物合格证号为SCXK(京)2016-0002,动物实验经天津中医药大学伦理委员会批准,伦理编号为TCM-LAEC2021156。
1.2 试药
对照品2-乙酰基毛蕊花糖苷(批号:SA8050,纯度≥98%)、RIPA裂解液(批号:20180615)、苯甲基磺酰氟(PMSF,批号:20210930)、三乙醇胺缓冲盐水溶液(TBS,批号:20181011)、曲拉通(批号:301G056)、红细胞裂解液(批号:20220908)均购于北京索莱宝生物科技有限公司;青霉素及链霉素双抗(批号:1950172)、磷酸盐缓冲液(PBS,批号:0062819)均购于Biological Industries公司;胎牛血清(批号:04257,Ausbian公司);Ficoll细胞分离液(批号:10272519,GE公司);巨噬细胞集落刺激因子(M-CSF,批号:W220014128017-21060719310003-018)、核转录因子-кB 受体活化因子配体(RANKL,批号:W220014945000-210624173210036-001)均购于美国R&D 公司;抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(批号:04124,Sigma 公司);TRAP 活性检测试剂盒(批号:042821220519)、BCA 蛋白检测试剂盒(批号:20210102)、DAPI溶液(批号:C1006)均购于碧云天生物技术有限公司;α-MEM培养基(批号:2105319)、Alex-Fluor 568 标记Factin(批号:HY1126)均购于赛默飞世尔科技公司;细胞增殖活性检测试剂盒(CCK8,批号:22145325,Biosharp 公司);抗酒石酸酸性磷酸酶(TRAP)抗体(批号:GR3352902-4)、原癌基因c-Fos抗体(批号:GR3212874-1)均购于Abcam 公司;β肌动蛋白(β-actin)抗体(批号:UM4001,天津优抗生物技术有限公司);整合素β3(ITGβ3)抗体(批号:HN0810,Novus Biologicals公司);辣根酶标记山羊抗兔免疫球蛋白(Ig)G(批号:127917,北京中杉金桥生物技术公司)。
1.3 仪器
SPARK 型多功能酶标仪(TECAN 公司);TS2-S-SM 型倒置显微镜(Nikon公司);552BR066646型电泳槽、221BR 52209型半干转、734BR4251型超灵敏多功能成像仪均购自Bio-Rad 公司;KB-900 型脱色摇床(其林贝尔仪器制造有限公司)。
2 方法
2.1 小鼠单个核细胞分离培养
实验小鼠麻醉后脱颈处死,75%乙醇浸泡10 min。迅速分离出小鼠双侧胫骨与股骨浸泡在含10%双抗的PBS液中。彻底分离肌肉组织后,用1 mL 注射器吹出骨髓组织,充分吹散后收集细胞液。使用75 μm细胞滤器将单个细胞收集至50 mL 无菌离心管中。随后使用Ficoll细胞分离液分离单个核细胞,将细胞于250×g离心10 min 后使用红细胞裂解液裂解红细胞,清洗细胞2遍,得到单个核细胞。
2.2 破骨前体细胞和破骨细胞诱导
单个核细胞用提前预热的含25 ng·mL-1M-CSF的完全培养基(α-MEM+10%胎牛血清+1%双抗)中重悬,置于5% CO2培养箱内37 ℃继续培养过夜,非贴壁细胞即为破骨前体细胞。
收集破骨前体细胞,在M-CSF(25 ng·mL-1)和RANKL(50 ng·mL-1)条件下连续培养7 d,即为破骨细胞。
2.3 CCK8 法检测2-乙酰基毛蕊花糖苷对破骨前体细胞活性的影响
单个核细胞培养在含25 ng·mL-1M-CSF 的完全培养基中,密度为3×105个/孔。48 h后按照实验设计分为对照组(含25 ng·mL-1M-CSF 的完全培养液)和不同浓度2-乙酰基毛蕊花糖苷给药组(25 ng·mL-1M-CSF 中分别加0.1、1.0、10.0 μmol·L-12-乙酰基毛蕊花糖苷的完全培养液)干预7 d,每3 d 换1次培养液。最后1 d 加入含10% CCK8 溶液的完全培养液,37 ℃孵育2 h 后在450 nm 处检测吸光度(A)值,按公式(1)计算细胞活力。

式中A给药组表示具有细胞、培养基、CCK-8溶液和药物溶液的孔的吸光度值;A空白组表示具有培养基、CCK-8 溶液,没有细胞的孔的吸光度值;A对照组表示具有细胞、培养基、CCK-8 溶液,没有药物溶液的孔的吸光度值。
2.4 TRAP染色及TRAP活性检测
为研究2-乙酰基毛蕊花糖苷对破骨细胞分化的影响,采用25 ng·mL-1M-CSF 和50 ng·mL-1RANKL联合诱导破骨前体细胞向破骨细胞分化。实验分为对照组(含25 ng·mL-1M-CSF 的完全培养液)、模型组(含25 ng·mL-1M-CSF 和50 ng·mL-1RANKL的完全培养液)、不同浓度2-乙酰基毛蕊花糖苷给药组(25 ng·mL-1M-CSF 和50 ng·mL-1RANKL 中分别含0.1、1.0、10.0 μmol·L-12-乙酰基毛蕊花糖苷的完全培养液),干预7 d,每3 d换1次培养液,诱导为成熟的破骨细胞。随后用TRAP活性检测试剂盒检测各组细胞上清液中TRAP活性。用PBS润洗细胞2次,于4%多聚甲醛中固定15 min,利用TRAP染色试剂盒进行TRAP染色。使用倒置显微镜拍摄染色图像。
2.5 F-actin环染色
按2.4 项下方法分组,将破骨前体细胞诱导为成熟的破骨细胞后,弃去上清液。4%多聚甲醛固定细胞15 min,采用含0.1%曲拉通的PBS 对细胞透化。PBS 润洗细胞并加入Alex-Fluor 568 标记的Factin 染料,37 ℃孵育40 min。再次洗涤细胞后,DAPI复染10 min。洗涤细胞后在荧光显微镜下观察荧光信号,采集图像后采用Image Pro 6.0分析图像。
2.6 骨陷窝形成实验
将破骨前体细胞接种于放有骨切片的培养板中,按2.4 项下方法分组培养细胞,7 d 后采用次氯酸钠溶液除去涂层板上的细胞。倒置显微镜下观察骨吸收程度,获得骨吸收图像并用Image Pro 6.0分析图像。
2.7 蛋白印迹法(Western blot,WB)分析
6 孔板中培养破骨细胞,吸弃细胞上清液,采用预冷的PBS 润洗1 次。按60 μL/孔加入RIPA 和PMSF(100∶1),在冰上裂解总蛋白15 min。将悬浮液在4 ℃,15 000×g离心10 min,上清液收集至新的离心管中即为总蛋白,采用BCA 蛋白检测试剂盒检测总蛋白浓度。加入适量的上样缓冲液,在100 ℃煮沸5 min。接着使用8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测目标蛋白的表达(总蛋白40 μg/孔),60 V 电泳30 min、120 V电泳60 min,之后将蛋白转移至聚偏氟乙烯(PVDF)膜上,然后使用5%脱脂奶粉封闭2 h,用TBST 稀释(1∶1000)兔多克隆抗体ITGβ3、c-Fos、TRAP 在4 ℃孵育过夜。次日,将膜在TBST 中清洗3 次(5 min/次),接着与相应的二抗(1∶10 000)在室温条件下孵育2 h。最后加化学发光底液显影检测,采用Image Pro 6.0分析图像。
2.8 统计学方法
数据均采用SPSS 22.0 分析软件进行统计分析,结果以(xˉ±s)表示。多组定量选用单因素方差分析。采用GraphPrism 7进行作图处理。
3 结果
3.1 2-乙酰基毛蕊花糖苷对破骨细胞分化的影响
M-CSF 和RANKL 诱导单个核细胞聚集融合形成具有多核形态的TRAP 染色阳性细胞(图2),提示模型组中破骨细胞形成增多。给予0.1、1.0、10.0 μmol·L-12-乙酰基毛蕊花糖苷7 d后,TRAP阳性染色多个核细胞数量减少,且细胞形态明显变小。进一步采用TRAP 活性检测试剂盒对各组细胞酶活性进行检测,结果见图3,与对照组相比,诱导分化模型组细胞TRAP 酶活性显著升高(P<0.05)。与模型组相比,0.1、1.0、10.0 μmol·L-12-乙酰基毛蕊花糖苷均能显著抑制M-CSF 和RANKL 诱导的细胞内TRAP 酶活性的增加(P<0.05),提示2-乙酰基毛蕊花糖苷具有抑制破骨细胞形成的作用。
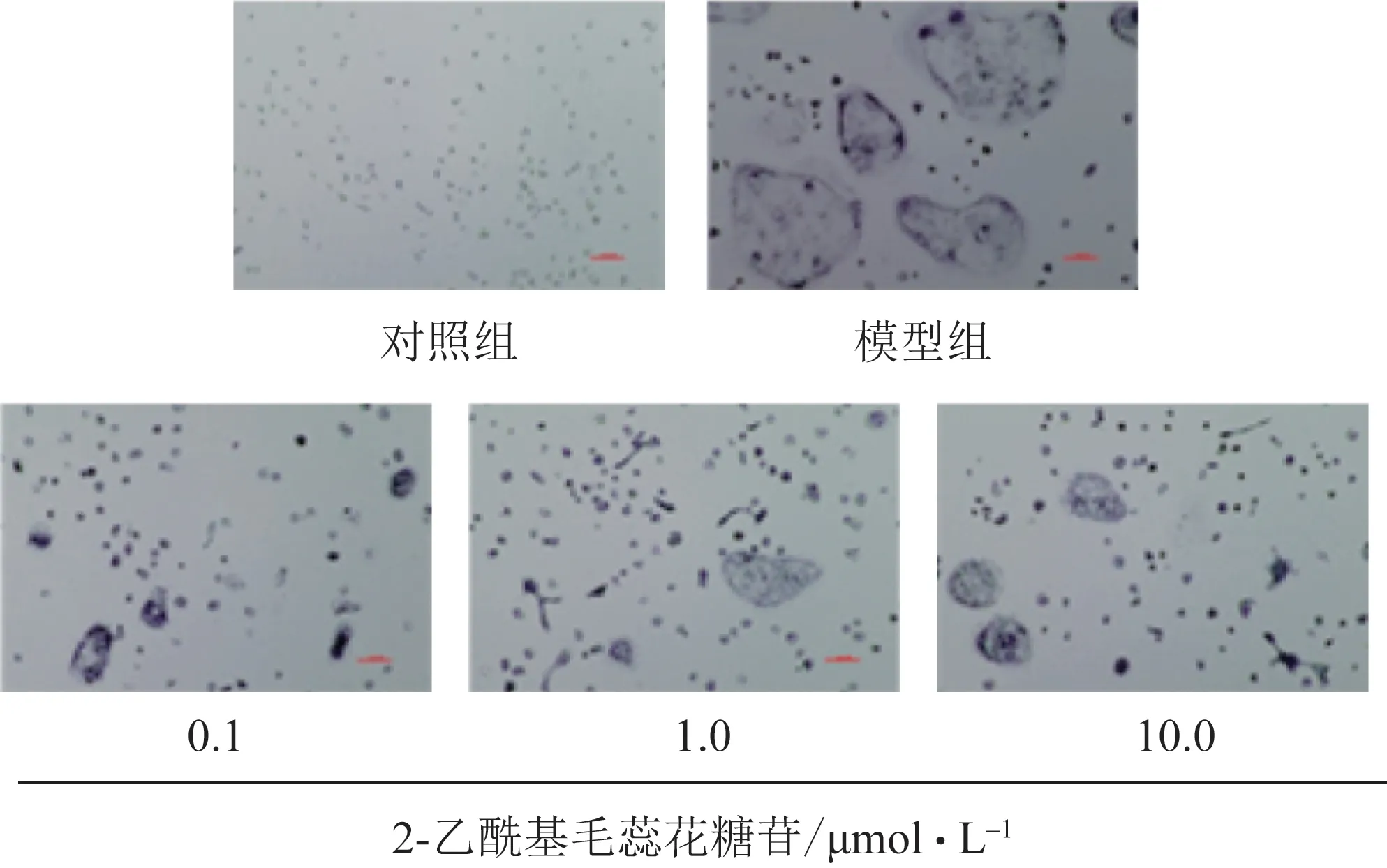
图2 破骨细胞TRAP染色图

图3 破骨前体细胞TRAP活性(,n=5)
3.2 2-乙酰基毛蕊花糖苷对破骨前体细胞的影响
破骨前体细胞活性实验结果见图4,与对照组相比,0.1、1.0、10.0 μmol·L-12-乙酰基毛蕊花糖苷对破骨前体细胞活性无显著影响。提示2-乙酰基毛蕊花糖苷抑制破骨细胞形成并非是由于其抑制破骨前体细胞活性产生的。

图4 破骨前体细胞的细胞活力(,n=6)
3.3 2-乙酰基毛蕊花糖苷对骨吸收功能的影响
通常破骨细胞只有形成闭合F-actin环才具有骨吸收功能,因此,继续采用F-actin染色来检测2-乙酰基毛蕊花糖苷对破骨细胞骨吸收功能的影响(图5~6)。与对照相比,模型组F-actin环数量及面积显著增加,而0.1、1.0、10.0 μmol·L-12-乙酰基毛蕊花糖苷抑制M-CSF和RANKL 诱导的F-actin 环的形成。进一步采用骨吸收陷窝实验确证2-乙酰基毛蕊花糖苷的抗骨吸收功能,发现模型组骨吸收陷窝数量增多,而0.1、1.0、10.0 μmol·L-1的2-乙酰基毛蕊花糖苷显著减少破骨细胞骨吸收形成的骨陷窝面积。
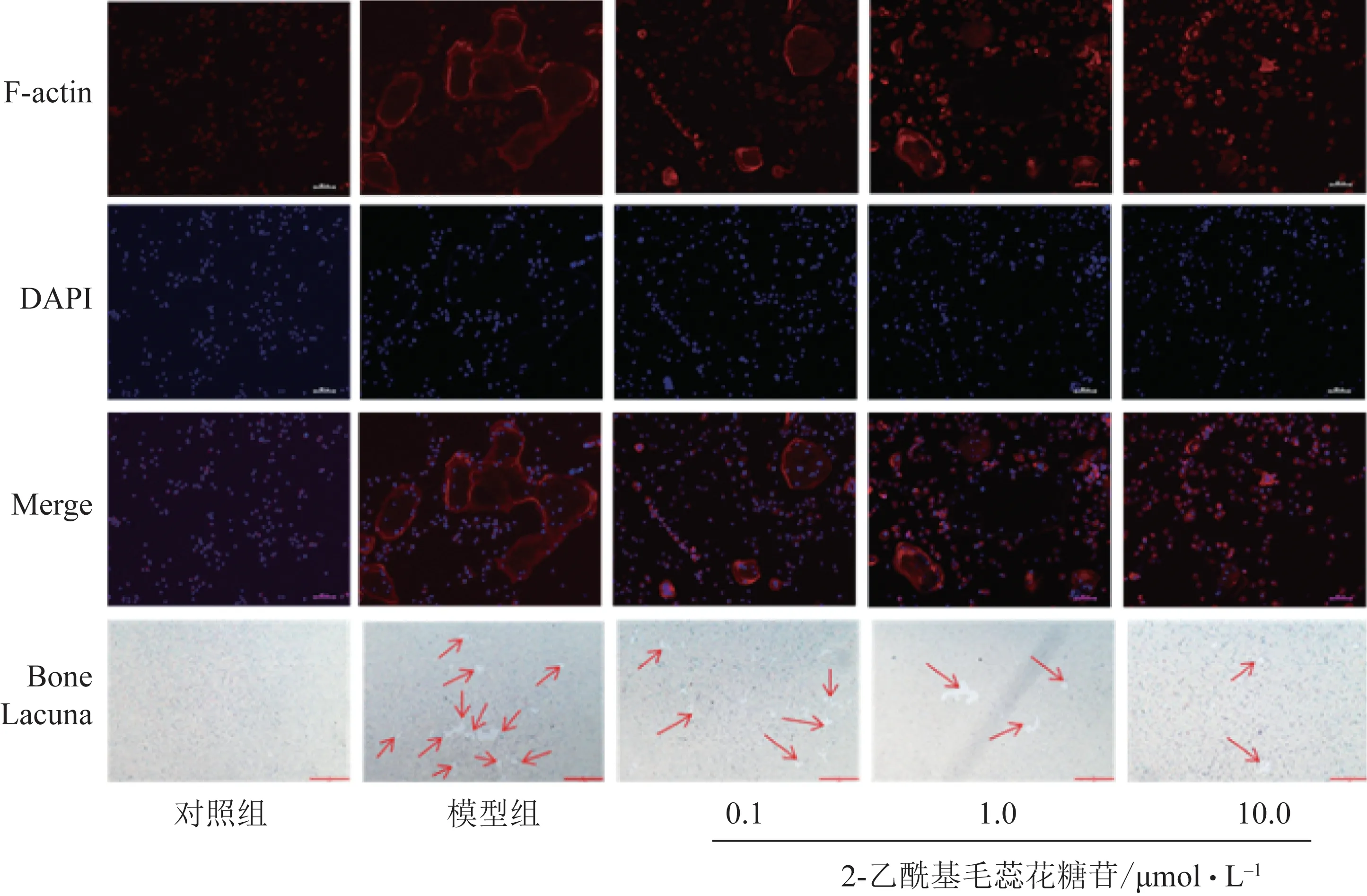
图5 破骨细胞的F-actin染色和骨吸收陷窝实验结果(100×)
3.4 2-乙酰基毛蕊花糖苷对破骨细胞形成特异性指标蛋白TRAP、ITGβ3、c-Fos蛋白表达的影响
WB 检测2-乙酰基毛蕊花糖苷对破骨细胞形成特异性指标蛋白的影响,结果见图7~8。与对照组相比,模型组破骨细胞形成特异性指标蛋白TRAP、ITGβ3和c-Fos 表达显著升高(P<0.05);与模型组相比,0.1、1.0、10.0 μmol·L-12-乙酰基毛蕊花糖苷干预后可显著降低ITGβ3、TRAP、c-Fos蛋白的表达,差异有统计学意义(P<0.05)。
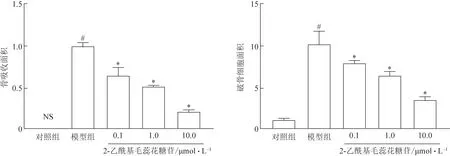
图6 2-乙酰基毛蕊花糖苷抗破骨细胞骨吸收功能的影响(,n=3)
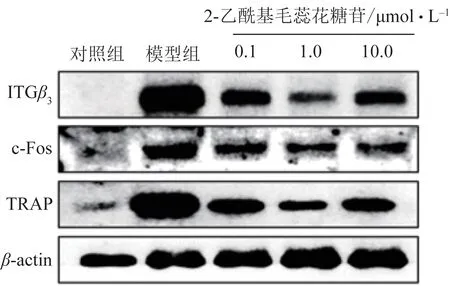
图7 破骨细胞WB结果图
4 讨论
人的一生中,骨组织一直处于由破骨细胞和成骨细胞介导的骨吸收和骨形成的骨重建过程。随着骨重建的发生,骨形成大于骨吸收,从而人体骨骼得以生长。随着衰老的发生或体内激素水平的变化,出现骨吸收与骨形成之间失衡状态,破骨细胞介导的骨吸收大于成骨细胞介导的骨形成,从而出现骨量减少,最终形成OP[10]。因此,抑制破骨细胞介导的骨吸收或促进成骨细胞介导的骨形成成为抗OP药物研发的两个重要方向。其中,破骨细胞介导的骨吸收功能异常在骨重塑过程中起着关键作用。因此,从抑制破骨细胞形成及功能角度出发,研究具有抗破骨细胞形成的药物对抗OP药物的研发具有重要意义[10]。本研究发现2-乙酰基毛蕊花糖苷在对破骨前体细胞活性未见显著影响的前提下,具有显著抑制M-CSF 和RANKL 共同诱导的细胞TRAP 酶活性的增加,减少多个核细胞形成的作用,提示2-乙酰基毛蕊花糖苷具有显著的抗破骨细胞形成作用。此外,骨陷窝实验表明2-乙酰基毛蕊花糖苷进一步抑制破骨细胞功能。临床上绝经期OP、牙周病、类风湿关节炎和多发性骨髓瘤等骨代谢性疾病均与破骨细胞的过度活跃密切相关[11-13],提示2-乙酰基毛蕊花糖苷可以作为上述破骨细胞过度活性相关疾病的潜在药物进行深入研究。

图8 2-乙酰基毛蕊花糖苷对TRAP、ITGβ3、c-Fos蛋白表达的影响(,n=3)
破骨细胞由骨髓中单个核细胞在M-CSF 和RANKL 共同作用下,相互融合形成巨大的多核细胞,即成熟的破骨细胞。在破骨细胞分化过程中,细胞骨架F-actin 形成环状结构,以封闭下方区域并形成一个封闭的空间,其中通过吸收骨基质和骨矿物质产生吸收坑[14]。因此,骨陷窝的形成被认为是破骨细胞的典型标志[15]。因此,笔者研究2-乙酰基毛蕊花糖苷对F-actin 环的形成和骨吸收的影响,结果表明RANKL 诱导的破骨细胞产生更多的F-actin环和骨吸收坑,具有更强的骨吸收功能,这些特征可显著被2-乙酰基毛蕊花糖苷抑制。成熟的破骨细胞附着于骨骼表面,高表达TRAP 行使骨吸收功能[16]。本研究结果显示2-乙酰基毛蕊花糖苷显著抑制破骨细胞诱导剂诱导的细胞TRAP 活性,抑制细胞内TRAP 蛋白表达,表现出对破骨细胞活性较强的抑制作用。整合素蛋白家族是一组细胞表面的黏附分子,由α、β2条链(或亚单位)经非共价键连接组成的异二聚体,与相邻细胞上的特异性细胞外基质蛋白或受体结合,参与调控包括增殖、存活、迁移及分化等多方面的细胞行为。ITGβ3是整合素家族中的一种亚单位,ITGβ3亚单位与αⅡb配对形成αⅡbβ3与纤维蛋白原和血管性血友病因子结合,在止血和血栓形成过程中介导血小板聚集[17]。ITGβ3亚单位还可与αⅤ结合形成αβ3,在破骨细胞中高度表达,参与破骨细胞形成[18]。因此,ITGβ3也被当成一个破骨细胞标志物而被广泛应用于破骨细胞形成相关研究中[19]。本研究发现,模型组中ITGβ3蛋白表达增加,而2-乙酰基毛蕊花糖苷显著抑制ITGβ3蛋白表达,与其抑制TRAP 蛋白及其酶活性结果一致。c-Fos 属于Fos 转录因子家族,由位于染色体14 上的c-Fos 基因编码。c-Fos 与c-Jun 异源二聚形成激活蛋白-1(AP-1)转录因子,该转录因子调控在细胞信号转导、细胞增殖和分化中起重要作用的多个基因的转录,也参与了破骨细胞分化过程[20-21]。从本研究蛋白结果我们可以看出,2-乙酰基毛蕊花糖苷能调节c-Fos 蛋白含量,这可能是其抑制破骨细胞分化的潜在作用途径。
随着人口老龄化程度日益加重,我国OP 的防治形势日益严峻。骨质疏松症及其严重骨折给个人、家庭和社会均带来了沉重的负担,为此抗OP药物的研发变得尤为重要。近年来,虽然在抑制骨吸收、促进骨形成等方面抗OP 药物日渐丰富,但是无论是药物研发还是临床抗OP 治疗仍存在多方面问题。而中医药长期应用于骨科相关疾病的临床治疗,在治疗OP 等慢性疾病方面具有一定优势,本研究以肉苁蓉中主要有效成分之一2-乙酰基毛蕊花糖苷为研究对象,发现其具有显著的抗破骨细胞形成及抗骨吸收的作用,为临床OP治疗药物的进一步研发提供参考。
