抗生素残留对施用牛粪土壤氮素矿化的影响及amoA、nxrA基因的响应*
2022-12-26陈思玮马瑛骏张克强沈仕洲
万 辰 陈思玮 马瑛骏 张克强 王 风 沈仕洲#
(1.农业农村部环境保护科研监测所,天津 300191;2.大理农田生态系统国家野外观测研究站,云南 大理 671004;3.云南农业大学资源与环境学院,云南 昆明 650201;4.东北农业大学资源与环境学院,黑龙江 哈尔滨 150030)
氮素是满足作物生长和提高作物产量所必须的营养元素[1]。农田生态系统氮素有多种输入途径,但作物获取的氮素主要来源于土壤和肥料[2],土壤中90%(质量分数)以上氮素以有机态氮的形式存在[3],仅有部分小分子有机态氮能被作物吸收利用,大部分需经过矿化作用转化成铵态氮和硝态氮才能被作物吸收利用[4]。土壤氮素矿化释放是微生物主导的生物化学过程,受土壤质地、温度、含水率、有机质含量等因素影响[5-6],土壤中污染物也会通过抑杀土壤微生物来抑制土壤氮素矿化作用。
抗生素是一类具有干扰、杀死微生物或生物细胞的有机化学物质[7],在畜禽养殖等方面被广泛应用。有研究表明,只有部分抗生素参与动物的新陈代谢并被有效使用,大部分抗生素直接随动物尿液和粪便排出体外[8],并以原药形式输入环境系统[9]。中国畜禽粪便产量较大,2015年畜禽粪便总产量可达10.19亿t[10],其中80%未经无害化处理直接用作农作物肥料[11]。这些未经处理并且残留抗生素的粪便作为有机肥施用于农田,不仅会造成土壤、水体污染[12],还会选择性抑杀某些土壤微生物,破坏土壤环境中微生物群落组成和结构[13]。土壤氮素矿化作用依赖于微生物调控[14],土壤或肥料中残留的抗生素会干扰相关微生物活动,势必会对土壤氮素矿化造成影响。不同抗生素的药效不同,对氮素矿化的影响存在差异。YU等[15]研究发现,低浓度红霉素对氨氧化菌有明显抑制作用,而中浓度和高浓度红霉素对氨氧化菌具有明显增益作用。HAMMESFAHR等[16]利用磺胺嘧啶污染新鲜和腐熟的猪粪,结果显示磺胺嘧啶明显抑制氨氧化细菌和氨氧化古菌生长,降低氨氧化微生物的丰富度和多样性,进而抑制氨氧化过程。
畜禽粪便中检出率较高的抗生素类型有磺胺类、四环素类、大环内酯类和喹诺酮类[17],虽然抗生素在堆肥过程中可由于生物降解等作用有所降低,但难以全部去除,最终通过施肥进入土壤。本研究以水稻土作为研究对象,在施加传统有机肥条件下,通过室内好氧培养试验探究不同抗生素处理下的土壤氮素矿化特征,及对氮素矿化功能基因的影响,对指导畜禽粪便等有机物料合理利用具有重要的科学意义。
1 材料与方法
1.1 试验材料
供试土壤采自云南大理农田耕层土壤(0~20 cm),样品经过风干后过1 mm筛备用。供试牛粪采自某奶牛养殖场,经测定无抗生素检出,样品经堆肥腐熟和风干后过1 mm筛备用,供试土壤及牛粪基本理化性质见表1。
1.2 试验设计
参考有机肥常规施加量进行试验设计,取104 g风干土样于塑料瓶中,加入3.07 g风干牛粪,分别加入恩诺沙星(ENR)、四环素(TCY)和金霉素(CTC)3种畜禽养殖常用抗生素,调节混合土样中抗生素质量浓度分别为10、25、50、100 mg/kg。向混合土样中加入20 mL蒸馏水,使其含水量与田间持水量基本持平。塑料瓶用盖封口并扎孔保持通气,于恒温避光处培养。每个处理设置3个重复,以不加抗生素作为对照(CK)组。试验期间,每隔2~3天称量一次补充蒸馏水保持混合土样含水量。为防止抗生素降解吸附以及微生物适应性增强等因素对试验结果产生影响[18],试验培养周期设置为25 d,分别于第3、6、9、16、25 天时采样。土壤矿质氮包括铵态氮与硝态氮,因此称取20 g土样加入浸提瓶中并加入100 mL质量浓度为2 mol/L的氯化钾浸提液,在恒温振荡器中振荡1 h,过滤收集浸提瓶中的水样并测定氨氮及硝态氮含量,折算土样中铵态氮、硝态氮质量浓度[19],试验过程中土壤矿质氮的增量即为氮素累积矿化量,矿质氮的增速即为净氮矿化速率。
1.3 土壤功能基因提取与分析
试验结束后,准确称取0.5 g土样采用FastDNA®SPIN试剂盒(美国MP Biomedicals)进行脱氧核糖核酸(DNA)提取,每个土样做3个重复,提取DNA后的样品置于冰箱中-20 ℃下保存,用于后续分析检测。
采用ABI7300型荧光定量聚合酶链式反应(qPCR)仪(美国Applied Biosystems)对amoA、nxrA基因进行qPCR分析。qPCR扩增过程如下:预变性95 ℃持续3 min;95 ℃变性5 s,58 ℃退火/延伸持续30 s,进行40个循环;熔点曲线分析在72 ℃进行。各DNA模板设置3组平行,以无菌双蒸水为阴性对照[20]。

表1 供试土壤及牛粪的基本理化性质Table 1 Basic chemical and physical characteristics of cow manure and soil
2 结果与分析
2.1 不同抗生素对土样铵态氮的影响
施加不同水平的ENR、TCY、CTC后,土样铵态氮的变化见图1。由图1(a)可见,在不同水平的ENR处理下,土样铵态氮总体呈先上升后下降的变化趋势。其中,ENR为10、25 mg/kg处理组的土样铵态氮在第3天达到最大值后开始下降,而ENR为50、100 mg/kg处理组的土样铵态氮在第6天达到最大值,分别为16.01、15.92 mg/kg,明显高于其他处理组。CK处理组的土样铵态氮在试验前9天变化不大,基本维持在12 mg/kg左右,第9天后土样铵态氮开始迅速下降;试验进行到第16天后,各处理组土样铵态氮含量趋于稳定,试验结束时,CK处理组土样铵态氮为5.71 mg/kg,ENR为10、25、50、100 mg/kg的处理组土样铵态氮分别为3.99、3.79、4.84、3.96 mg/kg,明显低于CK处理组。由图1(b)可见,试验第3天时,TCY为10、25、50、100 mg/kg处理组的土样铵态氮分别为12.68、14.23、14.52、14.91 mg/kg;第3天后,除100 mg/kg处理组的土样铵态氮继续升高,其他各处理组土样铵态氮均有下降,其中TCY为10、25 mg/kg处理组的土样铵态氮含量与CK处理组差异不明显;第6天后,TCY为100 mg/kg处理组的土样铵态氮含量也迅速下降,不同处理间差异逐渐缩小;各处理组土样铵态氮含量均在第16天时达到最小值,然后稍有上升。试验结束时,TCY为10、25、50、100 mg/kg处理组的土样铵态氮分别为5.68、4.90、4.91、4.59 mg/kg。由图1(c)可见,不同CTC处理组土样铵态氮在试验前3天无明显变化;试验第6天时,除CTC为10 mg/kg处理组及CK处理组土样铵态氮有所下降外,CTC为25、50、100 mg/kg处理组土样铵态氮均明显上升,分别达到22.27、26.37、25.06 mg/kg,在第6天后,3个CTC处理组土样铵态氮均迅速下降,各处理组之间差异逐渐减小。试验结束时,CTC为10、25、50、100 mg/kg处理组的土样铵态氮分别为5.62、5.58、5.53、5.64 mg/kg,与CK处理组无明显差异。

图1 不同抗生素对土样铵态氮的影响Fig.1 Effect of different antibiotics on ammonium nitrogen in soil samples
2.2 不同抗生素对土样硝态氮的影响
施加不同水平的ENR、TCY、CTC后,土样硝态氮的变化见图2。由图2(a)可见,在不同水平的ENR处理下,土样硝态氮含量总体均呈上升趋势。试验前6天,仅CK处理组土样硝态氮逐渐上升,其余4个ENR处理组土样硝态氮总体无明显变化。第6天后,ENR处理组土样硝态氮开始迅速上升,但与CK处理组间的差距持续增大。第9天后,各处理组土样硝态氮上升趋势放缓,试验结束时,ENR为10、25、50、100 mg/kg处理组的土样硝态氮分别为52.95、50.37、48.93、45.25 mg/kg,CK处理组土样硝态氮则达到75.87 mg/kg,明显高于4个ENR处理组。由图2(b)可见,TCY处理下土样硝态氮变化趋势与ENR处理基本相似,但与CK处理组土样硝态氮的差异有所减小,试验结束时,TCY为10、25、50、100 mg/kg处理组的土样硝态氮分别为65.33、65.07、65.29、52.80 mg/kg。由图2(c)可见,试验期间CTC为10 mg/kg处理组的土样硝态氮变化与CK处理组十分接近,除试验第6天时,CTC为25、50、100 mg/kg处理组的土样硝态氮出现下降,明显低于CK处理组,此后各处理组土样硝态氮均迅速上升,处理组间差异逐渐减小。试验结束时,CTC为10、25、50、100 mg/kg处理组的土样硝态氮分别为75.95、73.54、72.80、73.49 mg/kg,与CK处理组差异不大。
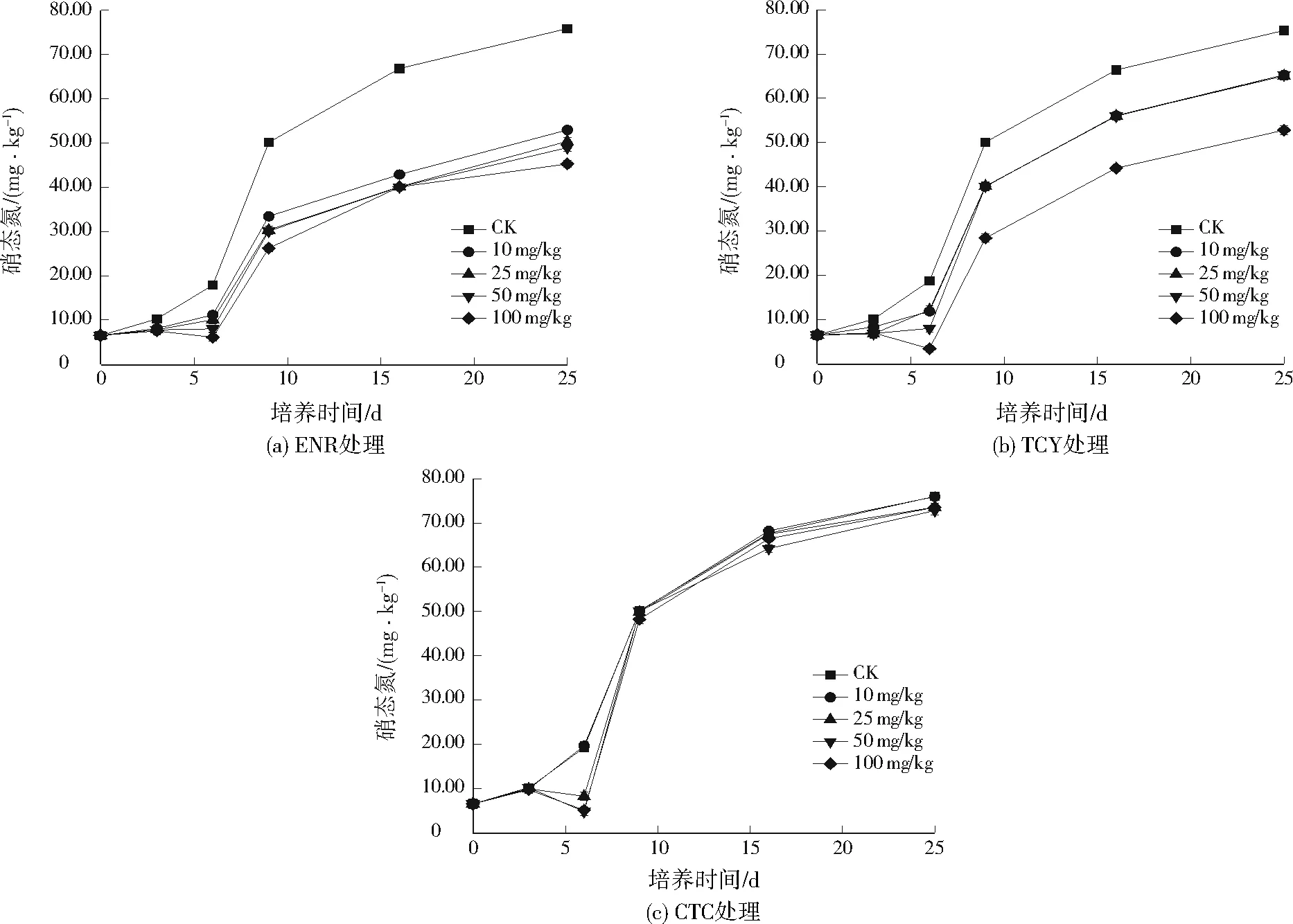
图2 不同抗生素对土样硝态氮的影响Fig.2 Effect of different antibiotics on nitrate nitrogen in soil samples
2.3 不同抗生素对土样净氮矿化速率的影响
试验期间,不同抗生素处理下土样的净氮矿化速率计算结果见表2。在0~3 d,3种抗生素处理组的净氮矿化速率均低于CK处理组,其中ENR处理组及TCY为10、25、50 mg/kg处理组显著低于CK处理组,CTC处理组略低于CK处理组。在3~6 d,CK处理组土样的净氮矿化速率达到2.47 mg/(kg·d),ENR处理组及TCY处理组较CK处理组最高分别下降了1.96、2.30 mg/(kg·d),CTC处理组与CK处理组差异不显著。在6~9 d,ENR处理组及TCY处理组的净氮矿化速率与CK处理组的差异达到最大,其中ENR为100 mg/kg处理组土样净氮矿化速率较CK处理组差距最大,相差8.17 mg/(kg·d);CTC为10 mg/kg处理组的土样净氮矿化速率高于CK处理组,其余CTC处理组均低于CK处理组。在9~16 d,各ENR处理组间土样净氮矿化速率无显著差异,且与CK处理组的差异减小,最大净氮矿化速率差仅为0.36 mg/(kg·d);TCY为10 mg/kg处理组及CTC为50、100 mg/kg处理组土样净氮矿化速率高于CK处理组,其余处理组均低于CK处理组。在16~25 d,除CTC为25 mg/kg处理组土样净氮矿化速率显著高于CK处理组,其余处理组与CK处理组间均无显著差异。
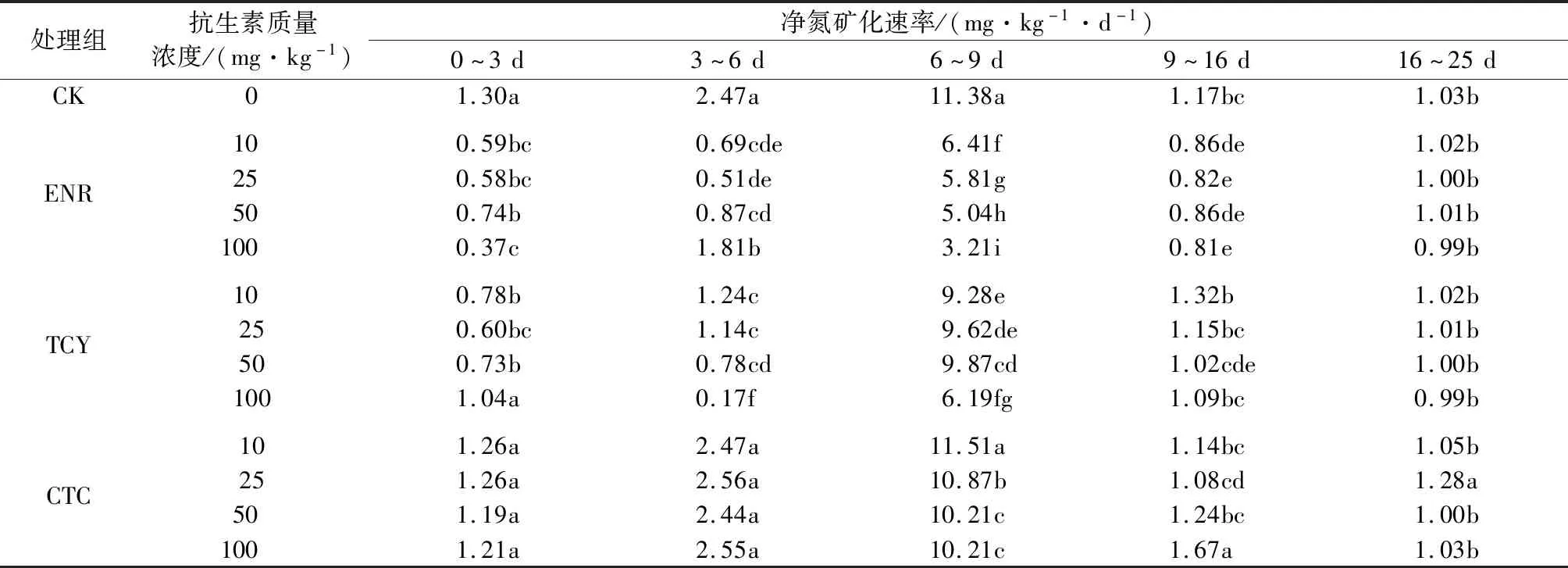
表2 不同抗生素处理下土样净氮矿化速率变化1)Table 2 Changes of net nitrogen mineralization rate in soil after treated by different antibiotics
2.4 不同抗生素对amoA、nxrA基因的影响
经计算,培养结束时CK处理组氮素累积矿化量为62.89 mg/kg,ENR为25、50、100 mg/kg处理组的氮素累积矿化量分别为35.27、35.08、30.79 mg/kg,TCY为25、100 mg/kg处理组的氮素累积矿化量分别为51.27、38.70 mg/kg,显著低于CK处理组(P<0.05),各浓度CTC处理组的氮素累积矿化量均与CK处理组无显著差异(P>0.05),说明土壤中的CTC残留不会降低有机肥氮素矿化量。为探究土壤中抗生素对有机肥氮素矿化机制的影响,选取与CK处理组氮素累积矿化量存在显著差异的处理组土样进行氮素矿化功能基因检测,其中包括amoA和nxrA基因,结果见图3。

图3 抗生素处理对amoA、nxrA基因的影响Fig.3 Effect of antibiotics on amoA gene and nxrA gene
与CK处理组相比,TCY为25 mg/kg处理组amoA基因丰度无显著差异,nxrA基因丰度提高0.84%,当TCY上升到100 mg/kg时,amoA、nxrA基因丰度分别下降了35.35%、52.38%,且为各处理组中的最低水平。ENR为25 mg/kg时,amoA、nxrA基因丰度分别比CK处理组下降了28.17%、31.38%,ENR上升到50、100 mg/kg时,amoA、nxrA基因丰度有所上升,且两处理组间无显著差异。
3 讨 论
抗生素进入土壤后将对土壤微生物结构和数量造成影响,进而影响土壤中的氮素矿化。本研究中,ENR在培养开始后便对氮素矿化产生抑制作用,试验6~9 d抑制作用最明显,该阶段10、25、50、100 mg/kg的ENR对土样净氮矿化速率的抑制率分别为43.67%、48.95%、55.71%、71.79%;第16天后,ENR对氮素矿化抑制强度减弱,试验后期不同ENR处理组土样的净氮矿化速率与CK处理组无显著差异。分析原因,主要是由于ENR对硝化作用产生抑制导致,培养结束时,各ENR处理组的硝态氮含量明显低于CK处理组。闫赛红[21]研究指出,ENR限制了土壤细菌、放线菌和真菌数量增长,高浓度下对氨氧化细菌和氨氧化古菌基因丰度表达和脲酶活性存在显著抑制。本研究发现随着ENR处理浓度梯度上升,培养结束后氮素累积矿化量呈递减趋势,而amoA、nxrA基因丰度却呈上升趋势,原因可能是高浓度ENR虽然不会对微生物菌群数量产生影响,但会通过降低主导氮素矿化的微生物酶活性来抑制氮素矿化。
试验前3天,仅TCY为100 mg/kg处理组未对氮素矿化产生显著影响,其余各TCY处理组土样净氮矿化速率显著低于CK处理组。随着试验的进行,各TCY处理组对氮素矿化抑制作用均有所增强,其中TCY为100 mg/kg处理组在6~9 d的净氮矿化速率抑制作用最明显,抑制率达到45.61%。试验第9天后,TCY对氮素矿化抑制作用逐渐减弱,各TCY处理组净氮矿化速率与CK处理组均无显著差异。TCY对氮素矿化作用的抑制主要体现在对硝化作用的影响上,各TCY处理组土样硝态氮含量明显低于CK处理组。有研究指出TCY对土壤细菌和真菌生长有显著抑制作用,高浓度TCY可显著抑制土壤酶活性[22];张继旭等[23]研究表明,低浓度TCY对土壤氮素矿化及硝化过程均产生促进;吴颖等[24]研究表明,高浓度TCY可显著抑制amoA、nxrA基因丰度。本研究也发现,TCY为100 mg/kg处理组土样amoA、nxrA基因丰度分别比CK处理组下降了35.35%、52.38%。本研究发现TCY由25 mg/kg上升至100 mg/kg时,amoA、nxrA基因丰度均显著降低,说明TCY会对土壤氮素矿化相关的功能微生物菌群数量产生影响。
试验3~6 d,CTC为25、50、100 mg/kg处理组土样硝态氮含量明显下降,该阶段CTC抑制了硝化作用,随着试验时间延长,CTC对硝化的抑制作用立即减弱。试验结束时,不同浓度CTC处理对土样氮素累积矿化量均无显著影响,这与其他研究结果不同。易良银[25]研究发现,随着土壤培养时间延长,CTC会显著抑制土壤矿化过程,不同浓度处理间无显著差异;袁德梽[26]的研究也表明CTC对土壤矿化存在抑制作用。本研究中外源添加CTC未对土样累积氮素矿化量产生影响,分析原因可能是本研究使用土样为施肥土壤,使CTC在土壤中快速降解或被土壤强烈吸附[27],降低了其对氮素矿化和硝化相关微生物的毒害作用,施肥后土样中微生物活性较高,对CTC胁迫适应性强,而CTC对氮素矿化影响时间较短暂,导致试验过程中未能表现出对氮素矿化的影响。
总体看来,不同抗生素对土壤氮素矿化的影响并不相同,ENR、TCY对氮素矿化具有抑制作用,CTC对土壤氮素矿化影响不明显。ENR、TCY对氮素矿化的抑制强度随培养时间的延长呈现先增加后减小的趋势,且均体现在对硝化作用的影响上,但对氮素矿化及硝化的影响不会持续存在。从功能基因丰度上看,ENR、TCY对氮素矿化的抑制存在差异,ENR主要通过降低主导氮素矿化的微生物酶活性来抑制氮素矿化,而TCY对相关的功能微生物菌群数量产生影响。若土壤中有ENR或TCY残留时,会抑制有机物料的矿质氮释放,可能造成作物减产和品质下降。
4 结 论
(1) 不同抗生素对土壤氮素矿化的影响并不相同。培养试验结束时,各ENR处理组及TCY为25~100 mg/kg处理组土样铵态氮均明显低于CK处理组,各ENR处理组及各TCY处理组土样硝态氮均明显低于CK处理组,而各TCT处理组土样铵态氮与硝态氮与CK处理组相差均不明显。
(2) ENR、TCY对氮素矿化的抑制强度随培养时间的延长呈现先增加后减小的趋势,试验6~9 d的抑制作用最明显,第16天后抑制强度减弱,各处理组间无显著差异,说明抗生素对氮素矿化及硝化的影响不会持续存在。ENR、TCY对氮素矿化的抑制作用均体现在对硝化作用的影响上。
(3) ENR、TCY对氮素矿化的抑制存在差异,ENR可能主要通过降低主导氮素矿化的微生物酶活性来抑制氮素矿化,而TCY可能主要对相关的功能微生物菌群数量产生影响。
