烧伤患者耐碳青霉烯类肺炎克雷伯菌感染的环境追踪研究
2022-12-26戴小华朱春梅
曾 凌,徐 珍,戴小华,刘 洋,朱春梅,刘 蓬
(南昌大学第一附属医院 1. 感染控制处; 2. 烧伤医学科; 3. 检验科,江西 南昌 330006)
烧伤患者由于皮肤黏膜屏障受损,更易发生多重耐药菌感染,引起严重脓毒症、感染性休克,成为主要致死原因之一[1-2]。目前,国内外耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae, CRKP)的耐药形势严峻,感染患者的病死率可高达30%~70%[3],并有在烧伤病房内流行的趋势,给临床用药和治疗带来巨大困难[4]。烧伤创面感染与环境(内环境和外环境)密切相关[5],多重耐药菌的环境同源性分析和细菌定植等研究成为目前医院感染防控的研究重点和热点之一。但目前国内相关研究均为回顾性调查,往往是发生感染或感染暴发后再进行调查分析,缺乏基因同源性分析的科学依据[6]。本研究采用前瞻性研究方法,开展烧伤患者CRKP感染环境的追踪,查找感染患者与环境之间的传播链,明确传染源及传播途径,以期为烧伤患者感染的防控与治疗提供科学依据。
1 资料与方法
1.1 病例筛选及调查 应用“医院感染实时监控软件”对烧伤科重症监护病房(ICU)患者进行实时监测,确定并选取CRKP感染病例。对纳入的CRKP感染病例进行危险因素调查,调查内容包括年龄、性别、烧伤程度、基础疾病、送检标本类型、送检时间、侵入性操作(呼吸机、中心静脉置管等)、抗菌药物使用、住院时间及预后等。
1.2 标本采集及方法 临床采集CRKP感染烧伤患者的消化道、分泌物和血等标本,进行内环境的追踪。对CRKP感染烧伤患者所处的外环境进行追踪调查,包括床单元(床单、被套、床垫等)、生活卫生用品、床头柜表面、医疗仪器设备表面、工作人员手、工作服和病区空气等。
临床患者标本采集参照《医院感染预防与控制操作指南SOP》的操作标准执行;外环境的标本采集参照《医疗机构消毒技术规范》WS/T 367—2012的操作标准执行。采用蘸有无菌生理盐水的棉拭子对环境物体表面进行采样。
1.3 菌株鉴定及药敏试验 采用VITEK 2 Compact全自动微生物分析仪(法国生物梅里埃公司)对采集菌株进行鉴定和药敏试验。药敏结果判定依据2020年美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)标准。质控菌株为肺炎克雷伯菌ATCC 700603。
1.4 同源性分析 采用脉冲场凝胶电泳(pulsed field gel eledtrophoresis, PFGE)和多位点序列分型(multilocus sequence typing, MLST)的检测方法,确定菌株的DNA同源性,明确菌株的分子分型。沙门氏菌H9812用作标记菌株,XbaI酶进行酶切,BioNumerics软件(version 4.0;AppliedMaths)分析PFGE凝胶图像条带,相似度≥80%认为菌株属于同一基因分型。对7对管家基因gapA、infB、mdh、pgi、phoE、rpoB、tonB7进行聚合酶链式反应(polymerase chain reaction, PCR)扩增、测序,根据序列结果进行比对分型,获得序列型别(sequence-type,ST)[7]。
1.5 荚膜血清型及毒力基因检测 采用PCR对CR-hvKP菌株进行荚膜血清型基因(K1、K2、K5、K20、K54、K57)检测以及4个毒力因子基因检测[包括荚膜(rmpA、rmpA2)和铁载体(iutA、iroN)]。PCR的扩增引物、体系和扩增条件参照相关文献[8]进行。
2 结果
2.1 患者临床基本资料 2020年6—12月共有4例烧伤患者发生CRKP感染,2例患者标本为创面分泌物,2例为血,均无基础疾病。4例患者均为Ⅲ度以上烧伤,经历多次清创手术,均采用联合抗菌药物治疗。患者住院时间为20~47 d,年龄为37~50岁。预后情况:1例血液中分离出CRKP的患者死亡,2例患者好转,1例患者治愈出院。见表1。
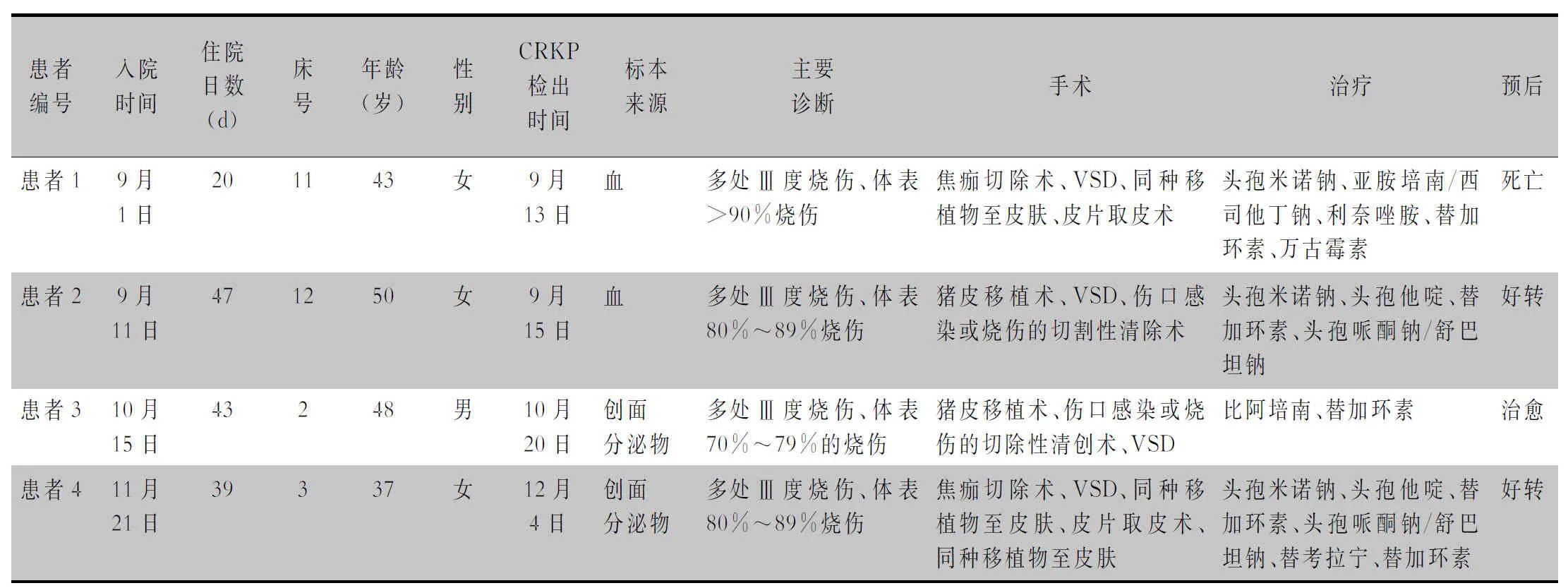
表1 4例CRKP感染烧伤患者临床基本情况Table 1 Basic clinical information of 4 burn patients with CRKP infection
2.2 菌株检出情况 共采集临床患者与环境标本152份。其中临床标本12份,环境标本140份(床单元40份,医疗器械40份,病区60份)。经细菌鉴定,分离出肺炎克雷伯菌18株,其中环境标本分离13株,临床标本分离5株。经药敏试验,最后共分离出CRKP菌株15株,其中临床标本4株,分别为1、2号患者血标本,3、4号患者创面分泌物标本;环境标本11株,主要为患者床旁隔离衣、呼吸机和医护人员手等。见表2。
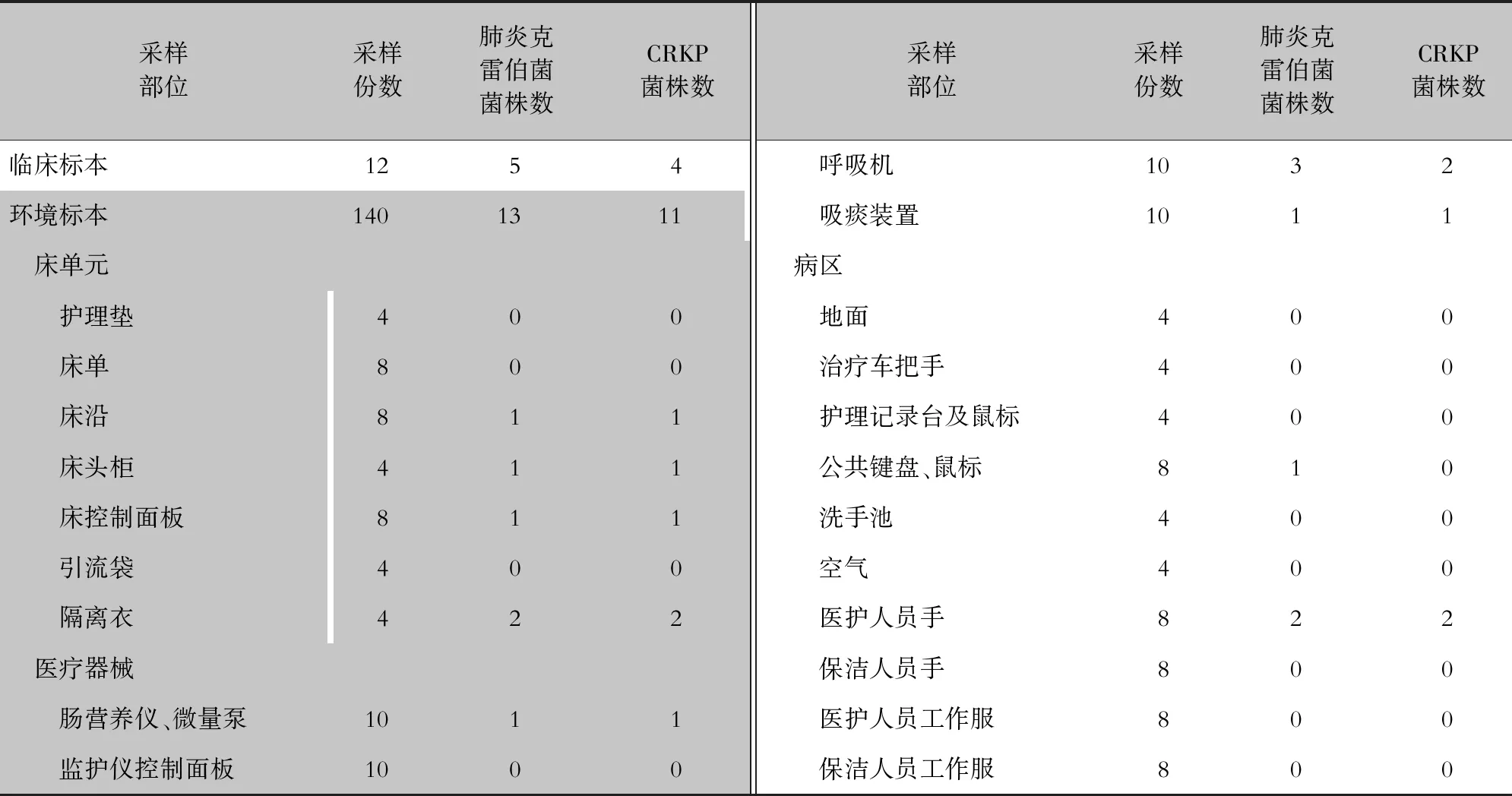
表2 CRKP感染患者临床及环境标本菌株检出情况Table 2 Isolation of bacterial strains from clinical and environmental specimens of patients with CRKP infection
2.3 菌株同源性分析结果 对15株CRKP分离株进行PFGE分型,通过PFGE分析,经聚类分析获得结果为A~G 7个聚类组,1号患者的血标本、2号患者的血标本及环境标本、3号患者的创面分泌物及环境标本具有同源性,为同一型别A型。将A~G型别的菌株进行MLST分析,结果分别得到A~G型为ST11、ST35、ST1、ST37、ST2929、ST23、ST17。见图1。

图1 15株CRKP菌株同源性分析聚类图Figure 1 Cluster diagram of homology analysis of 15 CRKP strains
2.4 毒力基因及荚膜血清型检测情况 对15株CRKP菌株进行毒力基因检测,K1、K2和K5型均未检出,其中5株K57型,ST型别为ST35、ST37和ST17。而未分型菌株以ST11型为主。见表3。
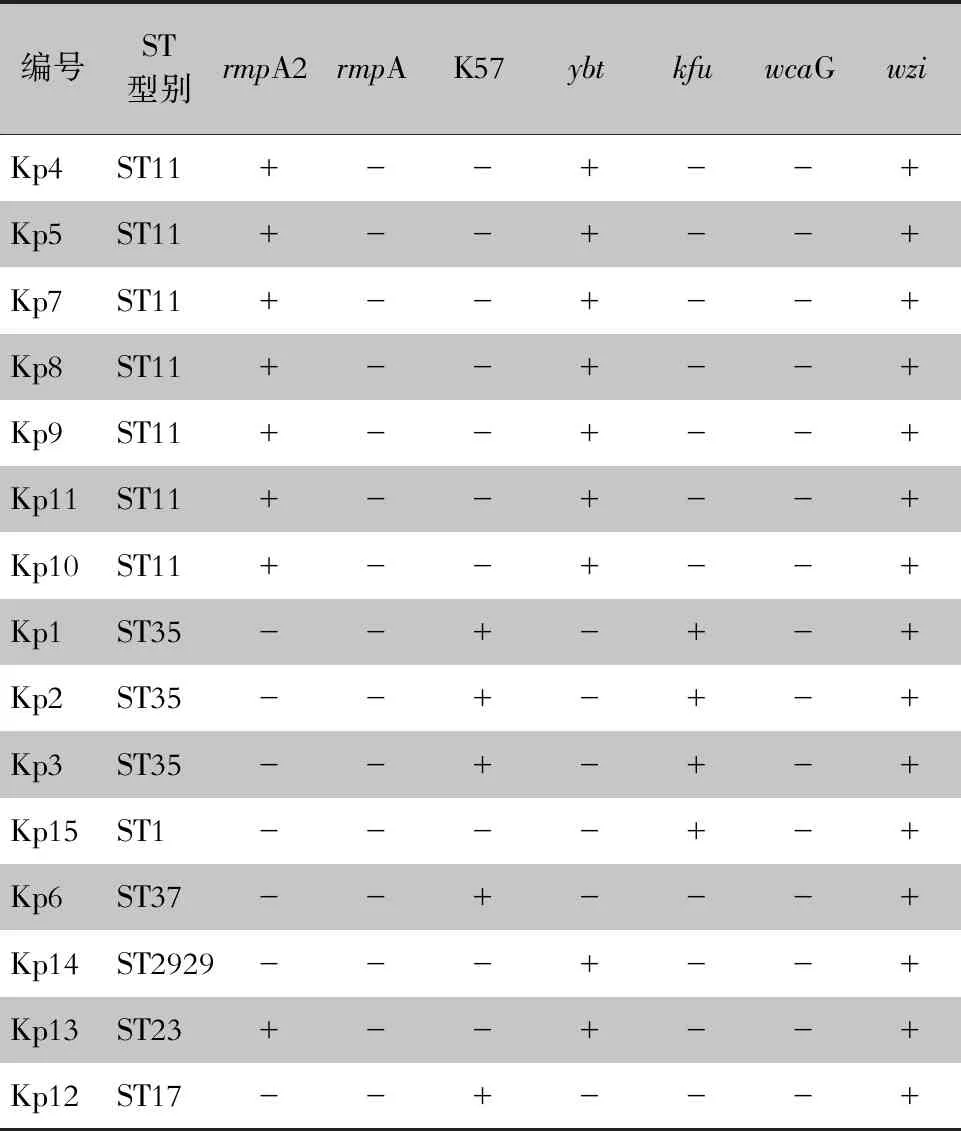
表3 15株CRKP毒力基因及荚膜血清型检测情况Table 3 Detection of virulence genes and capsular serotypes of 15 CRKP strains
3 讨论
烧伤病房是医院多重耐药菌感染监测的重点区域,极易发生细菌定植。烧伤患者因皮肤黏膜屏障受到破坏,影响机体正常的防御机制,并通过受损部位引起感染[9];此外,吸入性损伤、导管插管操作、住院时间长、机体免疫力下降等原因,也使烧伤患者发生感染的概率大大增加[10]。目前,在抗菌药物的选择压力下,烧伤患者发生CRKP感染的情况日益增多[11],并呈流行趋势。
本研究前瞻性监测烧伤病房患者CRKP感染发生情况,以预防和控制CRKP医院感染暴发。对患者周围环境进行监测,共分离出11株CRKP菌株。采用PFGE对其进行分子分型,共分为7个克隆组。病例1、2、3的床位分别为11、12、2床,患者1、2号的诊疗及护理为同一组医护人员,患者3号为另一组医护人员。1号患者虽早入院10 d,但与2号患者CRKP菌株检出时间间隔2 d,1、2号患者的血标本及环境标本、3号患者的创面分泌物及环境标本共7株CRKP菌株高度同源,为同一型别A型,ST序列型别均为11型。可考虑此菌株为不同区域间的水平传播导致,研究[10-12]证明感染者与其诊疗环境间存在相互传播,本研究中患者床旁隔离衣和医务人员手CRKP检出率高,患者极大可能通过接触医院环境而感染。烧伤患者创面破坏了人体原有的微生态平衡,污染的物体表面清洁消毒不彻底或手卫生未严格执行,将会造成细菌定植,成为传染源[13]。另外,由于机体肠黏膜屏障的应急损伤,肠道内毒素和微生物等有可能成为创面的一个内源性感染来源[14]。创面感染后如未能得到有效控制,继而导致的败血症是创面患者死亡的主要原因之一。
传统观点一直认为,细菌耐药性与毒力呈负相关,然而随着毒力-耐药杂合质粒的不断报道,高毒力高耐药肺炎克雷伯菌成为新型超级细菌[15]。我国CRKP中高毒力肺炎克雷伯菌以7.4%~15%的分离率位列世界前列[16]。本研究毒力基因检测中检出5株K57型,以ST35型别为主,提示该院烧伤科ICU出现局部CRKP克隆株流行,可能合并高毒高耐药,下一步应开展更大范围的监测。临床在对烧伤患者创面抗感染治疗时应给予足够重视。细菌的耐药性是临床抗感染治疗的难点之一,与烧伤患者治疗过程中长期大量使用抗菌药物密切相关,应及时根据患者感染的病原菌种类及药敏结果,合理选择抗菌药物[17-18]。
本研究通过对CRKP感染烧伤患者的内、外环境进行前瞻性研究,结果表明烧伤患者CRKP感染与环境之间有传播链。了解烧伤患者感染的危险因素,明确传染源及传播途径,对感染病例进行实时监测并及时追踪干预,从源头上阻止医疗机构相关医院感染暴发的可能。
本研究也存在一定不足之处:CRKP感染患者较少,导致样本量不够,因此后期仍需继续前瞻性监测,加大样本量;另外,本研究中对外环境中菌株和临床菌株进行了同源性分析,但同源性分析结果并不能证实外环境中菌株与临床菌株父子亲缘关系,因此不能说明环境中多重耐药菌是由环境中传播至患者还是患者传播至环境中,亦或是两种模式均有,多重耐药菌传播模式关系并不清楚[19]。同时国内外亦无相关研究报道,需要进一步进行研究,也是本课题组的下一步研究方向。
利益冲突:所有作者均声明不存在利益冲突。
