高原移居与返回平原青年人群血液生化及细胞因子指标分析*
2022-12-26马筱洁马聪聪刘鸿春史清海
马筱洁,马聪聪,刘鸿春,陈 玲,史清海△
1.石河子大学医学院,新疆石河子 832000;2.新疆医科大学医学院临床医学系,新疆乌鲁木齐830000;3.新疆军区总医院临床检验诊断中心,新疆乌鲁木齐 830000
高原地区的主要环境特点是低气压、缺氧、低温、紫外线强。平原人移居高原,尤其是4 000 m以上的特高海拔,都将面临高原习服和急慢性高原病的困扰[1-2]。高原缺氧环境对人体的影响是广泛且多样的,涵盖生理功能、血液系统、生化代谢、炎症反应等多方面,而返回平原脱离缺氧后一段时间又将恢复正常[3-4]。受限于高原特殊地理条件,既往国内外对于高原习服和急、慢性高原病的研究局限于小样本的横向研究,对于高原脱习服的系列研究尚处在起始阶段。现有的各项研究对高原习服和高原脱习服期人体功能的具体调节规律存在分歧,调节机制不清。本研究依托医疗保障单位的地理和人员优势,针对移居特高海拔的平原人群,从血液系统、生化代谢、炎症细胞因子表达等方面展开大样本纵向调查,重点关注平原人群在高原习服及返回平原阶段炎症细胞因子的表达变化规律,探讨炎症细胞因子对高原习服和高原脱习服的影响,寻找可能的高原病预防、治疗干预靶点,为深入研究急、慢性高原病和高原脱习服反应的发病机制提供参考依据。
1 资料与方法
1.1一般资料 选择2021年2月至2021年8月移居高原(西藏阿里,海拔4 500 m)6个月至1年的青年人群,抽样纳入554例为高原组;同期新疆乌鲁木齐地区抽样纳入移居高原连续居住6个月至1年后脱离高原返回平原2个月左右的青年人536例为返回平原组;以及同期体检健康的562例青年人为平原组。上述纳入的研究对象均排除心、肺疾病及其他慢性病,高原组和返回平原组研究对象排除急性高原病。本研究经新疆军区总医院伦理委员会批准,所有研究对象均知情同意后纳入研究。
1.2方法
1.2.1身高、体质量、血压、心率和血氧饱和度检查 嘱研究对象赤足,背向站立于超声波身高体重仪(大连欧姆龙HNH-318)底板上,保持双目直视前方,足跟、骶骨、肩胛“三点一线”姿势,静待30 s,仪器稳定后自动测量并读数,记录研究对象的身高、体质量。分别采用电子血压计(大连欧姆龙HEM-7127J)测量平静状态下肱动脉收缩压/舒张压;指夹式脉搏血氧仪(江苏鱼跃YX307)夹取左手中指,稳定10 s后读取心率、血氧饱和度。均反复3次取均值。
1.2.2血液常规和生化指标检测 采集空腹静脉血,乙二胺四乙酸二钾(EDTA-K2)抗凝,2 h内进行血细胞检测,分析标本白细胞计数(WBC)、中性粒细胞计数(NEUT)、红细胞计数(RBC)、血红蛋白(HB)水平、血小板计数(PLT);空腹采集静脉血于分离胶采集管中,2 h内离心收集血清,检测血清葡萄糖(GLU)、胆固醇(CHOL)、三酰甘油(TG)、肌酐(CREA)、尿酸(UA)、清蛋白(ALB)、总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)。高原组标本在当地陆军某医院检验科检测,血液常规检测采用迈瑞BC5800血液分析仪,血清生化指标采用迈瑞BS2000生化分析仪及其配套试剂检测;平原组和返回平原组标本在新疆军区总医院检验科检测,血液常规检测采用Sysmex XE-5000血液分析仪及其配套试剂,血清生化检测采用罗氏Cobas C701生化分析仪及其配套试剂。两所实验室开展的上述检测项目均严格执行室内质控,且参加国家卫生健康委员会室间质评结果均为合格。
1.2.3血液炎症细胞因子检测 采集空腹静脉血于分离胶采集管中,2 h内离心收集血清,-80 ℃冻存。高原组标本由冷链转运箱当日乘机转运回新疆军区总医院。
1.2.3.1筛选差异表达因子 随机抽取5份高原组血清标本,复溶后采用人血清炎症细胞因子多重微球流式免疫荧光发光试剂盒(天津旷博同生生物技术有限公司),检测标本中白细胞介素(IL)-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12p70、IL-17A、IL-17F、IL-22、肿瘤坏死因子(TNF)-α、TNF-β、干扰素(IFN)-γ水平;原理:利用包被不同抗体的微球捕获血清中相应的炎症细胞因子,在迈瑞BriCyte E6流式细胞仪上进行流式微球计数。然后参照试剂盒给出的参考值范围筛选出异常增高因子作为后期扩大样本量验证的目标因子。上述标本排除溶血、严重脂浊,并严格按照试剂盒说明书操作检测。
1.2.3.2目标因子扩大验证 异常增高的炎症细胞因子指标采用人血清IL-6、IL-8和IL-17A 酶联免疫吸附检测试剂盒(武汉伊莱瑞特生物科技股份有限公司)扩大样本量验证。上述标本排除溶血、严重脂浊,并严格按照试剂盒说明书操作检测。

2 结 果
2.1基础资料及生理指标比较 本研究纳入的3组研究对象为非自身对照关系,均为青年人群,年龄、性别、身高、体质量差异无统计学意义(P>0.05);与平原组、返回平原组比较,高原组舒张压、心率均较高,血氧饱和度均较低,差异有统计学意义(P<0.05),见表1。
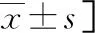
表1 各组研究对象一般资料及生理指标比较[n(%)或M(P25,P75)或
2.2血液常规和生化指标比较 平原组、高原组和返回平原组之间外周血RBC、HB、PLT差异均有统计学意义 (P<0.05);高原组、返回平原组RBC、HB高于平原组(P<0.05),且高原组最高;高原组、返回平原组PLT低于平原组(P<0.05),且返回平原组最低。高原组和返回平原组分别与平原组相比,WBC差异均有统计学意义(P<0.05),而高原组与返回平原组WBC差异无统计学意义(P>0.05);高原组NEUT水平高于平原组和返回平原组(P<0.05)。平原组、高原组和返回平原组之间相比,血清UA、TBIL、DBIL、ALT、AST、LDH水平差异均有统计学意义(P<0.05),且高原组、返回平原组血清UA、TBIL、DBIL、ALT、AST、LDH水平均比平原组高(P<0.05)。高原组和返回平原组分别与平原组相比,血清ALB、CHOL、TG水平差异均有统计学意义(P<0.05),而高原组血清ALB、CHOL、TG水平与返回平原组相比差异无统计学意义(P>0.05)。高原组血清CREA水平较平原组低(P<0.05),高原组血清GLU水平较平原组和返回平原组低(P<0.05)。见表2、表3。
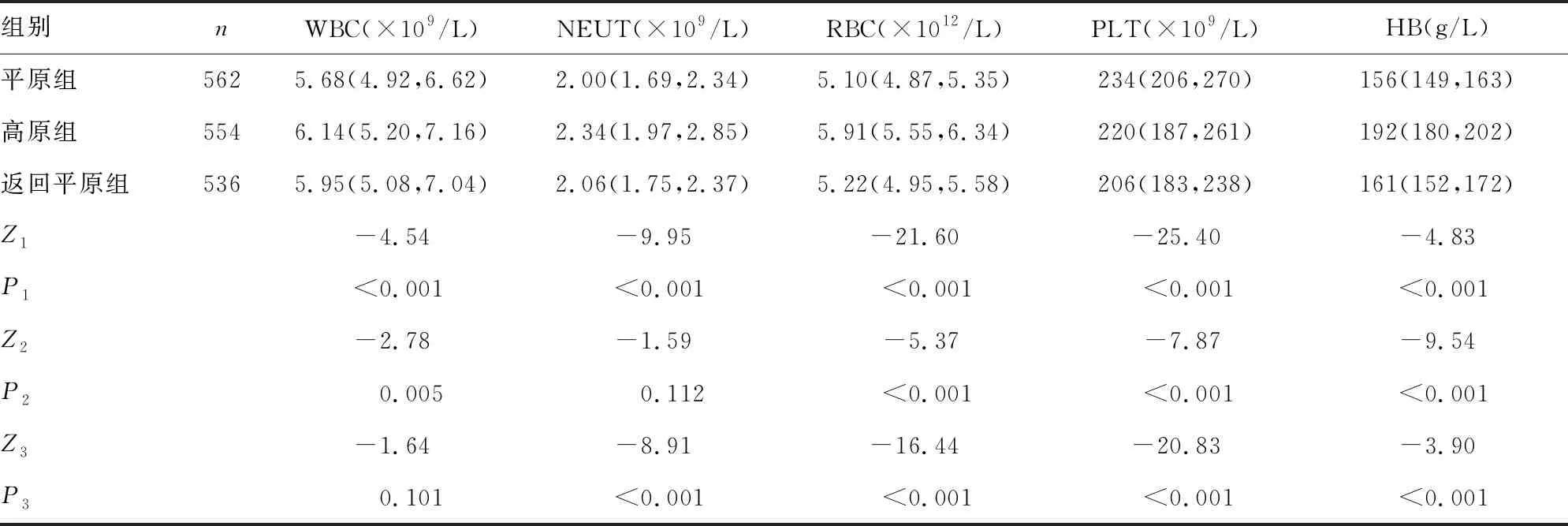
表2 各组研究对象血液常规指标比较[M(P25,P75)]
注:Z1、P1为平原组与高原组比较的统计值;Z2、P2为平原组与返回平原组比较的统计值;Z3、P3为高原组与返回平原组比较的统计值。
2.3血液炎症细胞因子指标比较 5例高原组血清标本经流式细胞仪14项炎症细胞因子筛查检测后,异常增高的炎症细胞因子是IL-6 [(13.49±8.97)pg/mL]、IL-8[(185.17±204.45)pg/mL]、IL-17A[(3.92±1.19)pg/mL]。扩大样本量验证试验共纳入平原组60例、高原组117例、返回平原组60例,分别检测了IL-6、IL-8和IL-17A水平,见表4。与平原组相比,高原组IL-6、IL-8、IL-17A水平均较高(P<0.05),返回平原组IL-6、IL-8水平较高(P<0.05);与高原组相比,返回平原组IL-6、IL-17A水平较低(P<0.05)。

表4 各组研究对象血清炎症细胞因子水平比较[M(P25,P75),pg/mL]
3 讨 论
本研究为非自身对照研究,探讨平原青年人群、移居特高海拔半年至一年青年人群和脱离高原返回平原2个月左右青年人群的机体生理、代谢、炎症免疫方面的适应性变化。针对本研究抽样纳入的高原组和返回平原组人群均为青壮年的年龄特点,平原组选择了同期健康体检的青年人群入组。3组人群抽样后一般资料可比,生理指标显示移居高原后,血氧饱和度显著下降,伴反射性心率加快、血压升高,符合高原代偿性生理反应的特征[5-7]。而脱离高原从低氧返回常氧环境,各项生理指标趋于恢复正常,其中血氧饱和度随大气氧分压的增加而升高,外周化学感受器所受缺氧刺激减弱后心率减慢、血压降低,但也偶发持续存在的高原脱习服反应症状。
高原缺氧可引发机体骨髓造血系统代偿性改变,包括外周血中RBC、HB代偿性增生,与以往的研究结果一致,可能的机制是缺氧诱导因子代偿性调控促红细胞生成素(EPO)的表达与释放,红系细胞大幅增生[8]。与此同时,外周血中WBC、NEUT轻度升高,可能与储存池细胞释放以维持机体应激状态有关[9]。低氧环境下,外周血中PLT虽略有下降,但仍在平原人群参考范围内。对于低氧如何影响PLT,目前学术界尚无统一结论,竞争所致的造血原料相对缺乏或是原因之一[10-11]。研究还发现低氧因素解除后,外周血WBC、RBC逐步下降,PLT持续走低,且返回平原2个月内上述指标仍未恢复至平原水平,主要原因是机体尚处于脱适应期,返回平原短时间内血液稀释[12],且血液学指标适应性调节变化不平行,属于高原脱习服的正常适应性反应。
高原缺氧影响机体物质代谢方面,国内外研究结论不完全一致。本研究中,研究者观察到高原组GLU明显降低,考虑与高寒高热量消耗关系密切,与贺迎春[13]、KATIE等[14]的研究结果部分一致,而蛋白及脂类变化不显著。高原组GLU、CHOL和ALB均处于较低水平可能与高原饮食和生活习惯有关。此外,高原组与返回平原组UA水平均较平原组高,也印证了以往的研究结果[15-16],原因可能是高原饮食结构改变、高嘌呤食物摄入、细胞代谢快等因素可促进UA生成;其次,低氧所致的血黏度增加使肾灌注不足[17],内环境失衡等因素可导致UA排泄障碍。本研究还观察到,移居高原人群血清肝功能指标发生一些变化,TBIL超出正常上限,ALT、AST、LDH水平显著升高;在脱离高原返回平原后,上述指标中除ALT不降反升外,其余指标均恢复至平原水平,与其他研究[18-20]结果部分一致,有差异的原因可能与不同研究针对的海拔高度和高原停留时间不同有关。
此外,高原缺氧还可诱导机体发生强烈应激反应,表现为炎症细胞因子及趋化因子所致的非感染性炎症。多项研究表明,高原移居人群外周血循环持续存在炎症细胞因子,可能导致伤口修复延迟甚至引发肺水肿或脑水肿[21-23]。然而相关炎症细胞因子种类较多,在高原习服过程中哪些炎症细胞因子异常表达,以及如何参与急慢性高原病的发生、发展,各方研究数据及观点不统一[24]。本研究发现,高原缺氧使得机体在炎症细胞因子表达方面也发生了相应改变。通过抽样筛查检测了高原组14项炎症细胞因子表达情况,发现血清IL-6、IL-8、IL-17A水平异常增高,扩大样本量验证仍然支持此发现。研究结果表明:当机体处于高原持续缺氧状态时,血清IL-6、IL-8、IL-17A水平大幅升高,表明高原缺氧后外周血循环持续存在炎症细胞因子表达。这和以往研究[25-26]结果一致,可能与机体在低氧应激状态下发生的红系代偿增殖、中性粒细胞释放等代偿性反应密切相关。目前对于返回平原人群血清炎症细胞因子变化情况的研究报道较少,本研究通过持续追踪返回平原人群炎症细胞因子变化,发现返回平原后血清IL-17A快速恢复至平原水平,而血清IL-6缓慢下降,但返回平原2个月后,IL-8仍保持与高原组相当的较高水平,可能与大量氧化物堆积所致的内皮损伤和细胞内炎症细胞因子释放有关。上述研究结果连续反映了平原人群、移居高原及返回平原3个时期的血清3项炎症细胞因子水平变化情况,但高原缺氧诱导炎症反应对机体而言是适应性保护还是病理性损伤,仍有待进一步深入探讨。
本研究尚有一定局限性,尤其是炎症细胞因子的初筛及扩大验证试验存在抽样误差,不除外遗漏其他异常指标的可能;其次,3组人群非自身对照,可能存在结果偏倚;再次,一些血液指标组间比较虽差异有统计学意义,但数值差别不明显,临床意义不显著。
综上所述,本研究通过三阶段、多指标的抽样人群调查研究,了解了特高海拔条件下人体生理、血液、代谢、炎症细胞因子等方面的代偿性变化过程,丰富了高原脱习服阶段炎症细胞因子表达变化规律,为更好地理解研究急慢性高原病、高原脱习服反应的发病机制提供了参考依据。
