NRF2信号通路在结肠癌发生、转移和耐药中的作用
2022-12-25胡思义
胡思义,王 梅,高 宁
(遵义医科大学 基础药理教育部重点实验室,贵州 遵义 563099)
据2020年统计显示,在全球常见的癌症中,结直肠癌(Colorectal cancer,CRC)是排名第三的恶性肿瘤,其癌症患者死亡率位居第二。结直肠癌又称大肠癌,可分为结肠癌和直肠癌。有研究报道西方国家近5年诊断为结直肠癌的人数达402 376例,其中结肠癌266 536例,占总数的66.2%,直肠癌135 840例,占总数的33.8%;表明结肠癌发病率远高于直肠癌[1]。同样,结肠癌在我国也是高发疾病之一,2020年中国新诊断的结肠癌占全球结肠癌的28.8%,结肠癌死亡人数占全球结肠癌死亡人数的30.6%[2]。氧化应激被认为与结肠癌的发生发展、转移和耐药密切相关。氧化应激是指机体遭受各种有害刺激时,体内高活性分子如活性氧自由基(Reactive oxygen species,ROS)等产生过多,与自身抗氧化系统的清除能力之间失衡,导致ROS累积的现象[3]。氧化应激产生的过量ROS可引起大分子如DNA、RNA、脂质和蛋白质的过度氧化,进而导致氧化损伤、癌变或细胞死亡[4]。核因子红细胞2相关因子2(Nuclear factor erythroid-derived factor 2-related factor2,NRF2)是机体主要的抗氧化调节因子,通过调节ROS的产生,调控氧化还原平衡,以维持细胞的正常功能[5]。现就氧化应激、抗氧化因子NRF2在结肠癌中的发生发展、转移和耐药方面的作用进行综述,为结肠癌的化学预防、临床治疗及改善预后提供新方向。
1 NRF2概述
1.1 NRF2结构介绍 NRF2是CNC (Cap’N’Collar)家族的成员之一,含有保守的碱性亮氨酸拉链(basic leucine zipper,bZIP)蛋白[6]。迄今为止,该家族已鉴定出6个成员,包括NFF2、NRF1、NRF2、NRF3、BACH1和BACH2。人类NFE2L2/NRF2基因定位于染色体2q31.2,包含6个外显子和14个转录本。人类NRF2蛋白全长605aa,共包含7个功能结构域,分别命名为Neh1-Neh7(见图1)[7]。其中Neh1结构域具有CNC碱性亮氨酸拉链DNA结合基序,促进NRF2与其它转录因子的DNA结合并发生二聚化。Neh2结构域位于NRF2的N端,包含7个泛素结合的赖氨酸残基,以及ETGE和DLG基序,ETGE和DLG可结合Keap1的Kelch结构域,促进Cullin 3 (CUL3)依赖的E3泛素连接酶的泛素化和蛋白酶体降解[8-9]。Neh3结构域位于NRF2的C末端,通过调节ATP酶/螺旋DNA结合蛋白6(CHD6) 促进NRF2转录活性[10]。Neh4和Neh5结构域富含酸性氨基酸残基,可与cAMP反应元件结合蛋白(CREB)的CH3结构域相互作用,激活NRF2活性[11]。Neh6结构域含有两个基序,即β-转导素重复序列蛋白(β-TrCP)的DsGIS和DsAPGS,其中DsGIS磷酸化受糖原合成酶激酶-3(GSK-3)调节,可促进β-TrCP泛素化NRF2[9]。Neh7结构域可与视黄酸X受体α相互作用,是抑制CNC-bZIP因子和NRF2靶基因转录的潜在靶点[12]。
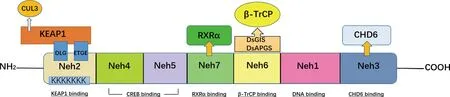
图1 NRF2结构
1.2 NRF2信号通路调控氧化应激 NRF2被认为是细胞抗氧化反应的主要调控因子之一,主要由Kelch样ECH相关蛋白1 (Kelch-like ECH-associated protein 1,Keap1)-NRF2信号通路调控。生理条件下,细胞质中的Keap1以同源二聚体形式识别NRF2,Keap1蛋白C端的kelch结构域与NRF2的Neh2结构域中的DLG和ETGE基序相互识别并结合,同时N端与CUL3相互作用,使NRF2蛋白被RBX1泛素化,被蛋白酶体降解,不能入核行使转录因子功能[13]。
氧化应激条件下,Keap1的半胱氨酸C151被氧化修饰而失去与NRF2结合的能力,使细胞质中的NRF2与Keap1解离,进入细胞核中,与Bach1竞争性地结合小Maf蛋白形成异源二聚体,识别ARE元件并激活下游靶基因的转录[14]。
NRF2主要靶蛋白包括醌氧化还原酶(Quinoneoxi-doreductase1,NQO1)、谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)、血红素加氧酶-1(Hemeoxygenase1,Hmox1,HO-1)、谷氨酸半胱氨酸连接酶(Glutamate-cysteine ligase catayticsubunit,GCLC)等[15-16]。NRF2靶蛋白在调控氧化还原稳态、药物代谢和排泄、能量代谢、铁代谢、氨基酸代谢、生存、增殖、自噬、蛋白酶体降解、DNA修复和线粒体生理等方面均发挥重要作用[5]。
2 氧化应激与肿瘤发生
氧化还原稳态是维持正常细胞存活和行使功能的基础。活性氧含量不同诱导不同的生物反应,适量ROS可维持细胞增殖和分化的信号分子,而过量的ROS则引起细胞成分受到损害,如DNA、蛋白质和脂质大分子等[17]。ROS包括超氧化物、羟基自由基以及非自由基分子,如过氧化氢(H2O2),这些分子主要来自线粒体、过氧化物酶体和内质网(ER)中的各种代谢反应所消耗的氧气[18]。
氧化应激与肿瘤的发生发展密切相关,主要与ROS含量相关,ROS可促进NRF2入核激活其下游靶基因的转录,调控肿瘤细胞生长、进展和耐药等;相反,NRF2激活可中和细胞内的ROS,恢复氧化还原平衡[19]。低中等水平的ROS可作为信号分子,促进基因组DNA突变来促进肿瘤形成。例如,ROS可通过激活丝裂原活化蛋白激酶(MAPK)和细胞外信号调节激酶(ERK)的磷酸化,增加细胞周期蛋白D1(Cyclin D1)表达或抑制JUN N末端激酶(JNK)的磷酸化促进肿瘤细胞的生长[20-21]。而高水平的ROS可导致细胞损伤并诱导细胞死亡。许多抗肿瘤药物通过促进ROS生成或抑制NRF2,进而促进肿瘤细胞死亡。例如,有研究发现阿帕替尼促进ROS产生,抑制NRF2和p62的表达,诱导非小细胞肺癌的自噬和凋亡[22]。Xie等[23]研究发现鸦胆子苦醇促进线粒体产生ROS,抑制NRF2介导的抗氧化反应,促进非小细胞肺癌细胞凋亡。此外,Roh等[24]发现青蒿琥酯通过降低细胞GSH和增加脂质ROS水平来诱导头颈部癌症细胞的死亡,同时抑制NRF2-ARE通路可以增加肿瘤细胞对青蒿琥酯的敏感性。
氧化应激被认为与肿瘤驱动密切相关,而NRF2是氧化应激的重要调控因子,一方面,NRF2与癌症预防和治疗相关,发挥抗癌作用;另一方面,NRF2过度激活可能为肿瘤细胞提供重要的生存环境,保护肿瘤细胞免受氧化应激、化疗或放疗的杀伤作用,有利于肿瘤的发生发展[25]。因此,NRF2的正常激活或过度激活决定了其在癌变中的双重作用。
3 NRF2与结肠癌发生
3.1 NRF2在肿瘤发生中的作用 NRF2通常被认为是细胞保护、细胞防御和细胞存活的主要转录因子。因此,传统观点认为NRF2是肿瘤抑制因子。有研究表明,NRF2缺陷小鼠更易致癌,NRF2缺失与肿瘤转移密切相关。然而,近年来越来越多的研究证明NRF2激活并不是对所有肿瘤都有利,NRF2不但促进正常细胞存活,也促进肿瘤细胞存活和化疗抵抗,也就是NRF2具有的“阴暗面”,即促进肿瘤细胞恶化。肿瘤细胞中过度激活NRF2可为肿瘤细胞创造适宜的生存环境,降低了肿瘤细胞化疗或放疗的敏感性[26]。因此,NRF2对肿瘤生长具有“双刃剑”作用。
一方面,NRF2具有抑制肿瘤生长的作用。电离辐照可增加正常的人肺成纤维细胞致癌风险,而叔本丁琨可激活NRF2,降低电离辐射引起肺成纤维细胞的DNA双链损伤(DNA double-strandbreaks,DSB),从而降低肺癌发生风险[27]。近期研究报道,与野生型小鼠相比较,将Lewis肺癌细胞系植入NRF2缺陷小鼠体内,出现更多的肺转移结节,形成转移性肺癌[28]。此外,肿瘤微环境中激活NRF2也可通过增强对肿瘤免疫应答来抑制肿瘤的发生及发展。在Keap1-wt肺癌异种移植瘤模型中,利用NRF2诱导物Bardoxolone处理可诱导NRF2表达,减少肺转移灶的数量[29]。
另一方面,NRF2具有促进肿瘤生长的作用。近年来研究发现NRF2在多种肿瘤中高表达,并发挥促肿瘤生长的作用。NRF2通过调控细胞增殖相关的基因表达,影响肿瘤细胞增殖。如NOTCH1、NPNT、BMPR1A、IGF1、ITGB2、PDGFC、VEGFC、JAG1和AP-1等基因[30-31],其中AP-1不仅是细胞增殖的重要调节因子,也是多种致癌信号传导所需的因子[32],NRF2基因的启动子中包含AP-1结合的TPA响应元件TRE[33],NRF2可通过启动AP-1的转录表达调控肿瘤细胞增殖和致瘤性。此外,NRF2受原癌基因的转录调控,如KRASG12D、BRAFV619E和MYC等原癌基因均可增加NRF2的转录,促进肿瘤细胞生长和增殖。在K-Ras (G12D)驱动的胰腺癌和肺癌中,基因靶向NRF2信号通路可降低体内K-Ras(G12D)诱导的细胞增殖和致瘤性[34]。在PTEN突变的细胞中,激活磷脂酰肌醇3-激酶(PI3K)-AKT和NRF2信号通路活性,促进细胞增殖和致瘤性。此外,肿瘤细胞快速生长和增殖需要高能量和合成代谢,丝氨酸生物合成是多种代谢途径的中间体,而NRF2是丝氨酸生物合成的重要调控因子,有研究报道,NRF2可以通过激活ATF4(activation of transcription factor 4)调控丝氨酸/甘氨酸生物合成酶基因PHGDH,PSAT1和SHMT2的表达,促进谷胱甘肽和核苷酸的合成,进而促进肿瘤细胞增殖[35]。
3.2 NRF2对结肠癌发生发展的影响 NRF2在结肠癌细胞中同样发挥“双刃剑”作用。一方面,激活NRF2可以降低结肠癌发生。在结肠细胞中,激活NRF2可通过减少氧化应激产生的基因毒性损伤,保护结肠细胞免受损伤,从而抑制结肠癌演进[36]。有研究报道,结肠细胞暴露于葡聚糖硫酸钠(DSS)可诱导结肠癌发生,而加入Keap1-NRF2 PPI信号通路抑制剂CPUY192018,可激活NRF2降低溃疡性肠炎转化为结肠癌的风险[37]。另外,洋地黄黄酮可通过p38 MAPK激活NRF2,促进NRF2核转位,诱导下游II相解毒酶的表达,保护结肠细胞免受氧化应激的损伤,降低AOM-DSS诱导结肠癌发生率[38]。相反,沉默NRF2可导致环氧化酶COX2表达降低,增加结肠组织中异常隐窝数量,促进腺瘤、腺癌发生,最终导致结肠癌形成[39]。此外,有研究将NRF2基因敲除小鼠和正常表达NRF2基因的小鼠同时暴露于溃疡性结肠炎诱导剂DSS或结肠癌诱导剂AOM中,观察两组小鼠结肠癌发生风险,研究结果显示,NRF2基因敲除小鼠暴露于DSS或AOM出现脱垂、直肠出血、炎症,并增加异常隐窝数量[40-41],表明NRF2敲除更易发生结肠炎或结直肠癌[42]。
另一方面,NRF2过表达可促进结肠癌的发生发展。有研究发现,结肠细胞受到氧化应激,产生过量的ROS,诱导NRF2过度表达,导致结肠组织炎症并促进结肠癌发生[43]。Arlt等[44]研究发现,结肠癌细胞中高表达NRF2,同时增加蛋白酶体亚基蛋白S5a/PSMD4和α-5/PSMA5的表达,增加蛋白酶体活性,为癌细胞提供抗凋亡保护和有效清除异常蛋白,促进结肠癌发生。Sebens等[45]发现M1型巨噬细胞与结肠上皮细胞共培养,可以激活结肠上皮细胞中NRF2的表达和蛋白酶体活性,使结肠细胞对细胞凋亡产生抵抗,促进炎症致癌作用,增加结肠癌发生风险。此外,结肠癌细胞中过表达NRF2,可通过ERK和AKT信号通路促进结肠癌进展[46]。
3.3 NRF2在结肠癌转移中的作用 NRF2与肿瘤转移密切相关。已有研究表明,NRF2是肿瘤转移的潜在标志之一。肿瘤转移,即癌细胞从原发部位向继发部位的扩散,是癌症治疗的重点,也是导致肿瘤患者死亡的关键因素。即癌细胞失去与邻近细胞之间的联系,经历上皮-间质转化(epithelial-mesenchymal transition,EMT)并迁移[47],克服失巢,通过间质-上皮转化(mesenchymal epithelial transformation,MET),恢复上皮表型,在新的位置“播种”,转移的癌细胞既可保持休眠状态,也可恢复增殖发展为继发性肿瘤[48]。而NRF2与EMT发生密切相关,在EMT过程中,上皮细胞降低黏附蛋白E-cadherin表达,同时增加N-cadherin表达,促进癌细胞发生转移[49],有研究报道,抑制NRF2可增加E-cadherin表达,同时降低N-cadherin表达,促进EMT并抑制肝癌的侵袭和转移[33]。同时,Wakabayashi等[30]发现沉默NRF2可下调其靶基因NOTCH1表达,增加E-cadherin表达,降低了N-cadherin表达,从而抑制肿瘤转移。
NRF2在肿瘤转移中可通过直接影响转移相关蛋白的表达调控肿瘤细胞转移,也可通过影响转移相关信号通路调节肿瘤细胞转移。一方面,NRF2可通过调节基质金属蛋白酶MMPs分泌,调控肿瘤细胞侵袭与转移。肿瘤转移早期,基底膜阻止转化细胞向下层间质浸润,发挥屏障作用。基底膜是一种特化的细胞外基质(extracellular matrix,ECM),由分泌蛋白和多糖组成,可阻止肿瘤发生转移[50]。当肿瘤细胞分泌MMPs,破坏基底膜,肿瘤细胞即可发生侵袭与转移[51]。而NRF2是调控肿瘤细胞分泌MMPs的重要因子,Shen等[52]研究发现下调NRF2可抑制MMP2分泌,同时增强E-cadherin表达,抑制食管鳞状细胞癌细胞转移和侵袭。此外,Zhang等[53]研究揭示NRF2在人肝癌细胞中高表达,并促进MMP-9分泌,促进人肝癌细胞侵袭与转移。另一方面,NRF2可通过影响转移相关信号通路调节肿瘤细胞转移。例如,NRF2可通过增强RhoA/ROCK信号通路促进乳腺癌细胞增殖和转移。Lignitto等[54]发现NRF2可通过抑制血红素和Fbxo22介导Bach1降解,促进肺癌细胞转移。
NRF2在高侵袭性的结直肠癌组织中高表达,其表达与Duke分期和临床预后呈正相关,是结肠癌预后的重要标志物[55]。NRF2可通过调控血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体调控结肠癌转移。新生血管生成对结肠癌组织生长有重要作用,在结肠癌早期和晚期(转移)VEGF和VEGFR活性均较高,而VEGF家族蛋白和受体可触发多个信号网络,引起内皮细胞存活、有丝分裂和迁移[56]。有研究发现抑制NRF2可阻断结肠癌细胞在缺氧条件下累积HIF-1α,抑制VEGF和HIF-1α的靶基因表达,同时降低了小鼠异种移植瘤的生长和血管生成[44]。目前,抗VEGF/VEGFR治疗是转移性结肠癌治疗的重要手段,可改善结肠癌患者的无进展生存期(FPS)和总体生存期(OS)。例如,贝伐珠单抗(Bevacizumab)是一种重组人源化、人鼠嵌合抗VEGF单克隆抗体,是FDA批准的第一个用于转移性结直肠癌的VEGF靶向药物[46]。而氧化应激重要调控因子NRF2是VEGF和HIF-1α的重要调节因子,因此,抑制NRF2可在结肠癌的转移中起抑制作用,可能成为转移性结肠癌治疗的潜在靶点。
3.4 NRF2在结肠癌化疗耐药中的作用 化疗是临床治疗肿瘤的经典手段之一,主要通过药物的细胞毒性作用抑制肿瘤的发生发展,然而长期使用化疗药物常导致肿瘤细胞产生化疗耐药,从而影响肿瘤治疗效果。NRF2作为氧化应激的重要转录调控因子,可以保护细胞免受氧化应激、化学药物的毒性损伤。但越来越多研究报道表明,NRF2持续过表达引起癌细胞对化疗药物(包括阿霉素、依托泊苷和顺铂等)的耐药性增强[57]。表明NRF2是肿瘤耐药的重要转录因子。
目前临床上治疗结肠癌最常用的化疗药物是5-氟尿嘧啶(5-FU),但由于结肠癌对5-FU产生了耐药性,大大降低了其临床治疗效果。5-氟尿嘧啶会产生活性氧(ROS)引起氧化损伤,从而导致癌细胞死亡。然而,在结肠癌亚群中有一种称为肿瘤干细胞(CSCs)的癌细胞亚群能够对ROS产生细胞适应性反应,从而抵消5- FU诱导结肠癌细胞氧化损伤[58],这与NRF2激活密切相关,NRF2激活引起抗氧化酶上调,增加癌细胞对5-FU的耐药性[59]。有研究发现,FoxO3过表达增加结肠癌细胞SW620和HCT-8对5-FU的敏感性,且FoxO3可通过抑制NRF2/TR1信号通路逆转人结直肠癌细胞对5-FU的耐药性[60]。此外,Kang等[61]发现结肠癌中5-FU耐药性机制与DNA去甲基化等表观遗传修饰上调NRF2和HO-1表达有关。通过比较抗5-FU的结肠癌细胞系SNUC5中NRF2诱导相关的表观遗传变化,得出SNUC5/5-FUR细胞中NRF2表达、核易位和与启动子的结合均高于SNUC5细胞,进一步通过siRNA介导的NRF2或HO-1敲低,可显著抑制结肠癌细胞在体外和体内的生长,从而增强了其对5-FU的敏感性。
NRF2在促进结肠癌其它化疗药物的耐药性也起关键作用。抑制NRF2可显著增加奥沙利铂诱导的结肠癌细胞凋亡,降低SW480/Res细胞迁移[62]。此外,NRF2可通过诱导蛋白酶体活性,降低NCM460或Colo320细胞对TRAIL/依托泊苷的敏感性,从而减少所引起的细胞凋亡,且组织免疫染色进一步证实了炎症区域内结肠上皮中NRF2处于激活状态,以及蛋白酶体表达增高[63]。以上研究表明NRF2对结肠癌化疗耐药产生具有重要的影响。
4 展望
结肠癌治疗主要以手术切除为主,辅助放疗和化疗手段,但结肠癌一旦发生转移,放化疗即为主要治疗手段,但其治疗疗效甚微,因此,针对转移性结肠癌的研究是临床亟需解决的问题。已有研究表明NRF2在结肠癌肿瘤发生、转移和耐药等方面具有重要作用。基于NRF2作为肿瘤的重要标志物,且在肿瘤中具有“双刃剑”作用,NRF2是否可以作为转移性结肠癌预防和治疗靶标,需进行深入研究。此外,目前针对NRF2信号通路的化合物对结肠癌发生发展、转移和耐药方面的作用,需深入探讨其具体分子机制。本课题组研究发现,中药单体沙蟾毒精可通过抑制原癌基因c-MYC降低NRF2抗氧化通路活性,有效抑制结肠癌肺转移。随着NRF2在结肠癌发生发展中的作用机制的深入研究,为针对NRF2作为潜在靶标的结肠癌预防和治疗提供新途径。
