屏障环境中IVC小鼠饲养微环境控制方法研究
2022-12-23龚光彩贺习之陈盟君余望贻
龚光彩 贺习之 陈盟君 陈 湘 彭 佩 余望贻
(1 湖南大学土木工程学院 长沙 410082;2 湖南中医药大学实验动物中心 长沙 410208)
实验动物作为生命科学研究必备的基本条件,对生物工程、生物医学等领域均起到重要作用[1]。大部分实验动物受室内环境因素变化影响较大,如室内气流速度过大会增加实验动物表面散热量,而温湿度、氨气质量浓度等参数若不控制在相应适宜范围内也会影响实验动物的生长繁殖,因此必须控制实验动物的饲养环境使环境因素对实验的影响最小化[2-3]。实验动物房作为实验动物繁育、饲养、实验的地点,其环境的控制不仅关系到实验动物的福利及身心健康,更是保障实验数据可靠性和可重复性的关键,对生命科学实验研究的结果和水平具有深远影响[4-7]。在新冠疫情期间,通过实验动物对不同模式的生物体进行临床前研究将为开发疫苗、测试治疗药物的安全性和有效性提供重要参考依据,为提高实验精度,饲养环境控制的重要性尤为突出[8]。
我国SPF级(清洁实验动物和无特定病原体)实验小鼠普遍饲养在屏障环境下的独立通风笼具(independent ventilation cage,IVC)中。IVC系统由控制主机、笼架、笼盒和独立送排风系统组成,各独立密闭笼盒自带送排风接头,独立送排风系统将空气过滤后分别送入笼盒中[4],从而为实验动物提供相对密闭稳定的饲养环境。该系统具有避免盒与盒之间或动物与人之间的交叉污染、维护实验动物福利、经济节能等优势[9-10]。
IVC系统将笼盒内环境与实验室大环境即外环境隔离,其中与实验动物的饲养质量关系更为密切的是贴近实验动物周围或实验动物主要活动范围内的环境,该环境可被理解为一种面向对象的目标微环境,也被称为实验动物饲养微环境[11]。微环境中各项重要指标的控制仍主要依赖于室内大环境和净化空调系统的调节作用[12],而实际使用中,IVC净化空调系统会同时对笼盒内环境和外环境进行调控[13-14]。因此,本文旨在针对IVC饲养微环境的控制方法进行研究以对现有实验动物房净化空调系统性能的提升提供思路。
为研究IVC饲养微环境的控制方法,国内外众多学者从换气次数、温湿度、氨气质量浓度、垫料种类等方面进行了大量研究[15-17]。已有研究多采用对笼内参数直接测量的方式,很少结合现场应用的笼盒采用针对内部饲养微环境的模拟和测试方法。现有主要测量方式如下:1)打开笼盒迅速将仪器放入笼盒内测量;2)检测仪的检测端口通过饮水瓶瓶嘴孔进入笼盒测量或提前在笼盒上开孔使检测端口进入笼盒测量[12,18-19]。综上可知,由于IVC饲养微环境的特殊性,难以在不破坏笼盒内流场并尽量减少对实验动物干扰的情况下测量IVC饲养微环境内各参数的具体分布。此外,现有研究多为针对同一笼盒的不同指标进行测量,较少考虑同一系统中不同笼位对饲养微环境的影响。因此,本文针对上述问题,对湖南省某高校实验动物中心一间SPF级实验动物房实际饲养小鼠时的独立通风笼盒内的饲养微环境特性进行模拟研究;并与实验方法相结合,在辅助模型搭建和模型验证外进一步研究饲养微环境与外环境的关系。
1 研究对象
1.1 实验场地
本文以湖南省某高校实验动物中心一间SPF级实验动物房[SYXK(湘)2019-0009]为实验场所。实验动物房各项目参数如表1所示,平面布置如图1所示。实验动物房外环境采用吊顶中央送风底部四角回风的气流组织形式,内部摆放4台IVC笼架,每台配置8×8个笼位。

表1 实验动物房各项目参数Tab.1 Parameters of each item of laboratory animal room

图1 实验动物房平面布置Fig.1 Arrangement of the laboratory animal room
1.2 IVC净化空调系统
IVC净化空调系统流程:室外空气经净化空调箱处理送入总风管后分成两路,一路送入各实验动物房外环境,一路增压后送入IVC笼架的送风管,由笼盒盖静压窗送至笼盒内;同理,笼盒内的排风和外环境排风经增压后进入总排风管。IVC饲养间采用全膜终端式过滤,饲养间自带的外环境温湿度及压差监控仪表布置于门口处。
1.3 实验动物
实验动物为购于湖南斯莱克景达实验动物有限公司的SPF级KM雄性小鼠25只[SCXK(湘)2019-0004],体重为18~25 g。实验小鼠养于5个IVC笼盒内,每笼5只,正常饲养喂水。另加一空态笼盒为空白对照组,除不饲养动物外与其他5个笼盒配置保持一致。6个笼盒全部放置于笼架4由下至上第五层的笼位中。
2 研究方法
2.1 饲养微环境的数值模拟方法
2.1.1 几何模型建立
该笼盒模型以实验动物房实际应用的FENGSHI GROUP的FS-003-1号小鼠笼盒为参考,尺寸为0.38 m×0.18 m×0.18 m(长×宽×高),实体主要由塑料底盖、盒盖、钢丝网盖及饮水瓶组成,采用上送上回的气流组织形式。模型中不考虑饮水口的大小及不锈钢网盖对气流阻拦作用,简化模型如图2所示。为建立小鼠模型,以KM小鼠为参考,根据体型特征和计算表面积建立了多种模型,兼顾网格质量及计算时间后最终采用的小鼠模型如图3所示。
图2 IVC笼盒简化模型Fig.2 Simplified model of IVC
图3 KM小鼠简化模型Fig.3 Simplified model of KM mice
2.1.2 实验室小鼠传热分析方法
实验室小鼠与环境不断进行能量交换以保证体内热量的动态平衡。与人体散热相似,小鼠主要散热方式包括辐射散热、对流散热、蒸发散热、排泄散热。由于小鼠的排泄量较少,又因长期生活在铺有厚垫料的笼盒内,小鼠体表可看作毛发和空气,因此排泄散热和辐射散热可忽略。热平衡方程如下[20]:
Q=Qc+Qe
(1)
式中:Q为全散热量,W;Qc为对流散热量,W;Qe为蒸发散热量,W。
由于小鼠表面真实流态速度场复杂,模拟中简化为平均散热模型,由式(2)计算自然对流与受迫对流的综合对流换热表面传热系数hc(W/(m2·℃))[20]:
(2)
式中:hnc为自然对流换热表面传热系数,W/(m2·℃);hfc为受迫对流换热表面传热系数,W/(m2·℃)。根据GB 50447—2008《实验动物设施建筑技术规范》[21]规定的动物实验区环境指标范围,一般情况下小鼠表面风速与环境的温差分别小于0.2 m/s、15 ℃,宜采用Winslow和Rapp的经验公式[20]。通过计算得到综合对流换热表面传热系数约为5.56 W/(m2·℃)。
对于蒸发散热部分,小鼠无汗液蒸发散热量,仅有呼吸散热量,计算如下[22]:
Qe=0.017 3M(5.867-pa)+0.001 4M(34-ta)
(3)
式中:M为小鼠的代谢量,W,可与人体代谢量进行换算[21];pa为环境空气中的水蒸气分压力,Pa;ta为小鼠附近空气温度,℃。
根据 Meeh-Ruhuer式计算小鼠的散热体表面积[23]:
A=KW2/3/1 000
(4)
式中:A为体表面积,m2;K为常数,随动物不同而不同;W为质量,g,小鼠的质量约为20 g[21]。通过计算得到小鼠的体表面积为0.006 9 m2。
2.1.3 饲养微环境模拟方法及边界条件
本文采用RNGk-ε湍流模型进行模拟,SIMPLE压力速度耦合算法求解。控制方程为连续性方程、动量守恒方程、能量守恒方程。以氨气作为污染物,考虑氨气密度与空气的差异,竖向加速度设置为-9.8 m/s2。
通过前期调查与实验测量,IVC笼盒的边界条件设置如下:
1)笼盒换气次数常用送风风速进行计算[24],因此用笼盒送风风速代表不同的换气次数。经实验测量笼架不同位置处送风风速的变化范围在2.79~4.94 m/s之间,因此主要模拟了送风风速为2.79、4.94 m/s的笼盒状态以对比不同换气次数下的饲养微环境;出风口为自然边界条件。
2)送风温湿度根据测量结果设置为23 ℃、30%。
3)仅考虑笼盒内部的传热传质,笼盒周围壁面作为绝热壁面处理。
4)小鼠散热模型采用生物传热模型,表皮温度为37 ℃且均匀散热。
5)通过实际观察,由于实验期间垫料不进行更换,小鼠频繁活动会使小鼠粪便充分混合于垫料中并使笼内各处垫料厚度趋于一致,因此把垫料面作为均匀稳定散氨源。
污染物边界条件采取根据通风量和质量浓度推算源散发量的方法,全面通风换气次数计算如下[25]:
(5)
式中:L为全面通风量,m3/s;KS为安全系数,通常取3~10,为讨论最不利于氨气稀释排放的情况,本文取3;qm为氨气散发量,mg/s;C0为送风空气中氨气质量浓度,mg/m3,因采用全新风,取0;C为稳定时室内氨气质量浓度,mg/m3,根据美国国立图书馆提供的实验数据,0.23 m×0.45 m×0.165 m(长×宽×高)的通风笼盒内饲养两只小鼠,送风量为56 L/min,平衡后氨气质量浓度维持在0.23 mg/m3[25]。通过计算得到每只小鼠的氨气散发量为3.5×10-5mg/s,垫料面氨气散发量为1.8×10-4mg/s。
2.1.4 网格划分及网格无关性验证
模拟采用ICEM软件绘制模型和生成非结构化网格,用FLUENT软件进行计算。为进行网格无关性验证,正式计算前选择903 658、1 275 275、1 734 664三种网格密度不同的网格试算,并在小鼠附近和笼盒上部设置不同监测点检测风速,结果表明,903 658、1 275 275两种网格试算后监测点风速最大相对误差为7.63%,1 275 275和1 734 664两种网格最大相对误差为1.33%,计算结果接近,因此正式计算选择的网格数为1 275 275。
2.2 饲养微环境的实验测量方法
该实验按照3R原则进行,经实验动物中心伦理委员会审批[LLBH-202101050001]。对IVC饲养间的笼内送风风速、温湿度环境特性以及氨气质量浓度分布特性等参数进行实测。小鼠饲养前3天为适应性喂养,期间不进行实验。
笼盒内外测点布置如图4所示,由图4可知,温湿度和氨气质量浓度的笼盒内测点位置选取在笼盒内上部空间以避免小鼠抓咬。笼盒外根据与笼具距离不同选择两组测点,设于笼盒外表面的测点为近处外环境测点,外环境4个回风口处测点为远处外环境测点。实验所用器材与测量方法如表2所示。
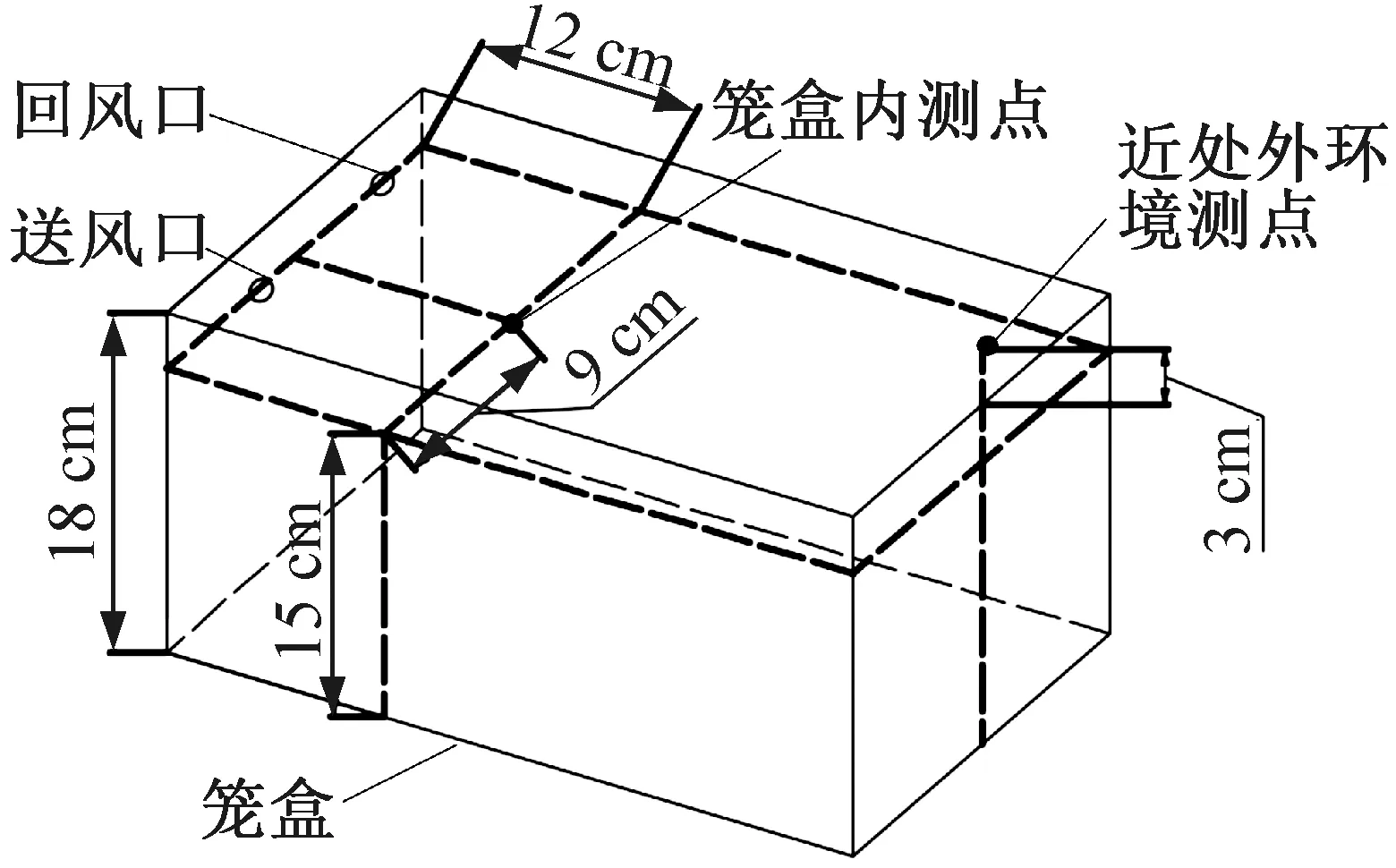
图4 笼盒内外测点布置Fig.4 Layout of measuring points

表2 实验仪器及测量方法Tab.2 Experimental instruments and measurement methods
3 结果与分析
3.1 模型验证
为验证模型有效性,以实验中5个饲养小鼠的笼盒日平均送风风速为参考,利用所建模型对笼盒内温度场进行模拟计算,并将笼盒内温度测点的模拟数据与实验值进行对比,对比结果如表3所示。误差应是由笼盒壁面进行绝热假设引起的,该模型满足误差要求,具有较好的适用性。在实际的实验动物房运行维护中仍使用摄氏温度进行调控,因此后续温度模拟和实验结果均换算为摄氏温度表示。
为进一步验证笼盒内饲养微环境温度场分布模拟结果,利用红外热像仪拍摄小鼠在自由活动状态下的热成像图,如图5所示。送风风速为3.50 m/s,距离笼盒底部0.03 m处的模拟结果如图6所示。由图5、图6可知,自由活动时小鼠的表面温度约为37 ℃,小鼠附近即饲养微环境温度约30.9 ℃,均与模拟结果接近。

表3 笼内测点模拟值与实测值对比Tab.3 Comparison of simulated and experimental values for temperature measuring points

图5 小鼠自由活动时温度分布Fig.5 Temperature distribution during free movement in mice

注:图中空白处为KM小鼠截面(下同)。图6 温度分布云图(z=0.03 m)Fig.6 Temperature distribution (z=0.03 m)
3.2 饲养微环境的风环境分析
3.2.1 饲养微环境的风环境模拟结果
IVC小鼠饲养微环境的风环境模拟结果如图7和图8所示。送风口侧和回风口侧的笼盒截面分别对应x=0.15 m、 0.03 m截面。由图7、图8可知,不同送风速度下主流区域的速度分布相似,笼盒下部的气流漩涡碰到小鼠表面上移。送风风速为2.79 m/s(实测最小送风风速工况)和4.94 m/s(实测最大送风风速工况)时笼盒内的平均风速分别为0.14 m/s和0.24 m/s;送风风速为2.79 m/s时送风口截面和回风口截面的平均风速分别为0.28 m/s和0.11 m/s,相差60.7%;送风风速为4.94 m/s时送风口截面和回风口截面的平均风速分别为0.47 m/s和0.20 m/s,相差57.4%。位于送风口侧的小鼠周围气流速度显著高于回风口侧的小鼠。
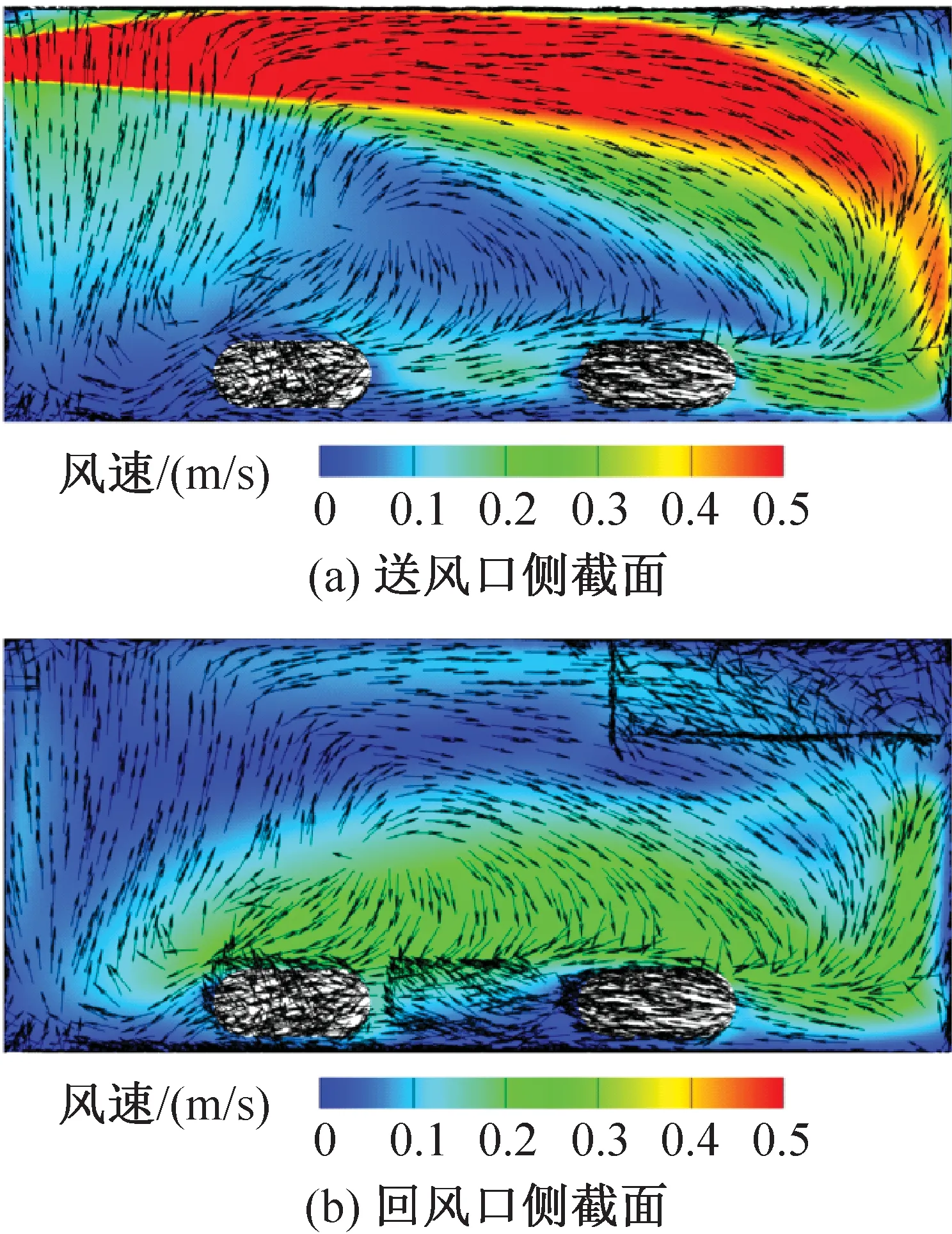
图7 送风速度为2.79 m/s时笼盒内气流速度云图Fig.7 Velocity distribution at speed of 2.79 m/s
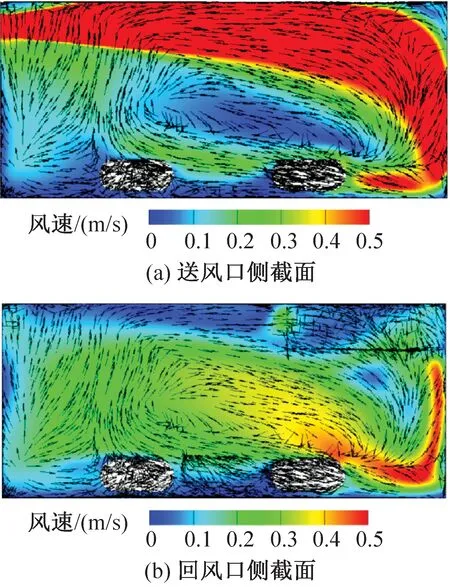
图8 送风速度为4.94 m/s时笼盒内气流速度云图Fig.8 Velocity distribution at speed of 4.94 m/s
上送上回的气流组织形式还易使笼盒上部及小鼠背部形成高风速区,当送风速度为4.94 m/s时,小鼠背部一侧的部分风速达到0.3 m/s以上,已经超过标准规定的0.2 m/s。在实际的实验观察中,小鼠也更倾向于待在笼盒的前侧,即风速较低的区域。
3.2.2 斜体饲养微环境的风环境实测结果
IVC系统各笼盒内饲养微环境送风风速如图9所示,实验期间送风风速总体变化范围在2.79~4.94 m/s之间,笼盒日平均送风风速变化范围在2.85~3.57 m/s之间。由于IVC净化空调系统对饲养微环境和外环境分别加压送风,微环境送风风速基本不受外环境支路波动影响,而受系统特性的影响较大。由图9可知,随着笼位垂直高度增加,笼盒的送风风速逐渐增大;笼架同一层内,与主风管距离不同的笼盒送风风速也存在差异,这与笼架送风管道的布置形式造成的垂直和水平气力(水力)失调有关。饲养微环境的送风风速直接影响单个笼盒的送风风量或换气次数,进而影响动物的健康和行为[26]。在实际应用中,定期将位于笼架不同高度处的笼盒调换位置,从消除风环境对实验动物的影响的角度,该行为措施具有一定合理性。

图9 同一IVC系统中不同位置处笼盒送风风速Fig.9 Air supply speed of cage at different positions in the same IVC system
结合模拟与实验结果,在设置IVC空调系统换气次数时,应以所有笼盒中两个空气分布最不利处的情况为准,即因气力(水力)不平衡造成的送风风速过大处和风速过小处,保证其维持最小换气次数要求的同时兼顾笼内气流组织分布。目前调节IVC笼具内送风风量主要是通过改变系统总风量或对同一IVC笼架的送风量[27],而缺少对各个笼盒的调控装置。建议增设笼盒送风口的入口调节装置以调节水力平衡、改善气流组织,减小不同位置笼盒内饲养微环境的差异。
3.3 饲养微环境的热环境分析
3.3.1 饲养微环境的热环境模拟结果
图10、图11为两种送风风速下的IVC饲养微环境的温度分布模拟结果。送风速度为 2.79、4.94 m/s 时笼盒内平均温度分别为 27.8、27.6 ℃。
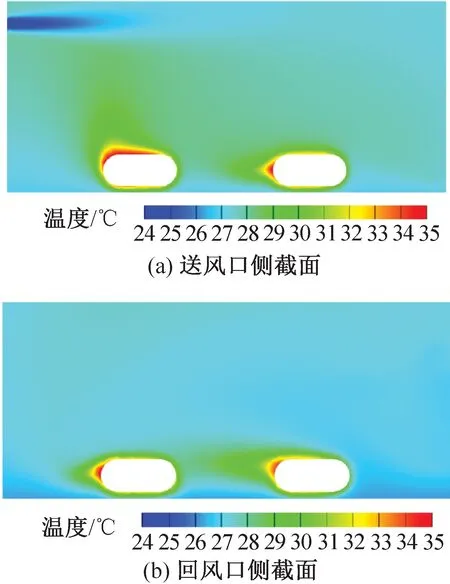
图10 送风速度为2.79 m/s时笼盒温度云图Fig.10 Temperature distribution at speed of 2.79 m/s
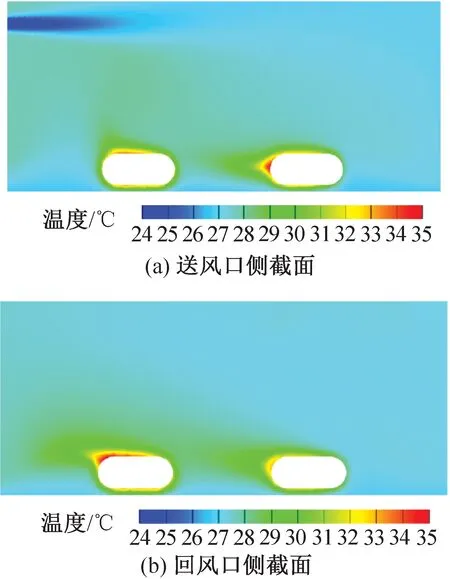
图11 送风速度为4.94 m/s时笼盒温度云图Fig.11 Temperature distribution at speed of 4.94 m/s
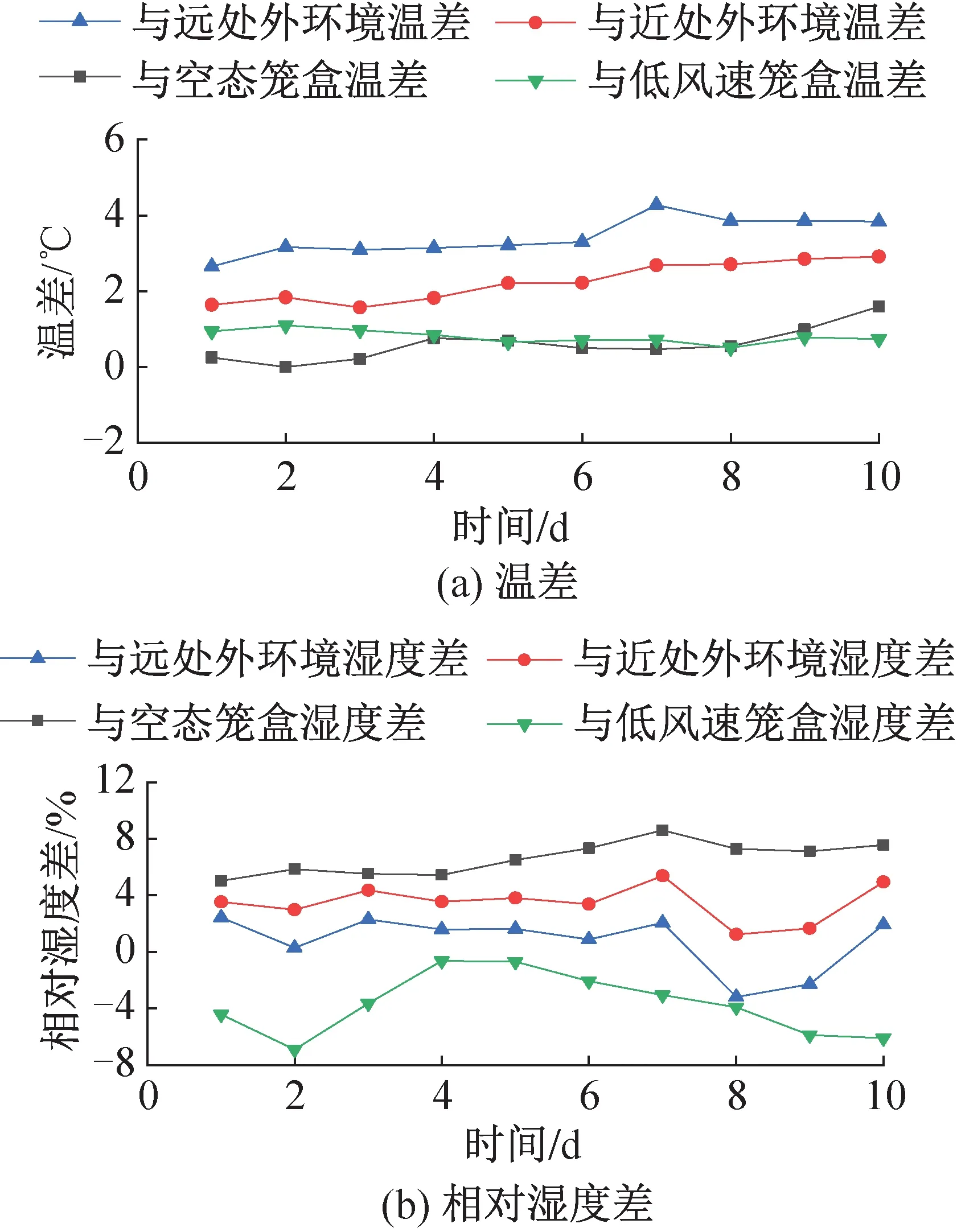
图12 高风速笼盒内外温湿度差变化特性Fig.12 Differences of temperature and relative humidity between microenvironment and macroenvironment at high air supply speed
结合气流速度云图可知,风速场对温度场的分布影响较大,风速较大的区域温度一般较低,涡漩处可能造成局部高温,导致温度分布不均。主流气流碰撞到笼壁返回造成小鼠下侧温度较低,但实际笼盒底部粗糙的垫料能有效保温并分散气流,因此小鼠下侧的温度降低不显著。
3.3.2 饲养微环境的热环境实测结果
图12、图13所示为饲养实验动物的5个笼盒中日均送风风速最高和最低的两个笼盒(日均送风风速为3.57、2.85 m/s)分别与空态笼盒、近处外环境、远处外环境和两笼盒彼此之间的温湿度差值随时间的变化。笼盒外表面附近即笼盒近处外环境测点与回风口处即笼盒远处外环境测点的平均温度分别为23.7、22.5 ℃,实验期间最高相对湿度分别为53.8%、57.1%。所有笼盒内部温湿度最高可达到27.0 ℃、54.0%。虽然IVC空调系统对笼盒内的送风湿度仅为30%,但由于小鼠自身的散湿量和饮水瓶滴水蒸发,笼盒内湿度可以保持在40%~50%之间,符合规范要求。
实验期间所有实验笼盒内部与笼盒近处外环境的温湿度差最高可达3.6 ℃、11.0%,饲养微环境与外环境差异显著,且由图12、图13可知,离笼盒越远,外环境与饲养微环境的温度差越大,而湿环境差的变化则相反。但饲养间自带仪表仅能检测外环境固定测点的参数,不能反映实验动物实际生活区域的饲养微环境状况,也不能准确描述外环境参数分布。因此,从提高饲养微环境控制精度、保护实验人员安全的角度出发,有必要对IVC系统外环境和饲养微环境提出更高的指标检测要求。
实验期间所有实验笼盒内部与空态笼盒的温湿度差最高可达2.7 ℃、18.0%,由图12、图13可知,由于风速引起的温度差异与是否饲养小鼠引起的温度差异接近,在实际应用中送风风速对饲养微环境的温度分布影响可能与小鼠的影响相当,应给予充分考虑。
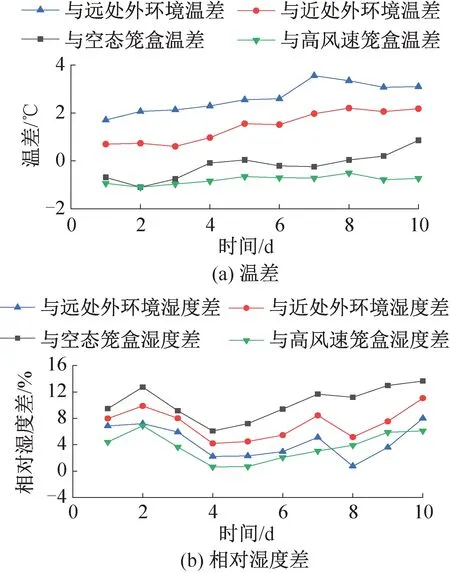
图13 低风速笼盒内外温湿度差变化特性Fig.13 Differences of temperature and relative humidity between microenvironment and macroenvironment at low air supply speed
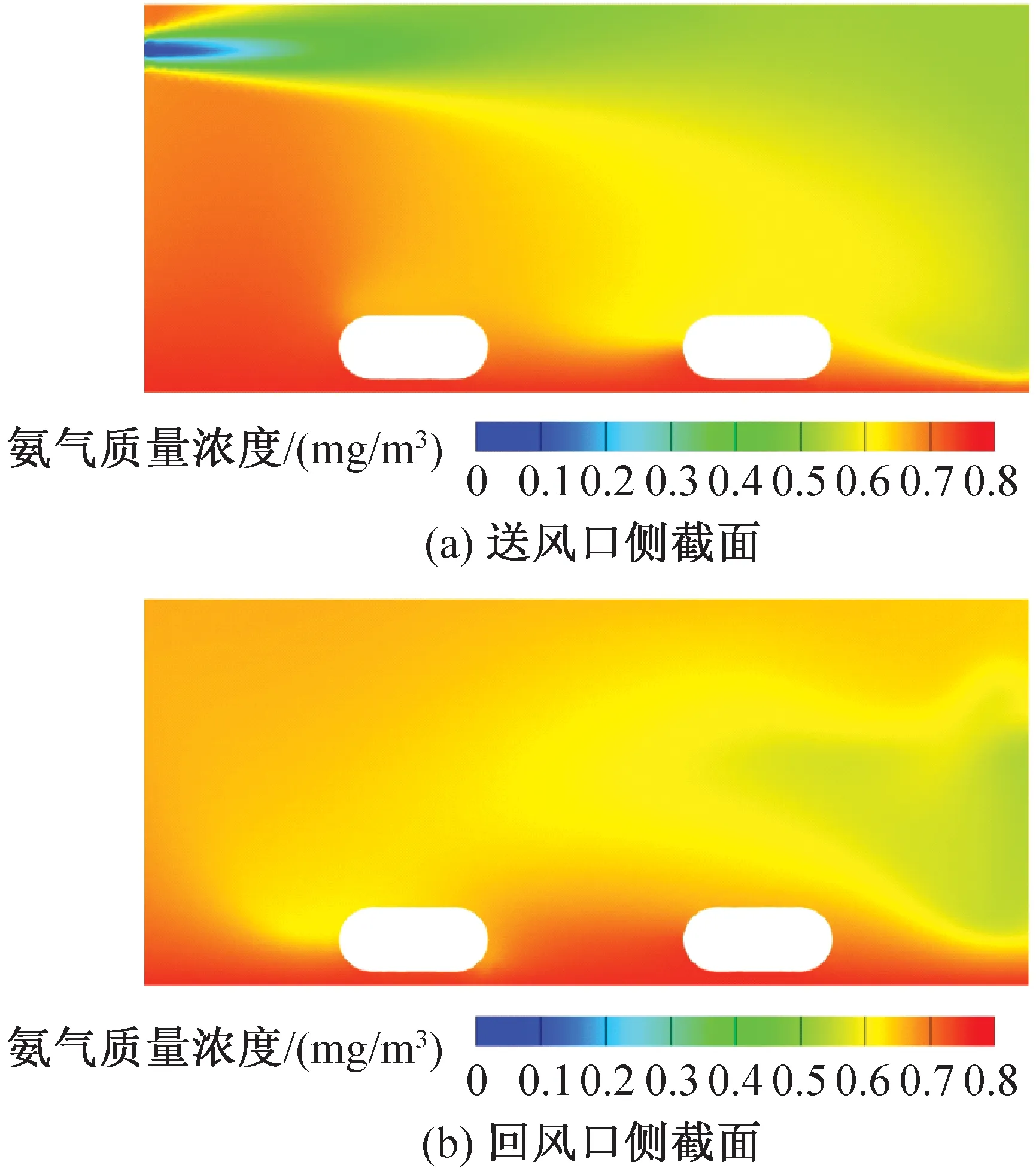
图14 送风速度为2.79 m/s时笼盒氨气质量浓度云图Fig.14 Mass concentration distribution of ammonia in cage at speed of 2.79 m/s
3.4 饲养微环境的氨气质量浓度分析
3.4.1 饲养微环境的氨气浓度模拟结果
饲养微环境氨气质量浓度模拟结果如图14、图15所示。由图14、图15可知,送风速度分别为2.79、4.94 m/s的笼盒内部平均氨气质量浓度分别为0.63、0.60 mg/m3。送风风速较小时小鼠饲养微环境的氨气质量浓度更高,送风风速越大越利于氨气的稀释和排放。目前的IVC系统满足规范要求,处于最不利处即送风速度为2.79 m/s的笼盒中氨气质量浓度仍在规定范围之内。
氨气由垫料面向外扩散,由于气流漩涡和流向作用,小鼠饲养微环境中氨气质量浓度较高,高浓度区主要集中于笼盒前侧,即靠近送回风口一侧。相比送风口侧的小鼠,回风口侧由于受主流气流的影响较小,小鼠被较高的氨气浓度包围。结合温度分布云图和速度分布云图可知,IVC笼盒内温度场和氨气质量浓度分布均受风环境影响,且二者有相对一致的分布规律,符合广义雷诺比拟法则。因此在实际设计IVC净化空调系统时应同时考虑多参数的相互影响,使最不利处笼盒饲养微环境指标符合要求,保证实验动物福利。
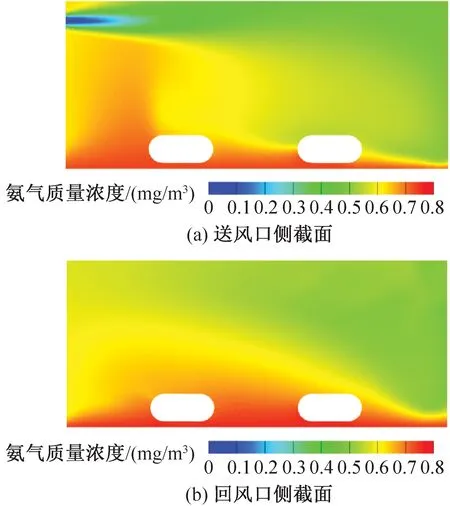
图15 送风速度为4.94 m/s时笼盒氨气质量浓度云图Fig.15 Mass concentration distribution of ammonia in cage at speed of 4.94 m/s
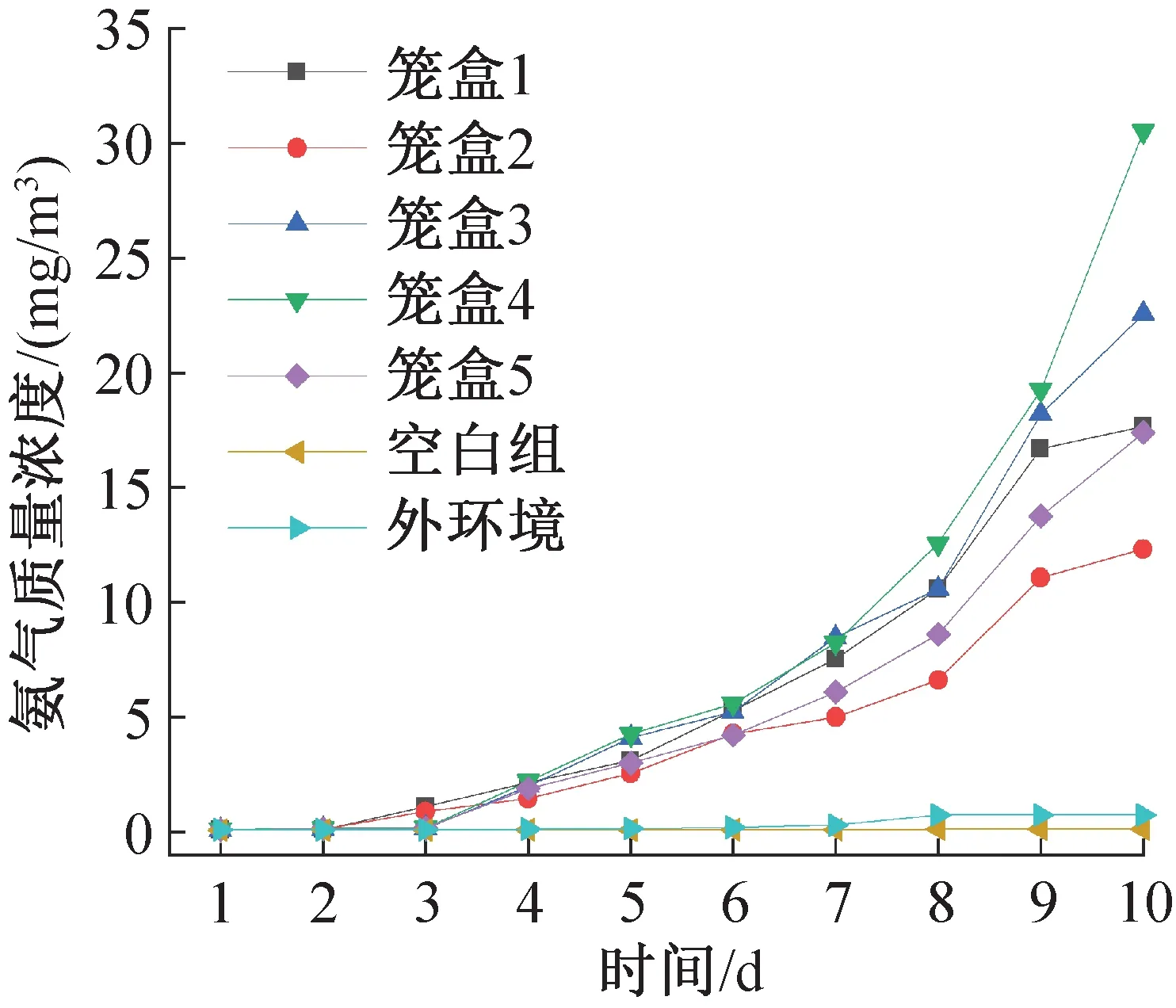
图16 氨气质量浓度随时间的变化Fig.16 Variation of ammonia mass concentration with time
3.4.2 饲养微环境的氨气质量浓度实测结果
图16所示为连续10天测得的各实验笼盒内部、空态笼盒及外环境的氨气质量浓度随饲养天数的变化。因组装笼盒时氨气从外环境进入笼盒以及笼盒存在一定泄漏,第一天笼盒内的氨气质量浓度不为0。随着天数的增加,由于笼盒的阻碍以及外环境的气流组织扩散作用,外环境与空白笼盒的氨气质量浓度值稳定在0.1 mg/m3以下。由于外环境会在更换饮水瓶或进行其他操作时与饲养微环境进行物质交换,外环境氨气质量浓度会略高于空态笼盒。饲养微环境的氨气质量浓度在第4天开始急剧升高,第9天时已有两个笼盒内的氨气质量浓度大于15 mg/m3,超过了规范规定的14 mg/m3限值,因此实际操作中规定的7天换一次笼盒与垫料是合理的。
4 结论
本文通过对湖南省某高校实验动物中心一间SPF级实验动物房的IVC小鼠饲养微环境(本文的饲养微环境即针对笼盒内部小鼠主要活动范围)进行数值模拟分析和实验测量,发现该实验动物房笼盒内小鼠饲养微环境满足规范要求,得到如下结论:
1)笼盒内小鼠饲养微环境的气流组织分布有较大改进空间。位于送风口侧饲养微环境气流速度显著高于回风口侧;上送上回系统中部分笼盒内小鼠背部一侧的风速可达0.3 m/s以上,易超过标准规定风速,不利于保证动物福利与安全。
2)对于IVC系统,饲养微环境受自身送风支路布置形式及气力(水力)失调影响较大,位于同一笼架不同位置的笼盒内送风风速存在显著差异,送风风速变化范围在2.79~4.94 m/s之间。实际设计时应以最不利送风风速为基准,建议笼盒送风口的入口加上调节装置,调节水力平衡并改善笼盒内饲养微环境的气流组织,减小不同位置笼盒内饲养微环境差异。同时表明目前在实际应用中将位于笼架不同高度处的笼盒调换位置的措施是合理的。
3)IVC笼盒内温度场和氨气质量浓度分布均受风环境影响,且二者存在相对一致的分布规律,符合广义雷诺比拟法则。实际设计IVC净化空调系统时应同时考虑多参数的相互影响,使最不利处笼盒饲养微环境指标符合规范要求,保证实验动物福利。
4)实验室自带检测仪表仅能监测外环境局部状况,从提高饲养微环境控制精度、保护实验人员安全的角度出发,有必要对IVC系统外环境和饲养微环境提出更高的指标检测要求。
本文受湖南省重点领域研发计划(2020DK2003)和湖南省科技成果转化及产业化计划(2020GK2077)资助。(The project was supported by Research and Development Plan of Key Areas in Hunan Province(No. 2020DK2003)and Hunan Provincial Scientific and Technological Achievements Transformation and Industrialization Plan(No. 2020GK2077).)
