内质网应激抑制剂4-PBA对高糖诱导大鼠视网膜Müller细胞胶质增生的作用及机制*
2022-12-23酆啸龙秋双甘诗泉沈祥春陈妍
酆啸, 龙秋双, 甘诗泉, 沈祥春*, 陈妍*
(贵州医科大学 药学院 & 贵州省高等学校天然药物药理与成药性评价重点实验室, 贵州 贵阳 550025)
糖尿病视网膜病变(diabetic retinopathy, DR)是一类严重的糖尿病微血管病变[1]。体内长期高糖(high glucose,HG)环境下诱导的视网膜胶质增生,是DR的早期特征,其中Müller细胞作为视网膜中的主要支撑和营养细胞,在胶质增生中扮演重要角色[2-4]。研究表明,HG诱导Müller细胞发生胶质增生,表现为细胞异常增殖和胶质纤维酸性蛋白GFAP表达上调[5],并且导致氧化应激、炎症介质产生和分泌、以及视网膜内环境破坏[6-7]。寻找调节Müller细胞胶质增生的新机制,并以此为基础进行创新药物的开发,成为DR防治的研究热点。内质网应激(endoplasmic reticulum stress, ERS)是细胞内质网稳态失衡引发的一种病理过程,表现为内质网腔内错误折叠与未折叠蛋白聚集[8]。细胞内环境的改变可中断蛋白质加工,导致内质网中未折叠蛋白质的积累,并激活未折叠蛋白质反应(unfolded protein response,UPR),这种应激反应的触发因素包括缺血、缺氧、HG和氧化应激等[9-10]。UPR最初旨在恢复内质网功能和促进细胞存活,但当持续发生ERS时,通过蛋白激酶R样内质网激酶(protein kinase RNA-like ER kinase ,PERK)途径参与DR的发生,干扰视网膜细胞的生理代谢[11]。研究表明ERS与DR的病理过程密切相关,参与调节了DR中的氧化应激、炎症、细胞凋亡、血-视网膜屏障破坏和血管生成等[12-13]。HG同样可诱导Müller细胞发生ERS,此时葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)蛋白水平迅速上调,从内质网膜进入内腔,并通过作用转录激活因子4(activating transcription factor 4,ATF4)诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白合成与分泌[14-15],然而ERS与Müller细胞胶质增生的关系尚不清楚。因此,本研究通过建立HG诱导的Müller细胞胶质增生体外模型,使用ERS特异性抑制剂4-苯基丁酸(4-Phenylbutyric acid,4-PBA)进行干预,探讨ERS与Müller细胞胶质增生的关系,为抑制ERS防治DR的创新药物提供实验证据。
1 材料与方法
1.1 实验材料
1.1.1细胞株 视网膜神经胶质Müller细胞株购自上海冠导生物工程有限公司。
1.1.2主要药物及试剂 低糖培养基(dulbecco's modified eagle medium,DMEM;美国Gibco公司)和胎牛血清(fetal bovine serum,FBS;美国Gibco公司),4-PBA(美国MedChemExpress),抗GRP78、PERK、eukaryotic translation initiation factor 2 alpha(eIF2α)、ATF4和glial fibrillary acidic protein(GFAP)单克隆一抗(武汉Proteintech),抗磷酸化-eIF2α(p-eIF2α)、磷酸化-PERK(p-PERK,江苏Affinity公司),抗VEGF-A(美国Abcam公司),单克隆一抗羊抗兔和羊抗鼠抗体(美国Bioword公司)。
1.1.3主要仪器 DMIL型倒置显微镜(德国LEICA公司),NovoCyte流式细胞仪(艾森生物),3020-426多功能全波长酶标仪(美国Thermo公司),超净工作台SW-CJ-1型(中国苏州净化设备有限公司),Heal force型细胞培养箱(中国上海力申科学仪器有限公司),Microfuge20R型冷冻离心机(美国Beckman Coulter公司)。
1.2 研究方法
1.2.1细胞培养及分组处理 Müller细胞置于含10% FBS和1%青霉素/链霉素的DMEM低糖培养基中37 ℃的5% CO2饱和湿度培养箱中培养,隔天换液至长满。实验分为Control组(5.5 mmol/L葡萄糖)、Mannitol组(34.5 mmol/L甘露醇+5.5 mmol/L/L葡萄糖)、HG组(40 mmol/L葡萄糖)、4-PBA-L组(1 mmol/L4-PBA+40 mmol/L葡萄糖)及4-PBA-H组(5 mmol/L 4-PBA+40 mmol/L葡萄糖),4-PBA给药组及Mannitol组给予相应药物预处理1 h,再加40 mmol/L葡萄糖继续培养48 h。
1.2.2Giemsa染色 取对数增长期Müller细胞按1.2.1项下分组接种于24孔板中,待给药预保护1 h,40 mmol/L 葡萄糖继续培养培养48 h,弃原培养液,每孔加PBS洗3次,加4%多聚甲醛静置固定细胞15 min;每孔加PBS摇洗3次;Giemsa染色液(浓缩液 ∶PBS=1 ∶5)沿壁加入,静置染色5 min,PBS冲洗干净,倒置显微镜下采集照片(100×)。
1.2.3二苯基四氮唑溴[3-(4,5-dimethyl-2- thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT]法检测4-PBA对HG诱导Müller细胞增殖的影响 取对数生长期Müller细胞以密度为5 ×106个/L,接种于96孔板中,给予0、0.1、0.25、0.5、1、2.5、5、7.5、10mmol/L 的4-PBA预处理细胞1 h,然后继续培养48 h,采用 MTT法检测Müller细胞存活率;同样取对数生长期Müller细胞,以密度为5 ×106个/L,接种于96孔板中,按1.2.1项下分组培养2 d, MTT法检测5组细胞的增殖,计算细胞存活率(细胞存活率= OD给药组/OD对照组×100%)。
1.2.4流式细胞仪检测细胞周期 取“1.2.1”项下密度为1×109个/L的各组细胞,制成单细胞悬液1 mL,1 500 r/min离心5 min,弃上清,70%乙醇500 μL预冷,于4 ℃固定过夜;加RNA Nase(终浓度50 mg/L)100 μL于37 ℃水浴30 min;避光加碘化丙啶(propidium,PI;终浓度50 mg/L)400 μL ,室温避光染色30 min;上机检测,激发波长为488 nm,收集细胞10 000个以上。
1.2.5Western blot检测相关蛋白的表达 取对数增长期的Müller细胞按“1.2.1”项下分组接种于培养皿中,待给药预保护1 h,40 mmol/L 葡萄糖继续培养48 h,弃原培养基,预冷PBS洗2次,加含1%蛋白酶抑制剂苯甲磺酰氟(phenylmethyl sulfonyl fluoride,PMSF)细胞裂解液(radio immunoprecipitation assay,RIPA)裂解细胞、提取各组细胞总蛋白,采用二喹啉甲酸(bicinchoninic acid,BSA)蛋白定量;将蛋白样品进行凝胶电泳分离,电泳时间1.5 h,湿转法转膜1.5 h,5%BSA溶液封闭1 h;加配制好相应浓度的一抗GRP78(1 ∶1 000)、ATF4(1 ∶1 000)、GFAP(1 ∶1 000)、PERK(1 ∶1 000)、p-PERK(1 ∶500)、eIf2α(1 ∶1 000)、p-eIf2α(1 ∶500)、VEGF-A(1 ∶1 000)及β-actin(1 ∶10 000)于4 ℃孵育过夜,洗膜3次,加入兔二抗(1 ∶10 000)室温孵育1.5 h;采用Bio-Rad显影成像系统获取图像,Image J分析软件统计各蛋白印迹灰度值进行分析比较。
1.3 统计学分析

2 结果
2.1 细胞形态
Giemsa 染色结果显示(图1),Control组Müller细胞间隙明显,分散均匀;HG组Müller细胞数目急剧增多,形状变为圆,细胞间隙变小;1 mmol/L和5 mmol/L 4-PBA干预后,4-PBA-L组和4-PBA-H组Müller的细胞数量和形态有所恢复。表明4-PBA可减少HG诱导Müller数目和病理形态改变。

图1 各组视网膜Müller细胞的形态学特征(Giemsa染色,×100)Fig.1 Morphological characteristics of retinal Müller cells in each group (Giemsa staining,×100)
2.2 细胞增殖活性及4-PBA浓度的确定
经0、0.1、0.25、0.5、1、2.5、5、7.5及10 mmol/L 4-PBA进行给药处理1 h,MTT法检测结果显示(图2),与Control组相比,Müller细胞在0~5 mmol/L 4-PBA干预下细胞存活率无明显影响(P>0.05);当4-PBA 浓度>5 mmol/L后,Müller细胞存活率下降(P<0.05)。此外,与Control组相比,HG组Müller细胞存活率升高(P<0.05);给予1mmol/L和5 mmol/L 4-PBA预保护 1 h,与HG组相比,4-PBA-L组和4-PBA-H组 Müller细胞存活率下降(P<0.05),Mannitol组无明显差异(P>0.05)。
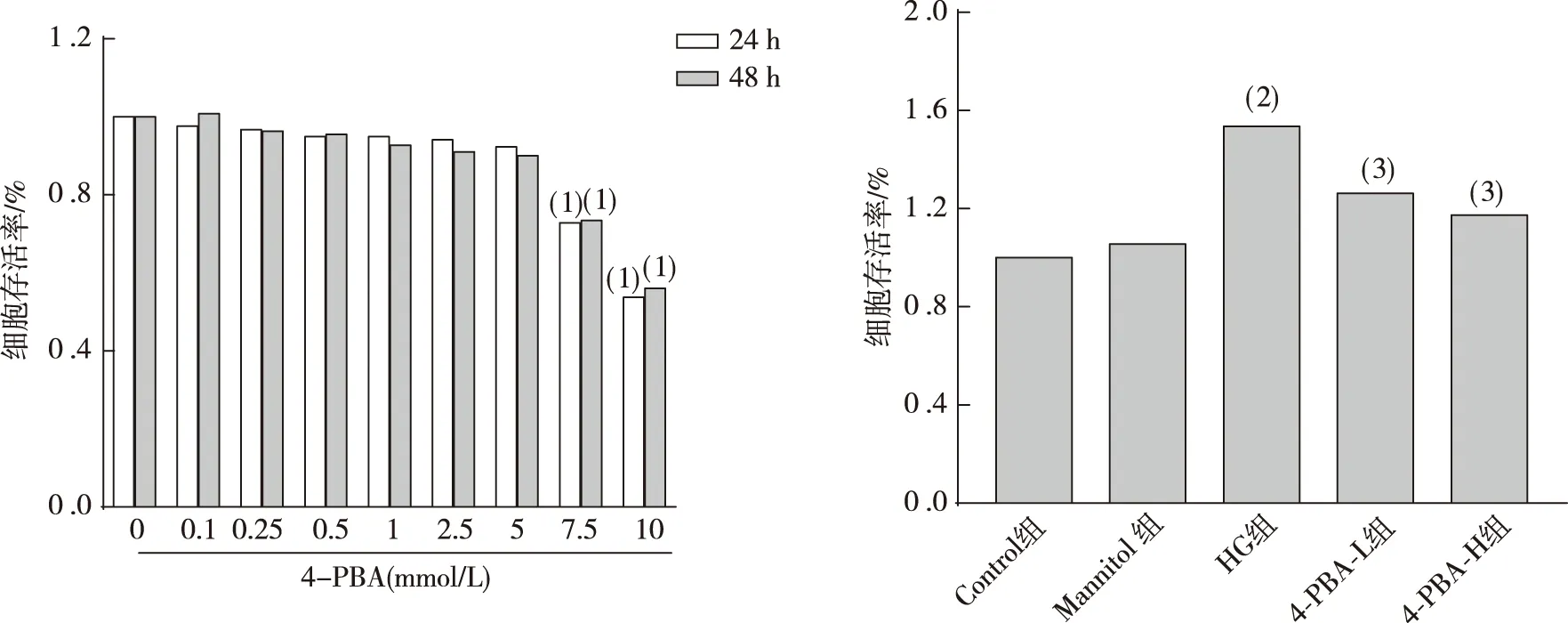
注:A、B为不同培养条件下Müller细胞增殖活性统计结果;(1)与同浓度24 h组比较,P<0.05;(2)与Control组比较,P<0.05;(3)与HG组比较,P<0.05。图2 各组视网膜Müller细胞的增殖活性(MTT)Fig.2 Proliferative activity of the retinal Müller cells in each group(MTT)
2.3 细胞周期
流式细胞术检测结果显示(图3),与Control组相比,HG作用Müller细胞 48 h后,HG组Müller细胞S期所占比例增加(P<0.05);而给予不同浓度4-PBA预处理1 h后,与HG组相比,4-PBA-L组和4-PBA-H组 Müller细胞S期所占比例减少(P<0.05),Mannitol组无明显差异(P>0.05)。
2.4 ERS相关蛋白的表达
结果如图4所示,与Control组比较,HG作用Müller细胞 48 h后HG组Müller细胞ERS未折叠蛋白反应蛋白GRP78、p-PERK、p-eIf2α和ATF4 蛋白表达升高(P<0.05);而给予不同浓度4-PBA(1 mmol/L、5 mmol/L)预处理1 h,与HG组相比,4-PBA-L组和4-PBA-H组 Müller细胞GRP78、p-PERK、p-eIf2α和ATF4 蛋白表达减少(P<0.05),Mannitol组无明显差异(P>0.05)。
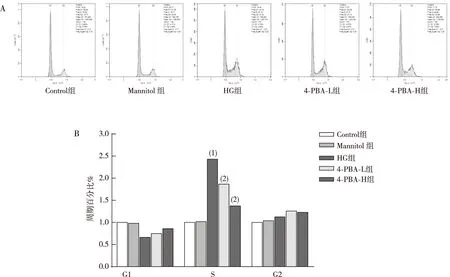
注:A为流式细胞术检测结果,B为流式细胞术检测的定量结果;(1)与Control组比较,P<0.05;(2)与HG组比较,P<0.05。图3 各组视网膜Müller细胞的细胞周期变化(流式细胞术)Fig.3 Cell cycle changes in retina Müller cells in each group(flow cytometry)
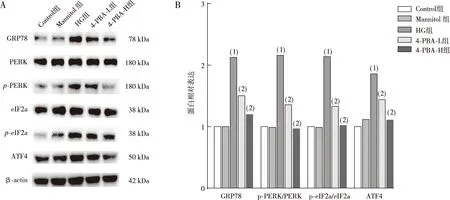
注:A、B分别为Western blot电泳图和蛋白定量结果;(1)与Control组比较,P<0.05;(2)与HG组比较,P<0.05。图4 各组视网膜Müller细胞GRP78、p-PERK、p-eIf2α及ATF4 蛋白的表达Fig.4 Levels of GRP78, p-PERK, p-eIf2α, and ATF4 protein expression in retinal Müller cells in each group
2.5 细胞胶质增生
Western blot结果表示(图4),与Control组比较,HG作用48 h后,HG组Müller细胞中GFAP和VEGF-A蛋白表达升高(P<0.05);给予不同浓度4-PBA预处理1 h,与HG组相比,4-PBA-L组和4-PBA-H组 中Müller细胞GFAP、VEGF-A蛋白表达减少(P<0.05),Mannitol组无明显差异(P>0.05)。
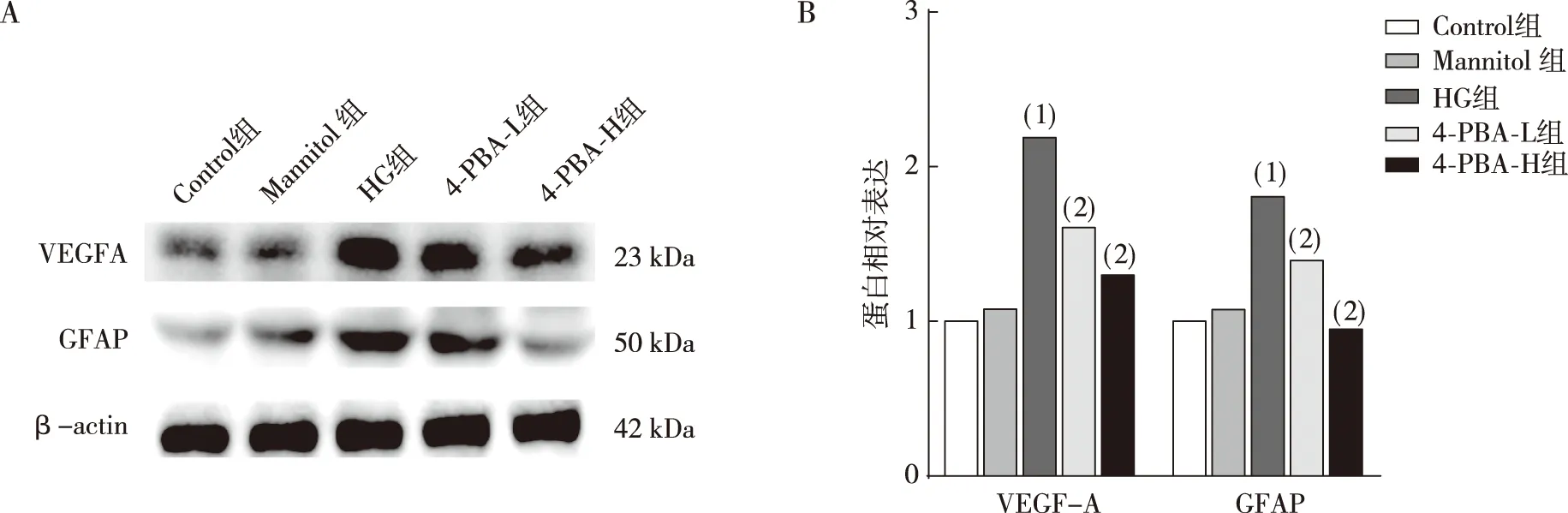
注:A、B为VEGF-A和GFAP的Western blot电泳结果和蛋白定量统计结果;(1)与Control组相比,P<0.05;(2)与HG组相比,P<0.05。图5 各组视网膜Müller细胞的GFAP和VEGF-A蛋白表达Fig.5 Levels of GFAP and VEGF-A protein expression in retinal Müller cells in each group
3 讨论
DR是糖尿病常见的并发症之一,也是糖尿病人视力下降的主要原因[16]。有研究认为,当糖尿病患者视网膜出现损伤时,早于血管病变和其他胶质细胞受损,视网膜Müller 细胞就已经发生形态和功能性病变[8]。Müller细胞是视网膜中维持视网膜内稳态的主要胶质细胞,能够表达生长因子以滋养视网膜神经元和毛细血管细胞[17]。糖尿病长期存在的高血糖可诱导视网膜Müller细胞增殖活化,这是Müller细胞胶质增生的一种形式,也是导致DR发生的主要原因[18-19]。鉴于Müller细胞在维持视网膜神经血管结构和功能方面的重要性,糖尿病患者Müller细胞的功能障碍及随之发生的胶质增生被认为是导致视网膜病变的主要因素[20-21]。因此,抑制或逆转胶质增生过程可能是防治DR的重要策略。本研究结果表明,4-PBA能抑制HG诱导Müller细胞的异常增殖,并且可有效地改善HG诱导Müller细胞形态的异常改变。
内质网是负责蛋白质合成和加工的主要细胞器,其蛋白质折叠可受各种生理和病理条件干扰,导致ERS的发生[22]。ERS的3个跨膜传感器PERK、IRE1和ATF6负责激活介导UPR和后续反应的下游信号通路[22-24]。据报道,UPR反应经典通路PERK-eIF2α-ATF4信号通路与DR密切相关[25]。越来越多的证据表明,ERS通过增加Müller的胶质增生促进DR的进展[26-27];ERS抑制剂则可以改善视网膜神经病变[28]。GRP78是一种ERS蛋白,参与蛋白质的折叠和运输,其表达与ERS呈正相关[29]。本研究结果显示,与Control组相比,HG组内质网应激标志蛋白GRP78水平上调,表明Müller细胞在40 mmol/L葡萄糖诱导48h后发生ERS。此外,与Control组相比,HG组p-PERK、p-eIF2α、ATF4蛋白表达增加,表明HG组Müller细胞PERK-eIF2α-ATF4通路被激活,可能是糖尿病视网膜胶质增生发病机制中的主要信号通路。
研究表明,GFAP和VEGF-A的表达异常上调是DR中Müller胶质增生的显著标志[30-31];在HG处理的视网膜细胞中,缓解ERS或者抑制 ATF4 活性将减少细胞中VEGFA 及GFAP的表达,改善视网膜病变[31-32]。因此,本研究通过蛋白免疫印迹实验探讨4-PBA对HG诱导的Müller细胞中GFAP和VEGF-A表达的影响,结果表明,与HG组相比,4-PBA预处理1h后可显著抑制HG诱导的Müller细胞中GFAP和VEGF-A蛋白表达增加。这些结果进一步表明了4-PBA可以通过下调HG诱导Müller中GFAP和VEGF-A的表达来抑制视网膜Müller细胞的胶质增生。
综上所述,4-PBA可抑制HG诱导的视网膜Müller细胞胶质增生过程,恢复Müller细胞形态与功能,其作用与抑制ERSPERK-eIF2α-ATF4通路有关,但是4-PBA在体内的药效作用仍待进一步的验证。本研究为4-PBA药物开发利用提供了理论基础,也为临床治疗DR提供了新思路。
