不同病理分级IgA肾病患者肾小球足细胞自噬体数目分析
2022-12-23洪琴王娅粟凤甘昌玉达静静胡建军
洪琴, 王娅, 粟凤, 甘昌玉, 达静静, 胡建军**
(1.贵州省人民医院 病理科, 贵州 贵阳 550001; 2.贵州省人民医院 肾内科, 贵州 贵阳 550001)
IgA肾病(IgA nephropathy,IgAN)1968年被Berger和Hinglais首次描述和命名,其特点是肾小球系膜区有IgA或以IgA为主的免疫复合物沉积,免疫复合物由聚合IgA1(a IgA1)和补体3(C3)组成,亦还有可变的IgG和/或IgM共沉积[1]。IgAN是全球最常见的肾小球肾炎,是慢性肾病和终末期肾功能衰竭(ESRD)的重要原因,严重危害人类健康[2]。IgAN发病机制尚不清楚,认为是多种机制作用的结果,提出“四重打击学说”:第一重打击,lgAN患者循环中存在高水平的半乳糖缺失的IgA1(Gd-IgA1);第二重打击,Gd-IgA1作为自身抗原诱发自身抗体的产生(抗糖抗体);第三重打击,抗糖抗体和半乳糖缺失的IgA1二者形成循环免疫复合物在肾脏沉积;第四重打击,通过激活补体、诱发炎症因子等途径致肾组织损伤,导致IgA肾病的发病和进展。目前认为IgA1分子的糖基化异常造成IgA1易于自身聚集或被IgG或IgA识别形成“致病性”免疫复合物,可能是IgA肾病发病中的始动因素[3]。新近研究提示,足细胞自噬异常是IgAN发生发展过程中的重要机制[4]。自噬是由溶酶体介导的蛋白质和细胞器的降解过程,这个过程涉及清除衰老的细胞器和破坏性蛋白质,同时维持细胞内环境的稳定性[5]。自噬参与了人类多种疾病的发病机制,越来越多证据表明,自噬参与了肾脏疾病的发病机制[4]。足细胞是构成肾小球滤过屏障的重要细胞,位于肾小球毛细血管簇的表面,自噬与足细胞结构及功能的稳定密切相关,自噬功能的紊乱将导致足细胞的严重损伤,是导致IgAN蛋白尿发生、发展以及ESRD的重要原因及关键因素[6]。在糖尿病患者和大鼠的研究中发现,自噬不足伴有足细胞丢失的大量蛋白尿,在小鼠蛋白尿的进展中具有因果关系[7]。此外,早期研究发现IgAN儿童患者足细胞存在两种自噬类型(Ⅰ型、Ⅱ型),Ⅰ型自噬(直径约1 μm)表现为致密的核糖体区域和少量的脂滴,其限制膜起源于线粒体;Ⅱ型自噬(直径3~8 μm)表现为一个浓缩的核糖体和许多脂滴,其限制膜起源于粗面内质网;Ⅱ型自噬转变为自噬体和自噬泡,提示Ⅱ型自噬在清除蛋白质和脂质方面比Ⅰ型自噬更重要,以Ⅰ型自噬为主的IgAN患者的病理损害程度更严重,预后较差[8-9]。研究显示,IgAN成人患者足细胞中自噬体的数量较少,表明自噬参与足细胞损伤及IgAN的进展[10]。本研究通过比较IgAN患者及肾结石患者足细胞自噬体数目的差异,同时观察不同病理分级IgAN患者自噬体数目的变化,探究IgAN发展过程中足细胞自噬的作用。
1 资料与方法
1. 1 一般资料
收集2017—2020年有完整临床资料并确诊为原发性IgAN患者的肾组织石蜡标本,分为IgAN1组(2017—2019年206例)和IgAN2组(2018—2020年30例),选择2020年肾结石患者石蜡标本3例作为对照组。IgAN1组和IgAN2组的患者肾脏穿刺标本肾小球≥6个,电镜标本肾小球≥1个。
1.2 方法及观察指标
1.2.1血清肌酐、尿蛋白及24 h尿蛋白 收集IgAN1组血清肌酐、尿蛋白及24 h尿蛋白定量数据,分析组内不同性别患者3项指标的差异。
1.2.2肾脏组织学 对照组及IgAN1组、IgAN2组肾脏组织石蜡包埋标本均进行切片,苏木精-伊红(HE)染色及六氨银(PASM)染色,光镜下观察肾小球系膜区的增生情况、有无节段性硬化或球形硬化、有无新月体及肾小管萎缩。
1.2.3肾脏病理学分级及分组 由两位经验丰富的病理医师对IgAN1组、IgAN2组进行Haas病理分级,分为IgAN1组Hass Ⅰ~Ⅴ级组、IgAN2组Hass Ⅰ~Ⅴ级组。参考文献[11]对肾活检组织进行病理学分级:Ⅰ级,轻微病变型,仅见肾小球系膜区的轻微的系膜细胞增生、无节段性或球性硬化、无新月体;Ⅱ级,局灶节段性肾小球硬化样型,与原发性局灶节段性肾小球硬化症(FSGS)相似,无新月体;Ⅲ级,局灶增生型,不足50%的肾小球出现细胞增生,增生的细胞可以只限于系膜细胞,也可伴有内皮细胞增生、主要以节段性分布为主,可以有少数新月体;Ⅳ级,弥漫增生型,超过50%的肾小球出现细胞增生,增生的细胞常为系膜细胞中度以上的增生,也可伴有内皮细胞增生、多数弥漫性增生、部分节段性增生,可以有新月体;V级,进行性慢性肾炎型,≥40%的肾小球呈现球性硬化,肾皮质约40%的肾小管萎缩或消失。
1.2.4肾小球补体C3c及IgA免疫荧光沉积 免疫荧光显微镜观察对照组及IgAN1组、IgAN2组HassⅠ-Ⅴ级组肾小球补体C3c及IgA免疫荧光沉积。免疫荧光显示强度分为:“-”表示高、低倍镜均不显示沉淀,“±”表示高倍镜隐约显示沉积,“1+”表示低倍镜隐约可见沉积、高倍镜下可见沉积,“2+”表示低倍镜下可见显示沉积,高倍镜下清晰显示沉积,“3+”表示低倍镜下清晰沉积、高倍镜下耀眼沉积,“4+”表示低倍镜下耀眼沉积、高倍镜下刺眼的沉积。
1.2.5足细胞中自噬体 采用透射电镜观察对照组及IgAN2组HassⅠ~Ⅴ级组足细胞胞质内的自噬体。电镜下自噬体是由单层膜或双层膜包裹的圆球形的结构,每组每个病例随机选取20个足细胞计数自噬体数量,每个足细胞取1~2个视野,计数每个足细胞内自噬体的平均数量,分析对照组及IgAN2组HassⅠ~Ⅴ级组各组间自噬体数量的变化趋势,分析自噬体数量变化与病理分期的关系
1.3 统计学分析

2 结果
2.1 IgAN1组各临床指标的差异及其性别特点
IgAN1组不同性别患者的血肌酐、尿蛋白及24 h尿蛋白定量比较,男性患者血肌酐更高,尿蛋白及24 h尿蛋白更多,差异具有统计学意义(P<0.05),提示男性临床表现更严重,肾功能不全表现更显著;见表1。IgAN1组Hass分级:Hass Ⅰ级67例,Hass Ⅱ级59例,Hass Ⅲ级31例,Hass Ⅳ级14例,Hass Ⅴ级35例;与HassⅤ级比较,HassⅠ级组患者尿蛋白及24 h尿蛋白定量增加,血肌酐降低(P<0.05);见表2。

表1 IgAN1组不同性别患者尿蛋白及血肌酐比较Tab.1Comparison of urine protein and serum creatinine in IgAN1 patients between males and
2.2 肾脏组织学观察
光镜下观察,对照组肾小球系膜区未见增宽,IgAN1组和IgAN2组肾小球系膜区增宽、系膜基质和系膜细胞不同程度增生,可见节段性硬化及新月体形成,伴肾小管萎缩、肾间质纤维组织增生、慢性炎细胞浸润。
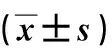
表2 不同病理分级IgAN1组患者尿蛋白及血肌酐比较Tab.2 Comparison of urine protein and serum creatinine in IgAN1 group between different pathological
2.3 肾脏病理学分级
HassⅠ级组肾小球系膜区轻度增宽,系膜基质及细胞轻度增生;HassⅡ级组可见节段性硬化;HassⅢ级组局灶系膜基质及细胞节段性中度加重伴内皮细胞增生,可见节段性硬化,可见新月体形成;HassⅣ级组系膜基质及细胞中度弥漫性增生,局灶节段性重度加重伴内皮细胞增生,可见节段性硬化及球性硬化,可见新月体形成;HassⅤ级组可见≥40%肾小球球性硬化,伴肾小管萎缩、肾间质纤维组织增生、慢性炎细胞浸润。提示Hass分级越高,肾小球病变越重、越多样。见图1。
2.4 免疫荧光沉积
对照组肾小球未见IgA及C3c的免疫荧光反应,IgAN1组、IgAN2组HassⅠ~Ⅴ级组肾小球均可见IgA、C3c在系膜区呈较强的团块状绿色荧光沉积(≥2+)。见图2。

注:光镜下观察肾小球系膜区有无增宽、系膜基质和系膜细胞有无增生、有无节段性硬化及新月体形成、伴/不伴肾小管萎缩、肾间质纤维组织增生以及慢性炎细胞浸润情况。图1 各组肾脏组织HE及PASM染色(HE,×400; PASM,×400)Fig.1 HE staining and PASM staining of renal tissues in each group (HE,×400; PASM,×400)
2.5 肾小球内自噬体
电镜下观察对照组及IgAN2组HassⅠ~Ⅴ级组肾小球的超微结构,均可见足细胞胞质内的自噬体。与正常对照组比较,IgAN2组HassⅠ~Ⅴ级组患者的自噬体数量减少, 随着IgAN2组Hass病理分级的进展,自噬体数量随着病理级别增加而增多(P<0.01)。见图3和表3。

注:荧光显微镜下观察肾小球系膜区有无IgA、C3c荧光沉积。图2 各组肾小球免疫荧光C3c、IgA沉积(IF,×400)Fig.2 Immunofluorescent staining results showing glomerular C3c and IgA deposits in each group (IF,×400)

注:箭头所示为自噬体。图3 IgAN2组患者足细胞胞质内自噬体(透射电镜,×20 000)Fig.3 Autophagosomes in podocyte cytoplasm in IgAN2 group (TEM,×20 000)

表3 各组肾小球足细胞自噬体数量比较Tab.3 Comparison of autophagosome numbers in glomerular podocytes between
3 讨论
IgAN是肾小球基底膜中IgA型免疫球蛋白沉积引起的肾小球肾炎的常见形式之一,其临床表现和进展率取决于临床病理表型和随访时间,其发病机制尚不清楚,目前研究发现其发病为多打击机制的结果[12-13]。现有研究发现,IgAN中足细胞损伤是导致蛋白尿发生、发展的重要原因之一,目前研究其损伤机制包括补体系统激活、细胞因子改变、足细胞裂孔隔膜蛋白(nephrin)蛋白异常、异常糖基化IgA1等,而足细胞自噬在上述损伤机制中起重要作用[14]。IgAN是我国最常见的肾小球肾炎,是导致终末期肾功能衰竭的病因之一,约30%的IgAN患者在确诊后10 ~20年进展为肾功能衰竭[15]。因此研究IgAN的发病机制,探讨并研制新的治疗方案改善患者病情十分重要。
自噬是一种在真核细胞中高度保守的、用于降解和回收利用细胞长效生物大分子和受损细胞器的过程[16],目前已知足细胞病变、IgA肾病、糖尿病肾病等多种肾脏疾病的发生发展与自噬密切相关[6-10]。研究发现,足细胞特异性缺失自噬相关因子Vps34的小鼠在9周后出现早期蛋白尿、进行性肾小球硬化和肾功能衰竭[17];肾脏缺血再灌注损伤的研究中发现,自噬相关基因(Atg)5基因缺陷型足细胞不能进行正常自噬,其氧化和泛素化蛋白的积累以及足细胞内质网应激最终导致蛋白尿增加和肾小球硬化[18];在用a IgA1刺激的肾小球系膜细胞中,有学者发现SUMO1可能通过抑制自噬来促进其细胞增殖[19];随着系膜细胞增殖,IgAN血清中TGF-β1升高,TGF-β1抑制足细胞自噬并激活mTOR通路,即IgAN进展时,TGF-β1可以激活mTORC1并抑制自噬,进一步了解系膜细胞增殖导致足细胞功能障碍的机制[20]。新近研究发现[21]在FSGS患者的足细胞中自噬空泡数量减少,可以通过雷帕霉素诱导自噬来减少足细胞的损伤,同时,3-甲基腺嘌呤抑制自噬使大鼠对氨基核苷诱发的FSGS变得敏感,而雷帕霉素部分保护足细胞免受氨基核苷诱导的肾病的影响。
目前研究发现足细胞自噬功能异常将导致足细胞的严重损伤,是导致IgAN蛋白尿发生、发展的重要原因,本研究根据收集年限将有完整临床资料并确诊为原发性IgAN患者的肾组织石蜡标本分为2017—2019年IgAN1组(206例),根据Haas病理分级分为IgAN1组Hass Ⅰ~Ⅴ级组,比较IgAN1组Hass Ⅰ~Ⅴ级组各组间患者尿蛋白定量、24h尿蛋白定量及血肌酐的差异及其性别特点,由于所在科室2018年起开展电镜检测,故收集2018—2020年IgAN2组(30例),选择2020年肾结石患者石蜡标本3例作为对照组,根据Haas病理分级分为IgAN2组HassⅠ~Ⅴ级组,电镜下观察自噬体并计数,观察时需要与其他细胞器相鉴别,如调亡小体,表现为由胞膜包绕的细胞碎片,包有胞质成分及核碎片,胞质中的细胞器出现变性改变,可被周围的细胞吞噬,比较IgAN2组HassⅠ~Ⅴ级组自噬体数量与对照组的改变,分析自噬体数量变化与病理分期的关系。统计结果发现IgAN1组不同性别两组患者在血肌酐、尿蛋白及24 h尿蛋白定量方面比较,差异明显(P<0.05),且男性患者血肌酐更高;IgAN1组HassⅠ级组患者尿蛋白定量及24 h尿蛋白定量较IgAN1组HassⅤ级患者更高,而IgAN1组HassⅤ级组患者血肌酐更高,提示IgAN1组HassⅤ级组患者肾功能减退更明显;IgAN2组HassⅠ~Ⅴ级组患者较对照组自噬体数量下降(P<0.001), 且随着Hass病理分级的进展,自噬体数量随着病理级别增加而增多(P<0.01),提示IgAN患者足细胞自噬体数目随病理分级的增高而增加,表明IgAN的发展过程中,足细胞自噬活性逐渐恢复,可能为组织自我清理过程增加,机体启动自我保护和调节机制所致,由此可见足细胞自噬可能参与了IgAN的进程,但其具体机制有待进一步研究。
IgAN是我国最常见的肾小球肾炎,是导致终末期肾功能衰竭的病因之一,其临床表现和进展率取决于临床病理表型和随访时间,其发病机制尚不清楚,目前研究发现足细胞自噬异常在IgAN发生发展过程中起关键作用,本研究结果也揭示足细胞自噬与 IgA 肾病时的发生发展关系密切,提示自噬可能为IgA肾病治疗的新靶点提供更多的思路。
