罗丹明B染色法快速测定土壤中微塑料
2022-12-23张万万郑永杰田景芝
张万万,郑永杰,田景芝
罗丹明B染色法快速测定土壤中微塑料
张万万,郑永杰,田景芝
(齐齐哈尔大学 化学与化学工程学院,黑龙江 齐齐哈尔 161006)
使用罗丹明B对微塑料进行快速染色,在波长为365nm的紫外光下显示荧光,从而将微塑料在土壤介质中分离。选择聚乙烯、聚丙烯、聚氨酯和聚苯乙烯为试验材料,将乙醇和去离子水作为溶剂,对罗丹明B的着色能力进行研究;对处在不同条件下的微塑料荧光稳定性进行了评价。结果表明,乙醇是溶解罗丹明B的最佳溶剂,在红外光谱检测时罗丹明B染色对微塑料识别无显著影响,对处于不同条件下的微塑料仍保持荧光稳定。在加标回收实验中,ZnCl2浮选液对土壤中微塑料分离效果较好,PE和PS回收率均达到99%以上,PP和PU的回收率均高于97%,同组试验回收率稳定,RSD值均小于2%。
微塑料;罗丹明B;染色;红外光谱;紫外光
塑料[1]是一种合成高分子量聚合物,通常在石油等化石燃料的副产品中制得,具有稳定的物理和化学特性,如有较好的耐腐蚀性和绝缘性、原料来源广泛、易于加工等原因,被广泛应用于多个领域[2]。自1950年以来,塑料工业的快速发展[3],全球已经生产了超过83亿公吨的塑料制品,给人们的日常生活带来了极大的便宜。然而,在塑料制品给人们带来便宜的同时,也带来了大量的塑料垃圾,现代回收基础设施已不能满足对塑料垃圾处理的需求[4]。进而导致了一系列环境污染问题[5],如大气污染,随意焚烧塑料,会散发有毒气体,污染空气;水污染,会被鱼类及动物当做食物吞入,造成鱼类及动物死亡;土壤污染,地膜覆盖导致土壤环境恶化,严重影响农作物的生长[6]。
2004年,Thompson等[7]首次提出微塑料一词,并将其尺寸界定在微米级别。目前微塑料指环境中粒径小于5 mm的塑料碎片、纤维、颗粒、泡沫或者薄膜等[8]。因微塑料具有粒径小、数量多、比表面积大、疏水性强等特点,所以更易吸附环境中有机污染物与重金属颗粒[9],这些污染物会随微塑料进入水体、土壤和空气中,这些问题导致生态环境遭到破坏以及对人类健康产生威胁[10],现如今微塑料污染已被纳入我国和国际海洋保护战略、政策和立法[11](例如,中国的《禁止、限制生产、销售和使用的塑料制品目录(征求意见稿)》、欧盟海洋战略框架指令等)。对于各种环境介质中的微塑料[12]而言,了解微塑料尺寸、时空分布、聚合物类型以及碎裂动力学是了解微塑料命运和影响的先决条件[13]。为了监测微塑料在空间上和时间上的发展趋势,研究人员需要开发简单、经济有效和检测标准化的方法,从而能够有效地分离与检测各种环境介质中的微塑料颗粒[14]。
罗丹明B是一种常用的染色剂[15-16],颜色呈红色至紫罗兰色的粉末,广泛应用于纺织着色[17]。同时也是一种荧光染料[18-19],即使在低浓度下也能发出强烈的荧光[20-21]。Qu等[22]利用罗丹明B标记纳米聚苯乙烯颗粒,研究了ACS-22突变对纳米聚苯乙烯颗粒在线虫体内分布和转运的影响,评估了纳米塑料对环境生物的潜在毒性。因此为了追踪环境介质中微塑料并提高其可辨别性,在实验中对微塑料进行标记是一种非常有效的方法。
本实验选择4种不同类型微塑料颗粒为试验材料,以去离子水、乙醇为溶剂,研究罗丹明B对微塑料的着色程度;通过染料将微塑料颗粒染色成粉色或紫色,并将其在波长为365nm的紫外光下显示荧光。为验证罗丹明B是否影响微塑料颗粒的检测,对微塑料颗粒在罗丹明B染色前后的红外光谱进行了比较,并对染色后微塑料颗粒置于不同条件处理后的荧光稳定性进行了评价。本研究将罗丹明B染色方法应用于环境样品,以验证该方法在实际样品染色中的可行性。
1 实验部分
1.1 实验试剂与仪器
罗丹明B(AR),上海试剂三厂;无水乙醇(AR),辽宁泉瑞试剂有限公司;30%H2O2溶液(AR),天津大茂化学试剂厂;盐酸、硝酸(AR),固安县金荣化工有限公司;氯化钠(GR)、氯化锌(AR)、氯化钙(AR),天津凯通试剂有限公司;硝酸纤维滤膜、尼龙滤膜、混合纤维素酯膜,上海新亚净化器件厂。
DHG-9123A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;SHZ-D(Ⅲ)循环水式真空泵,巩义市子华仪器有限公司;DF-Ⅱ集热式磁力搅拌器,金坛市荣华仪器制造有限公司;WFH-203三用紫外分析仪,上海精科实业有限公司;SZ-6745体式显微镜,江西道美智能科技有限公司;MSE3.6P-0CE-DM电子分析天平,赛多利斯科学仪器有限公司;Spotlight400傅里叶变换红外光谱,美国PE公司。
本实验中选择了常见的4种类型塑料进行研究:海瑟塑化聚丙烯(PP)、聚乙烯(PE)、聚苯乙烯(PS)和聚氨酯(PU),每个样本组都由这4种类型组成(见表1)。所研究的塑料类型为颗粒,所有塑料颗粒颜色均为透明或白色,粒径在0.1~3mm之间,通过傅里叶红外光谱仪和水平衰减全反射附件技术ATR-FTIR确认每种塑料类型。
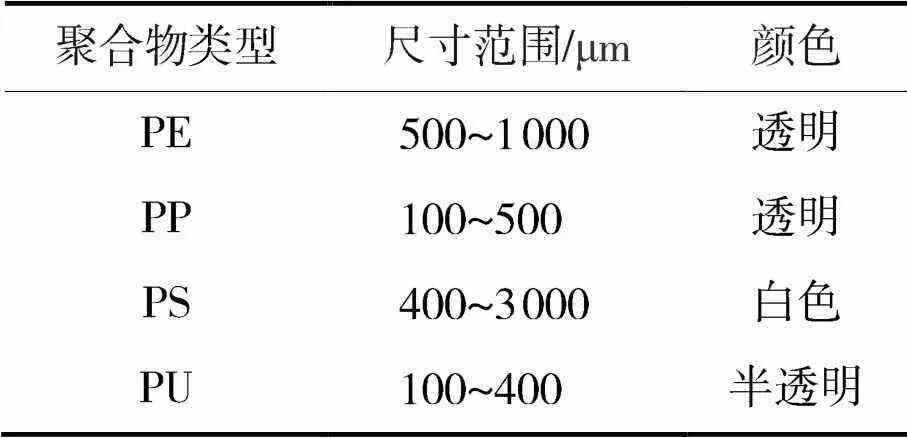
表1 微塑料的聚合物类型、尺寸范围和颜色
1.2 染料染色实验
取适量微塑料颗粒放入离心管中,加入10mL 30%H2O2进行消解,至气泡消失,过滤消解溶液,将样品自然风干。向处理过后的样品中加入用乙醇溶解的罗丹明B染料溶液和用去离子水溶解的罗丹明B染料溶液,染料浓度均为200μg mL−1,将样品置于温度为60℃烘箱中暗处理后,进行真空过滤,得到染色样品。
1.3 土壤样品加标回收率实验
本课题选择较为常用的ZnCl2(=1.6g/cm3)、CaCl2(=1.39g/cm3)与NaCl(=1.19g/cm3)溶液作为密度浮选液,对采集的土壤样品中微塑料进行提取分离。具体步骤如下,将干燥后的土壤混匀取300g,样品分为12等份。称取适量的PE、PP、PU、PS颗粒各3份使用30%H2O2消解后,分别与25 g过筛土壤样品置于烧杯中,并向含有不同类型聚合物的样品中分别加入不同浮选溶液。将加入浮选液的样品于恒温磁力搅拌器上持续搅拌30min,静置过夜。固液分层后,将上清液用真空过滤装置进行抽滤,滤膜采用纤维素滤膜。用少量去离子水多次冲洗滤器内壁,冲洗液一并过滤,重复上述密度浮选操作3次,将载有微塑料样品的滤膜用不锈钢镊子转移至玻璃培养皿中。对浮选后土壤样品,使用罗丹明B溶液添加到每个样品中暗处理30min后,使用尼龙有机滤膜过滤剩余的溶液,经染色后的样品自然风干后在波长为365nm的紫外光下进行观察并使用镊子进行挑拣。将挑拣后的样品使用天平称重并记录,通过计算不同类型微塑料颗粒的回收率来选出合适浮选溶液。
1.4 荧光稳定性实验
采用乙醇为溶剂的罗丹明B染色的微塑料进行荧光稳定性试验,具体过程将微塑料颗粒暴露在不同的条件:(a)光照;(b)暗处理,以及不同的溶液;(c)饱和氯化钠溶液;(d)氢氧化钠溶液;(e)硝酸溶液。本实验中为了更好地对罗丹明B荧光稳定性进行评价,将染色微塑料颗粒被分别放置在5个条件中,染色微塑料颗粒自然光照以及暗处理各24h;在密度浮选过程中,通过将染色微塑料颗粒塑料浸泡在饱和NaCl溶液中24h,考察饱和NaCl溶液对其影响;使用10% NaOH与8mol/L HNO3对染色微塑料颗粒处理24h,考察NaOH与HNO3溶液对染色微塑料颗粒的影响。将经过在不同条件处理后的样品分别在波长为365nm紫外光下使用显微镜观察并拍摄图像,以确定微塑料是否仍具有荧光效应。
1.5 实际土壤样品分析实验
为了量化环境样本中微塑料颗粒可能被染料染色的程度,从齐齐哈尔市不同区域采集了若干份土壤样本,将土壤样品置于电热鼓风干燥箱进行烘干,烘干后的大块土壤样品在研钵中轻微研磨,使其松散,再使用5 mm的筛网进行筛分,过筛后的土样贮存于铝盒中,用于后续实验。
将处理后土壤样品分别编号后,精确称量编号后土壤样品25g于烧杯中,用100mL量筒精准称量75mL的浮选液倒入装有土壤样品的烧杯,置于集热式磁力搅拌器中,常温搅拌30min,搅拌完成后静置过夜直至土壤完全沉淀,将上清液用真空过滤装置进行抽滤。经密度浮选后得到的土壤样品,加入30%H2O2溶液置于烘箱中进行消解处理,从而达到去除塑料颗粒表面微生物、有机质及土壤中团聚体的目的,将样品冷却过夜后,消解过后的土壤样品使用真空过滤装置过滤到纤维素滤膜上。
对消解后土壤样品,使用罗丹明B溶液添加到每个样品中。将样品置于温度为60℃烘箱中暗处理30 min后,使用尼龙有机滤膜过滤剩余的溶液,经染色后的样品自然风干后使用波长为365nm的紫外光进行检测分析。为了防止样品污染,在收集和过滤样品之前,用去离子水彻底冲洗金属筛和所有玻璃器皿,除将样品转移到真空过滤装置期间,所有样品都用铝箔覆盖。
1.6 微塑料颗粒检测分析
为了照亮微塑料样品,使用紫外光施加紫外线波长为365nm,作为微塑料颗粒发光的最佳波长进行施用。随后,使用显微镜在暗条件下观察微塑料,并记录微塑料的最大荧光图像。
在实际样品现场分析的情况下,由于样品中还是存在无法去除的杂质,所以使用ATR-FTIR进行分析,以确认实际样品中的发光颗粒是否为微塑料颗粒。实验条件:波长500~4000cm-1,分辨率4 cm−1,采集光谱平均扫描32次,用PerkinElmer软件库搜索并匹配检测到的光谱,并将检测的红外谱图与相对应标准品的红外光谱图进行比对,从而判断微塑料的类型。
2 结果与讨论
2.1 微塑料颗粒染色结果
在本研究中,使用罗丹明B快速染色微塑料的方法,测试罗丹明B染色对4种不同类型聚合物的适用性。以去离子水、乙醇为溶剂,研究罗丹明B对微塑料的着色程度。图1表示使用罗丹明B溶解在上述两种溶剂染色4种聚合物的染色结果以及聚合物在波长为365nm紫外光下显示出的荧光效果。
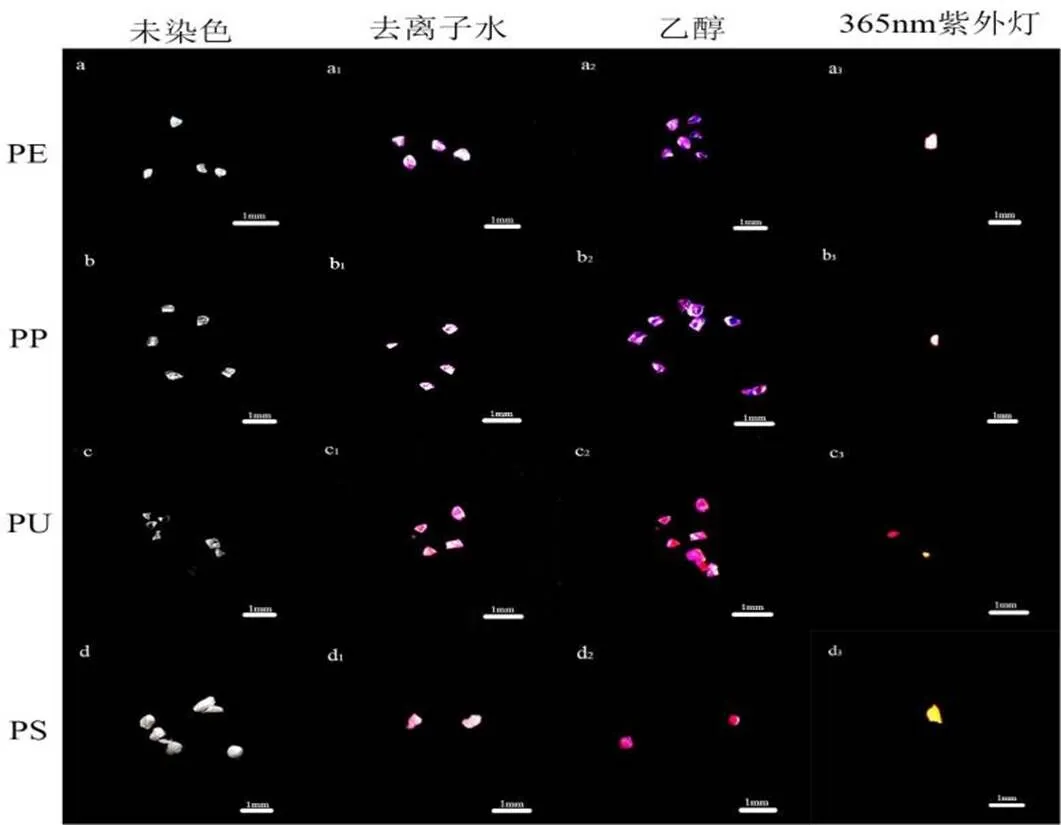
图1 微塑料在不同溶解条件下罗丹明溶液染色前后成像图
经显微镜观察后,检测到大部分成功用乙醇溶解的罗丹明B进行染色的微塑料,使用溶解在去离子水的罗丹明B溶液将PE与PP的染色颗粒染色为淡紫色,PU颗粒染色后变成浅粉色,对于PS,在使用去离子水溶解的仅有部分轮廓被染色,但其他部分的颜色变化不能轻易地被可视化。而PS可以用溶解在乙醇中的罗丹明B染色,并且可以通过增加罗丹明B的浓度和或染色时间长短来改善着色程度。因此,优化PS颗粒染色条件对其所有聚合物颗粒的染色具有重要意义。
在罗丹明B染色过程中,使用乙醇为溶剂染色效果明显优于用去离子水做溶剂。特别是对于白色、透明、体积较小的微塑料,用溶解于乙醇中的罗丹明B直接染色在显微镜下进行目视观察,是一种简便、快速的方法。实验结果直观地表明,相对大尺寸的塑料颗粒(>1mm)在用罗丹明B染色后很容易与土壤、沙子等其他物质区分开来。
用乙醇溶解的罗丹明B染色的微塑料在波长为365nm紫外光下观察,以确定4种类型的聚合物是否都在365nm处紫外光范围内发光。图1显示了所研究的4种聚合物的荧光图像,图像结果表明,4种类型的微塑料聚合物均有明显的荧光现象。
2.2 模拟土壤样品加标回收率测定结果
实验过程中最重要的一个环节是将微塑料这一目标物质在土壤介质中分离出来,因此选择不同浮选溶剂浮选土壤中微塑料颗粒,使用罗丹明B染色的4种微塑料在波长为365nm紫外灯下观察,并使用镊子挑选出来,称重并计算其回收率如表2所示,此实验过程中,滤膜对实验结果无影响。
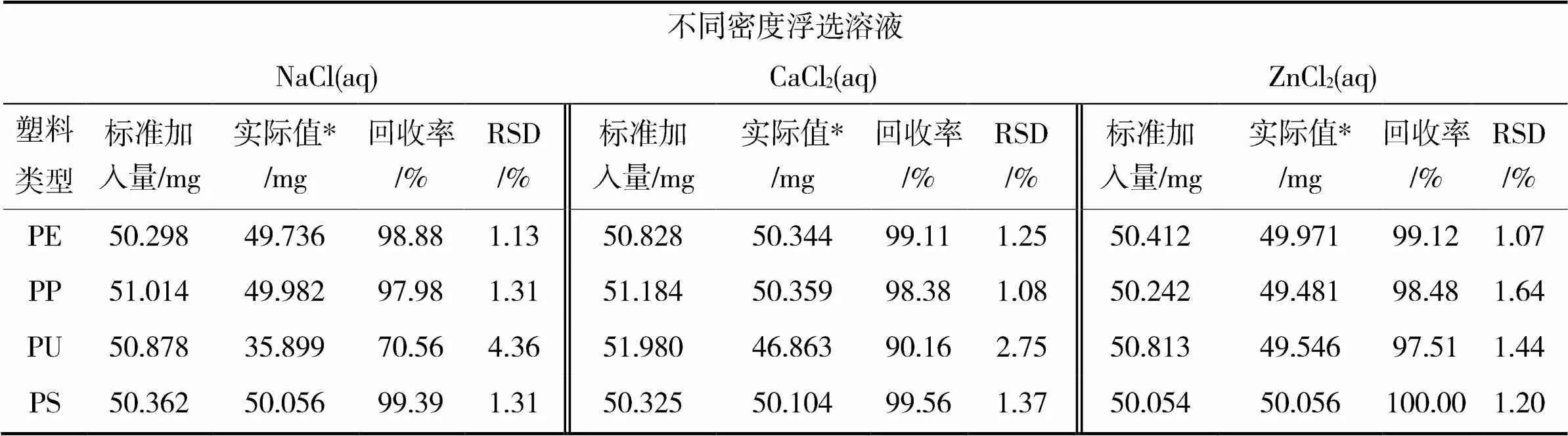
表2 微塑料颗粒在不同浮选液中回收率测定结果
“*”平行实验3组数据取平均值
表2记录了在土壤和密度浮选液体积比为1∶3,常温搅拌30min条件下,NaCl(aq)对不同种类塑料的回收率,PS最高,其次是PE、PP并都达到了97%以上,PU相对较差仅有70.56%;CaCl2(aq)对不同种类塑料的回收率,其中对PE、PS及PP的回收率都在97%以上,PU则刚达到90%;ZnCl2(aq)对不同种类塑料的回收率,PP和PS回收率都达到99%以上,PP和PU的回收率也都高于97%。
由于土壤组成的特殊性,想要分离土壤中的微塑料,利用微塑料与其他杂质之间存在密度差异,从而实现轻组分微塑料与重组分杂质分离是最为便利、高效的方法。因为微塑料本身的密度一般在0.8~1.4 g/cm3,土壤中其他杂质的密度一般大于2g/cm3,所以使用ZnCl2浮选液能够有效分离土壤中的微塑料。
综上回收率结果表明,在ZnCl2浮选液中四种聚合物的回收率都大于95%,RSD值均小于2%。在整个实验操作过程中,微塑料颗粒的损失较少不会影响实验结果。
2.3 荧光稳定性测定结果
如图2所示,在实验中使用的在不同的条件(a光照和b暗处理)或不同的溶液(c饱和氯化钠、d氢氧化钠及e硝酸中)下,染色后的微塑料颗粒在光照与暗处理24h的条件下,其在365nm紫外光下荧光稳定的。当使用不同溶液处理时,微塑料颗粒荧光变得比较暗淡,根据图2的荧光结果可知,微塑料的疏水性以及静电相互作用吸附罗丹明B是改变荧光强度的主要机制,在不同处理条件下加入溶剂,溶剂中的无机离子可以压缩双电层,过多的游离无机离子可能导致总吸附位点的数量减少,使得微塑料颗粒与罗丹明B之间的静电相互作用减小,从而导致微塑料颗粒的荧光强度减小。荧光稳定性实验结果表明,4种类型的微塑料聚合物仍保持荧光稳定。该染色方法可应用于标记环境介质中微塑料的研究。

图2 在不同条件下对染色后微塑料颗粒的荧光稳定性评价
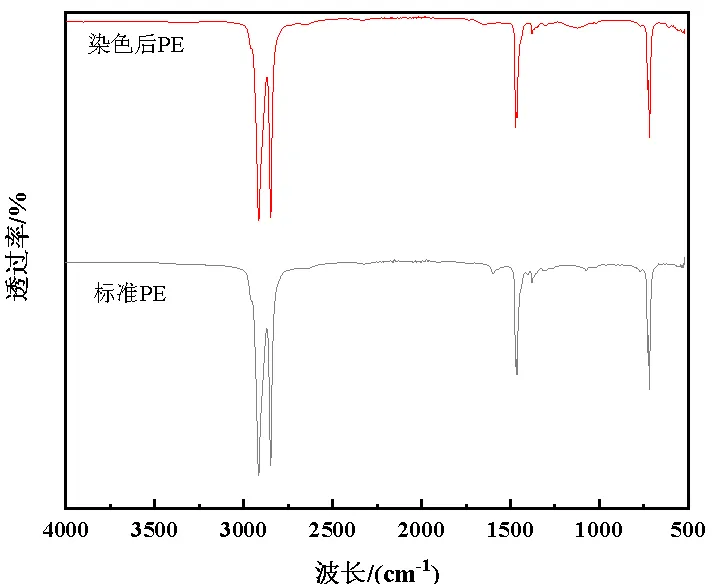
罗丹明B吸附在塑料表面并在紫外光下激发出荧光,通过对4种微塑料聚合物使用在乙醇中溶解的罗丹明B染色前后红外谱图的比较,如图3所示聚合物红外光谱中各官能团的特征峰仍然存在,并且出峰位置没有发生变化。但其特征峰强度会发生变化,PE、PP和PU染色后特征峰强度相对降低,PS峰强度增加,这证实了微塑料对罗丹明B的吸附是一个物理过程。实验过程中罗丹明B染色对红外光谱的影响轻微,表明该染色方法不会影响红外光谱检测时对微塑料的识别。
2.4 实际土壤样品分析检测结果
在土壤样品中共检出18个样品使用罗丹明B染色,尺寸在408.8~2440.7μm之间,微塑料在土壤中的丰度为(362~720)/kg(为微塑料个数;kg为土壤干重)。它可分为3种类型:透明薄膜(图4(a),=9)占比52.94%,白色泡沫(图4(b),=3)占比17.65%以及黑色薄膜(图4(c),= 6)占比35.29%,黑色薄膜由于所处黑暗条件下,所以未染色的图像不可见。在观察和计数罗丹明B染色的颗粒后,由图5可知,通过红外光谱法鉴定染色颗粒,土壤样品主要包含PE(透明薄膜)、PP(黑色薄膜)和PS(白色泡沫)聚合物。在土壤样品中,透明薄膜和白色泡沫可以被罗丹明B染色,在波长为365nm紫外光下显示出实际可用的荧光水平;而黑色薄膜只有部分轮廓被染色且在紫外光下激发出的荧光效应较弱。因此罗丹明B对透明、白色的聚合物颗粒染色效果更佳,从而使得目视鉴别的结果更准确。
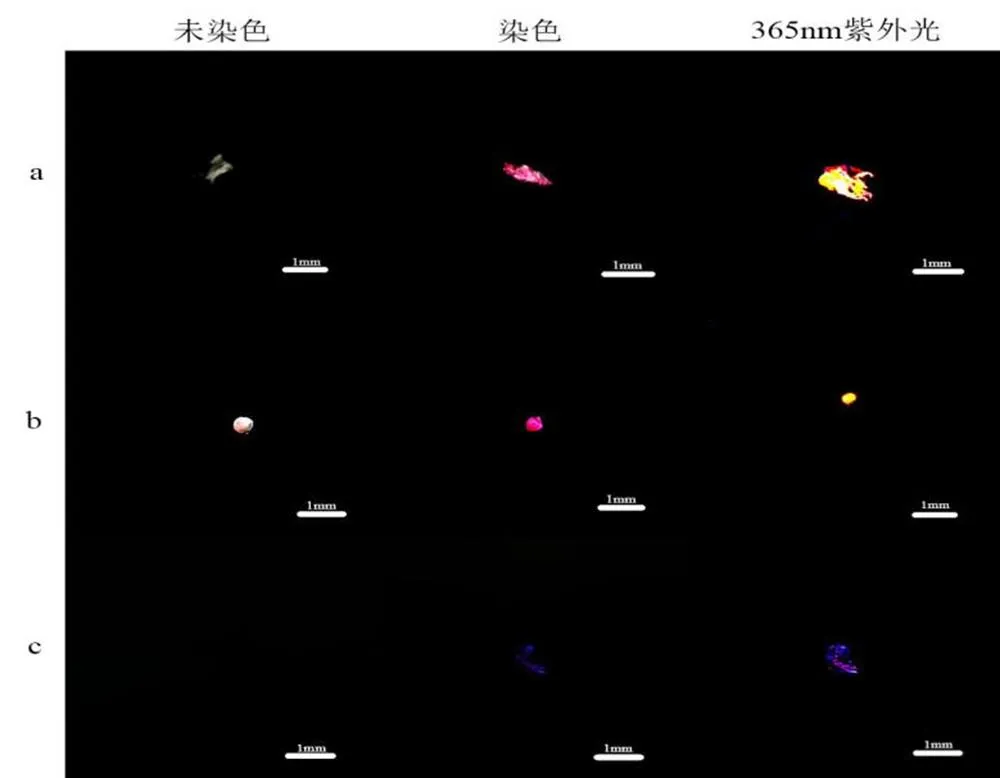
图4 实际样品中微塑料颗粒染色前后图像
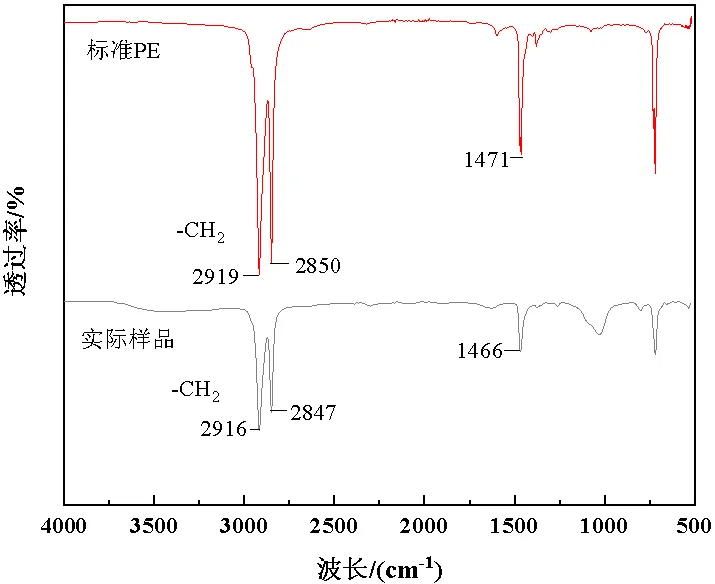
图5 实际样品中微塑料颗粒染色前后红外光谱对照
3 结论
(1)罗丹明B染色使所有四种评估类型的聚合物在波长为365nm范围内可显示出荧光,经罗丹明B染色后微塑料在使用不同的条件处理后的荧光强度较为稳定,从而在检测实际样品时减小了目检法的误差。
(2)回收率实验中通过3种密度浮选液对不同种类微塑料回收率考察的结果可知,ZnCl2(aq)的回收率效果最好,对不同塑料的回收率均在97%以上,因此选择ZnCl2(aq)作为密度浮选液,能够对土壤中的微塑料样品进行有效的分离。
(3)罗丹明B染色对微塑料检测红外光谱无显著影响,将该方法应用于土壤样品,对土壤样品中的PE、PP(薄膜)和PS(泡沫)进行染色,PE、PS均有较强荧光,PP相对于PE、PS荧光强度较弱。罗丹明B快速染色方法有助于观察和跟踪环境中微塑料颗粒,特别对白色、透明的微塑料有较好的辨别性,该方法相对简单、经济、快速得到检测结果,可以拓展至更多背景下进行应用。
[1] BARNES S J. Understanding plastics pollution: The role of economic development and technological research[J]. Environmental Pollution, 2019, 249(1): 812-821.
[2] MILLETTE S, WILLIAMS E, HULL C E. Materials flow analysis in support of circular economy development: Plastics in Trinidad and Tobago[J]. Resources, Conservation and Recycling, 2019, 150: 104436-104444.
[3] SKOCZINSKI P, KRAUSE L, RASCHKA A, et al. Current status and future development of plastics: Solutions for a circular economy and limitations of environmental degradation[J]. Methods in Enzymology, 2021, 648: 1-26.
[4] OBEROI I S, RAJKUMAR P, DAS S. Disposal and recycling of plastics[J]. Materials Today: Proceedings, 2021, (1526): 7875-7880.
[5] LAW K L, MORET-FERGUSON S E, GOODWIN D S, et al. Distribution of surface plastic debris in the eastern Pacific Ocean from an 11-year data set[J]. Environmental Science & Technology, 2014, 48(9): 4732-4738.
[6] WU X, LU J, DU M, et al. Particulate plastics-plant interaction in soil and its implications: A review[J]. Science of The Total Environment, 2021, 729: 148337-148355.
[7] THOMPSON Richard C, OLSEN Y, MITCHELL Richard P, et al. Lost at sea: where is all the plastic?[J]. Science, 2004, 304(5672): 838-838.
[8] YA H, JIANG B, XING Y, et al. Recent advances on ecological effects of microplastics on soil environment[J]. Science of The Total Environment, 2021, 798: 149338-149358.
[9] TURNER A, FILELLA M. Hazardous metal additives in plastics and their environmental impacts[J]. Environment International, 2021, 156(7): 106622-106632.
[10] 任欣伟,唐景春,于宸,等. 土壤微塑料污染及生态效应研究进展[J]. 农业环境科学学报,2018, 37(06): 1045-1058.
[11] COLE M, LINDEQUE P, HALSBAND C, et al. Microplastics as contaminants in the marine environment: A review[J]. Marine Pollution Bulletin, 2011, 62(12): 2588-2597.
[12] YANG L, ZHANG Y, KANG S, et al. Microplastics in soil: A review on methods, occurrence, sources, and potential risk[J]. Science of The Total Environment, 2021, 780: 146546-146566.
[13] HARMS I K, DIEKTTER T, TROEGEL S, et al. Amount, distribution and composition of large microplastics in typical agricultural soils in Northern Germany[J]. Science of The Total Environment, 2020, 758: 143615-143623.
[14] VERMEIREN P, MUOZ C, IKEJIMA K. Microplastic identification and quantification from organic rich sediments: A validated laboratory protocol[J]. Environmental Pollution, 2020, 262: 114298-114310.
[15] TONG H, JIANG Q, ZHONG X, et al. Rhodamine B dye staining for visualizing microplastics in laboratory-based studies[J]. Environmental Science and Pollution Research, 2021, 28(4): 4209-4215.
[16] KANG H, PARK S, LEE B, et al. Modification of a Nile Red staining method for microplastics analysis: A Nile Red plate method[J]. Water, 2020, 12(11): 3251-3263.
[17] LABBE A B, BAGSHAW C R, UTTAL L. Inexpensive adaptations of basic microscopes for the identification of microplastic contamination using polarization and Nile Red fluorescence detection[J]. Journal of Chemical Education, 2020, 97(11): 4026-4032.
[18] LV L, QU J, YU Z, et al. A simple method for detecting and quantifying microplastics utilizing fluorescent dyes-Safranine T, fluorescein isophosphate, Nile red based on thermal expansion and contraction property[J]. Environmental Pollution, 2019, 255: 113283-113294.
[19] NEL H A, CHETWYND A J, KELLEHER L, et al. Detection limits are central to improve reporting standards when using Nile red for microplastic quantification[J]. Chemosphere, 2021, 263: 127953-127962.
[20] MA C, LI L, CHEN Q, et al. Application of internal persistent fluorescent fibers in tracking microplastics in vivo processes in aquatic organisms[J]. Journal of Hazardous Materials, 2020, 401: 123336-123361.
[21] KARAKOLIS E G, NGUYEN B, YOU J B, et al. Fluorescent dyes for visualizing microplastic particles and fibers in laboratory-based studies[J]. Environmental Science & Technology Letters, 2019, 6: 334-340.
[22] QU M, XU K, LI Y, et al. Using acs-22 mutant Caenorhabditis elegans to detect the toxicity of nanopolystyrene particles[J]. Science of The Total Environment, 2018, 643: 119-126.
Determination of microplastics in soil by Rhodamine B rapid staining method
ZHANG Wan-wan,ZHENG Yong-jie,TIAN Jing-zhi
(College of Chemistry and Chemical Engineering, Qiqihar University, Heilongjiang Qiqihar 161006, China)
Microplastics were quickly stained with Rhodamine B, which showed fluorescence under UV light at a wavelength of 365nm, thus separating microplastics in the soil medium. PE, PP, PU and PS were selected as test materials, and ethanol and deionized water were used as solvents to study the coloring ability of Rhodamine B. The fluorescence stability of microplastics under different conditions was evaluated. The results showed that ethanol was the best solvent to dissolve Rhodamine B. Rhodamine B staining had no significant effect on the recognition of microplastics. The fluorescence of microplastics under different conditions is still stable. In the spiked recovery experiment, ZnCl2flotation solution had a good separation effect on microplastics in soil. The recoveries of PE and PS were above 99%, and the recoveries of PP and PU were above 97%. The recoveries of the same group were stable, and the RSD values were all less than 2%.
microplastics;Rhodamine B;dyeing;infrared spectrum;ultraviolet light
2021-10-19
黑龙江省教育厅基本业务项目(135309109)
张万万(1997-),男,山东德州人,硕士,主要从事土壤中污染物分析研究,1324294037@qq.com。
X505;X833
A
1007-984X(2022)02-0077-07
